がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
400) 医薬品の再開発と適応外使用(その1): Drug Repositioningとは
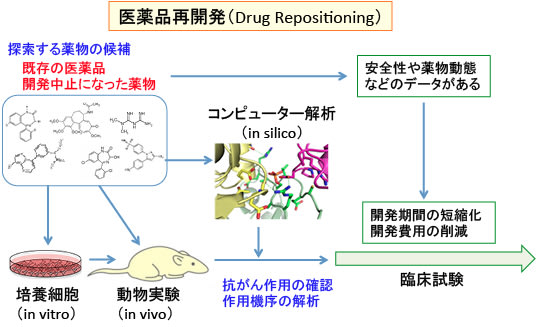
図:がん治療薬以外の既存の治療薬や、がん以外の疾患を対象に開発されて臨床試験で開発中止になった薬物を対象に、それらの薬物の抗がん活性を検討してがん治療薬を探索する研究が行われている。他の治療薬として開発された(あるいは臨床試験で効果が証明されずに開発中止になった)薬物から目的外の薬効を探索して別の疾患の治療薬を開発する手法を医薬品の再開発(Drug RepositioningあるいはDrug Repurposing)という。がん以外の疾患を対象に開発された医薬品あるいは薬の候補を、培養細胞(in vivo)や動物実験(in vitro)やコンピューターを使った解析(in silico)などで抗がん活性をスクリーニングする。もし抗がん活性が見つかれば、安全性や薬物動態のデータがあるので、臨床試験などの研究開発の期間を短縮でき、開発費用も節減できる。既に他の治療薬として使用されている場合は、保険適応外の使用でがん治療に直ちに応用できる場合もある。
400) 医薬品の再開発と適応外使用(その1): Drug Repositioningとは
【新薬の開発は年々難しくなっている】
近年、新薬開発の行き詰まりが問題になっています。
医薬品の研究開発には莫大な費用がかかります。研究開発に費やされる費用は年々増えているのですが、認可される薬は開発費の増加に比例していないことが指摘されています。
例えば、全世界で医薬品開発に1年間に使われた費用は1975年には40億ドルで、2009年には400億ドルと10倍になっていますが、1年間に認可された新薬は1976年は26個で2013年は27個とほぼ同じです。(Int J Biol Sci. 10(7): 654–663.2014年)。
物価上昇分を調整した実質ベースで、10億ドルの研究開発費当たりで認可される新薬の数は、1950年以降、約9年間毎に半減しており、60年間で80分の1になっていると報告されています。(1個の新薬の開発にかかる費用が、物価上昇分を調整した実質ベースで比較して60年前の80倍になっているということです。約9年で2倍になるような指数関数的に増加しているので、54年(=9年x6)で2の6乗=64倍になっているという計算で、60年間で80倍という数字が理解できます)(Nat Rev Drug Discov. 11(3):191-200.2012年)
つまり、医薬品の開発には莫大な費用がかかり、その額が年々増えているということです。
また、欧米のデータでは、新規の薬効成分が発見されてから薬として認可されるまでの期間は1990年代は平均9.7年で2000年代は13.9年に延びています。(Nat Rev Drug Discov. 10(6):428-38. 2011年)
新薬として認可されるには、既存の医薬品より有効性や安全性で優位性が証明されなければなりません。つまり、新しい薬ほど認可されるハードルが高くなります。
また、既存の薬で病気がコントロールできている場合は新薬の開発は必要ありません。既存薬で病気が治っていない領域の新薬の開発に費用が向けられます。
つまり、がんや神経変性疾患など難病の治療薬(臨床試験で失敗するリスクが高い)の研究開発の比重が次第に増えていることも、一つの新薬が認可されるのに必要な開発費用と期間が増えている理由になっています。
2002年から2012年の間に行われたアルツハイマー病の治療薬の臨床試験は99.6%が失敗に終わっている(治療薬に認可されなかった)という報告があります。
がん治療薬の開発も開発リスクが高いことが指摘されています。米国のデータでは、2003年から2011年の間に第1相臨床試験の開始がFDA(米国食品医薬品局)に認められた物質のうち、最終的に医薬品として認可されたのは6.7%で、この数値は他の領域の医薬品(がん治療薬以外の薬)の半分の成功率と報告されています。
米国で2000年から2009年の10年間に認可された新薬は212種類で、そのうちがん治療薬は24種類で、このうち14種類は血液がんの治療薬です。つまり、固形がんの治療薬は特に開発が難しいようです。
がん治療薬の開発は失敗するリスクが極めて高いので、がん領域の薬の開発に参入しない方針の製薬会社は多いと言われています。
最近は細胞の受容体やシグナル伝達物質をターゲットにした分子標的薬が開発されていますが、それほど大きな治療効果は得られていません。
培養細胞や動物実験でがん治療薬としての可能性がある物質は、臨床試験で有効性と安全性が証明されれば医薬品として認可されます。
動物実験などで有効性と安全性が確認された医薬品の候補は、実際に人間の病気に対して有効かどうかや副作用などが検討されます。臨床試験は第1相、第2相、第3相の3段階に分けられます。
第1相試験は、少数の健常人を対象に、薬の吸収や代謝や副作用などを検討し、第2相試験では少数の患者を対象に有効性や副作用や服用量を決めます。そして第3相試験では多くの患者を対象に有効性と安全性を検討し、有効性と安全性が証明できれば治療薬として認可されます。
動物実験などの基礎研究でがんの治療薬として効果が期待されて臨床試験の許可を得た候補薬のうち、20個に1個程度しか最終的に薬として成功していません。残りは、開発中止になるので、それまでの研究開発費用は無駄になるということです。
このように、がん治療薬の開発は製薬会社にとって非常にリスクが高いので、新薬として認可された薬は、その薬自身の研究開発に費やした費用の何十倍もの研究開発費を回収しないと元が取れないために、がんの新薬は年々高額になっています
このようなお金がかかる新薬の開発において、近年注目されているのが、既存の医薬品が他の治療薬にならないかを検討する医薬品再開発(Drug Repositioning)です。がん以外の疾患の治療に用いられている既存薬や、がん以外の疾患の治療薬として開発されて臨床試験まで行ったが有効性が証明できなくて開発中止になった物質を、がんの治療薬として再開発(再利用)する研究が注目されています(後述)。
【有効なのに標準治療に使われない薬がある理由】
がんの標準治療の足りない部分を補ったり替わりになる治療法が「補完・代替医療」の定義ですので、がんの補完・代替医療で使用されている薬やサプリメントは基本的には標準治療では使用されていません。
「臨床試験で有効性が証明されていれば標準治療で使われるはずだから、補完・代替医療で使用されている薬やサプリメントは有効性が証明されていないものだ」という意見で、補完・代替医療を否定し、標準治療以外は認めない医師もいます。しかし、これは全くの間違いです。
標準治療で使用されていない医薬品やサプリメントの中に、がん治療に有効性が証明されたものは多数あります。十分なエビデンスがあっても標準治療で使われないのは特許の問題が関連しています。
標準治療で使用される薬は日本では基本的に保険適用薬に限られます。「保険医は、厚生労働大臣の定める医薬品以外の薬物を患者に施用し、叉は処方してはいけない」という規則が定められています。(保険医療機関及び保険医療養担当規則の第19条)
治験用に用いる場合に限って例外は認められていますが、基本的には保険医療機関や保険医が保険適用薬以外を患者に使用することは禁じられているのです。
保険適用されるためには、製薬会社が臨床試験を実施し、有効性や安全性を証明して、厚生労働大臣に製造販売の承認を受けなければなりません。この場合、その物質の特許があれば、その薬を独占して販売できるため利益を得ることができます。
しかし、特許が取れない場合は、莫大な費用(何十億円とは何百億円)を出して臨床試験を実施するメリットがありません。特許がなければジェネリック薬がすぐ出て来て利益が得られないためです。その結果、どの製薬会社も薬として申請しません。誰かが申請しなければ保険薬あるいは承認薬として認可されることはないので、標準治療の中で使用されることは永久にないことになります。
例えば、ジクロロ酢酸ナトリウムや2-デオキシグルコースやメチオニン・エンケファリン(オピオイド増殖因子)など世界中でがんの代替医療で使用され、臨床試験で有効性が示されている物質も、何十年も前から知られている物質で物質特許が取れないので、製薬会社は費用を負担して臨床試験を実施することも、医薬品として開発することもありません。研究者が公的なグラントを使って小規模な臨床試験を行っている程度です。
また、サプリメントとして流通しているビタミンD3やドコサヘキサエン酸(DHA)などがん治療における有効性が臨床試験で証明された物質も、保険薬にはなり得ないので標準治療を行っている保険医が使うことはありません。このような薬やサプリメントは患者さんが自分の意思と自己責任で利用するしかないということになります。
がん治療以外の既存薬でも、抗がん作用が確認されれば、がん患者を対象にして新たに臨床試験を実施して、抗がん剤として適応を追加することはできます。
しかし、特許権の存続期間は原則として特許出願日から20年で、通常は臨床試験を開始する前に出願するので、臨床試験が終了して薬として認可される頃には特許は10年程度しか残っていません。さらにがん治療薬としての別の臨床試験が終わるころには特許が切れるので、そのような申請も行われない可能性が高いと言えます。
例えば、胃酸分泌阻害薬のシメチジン、糖尿病治療薬のメトホルミン、シクロオキシゲナーゼ-2阻害薬のセレコキシブ(celecoxib)など、他の疾患の治療に用いられている薬で抗がん作用が臨床試験で示されている薬があります。これらは特許が切れているので今後がん治療薬として開発されることも認可されることもないと言えます。がん治療の目的で使用しようとすると、保険適応の疾患を持っていなければ処方はできません。つまり、保険診療の医療機関では、保険適応の病気を持っていなければ、たとえがんに対する効果が証明されていても使えないことになります。
しかし、自由診療の医療機関であれば保険適応外の処方も可能になります。このようながん治療において有用な保険適応外使用の例は多くあり、そのような知識があれば、安い費用でがん治療の効果を高めることができます。
以上のような理由で、サプリメントやがん以外の治療に使われている既存薬や古くから知られている抗がん成分などは、たとえがん治療に有効性が証明されても、標準治療に使われることはないことになります。
さて、最近の抗がん剤の新薬は極めて高額です。
がんが根治できる可能性が高ければ、費用が高額で副作用が強くても我慢できます。
しかし実際は、費用が高額で副作用で苦しむ割に、延命効果がわずかであることが多いので、抗がん剤治療に様々な批判があると言えます。
開発に失敗するリスクを減らすため、既存の抗がん剤より少し効果がある程度の薬を目標に設定しているため、新薬が出てもそれまでの治療薬と大差ないという意見もあります。先行薬をベースに多少の改変で新薬を作ると失敗するリスクは減りますが、効果の劇的な改善は望めません。
費用が安く副作用が少なければ、延命効果が少しでも、その方が良いと考えるがん患者さんも多くいます。
そのような患者さんの受け皿になる治療が必要です。これは、「副作用が少なく、費用が安価で、それなりの抗腫瘍効果や延命効果がある」というのが条件になります。
最近、がん以外の既存の治療薬や、がん以外の治療の目的で臨床試験が行われて有効性が証明できなかった物質などからがん治療薬を見つける研究が注目されています。
それは、開発の費用を少なくし、期間を短縮することができるからです。
がん以外の治療薬で抗がん作用があるものは、通常の抗がん剤のような強い毒性(副作用)が少ないものが多いと言えます。したがって、このような薬は「副作用が少なく、費用が安価で、それなりの抗腫瘍効果や延命効果がある」という条件に合致する可能性があります。
【医薬品の再開発(Drug Repositioning)とは】
新薬開発研究の行き詰まりを打開する方法として,ドラッグ・リポジショニング(Drug Repositioning)あるいはドラッグ・リパーポジング(Drug Repurposing)と呼ばれる方法があります。
「Repositioning」や「Repurposing」というのは、位置や立場(position)や目的や意図(purpose)を新たにする(re-)という意味です。医薬品の「再開発」や「再利用」という意味です。
ヒトでの安全性や体内動態が既に確認されている既存薬や、ある疾患の治療薬として臨床試験が行われたが有効性が証明できなかった物質を対象にして、これらの物質の新たな薬効を見つけ出し,実用化につなげていこうというのがDrug Repositioning(あるいはDrug Repurposing)という方法です。
新規の開発よりも、開発の費用を減らし期間も短縮できるというメリットがあります。
がん治療薬の場合、そのような既存薬や薬の候補成分を、培養がん細胞(in vitro)や移植腫瘍などを使った動物実験(in vivo)で抗がん活性を見つければ、すでに安全性や薬物動態が判っているので比較的早く臨床試験を実施できます。
最近は、薬剤の候補物質がデータベース化され、細胞の受容体やシグナル伝達物質の構造のデータベースや、抗がん剤による遺伝子発現パターンのデータベースなど様々な情報をコンピューターを使って探索する方法(in silico)もあります。(トップの図)
「in silico」という用語は,「コンピュータ(シリコンチップ)の中で」の意味で、in vitro(試験管内で)やin vivo(生体内で)に対応して作られた用語で、コンピューターを駆使した研究です。
米国では、FDA(米国食品医薬品局)が承認した既存薬や、開発に失敗して製薬企業内で保存されている物質のデーターベースが公開されており、様々な手法で新たな薬効を見つける研究が進んでいます。
この手法で寄生虫治療薬のメベンダゾールががん治療薬として研究されだしたことが報告されています。Drug Repositioningの具体例としてこの論文の要旨を日本語訳しておきます。
Repositioning of the anthelmintic drug mebendazole for the treatment for colon cancer.(寄生虫治療薬メベンダゾールの大腸がん治療薬としての再開発)J Cancer Res Clin Oncol. 139(12): 2133-40, 2013年
【要旨】
目的:大腸がんの治療薬として再開発する目的で、臨床的に使用されている1600種類の医薬品を含む多数の物質をスクリニーングした。
方法:2種類の大腸がん細胞株を用い、蛍光微小細胞傷害性検定法(fluorometric microculture cytotoxicity assay)で抗がん活性を検討した。物質の比較には、Connectivity Map解析による遺伝子発現解析、米国がん研究所(NCI)の抗がん剤評価系のデータベース(NCI 60 data mining)、プロテインキナーゼ結合測定を実施した。
結果:2種類の大腸がん細胞において、10μMの濃度で細胞生存率を40%以下のに減らす細胞傷害活性を示す物質が68種類スクリーニングされた。これらの物質は遺伝子発現の解析から幾つかの種類に分類され、その一つが寄生虫治療薬のベンゾイミダゾール(Benzimidazole)系の薬物であった。このうちメベンダゾール(Mebendazole)とアルベンダゾール(Albendazole)が臨床で使用されていた。NCIの60種類のがん細胞株を用いた薬剤感受性のデータベースとの比較から、メベンダゾールとアルベンダゾールの類似性は低く、作用機序が異なることが示唆された。Connectivity Map解析による遺伝子発現パターンの比較でも、この2つの類似性は低かった。
さらに、メベンダゾールはBCR-ABLやBRAFを含む幾つかのプロテインキナーゼと相互作用を示したが、アルベンダゾールにはそのような作用は認めなかった。
メベンダゾールはNCA60パネルの大腸がん細胞株の80%に対して抗腫瘍活性を示した。さらに3種類の大腸がん細胞と3種類の非がん細胞での検討から、メベンダゾールの大腸がんに対する選択性が確認された。
結論:メベンダゾールは大腸がん治療薬として再開発する価値がある。
このような薬剤のスクリーニングとは関係なく、多形神経膠腫(glioblastoma multiforme)に対するメベンダゾールの効果は2011年に偶然に発見されました。グリオブラストーマを移植したマウスを使った研究で、マウスにおけるギョウ虫の繁殖を防ぐ目的でフェンベンダゾール(Fenbendazole)を投与したマウスでは移植腫瘍が増大しないことが発見されました。フェンベンダゾールは動物に使われるベンゾイミダゾール系の寄生虫治療薬の一種です。さらに研究を進め、ベンゾイミダゾール系薬物の中でメベンダゾールが最も強力にグリオブラストーマの増殖を抑制することが明らかになりました。
既存の薬の抗がん活性を検討するのは、培養がん細胞を用いた細胞傷害作用の検討で大まかに評価できるので、スクリーニングは簡単です。さらに、最近は、いろんな物質に対する遺伝子発現パターンのデータベースや、NCI(米国がん研究所)が提供している60種類のがん細胞株(NCI60がん細胞パネル)における様々な抗がん剤の薬剤感受性のパターンのデータベースなどを使うと、その物質の作用機序やがん細胞特異性などが推測できます。このようにして、何千種類という既存の薬や候補薬剤からスクリニーングして新たながん治療薬を作り出そうというのががん治療領域のDrug Repositioningです。
この論文のメベンダゾールは現在臨床試験が行われていますが、結果はまだです。メベンダゾールが有効であった2例の症例報告があります。(詳細は次回)
このようにして非がん治療薬から見つかったがん治療薬は、基本的には保険適用の対象にならない可能性が高いので(特許が切れていることが多いので)、代替医療の範疇で使用される可能性が高くなります。
つまり、Drug Repositioningの研究は、今後のがんの補完・代替医療の新たな治療薬を提供してくれる宝庫になる可能性があり、この研究領域からの論文を注視しておくことは重要です。
画像をクリックするとサイトに移行します。
| « 399)水素ガス... | 401)医薬品の... » |





