がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
401)医薬品の再開発と適応外使用(その2):メベンダゾール。
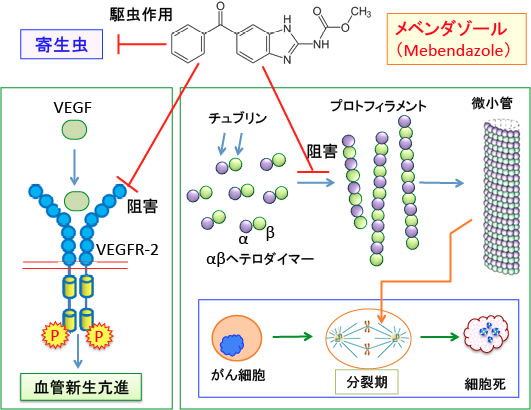
図:寄生虫治療に使われるメベンダゾールはチュブリン・タンパク質に結合して微小管の重合を阻害する作用によって駆虫作用を示す。微小管重合阻害剤は抗がん剤としても使用されており、実際にメベンダゾールががん細胞の細胞分裂を阻害する作用により抗腫瘍効果を発揮することが動物実験や臨床例で確認されている。さらに血管内皮細胞増殖因子(VEGF)の受容体(VEGFR-2)の活性化を阻害して血管新生を阻害する作用も報告されている。メベンダゾールは毒性が低く、安価で、駆虫薬として長く使用され安全性が高いためがん治療への応用が検討されている。
401)医薬品の再開発と適応外使用(その2):メベンダゾール。
【「縮小なくして延命なし」は正しいのか?】
現在行われている抗がん剤治療は「副作用が耐えられる最大量(最大耐用量)を投与して、がん細胞をできるだけ多く死滅させる」ことを基本方針としています。この方法は、白血病や悪性リンパ腫や精巣腫瘍など一部のがんでは成功しています。
しかし、多くの固形がんでは、患者が死なないレベルの最大耐用量を投与しても、がんを全滅させることはできず、延命効果もそれほど高くないことが指摘されています。
西洋医学では、がん治療において「縮小なくして延命なし」という考えを基本にしていますが、そもそもこの考え自体に根本的な間違いがあるという指摘があります。がんの一時的な縮小が必ずしも延命につながる保証がないからです。
強力な抗がん剤治療によって一時的に腫瘍を縮小させても、ほとんどの場合、抗がん剤に抵抗性をもったがん細胞が出現し、根治させることはできません。抗がん剤治療を行っていると次第に薬剤耐性を持ったがん細胞が増えて、いずれはどの抗がん剤にも効かないがん細胞集団になっていくということは、抗がん剤治療の宿命になっています。
また、強力な抗がん剤治療が生き残ったがん細胞の増殖を刺激する場合もあります。
生体は組織がダメージや傷を受けるとそれを修復する反応を起こします。死滅した細胞を排除するために炎症細胞が集まり、炎症細胞が分泌する炎症性サイトカインや成長因子は細胞の増殖や血管新生を促進して組織を修復します。組織を修復させるために既存の血管内皮細胞の分裂や、あるいは骨髄からの血管内皮前駆細胞の動員が起こって、血管新生が促進され、その結果、組織の修復が促進されることになります。
このような修復反応はがん組織でも起こります。ダメージを受けたがん組織に炎症細胞や血管内皮前駆細胞などが動員され、がん細胞の増殖や血管新生が刺激されることになります。
つまり、がん組織を縮小させる治療が、逆に耐性をもったがん細胞の増殖を促進したり、血管新生を促進して生存期間を短縮する場合もあるのです。
がん組織が縮小すると、患者さんも主治医も安心します。延命できるかもしれないという期待が持てるからです。しかし多くの場合、腫瘍の縮小は一時的であり、抵抗性をもったがん細胞がかえって急速に増えてしまい、生存期間を延ばす効果につながらないことが多いことも指摘されています。
最近は、がんの縮小を目指すのではなく、がんの増殖をくい止め、がんと共存しながら延命をはかるという戦略が提唱されています。
低用量の抗がん剤を投与しながら、がんを大きくしないという「休眠療法」や「メトロノミック・ケモテラピー(Metronomic Chemotherapy)」が提唱され、一部の医師によって実践されています。(397話参照)
この低用量の抗がん剤投与の有効性に対しては、がん専門医の多くは懐疑的です。
しかし、数学的解析とコンピューターシミュレーションによって、「大量の抗がん剤を投与して一時的ながん組織の縮小を目指すより、腫瘍の大きさを一定に保つことを目標に抗がん剤を投与した方がより生存期間が長い」という結果を示した論文もあります。
(134話参照)
このコンピュータ−シミュレーションでは「がんを徹底的に攻撃する治療戦略」より「がんを安定化させる治療戦略」の方が生存期間を最大限に延ばすことができることが示されています。
製薬会社は抗がん剤の開発に興味を失っているという指摘があります。開発で失敗するリスクが高いからです。
失敗するリスクを少しでも減らすために「がんを徹底的に攻撃する治療戦略」の方針での開発が主体になってきます。たとえがん患者が副作用で苦しんでも、腫瘍を縮小させる奏功率が高いものはがん治療薬として認可される可能性が高いからです。
一方、「がんを安定化させる」「がんと共存する」という治療戦略での薬の開発は、短期的な有効性の証明が困難であるため、多くの製薬会社はそのような薬の開発に興味を持ちません。
この治療戦略には、長期使用を前提とするため「副作用が少なく、安価で、がん細胞の増殖を抑制できる」ことが条件になります。
このような条件を満たす抗がん剤は、抗がん剤治療薬として開発された薬の中には存在しません。がんとの共存という戦略で開発された抗がん剤はないからです。
しかし、前回(400話)紹介した医薬品の再開発(Drug RepositioningあるいはDrug Repurposingという)で見いだされた「抗がん作用が見いだされた非がん治療薬」、つまり、「がん以外の病気の治療に既に使用されていて抗がん作用が見つかった医薬品」は、このような条件に合致するものが多くあります。
既存薬でジェネリック薬があるので極めて安価で、がん以外の疾患の治療薬として長く使われているので、副作用は比較的少なく安全性に問題がないからです。
このような薬として駆虫薬のメベンダゾールやアルベンダゾールなどのBenzimidazole系薬、糖尿病治療薬のメトホルミン、胃酸分泌阻害剤のシメチジン、抗炎症薬のジクロフェナク、抗真菌薬のItraconazoleなど多数が候補として報告されています。
この中で最も期待されているメベンダゾールの抗腫瘍効果について以下にまとめています。
【メベンダゾールの抗がん作用】
医薬品再開発(Drug Repositioning)の例として、寄生虫治療薬のメベンダゾールががん治療薬として臨床試験が行われていることを前回の400話で紹介しました。
既存の医薬品1600種を含む多数の物質をスクリーニングして抗がん作用が認められた68種類の医薬品の一つがメベンダゾール(Mebendazole)という既存の寄生虫治療薬です。
多くの種類の腫瘍に対して抗腫瘍効果を示すことが前臨床試験で明らかになっており、さらに、人間における抗腫瘍効果を示す2例の症例が報告されています。臨床試験も現在進行中のものが2件あります。
メベンダゾールはVermoxという商品名で販売されています。ネット上で購入も可能です。治療法が無くなった場合の一つの選択肢になるかもしれません。
メベンダゾールをがん治療に使う場合に知っておくべき情報をまとめておきます。
1)薬の概要:メベンダゾール(Mebendazole)はベンズイミダゾール系の広範囲作用型の寄生虫治療薬(駆虫薬)です。線虫、条虫(サナダムシ)、回虫など多くの寄生虫に広く作用です。VermoxやOvexの商品名で欧米で広く使用され、ヨーロッパでは薬局で購入できる薬です。
2)用量:1錠が100mgで、寄生虫の治療には1日に100~200mgを数日服用します。エキノコックス症(包虫症)には長期間の投与が必要です。
WHOのガイドラインでは単包虫症(cystic echinococcosis, CE) では40–50 mg/kg/dayを少なくとも3~6ヶ月間服用、多包虫症(alveolar echinococcosis, AE)では40–50 mg/kg/dayを2年間以上服用するとなっています。
10年以上の服用の症例報告もあります。つまり、安全性がかなり高い薬です。
3)毒性:毒性は極めて低く、副作用が少ない薬です。寄生虫駆除の治療の場合は、大量の寄生虫が駆除される時に腹痛や下痢を起こす場合がある程度で、薬自体の毒性はほとんどないと報告されています。
ただし、稀に、アレルギー反応によって発疹やじんましんが出る場合もあります。
妊娠中は服用できません(禁忌)。2歳以下の小児もデータが無いため推奨できません。
4)薬物動態:消化管からの吸収率は20%程度で、服用後2~4時間で血中濃度はピークになります。脂肪の多い食事と一緒に服用すると吸収が高まります。
10mg/kgの服用で最高濃度の平均は137.4ng/ml(0.47μM)という報告があります。
シメチジンがメベンダゾールの薬物代謝酵素による分解を阻害し、血中濃度を1.5倍程度に高めるという報告があります。
シメチジン自体に抗腫瘍効果があるので、併用は有益という報告があります。(シメチジンはヒスタミン受容体拮抗作用によって胃酸分泌を阻害する薬で、がんの転移や再発を予防する効果が臨床試験などで示されています)
5)抗がん作用の基礎研究(培養細胞および動物実験):2002年にMukhopadhyay の研究グループが培養肺がん細胞を使った実験でメベンダゾールが用量および時間依存性にアポトーシスを誘導することが最初に報告されています。
50%阻害濃度(IC50)は0.16μMでした。
がん細胞はG2/M期で細胞周期が停止し、アポトーシスを起こしましたが、正常ヒト血管内皮細胞や正常線維芽細胞に対しては1μMの濃度でも細胞傷害作用は示しませんでした。
その後、メベンダゾールのがん細胞増殖抑制効果は、乳がん、卵巣がん、大腸がん、骨肉腫でも確認され、IC50は0.1から0.8μMでした。
肺がん細胞をヌードマウスに移植する実験系で、腫瘍の直径が3mm程度に増殖してから、メベンダゾール1mgを隔日に投与するという実験モデルで、用量依存的ながん細胞の増殖抑制作用が認められています。
その他のマウスの実験系でも同様の抗腫瘍効果が認められています。
マウスの尾静脈からA549細胞を注入して肺転移を形成する実験モデルで、コントロール群ではがん細胞を注入21日後に約300個の肺転移巣を認めましたが、メベンダゾールを1mgの隔日投与を受けたマウスでは肺転移巣の数は80%の減少を認めました。
この実験系でパクリタキセルは抗腫瘍効果を示しませんでした。
これらの動物実験では副作用は全く認めなかったと報告されています。
体表面積で換算すると20gのマウスの1日1mgの投与は、体重70kgの人間で1日500mgに相当します。
標準代謝量は体重の3/4乗(正確には0.751乗)に比例するという法則があり、一般にマウスの体重当たりのエネルギー消費量や薬物の代謝速度は人間の約7倍と言われています。マウスの場合は1mg/20gは50mg/kgで、人間では7mg/kgに相当し、70kgで490mgになるという計算でも、がん治療には成人で1日500mg程度というのが妥当な用量になります。
抗がん剤耐性のメラノーマ(悪性黒色腫)細胞を使って、既存の医薬品を中心に約2000種類の化合物をスクリーニングした研究では、10種類の物質が正常メラノサイトには影響せずに悪性黒色腫細胞の増殖を抑制し、このうち4種類がベンズイミダゾール(benzimidazoles)系物質でした。その4つはmebendazole、 albendazole、 fenbendazole、oxybendazoleで、この4種類のベンズイミダゾールのうちメベンダゾールが最も抗腫瘍効果が高かったと報告されています。
メベンダゾールは2種類の抗がん剤耐性の悪性黒色腫細胞株に対して用量依存的な増殖抑制作用を示しIC50は平均0.32μMでした。一方、非腫瘍性のメラノサイトの細胞株に対するIC50は1.9μMでした。
ヒト悪性黒色腫細胞をヌードマウス(免疫不全のマウス)に移植する実験モデルでメベンダゾールを1mgと2mgの用量で隔日投与を行うと、腫瘍の増殖はコントロール(メベンダゾール非投与)に対して1mgの場合で83%、2mgの投与で77%の増殖抑制を認めました。
これは、100mg/kgのtemozolomideを腹腔内に5日連続投与する効果と同等でした。Temozolomide(商品名;テモダール)は悪性黒色腫の治療に標準的に使用される抗がん剤でこの研究では陽性対照として用いています。
これは、悪性黒色腫に対するメベンダゾールの抗腫瘍効果は高用量のTemozolomide投与に匹敵するもので、しかも副作用がほとんど無いという特徴を持つことが示されています。(Mol Cancer Res. 6(8): 1308-1315, 2008年)
この実験で用いた悪性黒色腫の2つの細胞株はテモゾロマイドやシスプラチンに耐性で、一つ(M-14)は変異型のp53を持ち、もう一つ(SK-Mel-19)は正常型のp53を持つ細胞です。したがって、この2つの細胞株に抗腫瘍効果を示すことは、抗がん剤耐性でがん抑制遺伝子のp53の変異の有無に関係なく抗腫瘍効果を示すことを意味しています。
またこの論文ではメベンダゾールはBcl-2をリン酸化してがん細胞のアポトーシスを誘導するメカニズムを報告しています。Bcl-2の発現量や活性を抑える治療法との併用によってメベンダゾールの抗腫瘍効果を高める可能性が示唆されています(後述)
多形神経膠腫(glioblastoma multiforme)に対するメベンダゾールの効果は2011年に偶然に発見されました。
グリオブラストーマを移植したマウスを使った研究で、マウスにおけるギョウ虫の繁殖を防ぐ目的でフェンベンダゾール(Fenbendazole)を投与したマウスでは移植腫瘍が増大しないことが発見されました。フェンベンダゾールは動物に使われるベンゾイミダゾール系の寄生虫治療薬の一種です。
さらに研究を進め、ベンゾイミダゾール系薬物の中でメベンダゾールが最も強力にグリオブラストーマの増殖を抑制することが明らかになりました。
培養細胞の実験では、マウスのグリオーマ細胞株GL261に対するメベンダゾールの50%増殖抑制濃度(IC50)は0.24μM、ヒトのグリオブラストーマ細胞株(060919)に対するIC50は0.1μMでした。
グリオブラストーマ細胞をマウスに移植する動物モデルでメベンダゾールの経口投与(50mg/kg)は顕著に生存期間を延長(63%程度の延長)を示しました。(Neuro Oncol. 13(9): 974–982.2011年)
大腸がんに有効な抗がん物質の探索でもメベンダゾールは候補物質として同定されました。この研究では、1600種類の既存の医薬品が2種類の大腸がん細胞株(HCT116とRKO)を使って、その抗がん作用が検討され、64種類の物質が候補として残りました。
その中にbenzimidazoles 系の薬物(albendazole, mebendazole, oxybendazole and fenbendazole)があり、さらに メベンダゾールとアルベンダゾールの抗腫瘍効果が検討されました。
この2つが選択された理由は、すでに医薬品として認可され長く使用されており、臨床試験にすぐに入れるためと著者らは言っています。
白血病、大腸がん、脳腫瘍、悪性黒色腫に対して顕著な抗腫瘍活性を示しました。
大腸がんの細胞株に対しては80%の細胞株に対してメベンダゾールは抗腫瘍効果を示しました。
5種類の大腸がん細胞株(HCT 116, RKO, HT29, HT-8 and SW626)を用いた検討では、IC50はいずれの大腸がん細胞に対して5μM以下であり、正常細胞に対しては細胞毒性は認めませんでした。
抗がん剤耐性の乳がん細胞株(SKBr-3)を用いた研究では、ベンズイミダゾール類の薬物は増殖抑制効果を示し、メベンダゾールは最も強い抗腫瘍効果を示し、0.5μMの濃度で乳がん細胞の生存率を63.1%減少させました。(J Clin Exp Oncol 02(02) DOI: 10.4172/2324-9110.1000109)
犬の骨肉腫細胞を用いた研究でも、メベンダゾールは臨床的に達しうる濃度で骨肉腫細胞の細胞周期を停止させアポトーシスを誘導しました。
6)人間での抗腫瘍効果の研究:メベンダゾールの人間での抗腫瘍効果に関する臨床試験の結果は現時点ではまだ得られていませんが、2例の症例報告があります。
①転移した副腎皮質がんが長期間コントロールされた症例が2011年に報告されています。
副腎皮質がんは稀な悪性腫瘍で、切除できない場合は、有効な治療法がほとんどありません。
この症例では、複数の抗がん剤治療を受けたが効果が認められずに進行しました。
もう治療法が無いという段階になって、患者はPubmedの文献検索で、副腎皮質がんにメベンダゾールが抗腫瘍効果を示した前臨床研究の結果を見つけました。そして主治医に相談して、基礎研究での結果と比較的安全性が高い(毒性が低い)ことから、メベンダゾールの投与を了解しました。
メベンダゾールを1回100mgを1日2回投与する寄生虫治療の標準的な方法を用いて服用を開始。内服を開始して転移巣の縮小を認め、19ヶ月間の病状安定(がんが大きくならない)を認めました。副作用はほとんど認めず、生活の質(QOL)は最初の手術の前のレベルまで改善しました。
しかし、メベンダゾールの内服を開始して24ヶ月後に腫瘍の増大を認めたので、エベロリムス(everolimus)を追加したが、効果は認められませんでした。(Endocr Prac 17(3) e59–62 DOI: 10.4158/EP10390.CR)
②もう一例は大腸がんの転移に対してメベンダゾールを投与した症例が2013年に報告されています。
74歳男性の転移した進行性の大腸がんで、ファーストラインの抗がん剤としてカペシタビン+オキサリプラチン+bevacizumabを用い、効果が無くなってからはカペシタビン+イリノテカンによって治療されました。その後、標準的治療が効果を認めなくなった段階で、メベンダゾールが使用されました。
メベンダゾール単独で6週間経過後にCT検査を行うと、肺とリンパ節の腫瘍は完全奏功を示し、肝臓の転移も顕著な縮小を認めました。
しかしながら、肝機能が悪化(ASTとALTの上昇)したので、一時的にメベンダゾールの投与を中止し、肝機能が回復してから半分の量で開始しました。CT検査で腫瘍の縮小を認めました。
治療を中止して3ヶ月後に脳転移を認めたので放射線治療を受け、リンパ節転移が増大したため、メベンダゾールの効果は得られないという判断で治療は終了しています。
さらに5例がメベンダゾールで治療受け1例が部分縮小を認められています。(Acta Oncol 57(3) 427–8, 2013年)
7)臨床試験:がん治療におけるメベンダゾールの効果を検討する2件の臨床試験が現在進行中です。ともに脳腫瘍が対象です。
一つはジョンズ・ホプキンス大学で行われており、テモゾロマイド治療中の高悪性度グリオーマ患者を対象にした第1相の非盲検研究。
1日1500mg(500mgのメベンダゾール錠を1日3回服用)
テモゾロマイドとの併用での服用量の検討と有効性の検討が目的です。
もう一つの臨床試験は、ニューヨークのコーエン小児医療センター(Cohen Children’s Medical Centre)における低悪性度グリーマを対象に、ビンクリスチン、カルボプラチン、テモゾロマイドとの併用の第1相、第2相の予備試験です。併用によって治療効果が高まるかどうかの検討です。
100mg を1日2回、70週以上の治療期間で検討されています。
8)作用機序:寄生虫を死滅させる作用機序として、チュブリンの重合を阻害して、細胞の分裂に重要な役割を果たす微小管の働きを阻害する効果が提示されています。
微小管阻害としてパクリタキセル(商品名;タキソール)やビンクリスチンなどがあります。
パクリタキセル(paclitaxel)はチュブリン (tubulin) の重合を促進することにより微小管 (microtubule) を安定化し、がん細胞の分裂を阻害します。(微小管はαとβのチューブリンの2量体から形成され、タキソールはその内β-チューブリンに結合し、その重合を促進することにより抗がん作用を示す)
一方、メベンダゾールはチューブリンに結合して微小管の重合を阻害します。メベンダゾールはチューブリンのコルヒチン結合ドメインに結合します。

図:(上)微小管はαチュブリンとβチュブリンが結合したヘテロ二量体(ヘテロダイマー)を基本単位として構成され、チュブリンのヘテロ二量体が繊維状につながったものをプロトフィラメントと呼び、これが13本集まって管状の構造(直径25nm)を取ったものが微小管となる。(下)細胞分裂が行われる際、細胞の中ではDNAが複製され、複製されたDNAは微小管によって引き寄せられ、分裂後のそれぞれの細胞に分けらる。メベンダゾールはチュブリンに結合して微小管の重合を阻害し、細胞分裂のM期を停止させてアポトーシスを起こす。
高用量を服用すると副作用として脱毛、発疹、蕁麻疹、胃腸障害、白血球減少が起こります。
しかし、他の微小管阻害剤(タキサン系やビンカアルカロイド)で見られる末梢神経障害の報告はありません。
チュブリンのコルヒチン結合ドメインへの結合は神経障害を引き起こさないと言われています。
微小管阻害以外の作用機序の関与も指摘されています。
がん抑制遺伝子のp53に依存性の機序と非依存性の機序の関与が報告されており、p53が正常ながん細胞も変異したがん細胞にも抗腫瘍作用を示すことが報告されています。
血管新生阻害作用の関与も指摘されています(後述)。
微小管阻害剤のタキサン系やビンカアルカロイドを低用量でメトロノミックに使用すると免疫を活性化する作用があります。メベンダゾールにも免疫増強作用が示唆されています。
メベンダゾールと同じようにチュブリンのコルヒチン結合ドメインに結合して微小管重合を阻害し、副作用の少ない薬としてノスカピンがあります。ノスカピンは非麻薬性の中枢性鎮咳薬です。ノスカピンも血管新生阻害作用などの抗腫瘍効果が報告されています。
悪性黒色腫の細胞を使った実験では、アポトーシスを阻害するBcl-2をリン酸化して不活性してアポトーシスを誘導するBaxを活性化してアポトーシスを引き起こす作用が報告されています。(Bcl-2はBaxと直接結合して抑制的に調節している。Bcl-2がリン酸化されるとBaxがフリーになりBaxは別のBaxとホモダイマーを形成すると、アポトーシスが誘導されるというメカニズム)(Mol Cancer Res. 6(8): 1308-1315, 2008年)
メベンダゾールを中心に、メトロノミック・ケモテラピー(経口のシクロフォスファミドやビノレルビンの低用量投与)、ジクロフェナク(商品名ボルタレン)、セレコキシブ(商品名セレコックス)、メトホルミン(商品名メトグルコ)など、副作用が少なく安価で抗腫瘍効果が報告されている医薬品との併用で抗腫瘍効果が高まる可能性が指摘されています。
【メベンダゾールはVEGF受容体キナーゼ活性を阻害して血管新生を阻害する】
血管内皮細胞増殖因子受容体(Vascular Endothelial Growth Factor Receptor、VEGFR)は血管内皮細胞増殖因子(VEGF)をリガンドとする受容体型チロシンキナーゼの一種で、血管内皮細胞の増殖と遊走の促進や血管透過性の亢進などに関与しています。
がん細胞は腫瘍組織に対して酸素や栄養を運搬する血管を増やすため、VEGFの産生を亢進します。VEGFは血管内皮細胞のVEGFRを刺激することにより血管新生を促進します。
したがって、VEGF受容体の活性化を阻害する作用は血管新生を阻害する作用があり、腫瘍組織の増殖を阻止し、転移を抑制します。
VEGFRには幾つかのアイソフォームがありますが、血管新生に最も大きく関与しているVEGFR-2のチロシンキナーゼ活性を阻害する作用がメベンダゾールに指摘されています。

図:(左)血管内皮細胞の血管内皮細胞増殖因子受容体-2(VEGFR-2)に血管内皮細胞増殖因子(VEGF)が結合するとVEGFR-2は二量体を形成し、細胞内のチロシンキナーゼドメインに存在するチロシン残基の自己リン酸化が引き起こされ、細胞内のシグナル伝達系が活性化され、血管内皮細胞の増殖や血管形成が促進されて血管新生が促進する。(右)がん組織は増大するためにVEGFを分泌している。腫瘍組織を養う血管ができると増殖と転移が促進される。
医薬品の再開発(Drug Repositioning)では、受容体や転写因子などのターゲットの細胞内分子の構造の情報と、既存の医薬品や開発中の化合物の構造の情報から、コンピューターで活性を予測する方法でのスクリーニングが行われています。このようなin silico(コンピューターの中)での探索研究でメベンダゾールがVEGFR-2と結合して、その活性を阻害する作用が報告されています。
そして実際に血管内皮細胞を使った実験で、メベンダゾールがVEGFR-2に結合してその活性を阻害し、血管内皮細胞の増殖や遊走や血管新生を阻止することが確認されています。(J Cancer Res Clin Oncol 139:2133–2140 , 2013年)
また、メベンダゾールは血管の平滑筋細胞の増殖を抑制する効果も報告されています。以下のような論文があります。
Mebendazole reduces vascular smooth muscle cell proliferation and neointimal formation following vascular injury in mice.(メベンダゾールはマウスにおける血管傷害によって起こる血管平滑筋細胞の増殖と新生内膜形成を減少する)PLoS One. 2014 Feb 27;9(2):e90146. doi: 10.1371/journal.pone.0090146. eCollection 2014.
【要旨】メベンダゾールは寄生虫治療薬(駆虫薬)でその作用は寄生虫の微小管の働きを阻害することによって発揮する。血管平滑筋細胞の増殖によって引き起こされる血管病変の治療にメベンダゾールの有効性を検討する目的で、培養細胞を使った実験系とマウスの動脈を傷害する実験系において、血管平滑筋細胞の増殖に対するメベンダゾールの効果を検討した。
マウスの培養平滑筋細胞を用いた実験では、メベンダゾールは平滑筋細胞の増殖と移動を阻害し、この作用は細胞内の微小管の構築の変化と関連していた。
生体内での血管平滑筋細胞への作用を検討するために、メベンダゾールを投与したマウスと非投与マウス(コントロール)において、大腿動脈をワイアで傷をつけて病理学変化を比較した。動脈傷害後の血管平滑筋細胞の増殖と移動と新生内膜の形成はメベンダゾール投与マウスではコンロトールのマウスに比べて阻害された。
血管は機械的損傷を受けると、傷を修復する過程で平滑筋細胞が増殖し、新生内膜の形成が起こります。マウスを使った実験では、マウスの大腿動脈にガイドワイアで傷害する実験モデルがよく使用されます。この論文でも、マウスの大腿動脈をワイアで傷つける実験系でメベンダゾールを内服させておいたマウスでは、血管平滑筋の増殖と新生内膜の形成が抑制されるという実験結果を報告しています。したがって、メベンダゾールは動脈硬化など血管平滑筋細胞の増殖が関与する血管性疾患の治療に有用かもしれないという趣旨の考察です。
メベンダゾールは血管内皮細胞だけでなく血管平滑筋細胞の増殖も抑えるので、効果的な血管新生阻害作用による抗腫瘍活性が期待できることを示唆しています。
以上の最近の報告から、メベンダゾールはがんの代替医療に直ぐに利用する根拠はあると言えます。
参考文献:
Repurposing Drugs in Oncology (ReDO)—mebendazole as an anti-cancer agent(腫瘍学における医薬品の適応外使用:抗がん剤としてのメベンダゾール)
Ecancermedicalscience. 2014; 8: 443.Published online Jul 10, 2014. doi: 10.3332/ecancer.2014.443
以下のサムネイルをクリックするとYouTubeの解説に移行します。
https://www.youtube.com/watch?v=EXYNCs0iyH8
◉メベンダゾール治療についてはこちらへ:
画像をクリックするとサイトに移行します。
| « 400) 医薬品の... | 402)医薬品の... » |






