がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
733)膠芽腫(グリオブラストーマ)の代替療法(その5):医薬品再利用のまとめ
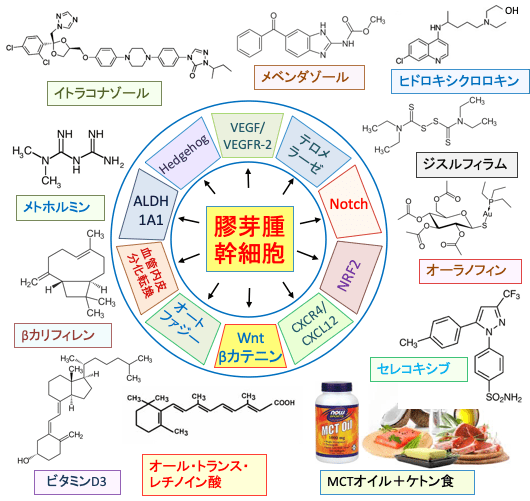
図:膠芽腫(グリオブラストーマ)を根治するには膠芽腫幹細胞を死滅しなければならいない。膠芽腫幹細胞を死ににくくしている幹細胞特性の維持には、HedgehogやNotchやWnt/βカテニンなど様々なシグナル伝達系が関与している。ケトン食や複数の既存の医薬品を組み合わせることによって、がん幹細胞特性維持に関与しているシグナル伝達系やタンパク質を阻害すると、膠芽腫幹細胞を死滅することができる。ケトン食以外に膠芽腫の治療のための医薬品再利用の候補として、メベンダゾール、イトラコナゾール、ヒドロキシクロロキン、オールトランス・レチノイン酸、ビタミンD3、β-カリオフィレン、ジスルフィラム、オーラノフィン、セレコキシブなどがある。
733)膠芽腫(グリオブラストーマ)の代替療法(その5):医薬品再利用のまとめ
【膠芽腫(グリオブラストーマ)の治療法はこの15年間ほとんど進歩していない】
膠芽腫は悪性脳腫瘍の中で最も頻度の高い腫瘍で、頭蓋内腫瘍の約10%を占めます。
膠芽腫の発症からの生存期間中央値は12ヶ月〜14ヶ月程度であり、5年生存率は10%以下とされています。治療成績はここ30年以上、ほとんど改善がないと言われています。
初発腫瘍の治療としては、開頭手術で腫瘍部分を可能な限り摘出し、その後、放射線治療(30回分割で60グレイの局所照射)と抗がん剤のテモゾロミド(テモダール)の併用治療を行って,退院後に外来でテモゾロミド(月に5日間)を維持療法として追加するというのが標準治療になっています。
膠芽腫細胞は周囲の脳組織にしみ込むように広がっているので、MRIの画像上で全摘出したつもりでも膠芽腫細胞が残ることが多く、残ったがん細胞を死滅するために放射線治療とテモゾロミドの併用治療が行われます。
放射線治療単独と放射線治療+テモゾロミドの併用治療を比較した2件の臨床試験で、放射線治療+テモゾロミドの生存期間延長効果が証明され、2005年に報告されています。したがって、手術+放射線+テモゾロミド治療は2005年からは世界中で標準治療となっています。
しかし、これは、2005年以降、治療法の進歩が無いことを意味します。
再発したときには様々な治療法が提案されていますが,まだ確立された標準治療はありません。
【標準治療が膠芽腫の再燃を促進する可能性が指摘されている】
アバスチン(一般名:ベバシズマブ)はVEGF(血管内皮細胞増殖因子)に対するモノクローナル抗体の製剤で、血管新生阻害作用があります。
放射線壊死の治療に対する有効性は証明されていますが、膠芽腫自体に対する有効性(延命効果)は複数の臨床試験で否定されています。
逆にがんを悪化させる可能性が指摘され、初期治療にはアバスチンは使用しない方が良いことになっています。アバスチンは放射線化学療法の効果を減じる可能性があることなどが指摘されています。腫瘍細胞の浸潤能が高まり,腫瘍が広範囲に広がる可能性も指摘されています。
血管新生阻害はがん治療では多くの場合、抗がん剤治療の奏功率や生存率を高めますが、膠芽腫の場合はいろんな理由でそうでは無いようです。
他の悪性腫瘍と比較しても膠芽腫は極めて再発しやすい腫瘍です。そこには何らかの理由が存在するはずです。その理由がわかれば、再発予防の対策を立てることができます。
その理由の一つとして、手術や抗がん剤治療や放射線治療が膠芽腫の再発(再燃)を促進することが、多くの研究で指摘されています。
がんを消滅することを目標に行った治療が、がん細胞の増殖を促進し、再発を誘導している可能性があるという指摘です。
手術や抗がん剤治療や放射線治療はがん幹細胞の増殖と血管新生を促進する作用があります。
放射線照射と抗がん剤投与によってがん組織が強くダメージを受けると、がん細胞やがん組織の間質にいる線維芽細胞などからダメージを受けたがん組織を修復するため様々な炎症性サイトカインやケモカインや増殖因子などが産生されます。
このような因子によって血管内皮前駆細胞が骨髄から動員されて、血管形成が促進されて、がん細胞の増殖や転移が促進することが明らかになっています。
骨髄の血管内皮前駆細胞はケモカイン受容体のCXCR4を持っているので、がん組織から産生されるケモカインのCXCL12によってがん組織に動員されて血管新生が促進されるのです。

図:がん組織には線維芽細胞(がん関連線維芽細胞)が存在する(①)。がん関連線維芽細胞はケモカインのCXCL12を分泌する(②)。CXCL12はがん細胞に発現するケモカイン受容体CXCR4に結合することによって、がん細胞の増殖や浸潤や転移を促進する(③)。がん組織から産生されるCXCL12は骨髄から血管内皮前駆細胞(CXCR4を発現している)をがん組織に動員して腫瘍血管を増生する(④)。高用量の抗がん剤治療や放射線照射は組織を損傷することによってがん細胞のCXCR4の発現を高め、がん関連線維芽細胞からのCXCL12の産生を増やす(⑤)。その結果、がん細胞の増殖や浸潤や転移を促進する(⑥)。したがって、抗がん剤や放射線治療中はがん間質細胞からのCXCL12の産生とがん細胞のCXCR4の発現や活性を阻害すると、がん治療に伴うがん細胞の悪化を防げる。
【複数の再利用医薬品を組み合わせた治療が注目されている】
膠芽腫の治療と併用して抗腫瘍効果を高める方法にケトン食が有効です。
私自身、8年くらい前から膠芽腫の患者さんにケトン食を勧めていますが、確実な抗腫瘍効果を感じています。
膠芽腫に対するケトン食の有効性は以下のサイトにまとめています。
http://www.f-gtc.or.jp/ketogenic-glioblastoma.html
さらに、膠芽腫を根治するためにはがん幹細胞をターゲットにして、膠芽腫幹細胞の幹細胞特性を阻止することが重要であることと、医薬品再利用を使った治療法を729話、730話、731話、732話で解説しました。
医薬品の再利用あるいは転用(英語ではDrug repositioningあるいは Drug Repurposing)と言われる方法で膠芽腫幹細胞をターゲットにする治療法が試みられています。
例えば、米国のバーモント大学とドイツのウルム大学の研究グループが、9種類の医薬品を組合せたCUSP9(Coordinated Undermining of Survival Paths;「生存経路の協調的弱体化」)という治療法を提案しています。
この治療法では、アプレピタント(aprepitant)、アルテスネイト(artesunate)、オーラノフィン(auranofin)、カプトリル(captopril)、 セレコキシブ(celecoxib)、ジスルフィラム(disulfiram)、イトラコナゾール(itraconazole)、 セルトラリン(sertraline)、リトナビル(ritonavir)の9種類の薬を組合せています。
これらは全てがん以外の治療目的で広く使用されている薬です。
個々の薬は、膠芽腫(グリオブラストーマ)の生存や増殖を促進する経路の一つあるいは幾つかを阻害する作用があります。このような生存のために経路を阻害することによって、膠芽腫に対する標準的ながん治療の効果を高めることができると報告しています。
それぞれ単独では抗腫瘍効果が弱くても複数の薬を組み合せることによって、膠芽腫細胞の生存や増殖に働いている複数の経路や因子を阻害して、治療に役立てることが可能かもしれないという話です。
これらの薬は比較的安価です。複数の再利用医薬品を組み合わせた治療を行うと、治療に抵抗性が高い膠芽腫でも根治が可能になります。
この際、1)大きな腫瘍があって標準治療を行っている場合に、がん細胞の感受性を高める方法と、2)目に見えるがん細胞が存在しない場合に再発(再燃)を防ぐ方法は分けて考える必要があります。
たとえば、2-デオキシグルコースはがん細胞に取り込まれて解糖系を阻害することによって放射線治療や抗がん剤の感受性を高める目的で有効です。したがって、腫瘍が存在するときには2-デオキシグルコースは極めて有効です。しかし、原発の腫瘍を治療して目にみえるがん細胞が無い状況での再発予防の目的では2-デオキシグルコースはあまり効果がありません。
がん細胞がほとんどいないので、服用した2-デオキシグルコースは正常細胞の方に取り込まれる率が高いので、がん細胞の増殖を抑える相対的効果は極めて弱くなります。
一方、ケモカインのCXCR4/CXCL12シグナル伝達系は、血管新生を誘導し、さらに生き残ったがん幹細胞の増殖を促進するので、CXCR4/CXCL12シグナル伝達系の阻害剤は治療後の再発(再燃)の予防に役立ちます。
CXCR4/CXCL12シグナル伝達系は手術や放射線や抗がん剤の刺激によって活性化されるので、治療後にCXCR4/CXCL12シグナル伝達系の阻害を積極的に行うことは再燃抑制に有効です。
手術や抗がん剤治療や放射線治療を受けたら安心というのではなく、これらの治療によって引きおこされる可能性のある悪影響に積極的に対処しないと、膠芽腫を根治することは困難だと思います。
逆に言えば、そのような対処を適切に実践すれば、膠芽腫を根治できる可能性を高めることができます。
【ケモカインのCXCR4/CXCL12シグナル伝達系が再発を促進する】
抗がん剤や放射線治療が、様々なメカニズムでケモカインのCXCL12とその受容体のCXCR4のシグナル伝達系を活性化し、さらに血管新生を促進する機序で再発を促進していると考えられています。
幾つかの抗がん剤はがん細胞の酸化ストレスを高めてがん細胞を死滅させます。がん細胞を死滅させるだけの十分な酸化ストレスが与えられれば、がん治療に有効ですが、完全に死滅できなければ、逆にがん細胞を悪化させることになります。
このように、通常の高用量の抗がん剤投与を行うと、血管の増生やがん細胞の浸潤性や転移性が亢進することになり、そのメカニズムとしてケモカインCXCL12とその受容体CXCR4の関与が重要と考えられています。
CXCL12はStrtomal derived factor 1(間質由来因子1)とも呼ばれ、本来は炎症などにおいてリンパ球や造血幹細胞の移動に関与しています。
がん関連線維芽細胞はCXCL12のようなケモカインだけでなく、様々な増殖因子や活性酸素を産生することによってがん細胞の増殖や浸潤を促進しています。
そして、抗がん剤や放射線によって強いダメージを受けると、損傷を受けたがん組織のダメージを修復する目的でケモカインや増殖因子を産生して血管内皮前駆細胞やマクロファージを動員し、その結果、がん細胞の増殖や浸潤は促進され、がんはさらに悪化するという経過を辿ることになります。
これが、高用量の抗がん剤治療がうまくいかない理由の一つです。
抗がん剤治療のターゲットはがん細胞だけでなく、間質の細胞(線維芽細胞やマクロファージなど)とがん細胞の相互作用についても十分に考慮することが重要です。
治療によってがん細胞を死滅しているのですが、その行為自体ががん細胞の増殖と血管新生と亢進し、がん幹細胞の幹細胞特性を維持し、がん幹細胞の生存と増殖と浸潤と転移を促進するので、再発(再燃)を促進する結果になっていると考えられます。
これが、膠芽腫の治療後にほとんどの例で再発が起こる理由と思われます。CXCR4/CCL12シグナル伝達系を阻害すると膠芽腫幹様細胞の生存率を低下させることが報告されています。以下の様な報告があります。
Inhibition of CXCL12/CXCR4 autocrine/paracrine loop reduces viability of human glioblastoma stem-like cells affecting self-renewal activity(CXCL12 / CXCR4オートクリン/パラクリンループの阻害は、自己複製活性に影響を与えるヒト神経膠芽腫幹様細胞の生存率を低下させる)Toxicology. 2013 Dec 15;314(2-3):209-20.
【要旨の抜粋】
ケモカインCXCL12とその受容体CXCR4は、膠芽腫の細胞株と初代培養細胞における増殖、浸潤、血管新生を制御しているが、膠芽腫幹細胞におけるそれらの活性についてはほとんど知られていない。
膠芽腫の不均一性から予測されるように、個々の培養で異なるレベルの発現と分泌が観察されたが、5つのヒト膠芽腫から単離された膠芽腫幹細胞がCXCR4を発現し、in vitroでCXCL12を放出することが明らかになった。
CXCL12添加は、Aktを介した有意な生存促進および自己複製活性を誘導したが、増殖促進作用は軽度であった。
CXCR4アンタゴニスト(阻害剤)のAMD3100は、CXCL12の量が多い培養条件でより効果的に自己複製と生存を減少させた。これは、膠芽腫幹細胞の生存と自己複製においてCXCR4シグナル伝達系が重要な役割を担っていることを示している。
同じ膠芽腫に由来する分化した膠芽腫細胞に対してはCXCR4アンタゴニストのAMD3100は生存率の低下を示さなかったことから、膠芽腫幹細胞の生存維持におけるCXCL12の特異性が示された。
限られた数の腫瘍サンプルで得られた結果ではあるが、これらの結果は、CXCL12/CXCR4シグナル伝達系が膠芽腫幹細胞の生存と自己複製能に高い選択性で関与することを示唆している。
つまり、CXCR4/CXCL12経路の阻害は、膠芽腫幹細胞の生存と自己複製能を阻害して幹細胞を死滅させる効果が期待できると言えます。
膠芽腫の増殖と生存を阻止する方法としてCXCR4/CXCL12シグナル伝達系とVEGF/VEGFR2シグナル伝達系の2つをターゲットにすることは有効です。
そのような作用がある代替療法として、ヒドロキシクロロキン、アセチル-L-カルニチン、シリマリン、β-カリオフィレン、セレコックス、メベンダゾール、イトラコナゾール、ニトロキソリンなどの併用は試してみる価値があると言えます。
これらはいずれも比較的安価で、副作用の少ない「医薬品再利用(Drug RepositioningあるいはDrug Repurposing)」の例です。

図:膠芽腫のがん組織微小環境(①)では、炎症細胞やがん関連線維芽細胞がケモカインのCXCL12を分泌する(②)。ケモカイン受容体のCXCR4(③)はGタンパク質共役受容体で、これにCXCL12が結合することによって細胞内のシグナル伝達系が活性化される(④)。このCXCR4/ CXCL12シグナル伝達系の活性化は、がん細胞の増殖と運動性を亢進し、生存・浸潤・転移能を亢進し、がん幹細胞特性の維持を促進し、抗がん剤や放射線に対する抵抗性を亢進する(⑤)。血管内皮細胞の血管内皮細胞増殖因子受容体-2(VEGFR-2)に血管内皮細胞増殖因子(VEGF)が結合すると(⑥)、VEGFR-2は二量体を形成し、チロシンキナーゼドメインに存在するチロシン残基の自己リン酸化が引き起こされ、細胞内のシグナル伝達系が活性化され、血管内皮細胞の増殖や血管形成が促進されて血管新生が促進する(⑦)。がん微小環境内におけるCXCR4-CXCL12シグナル伝達系とVEGF/VEGFR-2シグナル伝達系の活性化は膠芽腫細胞の再発と増殖を促進する(⑧)。ヒドロキシクロロキン、アセチル-L-カルニチン、β-カリオフィレン、シリマリン, セレコキシブはCXCR4/ CXCL12シグナル伝達系を阻害し(⑨)、ヒドロキシクロロキン、アセチル-L-カルニチン、メベンダゾール、ニトロキソリン、イトラコナゾールはVEGF/VEGFR-2シグナル伝達系を阻害する(⑩)。これらを組み合わせると膠芽腫の治療後の再発を防げる。
【オートファジー阻害は膠芽腫幹細胞の生存を低下させる】
ヒドロキシクロロキンは前述のCXCR4-CXCL12シグナル伝達系とVEGF/VEGFR-2シグナル伝達系の両方を阻害します。ヒドロキシクロロキンはオートファジーを阻害して抗がん作用を発揮することが知られています。
オートファジーの阻害は膠芽腫の治療にも有効です。以下の様な報告があります。
The impact of autophagy during the development and survival of glioblastoma(膠芽腫細胞の発生および生存におけるオートファジーの影響)Open Biol. 2020 Sep;10(9):200184.
【要旨の抜粋】
ゲノム研究により、腫瘍の成長を促進する受容体型チロシンキナーゼの増幅など、膠芽腫発生の主要な促進要因が特定されている。
治療を改善するには、細胞増殖と治療への耐性を促進する膠芽腫細胞の生存反応プロセスを理解することが重要である。
そのようなプロセスの1つはオートファジーである。オートファジーは小胞に隔離された細胞成分をリソソームで分解する異化経路である。
オートファジーは細胞の恒常性を維持する上で重要な役割を果たし、栄養素や酸素の供給低下などのストレス状態の間、および抗がん剤治療に応答してオートファジーが亢進される。
さらに、オートファジーは、腫瘍の成長を促進するために、がん細胞の増殖促進シグナル伝達と代謝を調節する。
このレビューでは、膠芽腫細胞の発生と生存にオートファジーがどのように関係しているかについての現在の知見について解説する。
オートファジー (Autophagy) は、細胞内のタンパク質を分解するための仕組みの一つです。
「auto-」はギリシャ語の「自分自身」を表す接頭語で「phagy」は「食べること」の意で、「自食(じしょく)」と日本語訳されています。
オートファジーは細胞内タンパクや小器官を二重の脂質膜で包み込み,これをリソソームに輸送して分解する仕組みです。
細胞は栄養飢餓に陥るとオートファジーにより細胞内のタンパク質や細胞内小器官の一部を分解および再利用し、細胞の生存に必要なエネルギーやアミノ酸を得ています。
細胞が飢餓条件下におかれると、細胞質に隔離膜と呼ばれる扁平な小胞が現れます。その後、膜は細胞質内の異常タンパク質や細胞内小器官を取り込みながら伸長し、先端どうしが融合して、オートファゴソームが形成されます。 オートファゴソームがリソソームと融合して内包物は分解されます。自己消化で得られたアミノ酸は栄養源として再利用されます。

図:細胞質に隔離膜と呼ばれる扁平な小胞が現れ、異常なタンパク質や細胞内小器官を取り込む(①)。その後、膜は細胞質を取り込みながら伸長し(②)、先端どうしが融合して、オートファゴソームが形成される(③)。 オートファゴソーム内にはミトコンドリアなどの大きなオルガネラも含まれる。オートファゴソームがリソソームと融合すると(④)、内包物は分解される(⑤)。自己消化で得られたアミノ酸は栄養源として再利用される。
がん細胞は急速な増殖による高い栄養要求性を有しており、増殖するとともに栄養飢餓状態になりやすく、そこでがん細胞はオートファジーを利用することにより増殖や転移に必要なアミノ酸をリサイクルして細胞死を回避していると考えられています。
がん細胞のオートファジーを阻害すると、がん細胞を死滅でき、がん細胞の抗がん剤感受性を高めると一般的に考えられています。
オートファジーの役割は、飢餓状態を生き抜くために自己消化することで栄養源を確保していると一般には理解されています。
がん細胞も、栄養飢餓による細胞死を防ぐためにオートファジーを利用していることが知られています。オートファジー阻害作用のあるヒドロキシクロロキンが膠芽腫に対する抗がん剤治療の効果を高めることが報告されています。以下のような報告があります。
Hydroxychloroquine potentiates the anti-cancer effect of bevacizumab on glioblastoma via the inhibition of autophagy.(ヒドロキシクロロキンはオートファジーを阻害することによって膠芽腫に対するベバシズマブの抗がん作用を増強する)Biomed Pharmacother. 2019 Oct;118:109339.
【要旨】
ベバシズマブは、再発性膠芽腫の患者の治療に広く使用されているが、ベバシズマブが細胞保護オートファジーを誘導し、腫瘍細胞の生存を助けていることが明らかになっている。
ヒドロキシクロロキンは、リソソームの酸性化を阻害し、オートファゴソームの融合と分解に影響を与えることでオートファジーをブロックする。
ヒドロキシクロロキンは、化学放射線療法の有効性を高めるためによく使用される。しかし、ヒドロキシクロロキンが膠芽腫細胞のベバシズマブに対する感受性を高めるかどうか、およびこの作用の分子メカニズムは明らかではない。
高濃度のベバシズマブがLN18およびLN229細胞株でLC3-II / LC3-I比を増加させ、Beclin1の分解を引き起こすことを示した。これは、高濃度のベバシズマブがLN18およびLN229細胞のオートファジーを誘導したことを示している。
しかし、ベバシズマブ(100μg/ ml)はLN18およびLN229細胞のオートファジーに影響を与えず、5μg/ ml未満のヒドロキシクロロキンはLC3B-IIおよびp62タンパク質を有意に蓄積し、オートファジープロセスを阻止した。
重要なことは、ヒドロキシクロロキン(5μg/ ml)がベバシズマブ(100μg/ ml)の抗がん効果を増強することである。したがって、ヒドロキシクロロキンは、オートファジーの阻害を介してに膠芽腫に対するベブシズマブの有効性を増強する可能性のある新しい戦略である。
抗がん剤治療で小胞体ストレスが亢進すると細胞に死滅しやすくなります。オートファジーは異常タンパク質を分解して小胞体ストレスを軽減すると同時に、タンパク質を分解してアミノ酸を再利用して増殖に使うことができます。
つまり、オートファジーはがん細胞を抗がん剤によるダメージから守る作用があります。したがって、抗がん治療にオートファジー阻害剤を併用すると抗がん剤の効き目を高めることができます。
ヒドロキシクロロキンは、マラリア、皮膚エリテマトーデス、全身性エリテマトーデスなどの治療薬として世界中で広く使用されています。
ヒドロキシクロロキン硫酸塩(商品名:プラケニル)は免疫調節薬に分類されており、免疫系を抑制することによって自己免疫疾患の活動性を抑制します。
ヒドロキシクロロキンががん治療で注目されている理由は、ヒドロキシクロロキンは細胞内のタンパク質を分解するオートファジーを阻害する作用があるためです。
オートファジー阻害薬はがん治療薬として開発が行われていますが、ヒドロキシクロロキンは現時点でFDA(米国食品医薬品局)が承認している医薬品の中でオートファジ阻害作用が証明されている唯一の医薬品です。
このオートファジー阻害作用は、がん細胞の細胞死を誘導し、抗がん剤感受性を高めます。
ヒドロキシクロロキンの効果をメタ解析した報告があります。
The clinical value of using chloroquine or hydroxychloroquine as autophagy inhibitors in the treatment of cancers:A systematic review and meta-analysis(がんの治療におけるオートファジー阻害剤としてのクロロキンまたはヒドロキシクロロキンを使用することの臨床的価値:系統的レビューとメタ分析)Medicine (Baltimore). 2018 Nov; 97(46): e12912.
【要旨】
背景:オートファジーは、異常なタンパク質や細胞内小器官の除去とリサイクルを行うリソソームを使った細胞内のメカニズムである。
オートファジーの異常ががんを含む様々な疾患の発症に関連していることが多くの研究で明らかになっている。がん治療におけるオートファジー阻害剤の使用が検討されているが、オートファジー阻害剤の有効性については議論の余地がある。
そこで、オートファジー阻害剤を使ったがん治療の臨床的価値を評価することを目的として、メタ分析を行った。
方法:オートファジー阻害剤を使ったがん治療を評価する臨床研究を検索した。これらの研究からデータを抽出して、全奏効率、6か月間の無増悪生存率、および1年全生存率率の相対リスク(RR)を評価した。
結果:7件の臨床試験が確認された(n = 293)。ヒドロキシクロロキン+ゲムシタビンの併用が2件、ヒドロキシクロロキン+ドキソルビシンの併用が1件、クロロキン+放射線の併用が1件、クロロキン+テモゾロミド+放射線の組み合わせが1件、およびヒドロキシクロロキンの単独療法が1件であった。
オートファジー阻害剤を併用しなかった場合に比べて、オートファジー阻害剤を併用したがん治療では、全奏功率(RR:1.33、95%信頼区間:0.95–1.86、P = .009)、6か月間の無増悪生存率(RR:1.72、95%信頼区間:1.05–2.82、P = .000 )、1年間の全生存率(RR:1.39、95%信頼区間:1.11–1.75、P = .000)はいずれも高かった。
結論:このメタ分析の結果は、化学療法や放射線療法においてオートファジー阻害剤の併用が治療効果を高めることを示しており、オートファジー阻害剤の併用はがん治療に新しい戦略を提供する可能性がある。
抗生物質のクラリスロマイシンもオートファジーを阻害する効果が報告されています。クラリスロマイシンとヒドロキシクロロキンは異なるメカニズムでオートファジーを阻害するので、この2つを併用するとオートファジーを強力に阻害できる可能性があります。

図:リボソームで合成されたタンパク質は小胞体で折り畳みや翻訳語修飾を受けて正常な機能を持ったタンパク質になる(①)。抗がん剤治療は小胞体にダメージを与え(②)、小胞体ストレスを引き起こし(③)、小胞体内で折畳み不全の異常タンパク質が増える(④)。異常タンパク質はオートファゴソームに取り込まれ(⑤)、リソソームと癒合してオートファジーのメカニズムで分解され、小胞体ストレスを軽減する(⑥)。ヒドロキシクロロキンとクラリスロマイシンはオートファジーの過程を阻害する(⑦)。したがって、抗がん剤とヒドロキシクロロキンとクラリスロマイシンを併用すると、小胞体ストレスが亢進し、小胞体内に異常タンパク質が凝集して蓄積し(⑧)、細胞機能が阻害されて細胞死が誘導される(⑨)。
【膠芽腫に対するメベンダゾールの抗腫瘍効果は偶然に発見された】
メベンダゾール(Mebendazole)はベンズイミダゾール系の広範囲作用型の寄生虫治療薬(駆虫薬)です。線虫、条虫(サナダムシ)、回虫など多くの寄生虫に広く作用します。日本でも、鞭虫感染症の治療に保険適用されています。
多形神経膠腫(glioblastoma multiforme)に対するメベンダゾールの効果は2011年に偶然に発見されました。
グリオブラストーマを移植したマウスを使った研究で、マウスにおけるギョウ虫の繁殖を防ぐ目的でフェンベンダゾール(Fenbendazole)を投与したマウスでは移植腫瘍が増大しないことが発見されました。
フェンベンダゾールは動物に使われるベンゾイミダゾール系の寄生虫治療薬の一種です。さらに研究を進め、ベンゾイミダゾール系薬物の中でメベンダゾールが最も強力にグリオブラストーマの増殖を抑制することが明らかになりました。
メベンダゾールは微小管の重合を阻害する作用、血管内皮細胞増殖因子受容体のキナーゼ活性を阻害して血管新生を阻害する作用が報告されています。
さらに、メベンダゾールはいくつかのプロテインキナーゼと作用して抗腫瘍活性を示すことが薬剤スクリーニングで明らかになっています。
メベンダゾールが「TRAF2およびNCK相互作用キナーゼ(TRAF2- and NCK-interacting kinase :TNIK)」の阻害剤として有用である可能性が報告されています。
TNIK(TRAF-2 and NCK-interacting kinase)はセリン・スレオニンキナーゼで、このキナーゼ活性(タンパク質をリン酸化する活性)はWnt/βカテニン経路の活性に必須です。
Wnt/βカテニン経路の最終段階であるβカテニンとTCFの相互作用において、TNIKはTCFのセリン154をリン酸化します。このリン酸化がβカテニン/TCFの遺伝子転写活性に必要です。
したがって、TNIKの阻害剤は大腸がんのようにWnt/βカテニンシグナル伝達系が亢進したがんの治療に有効と考えられており、多くの製薬会社が開発しています。まだ臨床的に使用できるものはありませんが、何十年も前から多くの国で使用されている駆虫薬のメベンダゾールが、TNIKの阻害剤としてかなり有望であることが報告されています(651話参照)。
【メベンダゾールの使用法】
メベンダゾールの副作用は極めて軽微ですが、抗がん作用を強めるために高用量を服用するときは肝障害など副作用にも注意が必要です。
消化管からの吸収率は20%程度で、服用後2~4時間で血中濃度はピークになります。脂肪の多い食事と一緒に服用すると吸収が高まります。10mg/kgの服用で最高濃度の平均は137.4ng/ml(0.47μM)という報告があります。シメチジンがメベンダゾールの薬物代謝酵素による分解を阻害し、血中濃度を1.5倍程度に高めるという報告があります。
シメチジン自体に抗腫瘍効果があるので、併用は有益という報告があります。シメチジンはヒスタミン受容体拮抗作用によって胃酸分泌を阻害する薬で、がんの転移や再発を予防する効果が臨床試験などで示されています。
通常、メベンダゾールは1日に体重1kg当たり5〜10mgを目安に服用します。体重60kgで1日に300mgから600mgを服用します。
初めは1日100mgから200mgで開始し、問題なければ1日300mg〜600mgに増やします。
メベンダゾールは食後に服用します。メベンダゾールは油に溶けるので、油の多い食事は吸収効率を高めます。
シメチジンを1日に400〜800mg服用します。シメチジンはそれ自体が抗腫瘍効果を示しますが、メベンダゾールの分解を抑制して血中濃度を高める効果があります。
メベンダゾールは消化管からの吸収が悪いので、消化管からの吸収を高め、分解を阻害して血中濃度を高めることがポイントです。そのためには、油脂の多い食事の後に服用するか、オリーブオイルなどの油と一緒に服用するのが良いと言えます。
メベンダゾールを分解する薬物代謝酵素を阻害するシメチジンやグレープフルーツの併用も有効ですが、シメチジンやグレープフルーツとの併用で血中濃度が高くなって副作用が出やすくなる医薬品がありますので、これらを併用するかどうかは服用中の他の薬との兼ね合いで決めます。
【イトラコナゾールはオールトランス・レチノイン酸の分化誘導作用を増強する】
がん組織の中にはがん幹細胞と呼べるような細胞が存在して通常のがん細胞を供給しながらがん組織を構成しています。
すなわち、無限に自己複製を行うがん幹細胞ががん組織中に少数存在し、不均等分裂により一部が自己複製のサイクルから逸脱して分化し通常のがん細胞となっているのです。
膠芽腫は神経幹細胞が悪性化した腫瘍です。膠芽腫の組織内にはがん幹細胞(膠芽腫幹細胞)が不均等分裂して成熟した膠芽腫細胞を作り出し、自己複製によって膠芽腫幹細胞を増やしています。
膠芽腫幹細胞は神経細胞やグリア細胞や血管細胞など他の細胞種に分化できる多分化能を持っています。

図:膠芽腫幹細胞は自己複製によって膠芽腫幹細胞を増やす(①)。幹細胞は非対称分裂を繰り返し、幹細胞自身と成熟した膠芽腫細胞を作る(②)。幹細胞は多分化能を持ち、神経細胞やグリア細胞や血管内皮細胞へ分化できる(③)。
オールトランス・レチノイン酸は不均等分裂(非対称分裂)を増やすことによってがん幹細胞を減らします。つまり、膠芽腫幹細胞から成熟膠芽腫細胞に分化誘導し、さらに正常な神経細胞やグリア細胞に分化させる効果があります。
ビタミンAは別名をレチノール(retinol)と言い、脊椎動物の発生過程、細胞分化、生殖、視覚、免疫系の調節などに重要な働きを行っているビタミンです。
レチノールは細胞内で代謝されてレチノイン酸に変換され、レチノイン酸が細胞核内の受容体に結合することによって遺伝子発現を誘導して様々な作用を発揮します。
レチノイン酸によって細胞分化や増殖に関連する500以上の遺伝子が誘導されると言われています。
ベータカロテンは体内でビタミンAに変換されます。ベータカロテンやビタミンA(レチノール)は食品から摂取され、レチノールは肝臓で貯蔵されて必要に応じて血中に放出され、血清濃度は1~2μMの範囲で維持されています。
細胞内に取り込まれたレチノールはまずレチノール脱水素酵素によってレチナールアルデヒド(レチナール)に変換され、さらにレチナールアルデヒド脱水素酵素によってオール・トランス・レチノイン酸(All-Trans Retinoic Acid:ATRA)になり、イソメラーゼで9-シス・レチノイン酸(9-cis RA)になります。ATRAと9-cis RAが遺伝子発現に関与します。(下図)

図:ベータカロテンとビタミンA(レチノール)は食品から摂取される。レチノールはレチノール脱水素酵素によってレチナールに変換され、さらにレチナールアルデヒド脱水素酵素によってオール・トランス・レチノイン酸(All-Trans Retinoic Acid: ATRA)になり、さらに9-シス・レチノイン酸(9-cis RA)になる。ATRAはレチノイン酸受容体(RAR)に結合し、9-cis RAはレチノイドX受容体(RXR)に結合し、レチノイン酸応答配列に結合して標的遺伝子の発現を誘導する。レチノイドによって誘導される遺伝子は細胞分化やアポトーシスの誘導や、細胞増殖を抑制する働きに関与するので、がん細胞の増殖を抑制する方向で働く。
レチノイド(retinoid)はビタミンA(レチノール)およびその誘導体や類縁化合物の総称で、生体内では活性型であるAll-trans retinoic acid (ATRA:オール・トランス・レチノイン酸)として細胞核内の受容体に結合して、その生理作用を発揮します。
レチノイン酸の核内受容体には、レチノイン酸受容体(retinoic acid receptor: RAR)とレチノイドX受容体(retinoid X receptor: RXR)があり、それぞれα、β、γのサブタイプが存在します。
これらの受容体はリガンドの結合刺激によりホモ二量体(RAR-RARやRXR-RXR)を形成しますが、RXRはRXRとのホモ二量体だけでなく、RARやPPARやビタミンD受容体(VDR)などの核内受容体とのヘテロ二量体(RAR-RXR、PPAR-RXR、VDR-RXRなど)も形成します。(「ホモ」は「同じ」、「ヘテロ」は「異なる」という意味で、同じ受容体が2つ並ぶのがホモ二量体で、異なる2種類の受容体が並ぶのがヘテロ二量体)
そして、これらの二量体は標的遺伝子のプロモーター領域に存在するレチノイン酸応答配列やレチノイドX応答配列、ペルオキシソーム増殖因子応答配列、ビタミンD応答配列などに結合することによって、様々な標的遺伝子の発現を調節しています。
異性体の関係にあるAll-trans-RA (ATRA) と 9-cis-RA (9C-RA)は2つともRARのリガンドになりますが、RXRのリガンドとなるのは9C-RAのみです。(異性体とは分子式は同じで、原子の結合状態や立体配置が違うために異なる性質を示す化合物)
レチノイン酸受容体(RAR)とレチノイドX受容体(RXR)には、それぞれのリガンドが入り込んで結合するポケット状の構造があるのですが、RARのリガンド結合ポケットにはATRAと9C-RAの両方のレチノイドが納められますが、RXRのリガンド結合ポケットには9C-RAしか納められなくて、ATRAははみ出すからRXRのリガンドとはなれないからです。
レチノイドは炭化水素鎖を基本骨格としており、炭素が水素で飽和している場合はまっすぐな構造をしますが、水素で飽和していない二重結合(CH=CH)の部分で構造が変わります。
すなわち、炭素間に二重結合がある所で曲がる時に、「シス型」と「トランス型」という2種類の構造を取ります。
「シス(cis)は「同じ側」「近い方」、トランス(trans)は「反対側」「遠い方」というような意味の接頭辞です。
つまり、二重結合の所でシス型は水素が同じ側に並び、トランス型は反対側に並びます。シス型の2重結合のところで炭化水素の鎖は曲がります。
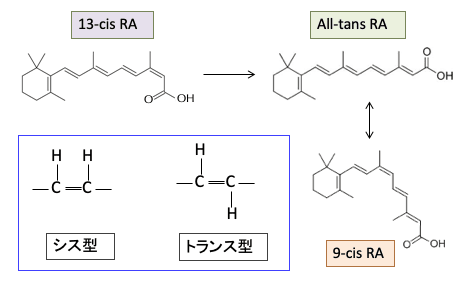
All-trans-RAは全ての不飽和炭化水素鎖がトランス型になっているレチノイン酸で、9-cis-RAというのは9番目の炭素のところでシス型の構造になっているレチノイン酸という意味です。
この構造の違いによって分子式(C20H28O2)は同じでも立体的な大きさに違いが生じるので、RARとRXRの2つの受容体のリガンド結合部位への親和性が異なるということです。
レチノイドによって発現が調節される遺伝子は、細胞の分化や増殖や死(アポトーシス)の制御に重要な働きを担っているため、その機能異常は細胞のがん化に関連し、ある種のがんに対してレチノイドが効く場合があります。
例えば、レチノイン酸の二重結合がすべてトランス型になったall-trans retinoic acid(ATRA)は急性前骨髄球性白血病の特効薬になっています。急性前骨髄球性白血病は白血球に分化する途中の骨髄細胞が腫瘍化した白血病で、オールトランスレチノイン酸によって途中で止まった分化を誘導することによって増殖能を失わせ、死滅させることができるのです。
免疫細胞の働きを抑制する骨髄由来抑制細胞の分化を誘導することによって抗腫瘍免疫を高める効果も報告されています。
難治性にきびの治療に用いられている13-cisレチノイン酸(イソトレチノイン)は、体内でAll-trans レチノイン酸に変換されて効果を発揮します(下図)。All-trans レチノイン酸は9-cis レチノイン酸に変換します。これらのレチノイドは単独では抗腫瘍効果は弱いのですが、他の治療との組合せで抗腫瘍効果が高まることが報告されています。

図:ビタミンAの体内における活性本体であるAll-trans retinoic acid(ATRA)はレチノイン酸受容体(RAR)に結合するとホモ二量体を形成し、標的遺伝子のプロモーター領域にあるレチノイン酸応答配列(RARE)に結合して遺伝子転写のスイッチをオンにする。ATRAの異性体である9-cis retinoic acidはレチノイン酸受容体(RAR)の他にレチノイドX受容体(RXR)にも結合して、ホモ二量体やヘテロ二量体を形成して細胞核内の受容体に結合して標的遺伝子の転写を誘導して生理機能を発揮する。13-cis retinoic acid(イソトレチノイン)はプロドラッグであり、細胞内でAll-trans RAに変換されて、同様の遺伝子発現の調節を行う。
オールトランス・レチノイン酸を用いたがん細胞の分化誘導は、膠芽腫の治療にも役立つと言えます。
オールトランス・レチノイン酸の分化誘導作用を強める方法としてビタミンD3(429話)、フェノフィブラート(370話)があります。
イトラコナゾールは、水虫等の白癬菌症、口腔や食道カンジダ症等に広く使用されている真菌治療薬です。
真菌のステロール生合成経路においてラノステロールから エルゴステロールを生成する 酵素を阻害します。エルゴステロールは真菌細胞膜の主成分であるため、エルゴステロールが生成されないと細胞膜を作れないので真菌は死滅します。
イトラコナゾールには強力な血管新生阻害作用が報告されています。さらに、哺乳類ラパマイシン標的タンパク質複合体1(mTORC1)シグナル伝達系阻害作用、ヘッジホッグシグナル伝達系の阻害作用、Wntシグナル伝達系阻害作用、コレステロールの細胞内輸送を阻害する作用、ミトコンドリアのVDAC1(電位依存性陰イオンチャネル)の働きを阻害する作用など多彩なメカニズムでの抗がん作用が報告されています。

図:イトラコナゾールは多彩にメカニズムで抗がん作用を発揮する。
イトラコナゾールはヘッジホッグシグナル伝達系を阻害して、がん幹細胞の幹細胞特性を阻害し、抗腫瘍効果を発揮する効果があります。
ビタミンDとメベンダゾールとニトロキソリンはヘッジホッグシグナル伝達系を阻害します。 ラパマイシンとメトホルミンはmTORC1を阻害します。ジスルフィラムはアルデヒド脱水素酵素を阻害します。これらを組み合わせると、がん幹細胞の幹細胞特性(Stemness)を阻害して、がん幹細胞を死滅できます(下図)。

図: PI3K/Akt/mTOR経路とヘッジホッグ(Hedgehog)経路は、自己複製能や不均等分裂などのがん幹細胞の性質(Stemness)を維持する上で重要な役割を果たしている(①)。アルデヒド脱水素酵素1A1はがん幹細胞で過剰に発現し、幹細胞の性質の維持に重要な働きを担っている(②)。PI3K/Akt/mTOR経路は増殖因子や栄養によって活性化され、セリン・スレオニンキナーゼのmTORを活性化して様々なタンパク質をリン酸化して活性化することによって細胞の増殖を促進する(③)。ヘッジホッグ・シグナル伝達系は細胞膜にある受容体のPatched-1 (PTCH-1)にソニック・ヘッジホッグ(SHh)が結合することによって開始され、smoothened(SMO)を介してシグナルが伝達され、転写因子のGLIの活性化によって細胞の増殖や分化を制御する(④)。これらの経路を阻害するとがん幹細胞の増殖を抑え、抗がん剤感受性を高めることができる。ラパマイシンはmTORC1を阻害する(⑤)。メトホルミンはAMP活性化プロテインキナーゼ(AMPK)を活性化してmTORC1の活性化を阻害する(⑥)。ヘッジホッグ経路の阻害剤としてはイトラコナゾール、メベンダゾール、ビタミンD3、ニトロキソリンがある。(⑦)アルデヒド脱水素酵素1A1の阻害剤として断酒薬のジスルフィラムがある(⑧)。これらを併用すると多くのがん細胞の抗がん剤感受性を高めることができる。
オールトランス・レチノイン酸(ATRA)で誘導される遺伝子の中に、ATRAを分解する薬物代謝酵素のチトクロームP450酵素のCYP26(CYP26A1とCYP26B1)があります。つまり、ATRAを投与しても、ATRAを分解するCYP26A1の発現を誘導するので、ATRAの効果が減弱します。
イトラコナゾールはCYP26を阻害する作用があります。

図:ビタミンA(レチノール)はTransthyrenin(TTR)とレチノール結合タンパク(Retinol Binding Protein: RBP)と結合して血中に存在し(①)、細胞膜のSTRA6(Stimulated by Retinoic Acid 6)という受容体を介して細胞内に入る(②)。細胞内では細胞内レチノール結合タンパク(Cellular Retinol Binding Protein: CRBP)に結合し(③)、レチノール脱水素酵素によってレチナール(レチナールアルデヒド)に変換され(④)、さらにレチナールアルデヒド脱水素酵素によってオール・トランス・レチノイン酸(ATRA)に変換される(⑤)。ATRAはイソメラーゼで9-シス・レチノイン酸(9-cis RA)に変換される(⑥)。ATRAはレチノイン酸受容体(RAR)に結合し(⑦)、9-cis RAはレチノイドX受容体(RXR)に結合して(⑧)標的遺伝子のレチノイン酸応答配列に結合して遺伝子転写を促進する。その結果、がん幹細胞の分化誘導、アポトーシスの誘導、細胞増殖抑制などの抗腫瘍効果を発揮する(⑨)。ATRAはチトクロームP450酵素のCYP26で分解される(⑩)。CYP26の発現はATRAで誘導される(⑪)。イトラコナゾールはCYP26の活性を阻害する(⑫)。したがって、イトラコナゾールはATRAの遺伝子発現誘導作用を増強する。
ATRAとビタミンD3とフェノフィブラートを使った膠芽腫の分化誘導療法は、ATRAを分解する酵素が誘導されるため、十分な効果が得られません。
最近はATRAを分解するCYP26A1とCYP26B1の阻害剤を併用することが検討されています。 この目的でイトラコナゾールを併用することは試してみる価値があります。
以上から、膠芽腫を根治する方法として、ケトン食を実践し、さらに医薬品再利用として、メベンダゾール、イトラコナゾール、ヒドロキシクロロキン、オールトランス・レチノイン酸、ビタミンD3、β-カリオフィレン、ジスルフィラム、オーラノフィン、セレコキシブなどを、治療の状況に応じて併用することを検討するのが良いと思います。
私自身の診療経験では、開業した18年前は、膠芽腫に対する補完・代替医療としてはサリドマイド+セレコキシブくらいしか手段はありませんでした。
2008年頃からミトコンドリアを活性化するジクロロ酢酸が膠芽腫に有効という報告があり、ジクロロ酢酸を使い出しました。
さらに2011年に膠芽腫のがん幹細胞の抗がん剤感受性を高める方法として、国立がんセンターと山形大学医学部の研究グループは、FoxO3aという転写因子の活性化が有効であることを示し、FoxO3aを活性化する薬として経口糖尿病薬のメトホルミンの有効性を指摘しています。 それ以来、メトホルミン、ジクロロ作酸、2-デオキシグルコースを併用する様になり、さらに2012年頃からケトン食を積極的に利用する様になってから、明らかに治療成績が向上しました。
さらに、数年前からメベンダゾール、イベルメクチンを追加すると、さらに治療成績が向上し、最近はNotchやWnt/βカテニンやHedgehog経路やCXCR4/CXCL12経路をターゲットにするヒドロキシクロロキン、イトラコナゾール、分化誘導法のオールトランス・レチノイン酸とビタミンD3を併用する様になって、膠芽腫の根治も可能と思う様になりました。
手術+放射線+テモゾロミドだけでは、ほとんど根治は期待できません。ケトン食と膠芽腫幹細胞をターゲットにした「医薬品再利用」による治療法を併用すれば根治も可能だと、最近は思っています。
これらは全て比較的安価です。膠芽腫だけでなく多くのがんの治療に試してみる価値はあると思います。
新刊紹介:膠芽腫(グリオブラストーマ)の根治を目指す補完・代替医療
本書はプリント・オン・デマンド(Print on Demand)という出版形式で書店では販売していません。アマゾンからの購入になります。
アマゾンからの購入はこちらへ:
| « 732)膠芽腫(... | 734)がんにな... » |




