がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
732)膠芽腫(グリオブラストーマ)の代替療法(その4):血管模倣と分化誘導療法
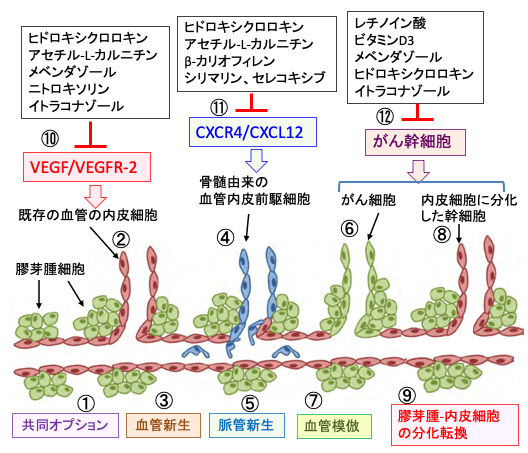
図:膠芽腫は様々なメカニズムで血流を確保している。がん細胞が既存の正常血管を利用することを共同オプション(Co-option)という(①)。がん細胞などからのVEGF(血管内皮細胞増殖因子)が血管内皮細胞に発現するVEGFR-2(VEGF受容体2)に結合すると血管内皮細胞が増殖し(②)、既存の血管が分岐・発芽して血管新生(Angiogenesis)が起こる(③)。ケモカインのCXCL12とその受容体のCXCR4は、骨髄から血管内皮前駆細胞を動員して新しい血管を形成する(④)。これを脈管形成(Vasculogenesis)という(⑤)。さらにがん細胞自身が血管と類似の脈管を形成する(⑥)。これを血管模倣(Vascular mimicry)という(⑦)。がん幹細胞は血管内皮細胞と同じ形態と機能を有する細胞に分化して血管を作ることもできる(⑧)。これを膠芽腫-内皮細胞の分化転換(glioblastoma-endothelial cell transdifferentiation)という(⑨)。VEGF/VEGFR-2シグナル伝達系(⑩)とCXCR4/CXCL12シグナル伝達経路(⑪)とがん幹細胞の幹細胞特性(⑫)を阻害すると、がん組織の血液供給を阻止してがん細胞の増殖を抑制できる。その方法として、医薬品再利用(Drug Repositioning)によるがん補完・代替療法の研究領域では、レチノイン酸、ビタミンD3、メベンダゾール、ヒドロキシクロロキン、イトラコナゾール、アセチル-L-カルニチン、βカリオフィレン、シリマリン、セレコキシブ、ニトロキソリンなどが候補薬物として注目されている。
732)膠芽腫(グリオブラストーマ)の代替療法(その4):血管模倣と分化誘導療法
【「血管新生を阻害すればがんは成長できない」は必ずしも正しくない】
がん治療における血管新生阻害の根拠は、「血管ができなければ腫瘍は数mm以上に成長したり、他の部位に転移することはできない」という考えです。
細胞が生きていくためには、酸素や栄養素が絶えず供給されなければなりません。毛細血管から酸素や栄養素が拡散して細胞に届く距離は数百μmmと言われています。つまり、血管ができなければ、がん組織は1~2mm以上の大きさには成長できないことになります。酸素や栄養素が届かないと細胞は死ぬからです。また、血管ができなければ、転移も起こりません。
がん細胞は増殖するために、自らを養う血管を作る必要があります。すなわち、細胞が酸素不足になると、がん細胞自らが、血管内皮細胞増殖因子(VEGF)などの血管を作るために必要な増殖因子を産生して、腫瘍組織を養う血管を作ろうとするのです。これを血管新生(angiogenesis)と言います。
血管新生(angiogenesis)とは既存の血管から新しい血管が形成される現象です。1970年代の初頭にハーバード大学のMoses Judah Folkman博士らは、腫瘍がある一定以上の大きさ(1-2mm3)になるには、栄養分と酸素を供給するための血管の新生が必要であることを示し、血管新生の抑制ががん細胞の増殖抑制につながる可能性を示しました。
その後、血管新生を調節する機能分子が次々に同定され、血管新生の抑制を目的とした薬剤の開発が進められました。
腫瘍における血管新生の基本的な機序は、がん細胞から分泌された血管内皮細胞増殖因子(VEGF)が、血管内皮細胞膜上のVEGF受容体(VEGFR)に結合し、VEGFRのチロシンキナーゼドメインの活性化を介して細胞内シグナル伝達を亢進し、これにより内皮細胞の増殖と遊走を刺激し、さらに管腔形成に至ると推定されています。
血管新生の場合は、新たにできる血管の内皮細胞は正常な血管内皮細胞です。
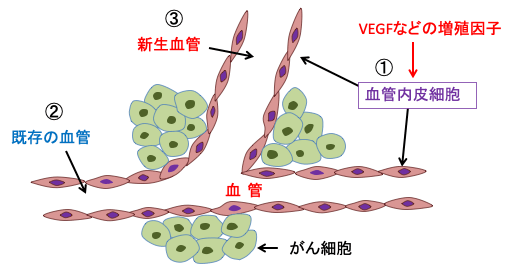
図:血管内皮細胞にがん細胞などから産生・分泌されるVEGF(血管内皮細胞増殖因子)などの血管新生促進因子が作用すると(①)、既存の血管(②)の内皮細胞の増殖と遊走が刺激されて、血管が分岐あるいは発芽する様に、新生血管が作られる(③)。新生血管は既存の血管と同じ正常な血管内皮細胞から作られる。
正常な血管内皮細胞の増殖を阻害する治療は、ターゲットが正常細胞なので耐性ができにくいと考えられ、がん治療法として有望視されてきました。
VEGFの産生・分泌やVEGFRの活性化の抑制が血管新生阻害のターゲットになっています。
例えば、ベバシズマブ(Bevacizumab;商品名はアバスチン)は、血管内皮細胞増殖因子(VEGF)に対するモノクローナル抗体で、VEGFの働きを阻害することにより、血管新生を抑えたり腫瘍の増殖や転移を抑えたりする作用を発揮します。
サリドマイドは腫瘍血管の新生を促進するVascular Endothelial Growth Factor(VEGF,血管内皮増殖因子)、Tumor Necrosis Factor-α(TNF-α,腫瘍壊死因子アルファ)、Interleukin(IL)-6やIL-8の産生や活性を抑えます。

図:がん組織から血管内皮細胞増殖因子(VEGF)などの血管新生を促進する増殖因子が分泌される(①)。VEGFは血管内皮細胞の増殖や血管形成を促進して新生血管を作る(②)。腫瘍組織を養う血管が増えると増殖と転移が促進される(③)。ベバシズマブやサリドマイドなどを使って血管新生促進因子の活性を阻害することは、血管新生を阻害し、がん細胞の増殖を抑制できる(④)。
血管の新生を促進するVEGF(血管内皮細胞増殖因子)などの増殖因子とその受容体の働きを阻害すれば、血管新生を阻止してがん細胞の増殖を抑えることができると思われます。
医薬品再利用によるVEGF/VEGFR-2をターゲットにした血管新生阻害の方法としてヒドロキシクロロキン、アセチル-L-カルニチン、メベンダゾール、ニトロキソリン、イトラコナゾールがあります(729話参照)。いずれも副作用が比較的少ない薬です。
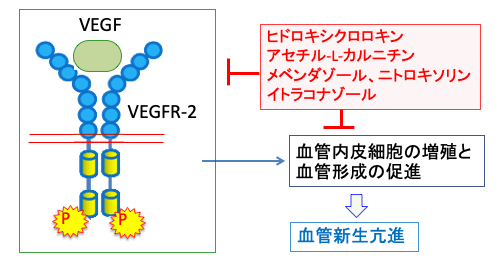
図:血管内皮細胞の血管内皮細胞増殖因子受容体-2(VEGFR-2)に血管内皮細胞増殖因子(VEGF)が結合すると、VEGFR-2は二量体を形成し、チロシンキナーゼドメインに存在するチロシン残基の自己リン酸化が引き起こされ、細胞内のシグナル伝達系が活性化され、血管内皮細胞の増殖や血管形成が促進されて血管新生が促進する。ヒドロキシクロロキン、アセチル-L-カルニチン、メベンダゾール、ニトロキソリン、イトラコナゾールはVEGF/VEGFR-2シグナル伝達系を阻害する。
しかし、血管内皮細胞増殖因子(VEGF)に対するモノクローナル抗体のベバシズマブ(Bevacizumab;商品名はアバスチン)の抗腫瘍効果は限定的です。膠芽腫に対するベバシズマブの臨床試験の結果では生存期間の延長効果は認められていません。
その理由は、ベバシズマブでは抑制できない血管新生があるためです。
つまりVEGFに依存しない血管新生の機序が存在するので、ベバシズマブを投与しても、膠芽腫組織への血液供給を阻止できないためです。
【膠芽腫ではVEGFに依存しない血管新生が多い】
前述の様に、VEGF(血管内皮細胞増殖因子)の働きを阻害するベバシズマブ(アバスチン)の複数の臨床試験で延命効果が認められていません。その理由は、VEGFに依存しない血管新生の寄与が大きいためと考えられています。次の様な総説論文があります。
Mechanisms of Glioma-Associated Neovascularization(神経膠腫関連の血管新生のメカニズム)Am J Pathol. 2012 Oct; 181(4): 1126–1141.
【要旨】
成人で最も一般的な原発性脳腫瘍である膠芽腫は、化学療法および放射線療法に対する耐性を特徴としている。 膠芽腫の特徴の1つは、豊富で異常な血管系である。
神経膠腫における正常血管のハイジャック(vascular co-option)、血管新生(angiogenesis)、および脈管形成(vasculogenesis)のプロセスは広く説明されている。
しかし、最近、神経膠腫において血管新生が起こるメカニズムはこれら3つのプロセスだけではないことが明らかになった。
さらに、これらのプロセスは広範囲に相互作用し、それらの間で潜在的な重複が認められる。
神経膠腫が血管新生を達成する少なくとも5つのメカニズムが提唱されている:血管のハイジャック(vascular co-option)、血管新生(angiogenesis)、脈管形成(vasculogenesis)、血管模倣(vascular mimicry)、および(最近説明された)神経膠芽腫-内皮細胞の分化転換(glioblastoma-endothelial cell transdifferentiation)である。
神経膠腫の血管新生におけるこれらのメカニズムをレビューし、各プロセスにおける低酸素症と神経膠腫幹細胞の役割に特に重点を置いて解説する。
これらのプロセスのいくつかは十分に解明されているが、他のプロセスは最近特定されたばかりであり、完全な検証のためにさらに検討する必要がある。
また、神経膠腫の血管新生を標的とする戦略と、これらの治療戦略に対する耐性の発達についてもレビューする。
最後に、これらの複雑なプロセスがどのように相互リンクおよびオーバーラップするかについて説明する。
ここでレビューした5つのプロセスを制御するメカニズムを完全に理解することは、膠芽腫の特徴である治療抵抗性を解決するのに役立つ。
この論文では、膠芽腫は以下の5つのメカニズムで血流を確保しているということです。
① 共同オプション(Co-option):がん細胞が既存の正常血管を利用すること。「ハイジャックする」という表現もされている。
② 血管新生(Angiogenesis):正常な血管内皮細胞がVEGFによって増殖が促進され、既存の血管が分岐・発芽してが起こる。
③ 脈管形成(Vasculogenesis):骨髄から血管内皮前駆細胞を動員して、新たな脈管を形成する。
④ 血管模倣(Vascular mimicry):がん細胞が血管と類似の脈管を形成する
⑤ 膠芽腫-内皮細胞の分化転換(glioblastoma-endothelial cell transdifferentiation):がん幹細胞が血管内皮細胞と同じ形態と機能を有する細胞に分化して血管を作ること
つまり、これら全ての過程を阻止しないと、膠芽腫の血流を止めることはできないということです。

図:がん細胞が既存の正常血管を利用することを共同オプション(Co-option)という(①)。正常な血管内皮細胞が増殖し、既存の血管が分岐・発芽して血管新生(Angiogenesis)が起こる(②)。骨髄から血管内皮前駆細胞を動員して新しい血管が形成される(③)。これを脈管形成(Vasculogenesis)という。さらにがん細胞は血管と類似の脈管を形成し、これを血管模倣(Vascular mimicry)という(④)。がん幹細胞は血管内皮細胞と同じ形態と機能を有する細胞に分化して血管を作ることもできる(⑤)。これを膠芽腫-内皮細胞の分化転換(glioblastoma-endothelial cell transdifferentiation)という。
【ケモカインのCXCR4/CXCL12シグナル伝達系が新たな脈管の新生を促進する】
共同オプション(Co-option)のCo-optionは 辞書によると「人・分派などを)吸収すること」、「反対者などを大きな集団に吸収する、引き入れる」とあります。
Co-optionは腫瘍血管形成の最初のステップであり、血管供給を受けていない腫瘍細胞が腫瘍周囲の正常組織に存在する既存の正常血管を取り込んでいく(ハイジャックする)過程を指します。
膠芽腫では、がん細胞がびまん性に浸潤し、著明な血管新生が無くても、正常の血管を取り込む co‒ option によって血管新生を伴わない血流を手に入れます。
さらに、がん組織における血管の新生や増生において、ケモカインとケモカイン受容体が重要な働きをしていることが明らかになっています。
ケモカイン(chemokine)とは細胞遊走活性を主機能とするサイトカインの一群で、様々な細胞の移動や局在を制御に関与している低分子量(8~12 kDa)のタンパク質です。
炎症性疾患や自己免疫疾患などの発症や病態に重要な役割を果たし、またがん細胞の増殖や転移にも関与しています。
ケモカインがケモカイン受容体に結合すると受容体の種類に応じた細胞内シグナル伝達系が活性化され、細胞の移動や増殖や生存や遺伝子発現などが亢進されます。
がん細胞の場合には、ある種のケモカイン受容体の活性化が浸潤や転移を亢進しています。(下図)

図:ケモカイン受容体はGタンパク質に共役した7回膜貫通型の受容体(Gタンパク質共役受容体)で、これにケモカインが結合することによって細胞内のシグナル伝達系が活性化されて、細胞の移動や増殖の制御に関わる。多数のケモカインとケモカイン受容体が知られており、生体内で多彩な細胞の活動を制御している。
ケモカインはよく保存された4個のシステイン残基の配置からCXC、CC、XC、CX3Cの四つのサブファミリーに分類されます。CXCおよびCX3Cケモカインでは最初と2番目のシステイン残基の間に1あるいは3個のアミノ酸残基が存在し、CCサブファミリーではそれらは連続しています。
全てのケモカインはGタンパク質共役受容体のケモカイン受容体を活性化して作用します。
現在までに、ケモカインは50種類程度、ケモカイン受容体は約20種類が見つかっており、その機能は極めて多彩で複雑です。
臓器や組織は恒常的あるいは炎症などの刺激によりケモカインを放出し、ケモカイン受容体を発現する細胞(リンパ球など)はケモカインの濃度勾配や発現部位に従って移動(遊走)します。どのリンパ球がどの臓器に移行するかは,ケモカインと受容体の種類によって厳密に制御されています。
がん細胞の転移や血管新生においてはケモカイン受容体CXCR4とそのリガンド(受容体に結合して活性化する物質)のCXCL12のシグナル伝達系が重要と考えられています。
CXCL12はSDF-1(stromal cell-derived factor 1)とも呼ばれます。
血管新生に関与する血管内皮前駆細胞(endothelial progenitor cells)はCXCR4を発現しているので、がん組織の線維芽細胞などがCXCL12を多く分泌すると血管内皮前駆細胞をがん組織に集めて血管新生を促進します。
つまり、CXCL12-CXCR4シグナル伝達系を阻害することは、がん細胞の増殖や転移を抑制する効果が得られることになります。
がん関連線維芽細胞や血管内皮前駆細胞はがん組織にリクルートされた正常細胞ですが、がん細胞の味方になってがん細胞の増殖や浸潤を支えていることになります。がん関連線維芽細胞や血管内皮前駆細胞はがん治療のターゲットになります。
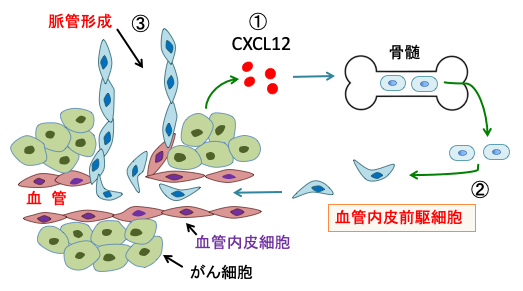
図:がん組織から産生されるケモカインのCXCL12(①)は、骨髄から血管内皮前駆細胞(CXCL12の受容体を持つ)を動員して新しい血管を形成する(②)。これを脈管形成(Vasculogenesis)という(③)。
膠芽腫の微小環境では、炎症細胞やがん関連線維芽細胞がケモカインのCXCL12を分泌しています。CXCL12がケモカイン受容体のCXCR4に結合することによって細胞内のシグナル伝達系が活性化されます。このCXCR4/ CXCL12シグナル伝達系の活性化は、がん細胞の増殖と運動性を亢進し、生存・浸潤・転移能を亢進し、がん幹細胞特性の維持を促進し、抗がん剤や放射線に対する抵抗性を亢進します。
医薬品再利用によるCXCR4/ CXCL12シグナル伝達系の阻害法としてヒドロキシクロロキン、アセチル-L-カルニチン、β-カリオフィレン、シリマリン, セレコキシブなどが報告されています(729話参照)。

図:膠芽腫の微小環境では、がん細胞や炎症細胞やがん関連線維芽細胞がケモカインのCXCL12を分泌する。CXCL12は骨髄の血管内皮前駆細胞のCXCR4に結合し、このCXCR4/ CXCL12シグナル伝達系の活性化は、血管内皮前駆細胞の増殖と運動性を亢進し、骨髄から血管内皮前駆細胞を動員する。その結果、新たな脈管の形成が促進される。ヒドロキシクロロキン、アセチル-L-カルニチン、β-カリオフィレン、シリマリン, セレコキシブはCXCR4/ CXCL12シグナル伝達系を阻害することによって、骨髄の血管内皮前駆細胞の動員を阻止できる。
【オールトランス・レチノイン酸は膠芽腫細胞の血管模倣を抑制する】
以下の様な報告があります。
Vasculogenic mimicry is a prognostic factor for postoperative survival in patients with glioblastoma(血管模倣は、膠芽腫患者の術後生存の予後因子である)J Neurooncol. 2013 May;112(3):339-45.
【要旨の抜粋】
以前の報告では、神経膠腫における血管模倣の存在と臨床的重要性が確認されている。しかし、膠芽腫における血管模倣の臨床的重要性に関する結論は、少数の患者グループに基づいているため、説得力がない可能性がある。
本研究の目的は、膠芽腫における血管模倣の臨床的重要性を再評価することである。
患者は、CD34および過ヨウ素酸シッフ染色に従って血管模倣陽性または血管模倣陰性に分類された。
血管模倣と患者の臨床的特徴との関連を分析した。コックス回帰ハザードモデルを使用して、全生存期間の独立した予後因子を特定するために、単変量解析と多変量解析が実行された。カプランマイヤー法を使用して生存時間を推定し、ログランク検定を使用して比較した。
86例の膠芽腫のうち、23例が血管模倣を有することが判明した。膠芽腫における血管模倣の存在は、性別、年齢、カルノフスキーのパフォーマンスステータス、水頭症、腫瘍量、微小血管密度、腫瘍再発、または腫瘍切除の程度とは関連していなかった。
単変量解析と多変量解析により、血管模倣が全生存期間の独立した予後因子であることが明らかになった。
血管模倣のある患者の生存期間の中央値は11.17か月であったが、血管模倣のない患者では16.10か月であった(P = 0.017)。
この血管模倣に加えて、年齢が65歳以上、カルノフスキーのパフォーマンスステータスが60以下、大きな腫瘍量が患者の生存の重要な予後因子であった。
私たちのデータは、血管模倣が新たに診断された膠芽腫の独立した有害な予後因子である可能性があることを示唆しており、この結果を確定するためにさらなる前向き研究が必要である。
膠芽腫の病理組織の検査で血管模倣が多いと予後が不良という結果です。
血管模倣を抑制する方法としてレチノイドのオールトランス・レチノイン酸の有効性が示唆されています。以下の様な報告があります。
All-trans retinoic acid impairs the vasculogenic mimicry formation ability of U87 stem-like cells through promoting differentiation(オールトランスレチノイン酸は、分化を促進することにより、U87幹様細胞の血管模倣形成能力を損なう)Mol Med Rep. 2015 Jul;12(1):165-72.
【要旨】
多形性膠芽腫に対する従来の抗血管新生療法の不十分な治療効果は、がん幹細胞によって促進される血管模倣(vasculogenic mimicry)に起因する可能性がある。
分化を促進する強力な薬であるオールトランスレチノイン酸(ATRA)は、特定の悪性腫瘍のがん幹細胞を根絶できることが報告されている。
本研究の目的は、U87神経膠芽腫がん幹細胞の血管模倣形成能力に対するATRAの影響を調査することである。
U87神経膠芽腫がん幹細胞を同定するために、がん幹細胞マーカーCD133およびネスチンの発現を免疫細胞化学を使用して検出した。
さらに、これらの神経膠芽腫がん幹細胞の分化は、免疫蛍光染色を使用してグリア線維性酸性タンパク質(glial fibrillary acidic protein)、β-チューブリンIII、およびガラクトシルセラミダーゼ(galactosylceramidase)の発現を検出することによって評価された。
グリア線維性酸性タンパク質、β-チューブリンIII、ガラクトシルセラミダーゼの発現レベルはATRA投与によって用量依存的に亢進した。さらに、ATRAは、U87神経膠芽腫がん幹細胞の増殖、侵襲性、管形成、および血管内皮増殖因子(VEGF)分泌を有意に減少させた。
結論として、がん幹細胞の血管模倣形成能力は細胞の分化と負の相関があることが示された。したがって、これらの結果は、ATRAが膠芽腫細胞の血管模倣形成を減少させる作用によって、神経膠芽腫の治療のための有望な新規薬剤として役立つ可能性があることが示唆された。
膠芽腫の成長は血管新生に依存しています。 したがって、血管新生阻害療法は腫瘍の進行を抑制するための有望な戦略であると考えられてきました。
しかし、従来の血管新生阻害療法が腫瘍の悪性度を高める可能性があるという証拠が増えています。これは、血管模倣が原因で発生することが示唆されています。
血管模倣は、悪性度の高い腫瘍細胞による血液伝導チャネルの形成として定義されています。 血管模倣の存在が膠芽腫患者の術後生存の予後因子であることが示唆されています。 したがって、血管模倣形成を抑制するための効果的なアプローチの解明は、膠芽腫の治療において重要と考えられています。
【膠芽腫幹細胞は血管内皮細胞へ分化して血管を形成できる】
膠芽腫幹細胞が血管内皮細胞に分化して血管を作ることが明らかになっています。これは膠芽腫-内皮細胞の分化転換(glioblastoma-endothelial cell transdifferentiation)と呼ばれています。
膠芽腫幹細胞が血管内皮細胞に分化することは2010年にNatureに報告されています。以下の様な論文があります。
Tumour vascularization via endothelial differentiation of glioblastoma stem-like cells.(膠芽腫幹様細胞の血管内皮分化を介した腫瘍血管新生)Nature. 2010 Dec 9;468(7325):824-8.
【要旨】
膠芽腫は高度に血管増生性の悪性腫瘍であり、その新生血管は既存の脳内毛細血管の発芽(sprouting)によって生じると考えられている。膠芽腫幹様細胞が膠芽腫組織を維持しているという最近の証明は、これらの膠芽腫幹様細胞が分化してできる細胞が神経系統に限定されていない可能性を示唆している。
正常な神経幹細胞は、機能的な内皮細胞に分化することができる。
神経幹細胞と血管内皮細胞の間の接続は、がん幹細胞が血管ニッチと密接に相互作用し、血管内皮増殖因子(VEGF)および間質由来因子1(stromal-derived factor 1)の放出を通じて血管新生を促進する神経膠芽腫において重要である。
ここでは、膠芽腫組織の血管の内皮細胞の平均60.7%(範囲20〜90%)が腫瘍細胞と同じゲノム変化を持っていることを示し、血管内皮のかなりの部分ががん細胞起源であることを示している。
免疫不全のマウスにヒト膠芽腫を移植した腫瘍組織の血管において、がん細胞の血管模倣による血管内皮細胞が存在していた。
膠芽腫幹細胞のin vitroの培養で血管内皮細胞の形態と機能的特徴を有する細胞を生成した。
同様に、免疫不全のマウスに膠芽腫幹細胞を同所注射または皮下注射すると、腫瘍異種移植片が生成され、そのがん組織の血管は主にヒト内皮細胞で構成されていた。
マウス異種移植片において膠芽腫幹細胞によって生成された内皮細胞を選択的に標的化する治療は、腫瘍の縮小および変性をもたらす。これらの発見は、腫瘍の脈管形成の新しいメカニズムを説明し、いくつかの悪性腫瘍におけるがん細胞由来の内皮様細胞の存在を示唆している。
マウスにヒトの膠芽腫細胞を移植したら、増殖してきた膠芽腫組織内の血管の内皮細胞の60%がヒト細胞であったということです。
通常の血管新生であれば、がん組織がヒト由来でも、血管はマウス由来というのがそれまでの常識でしたが、この論文では、マウスに膠芽腫細胞を移植して増殖したがん組織の中の血管の内皮細胞が人の遺伝子を持ち、移植した膠芽腫細胞と同じ遺伝子変異を持っていたと報告しています。
つまり、膠芽腫幹細胞が血管内皮細胞に分化誘導されて血管を形成しているということです。
【オールトランス・レチノイン酸は膠芽腫幹細胞の分化を誘導する】
膠芽腫幹細胞が血管内皮細胞に分化して血管を作るということであれば、この血管内皮細胞への分化を阻止する治療が有効と言えます。レチノイドのオールトランス・レチノイン酸にそのような作用が報告されています。以下のような報告があります。
All-trans retinoic acid therapy induces asymmetric division of glioma stem cells from the U87MG cell line(オールトランスレチノイン酸療法は、U87MG細胞株からの神経膠腫幹細胞の非対称分裂を誘発する)Oncol Lett. 2019 Oct; 18(4): 3646–3654.
【要旨】
悪性神経膠腫に対して現在の治療の効果が不十分な理由は、対称的に分裂することが実証されている神経膠腫幹細胞に起因すると考えられている。オールトランスレチノイン酸(ATRA)による分化は、経膠腫幹細胞を標的とするものと考えられており、特定の悪性腫瘍のがん幹細胞を根絶する能力があると報告されている。
本研究の目的は、U87MG神経膠芽腫細胞株から単離された経膠腫幹細胞の分裂様式に対するATRAの影響を調査することである。
経膠腫幹細胞マーカーのCD133およびネスチンの発現を免疫細胞化学を使用して検出し、神経膠腫幹細胞の同定に用いた。
さらに、これらの経膠腫幹細胞の分化能は、免疫蛍光染色を使用してグリア線維性酸性タンパク質(glial fibrillary acidic protein)、β-チューブリンIIIおよびガラクトシルセラミダーゼの発現を検出することによって評価された。
Numbタンパク質の分布は、神経膠腫幹細胞の分割後の2つの娘細胞で分析された。
本研究の結果は、Numbタンパク質が膠芽腫細胞の分裂中に2つの娘細胞に対称的に分離されることを示した。
さらに、本研究は、ATRAによる治療が神経膠腫幹細胞の非対称細胞分裂を増加させることを示した。
結論として、これらの結果は、ATRAによって誘導される神経膠腫幹細胞の非対称分裂による治療効果を示唆している。
組織の細胞には幹細胞(stem cell)と成熟した体細胞が存在します。
組織の幹細胞とは、組織固有の多分化能を有して各臓器・組織を構成する細胞の供給源となる細胞です。
組織幹細胞は自己複製によって幹細胞を維持すると同時に、非対称分裂(不均等分裂)により一部が自己複製のサイクルから逸脱して成熟細胞へと分化して、組織を構成する細胞(体細胞)を作り出しています。
組織幹細胞は、分裂して自分と同じ細胞を作り出すことができ(自己複製能)、またいろいろな細胞に分化できる(多分化能)という二つの重要な性質を持ち、この性質により、限られた寿命のある体細胞を絶えず供給し、傷ついた組織を修復することができるのです。
がん組織の中にも正常組織における幹細胞システムに類似した階層性が存在し、その中にがん幹細胞 (cancer stem cells)と呼べるような細胞が存在して通常のがん細胞を供給しながらがん組織を構成していることが明らかになっています。
すなわち、無限に自己複製を行うがん幹細胞ががん組織中に少数存在し、不均等分裂により一部が自己複製のサイクルから逸脱して分化し、通常のがん細胞となっているのです。
多くの場合、このがん幹細胞の起源は通常の組織幹細胞と考えられています。すなわち、組織幹細胞に遺伝子変異が蓄積して、がん幹細胞になるというわけです。
細胞ががん化するためには、複数のがん遺伝子やがん抑制遺伝子に異常が重なる必要があるため、短期間でアポトーシスで死滅する運命の成熟(=分化)した細胞に遺伝子変異が生じても、がん細胞に変化するとは考えにくく、「組織に持続的に存在する幹細胞の遺伝子に変異が蓄積することによってがん細胞(=がん幹細胞)が発生する」と考えられています。
膠芽腫は神経幹細胞が悪性化した腫瘍です。膠芽腫の組織内にはがん幹細胞(膠芽腫幹細胞)が不均等分裂して成熟した膠芽腫細胞を作り出し、自己複製によって膠芽腫幹細胞を増やしています。
膠芽腫幹細胞は神経細胞やグリア細胞や血管細胞など他の細胞種に分化できる多分化能を持っています。
したがって、オールトランス・レチノイン酸は不均等分裂(非対称分裂)を増やすことによってがん幹細胞を減らし、血管内皮細胞への分化も阻止できるということです。

図:膠芽腫幹細胞は自己複製によって膠芽腫幹細胞を増やす(①)。幹細胞は非対称分裂を繰り返し、幹細胞自身と成熟した膠芽腫細胞を作る(②)。幹細胞は多分化能を持ち、神経細胞やグリア細胞や血管内皮細胞へ分化できる(③)。
【ベータカロテンとレチノールとレチノイン酸の関係】
ビタミンAは別名をレチノール(retinol)と言い、脊椎動物の発生過程、細胞分化、生殖、視覚、免疫系の調節などに重要な働きを行っているビタミンです。
レチノールは細胞内で代謝されてレチノイン酸に変換され、レチノイン酸が細胞核内の受容体に結合することによって遺伝子発現を誘導して様々な作用を発揮します。
レチノイン酸によって細胞分化や増殖に関連する500以上の遺伝子が誘導されると言われています。
ベータカロテンは体内でビタミンAに変換されます。ベータカロテンやビタミンA(レチノール)は食品から摂取され、レチノールは肝臓で貯蔵されて必要に応じて血中に放出され、血清濃度は1~2μMの範囲で維持されています。
細胞内に取り込まれたレチノールはまずレチノール脱水素酵素によってレチナールアルデヒド(レチナール)に変換され、さらにレチナールアルデヒド脱水素酵素によってオール・トランス・レチノイン酸(All-Trans Retinoic Acid:ATRA)になり、イソメラーゼで9-シス・レチノイン酸(9-cis RA)になります。ATRAと9-cis RAが遺伝子発現に関与します。(下図)

図:ベータカロテンとビタミンA(レチノール)は食品から摂取される。レチノールはレチノール脱水素酵素によってレチナールに変換され、さらにレチナールアルデヒド脱水素酵素によってオール・トランス・レチノイン酸(All-Trans Retinoic Acid: ATRA)になり、さらに9-シス・レチノイン酸(9-cis RA)になる。ATRAはレチノイン酸受容体(RAR)に結合し、9-cis RAはレチノイドX受容体(RXR)に結合し、レチノイン酸応答配列に結合して標的遺伝子の発現を誘導する。レチノイドによって誘導される遺伝子は細胞分化やアポトーシスの誘導や、細胞増殖を抑制する働きに関与するので、がん細胞の増殖を抑制する方向で働く。
【レチノイドは細胞分化を誘導する】
レチノイド(retinoid)はビタミンA(レチノール)およびその誘導体や類縁化合物の総称で、生体内では活性型であるAll-trans retinoic acid (ATRA:オール・トランス・レチノイン酸)として細胞核内の受容体に結合して、その生理作用を発揮します。
レチノイン酸の核内受容体には、レチノイン酸受容体(retinoic acid receptor: RAR)とレチノイドX受容体(retinoid X receptor: RXR)があり、それぞれα、β、γのサブタイプが存在します。
これらの受容体はリガンドの結合刺激によりホモ二量体(RAR-RARやRXR-RXR)を形成しますが、RXRはRXRとのホモ二量体だけでなく、RARやPPARやビタミンD受容体(VDR)などの核内受容体とのヘテロ二量体(RAR-RXR、PPAR-RXR、VDR-RXRなど)も形成します。(「ホモ」は「同じ」、「ヘテロ」は「異なる」という意味で、同じ受容体が2つ並ぶのがホモ二量体で、異なる2種類の受容体が並ぶのがヘテロ二量体)
そして、これらの二量体は標的遺伝子のプロモーター領域に存在するレチノイン酸応答配列やレチノイドX応答配列、ペルオキシソーム増殖因子応答配列、ビタミンD応答配列などに結合することによって、様々な標的遺伝子の発現を調節しています。
異性体の関係にあるAll-trans-RA (ATRA) と 9-cis-RA (9C-RA)は2つともRARのリガンドになりますが、RXRのリガンドとなるのは9C-RAのみです。(異性体とは分子式は同じで、原子の結合状態や立体配置が違うために異なる性質を示す化合物)
レチノイン酸受容体(RAR)とレチノイドX受容体(RXR)には、それぞれのリガンドが入り込んで結合するポケット状の構造があるのですが、RARのリガンド結合ポケットにはATRAと9C-RAの両方のレチノイドが納められますが、RXRのリガンド結合ポケットには9C-RAしか納められなくて、ATRAははみ出すからRXRのリガンドとはなれないからです。
レチノイドは炭化水素鎖を基本骨格としており、炭素が水素で飽和している場合はまっすぐな構造をしますが、水素で飽和していない二重結合(CH=CH)の部分で構造が変わります。
すなわち、炭素間に二重結合がある所で曲がる時に、「シス型」と「トランス型」という2種類の構造を取ります。
「シス(cis)は「同じ側」「近い方」、トランス(trans)は「反対側」「遠い方」というような意味の接頭辞です。 つまり、二重結合の所でシス型は水素が同じ側に並び、トランス型は反対側に並びます。シス型の2重結合のところで炭化水素の鎖は曲がります。(下図)
All-trans-RAは全ての不飽和炭化水素鎖がトランス型になっているレチノイン酸で、9-cis-RAというのは9番目の炭素のところでシス型の構造になっているレチノイン酸という意味です。
この構造の違いによって分子式(C20H28O2)は同じでも立体的な大きさに違いが生じるので、RARとRXRの2つの受容体のリガンド結合部位への親和性が異なるということです。
レチノイドによって発現が調節される遺伝子は、細胞の分化や増殖や死(アポトーシス)の制御に重要な働きを担っているため、その機能異常は細胞のがん化に関連し、ある種のがんに対してレチノイドが効く場合があります。
例えば、レチノイン酸の二重結合がすべてトランス型になったall-trans retinoic acid(ATRA)は急性前骨髄球性白血病の特効薬になっています。
急性前骨髄球性白血病は白血球に分化する途中の骨髄細胞が腫瘍化した白血病で、オールトランスレチノイン酸によって途中で止まった分化を誘導することによって増殖能を失わせ、死滅させることができるのです。
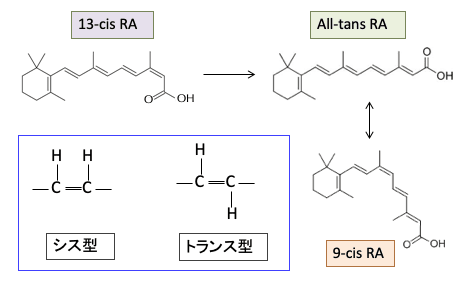
難治性にきびの治療に用いられている13-cisレチノイン酸(イソトレチノイン)は、体内でAll-trans レチノイン酸に変換されて効果を発揮します(下図)。
All-trans レチノイン酸は9-cis レチノイン酸に変換します。これらのレチノイドは単独では抗腫瘍効果は弱いのですが、他の治療との組合せで抗腫瘍効果が高まることが報告されています。

図:ビタミンAの体内における活性本体であるAll-trans retinoic acid(ATRA)はレチノイン酸受容体(RAR)に結合するとホモ二量体を形成し、標的遺伝子のプロモーター領域にあるレチノイン酸応答配列(RARE)に結合して遺伝子転写のスイッチをオンにする。ATRAの異性体である9-cis retinoic acidはレチノイン酸受容体(RAR)の他にレチノイドX受容体(RXR)にも結合して、ホモ二量体やヘテロ二量体を形成して細胞核内の受容体に結合して標的遺伝子の転写を誘導して生理機能を発揮する。13-cis retinoic acid(イソトレチノイン)はプロドラッグであり、細胞内でAll-trans RAに変換されて、同様の遺伝子発現の調節を行う。
以上から、オールトランス・レチノイン酸を用いたがん細胞の分化誘導は、膠芽腫の治療にも役立つと言えます。
オールトランス・レチノイン酸の分化誘導作用を強める方法としてビタミンD3(429話)、フェノフィブラート(370話)があります。
新刊紹介:膠芽腫(グリオブラストーマ)の根治を目指す補完・代替医療
本書はプリント・オン・デマンド(Print on Demand)という出版形式で書店では販売していません。アマゾンからの購入になります。
アマゾンからの購入はこちらへ:
| « 731)膠芽腫(... | 733)膠芽腫(... » |




