がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
676) Hippo経路をターゲットにしたがん治療:イベルメクチン+α
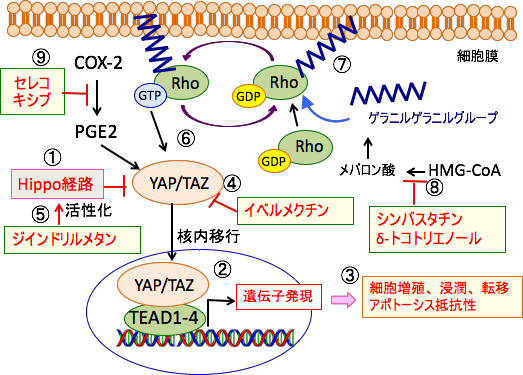
図: Hippo経路はYAP/TAZの核内移行を阻止している(①)。Hippo経路が不活性化されると、YAP/TAZは核内に移行し、TEADと相互作用して、YAP/TAZのターゲット遺伝子の発現を誘導する(②)。その結果、がん細胞の増殖や転移が促進される(③)。寄生虫治療薬のイベルメクチンはYAPの活性を阻害する(④)。ジインドリルメタンはHippo経路を活性化することによってYAP/TAZの働きを阻害する(⑤)。低分子量Gタンパク質の一種のRhoはYAP/TAZを活性化する(⑥)。RhoがGTP結合型の活性型に変換されるには、Rhoがゲラニルゲラニルグループによって細胞膜の脂質に接着していなければならない(⑦)。ゲラニルゲラニルグループは、ヒドロキシメチルグルタリル-CoA(HMG-CoA)からメバロン酸経路で産生される。HMG-CoAからメバロン酸を合成するHMG-CoA還元酵素の阻害剤であるシンバスタチンとHMG-CoA還元酵素の分解を促進するδ-トコトリエノールはゲラニルゲラニルグループの産生を阻害することによってRhoの活性化を阻害する(⑧)。シクロオキシゲナーゼ-2(COX-2)はプロスタグランジンE2(PGE2)を介してYAPの発現を亢進するので、COX-2阻害剤のセレコキシブ(celecoxib)はYAPの働きを抑制する(⑨)。
676) Hippo経路をターゲットにしたがん治療:イベルメクチン+α
【細胞の増殖や生存は複雑なシグナル伝達系ネットワークで制御されている】
がん細胞に関連するシグナル伝達経路や代謝経路は、代表的なものだけでも数十種類あり、しかも、一つのシグナル伝達系や代謝経路には何十種類というタンパク質が関与しており、さらに、それらが複雑に相互作用(クロストーク)しています。
解明されている部分だけでも複雑すぎて理解することも困難な状況ですが、解明されていない部分の方が多いので、理論的に治療法を考えてもまだかなりの限界があります。
いずれはシグナル伝達系の多くが解明され、がん細胞の遺伝子解析によるシグナル伝達系の異常が個々の症例毎に解析され、AI(人工知能)によって個別のがんに対する適切な治療薬の組合せが提供されるプレシジョン・メディシン(Precision Medicine:精密医療)が行われるようになると思われます。しかしまだ数年の間は、限られた情報の中で、人間の頭で考えて、試行錯誤するがん治療が続くように思います。
いずれにしても、がん治療を行うためには、細胞の増殖や生存に関するシグナル伝達系や代謝経路を理解するしかありません。がん細胞におけるシグナル伝達系や代謝の異常を理解し制御できれば、毒でがん細胞を死滅させるような野蛮な方法ではなく、がん細胞の増殖を理論的かつ効率的に抑制できます。
【がん細胞は接触阻害(contact inhibition)による増殖停止ができない】
がん細胞は増殖や生存に関連する遺伝子の異常によって、増殖の制御が壊れたために「無制限に増殖する」ようになった細胞です。
正常な細胞は隣り合う細胞同士が互いに接すると、細胞増殖を停止させる接触阻害(コンタクト・インヒビション)という現象がみられますが、がん細胞ではこの現象が破綻しており、増殖停止が起こらず、無制限な細胞増殖をします(下図)。

図:シャーレで細胞を培養すると、正常細胞はシャーレに細胞が一杯になったとき、細胞同士が接触阻害(contact inhibition)によって増殖を停止するので、単層(monolayer)の状態で細胞増殖は停止する。一方、がん細胞では、細胞同士の接触阻害による増殖停止の機序が起こらないので、幾重にも細胞が重なって栄養分があるかぎり増殖を続ける。
【接触阻害を制御するHippo経路】
接触阻害(コンタクト・インヒビション)を制御するメカニズムの中心がHippo経路です。
Hippo経路は器官のサイズを制御するシグナル経路としてショウジョウバエで発見されました。
Hippo経路は哺乳類にも高度に保存され、器官のサイズや形の制御の他にも、がん抑制や細胞分化に重要な経路であることが明らかになり、がん治療のターゲットとして近年注目されています。
典型的な哺乳類Hippo 経路ではMST、LATS の2つのキナーゼとそれぞれアダプター分子SAV、MOB1の4つをコア構成分子とし、転写共役因子であるYAP(Yes-associated protein)やTAZ(transcriptional co-activator with PDZ-binding motif) がその下流で作動します。
刺激を受けて活性化したMSTキナーゼはLATSキナーゼをリン酸化し、活性化されたLATS キナーゼは,主に細胞増殖促進に働く転写共役因子のYAP/TAZ をリン酸化します。リン酸化されたYAP/TAZ は核から細胞質へ排出されるとともに、タンパク質分解を受けます。すなわち,Hippo 経路の活性化はYAP/TAZ を負に制御し(YAP/TAZ活性を阻害する)、細胞増殖抑制に働くのです。
YAPとTAZ自身はDNAと結合しないので転写活性はありませんが、転写因子のTEADs(TEA domain transcription factors)に作用して、転写を促進する作用を発揮します。つまり、転写共役因子として働きます。
Hippo経路が働かないと、転写共役因子のYAP/TAZがリン酸化を免れて、核に移行して、増殖に関与する遺伝子の発現を促進します。(下図)

図:(左)Hippoシグナル経路がONのとき、LATS1/2がYAP/TAZをリン酸化する。リン酸化したYAP/TAZは分解するか、14-3-3と結合して細胞質内に保持される。この場合は、YAP/TAZによる遺伝子転写は阻止される。
(右)Hippoシグナル経路が不活性化されると、YAP/TAZは核内に移行して蓄積し、TEADと相互作用して、YAP/TAZのターゲット遺伝子の発現を誘導する。(参考:Genes 2016, 7(9), 55; Targeting the Hippo Signaling Pathway for Tissue Regeneration and Cancer Therapy)
Hippoシグナル伝達経路は、種を超えて高度に保存されたシグナル伝達系です。
YAP/TAZは、細胞増殖や組織傷害後の組織再生を促進する遺伝子の発現を亢進します。したがって、再生医学ではYAP/TAZの活性化が治療に使われます。
しかし、がん細胞においては、アポトーシス抵抗性、増殖促進、幹細胞の性状(stemness)に関与する遺伝子の発現を亢進するので、YAP/TAZはがん細胞の増殖を促進することになり、YAP/TAZの活性化を阻害することが治療になります。
Hippoシグナル伝達系を活性化してYAP/TAZを不活性化すれば、がん細胞の増殖を抑制できます。さらに、Hippo経路とは関係なく、YAP/TAZの活性を直接的に阻害する方法などもあります。
【肝臓がんではYAP/TAZの活性化が高頻度に起こっている】
正常な肝臓を切除すると、残った肝細胞が増殖し、元の大きさ(細胞数)に達すると細胞の増殖は停止します。肝臓がその大きさを知るメカニズムに接触阻害のメカニズムが関与していることは予想できますが、その具体的なメカニズムは長く不明でした。しかし、肝臓の大きさの決定にHippo経路が関与していることが明らかになっています。
マウスの肝細胞でYAPを過剰に発現させると、肝細胞や未熟胆管細胞の過形成のために肝臓が著しく腫大し、肝臓がんを発症します。
一方で肝細胞特異的なYAP欠損マウスでは、肝細胞や胆管細胞の減少と肝臓がんの発症抑制が報告されています。
またYAPの活性化は、成熟肝細胞を前駆細胞に脱分化させ、1細胞レベルで自己複製能や可移植能(移植して腫瘍を形成する能力)を持つようになることも示されています。
さらにYAP/TAZの活性を抑える上流のキナーゼやアダプタータンパク質(MST1/2、SAV1、LATS1/2、MOB1A/1B)のいずれかを肝臓特異的に欠損させたマウスにおいても、肝腫大と肝臓がん発症促進が認められることが報告されています。
つまり、Hippo-YAP/TAZ経路の破綻(YAP/TAZの活性化)は、肝臓を腫大させ、肝臓がんの発生を促進する結果を引き起こします。
Hippo 経路は肝細胞の増殖停止や器官サイズの制御に重要であり、その破綻は肝臓幹細胞や前駆細胞への脱分化と、腫瘍化を引き起こすことになります。したがって、Hippo-YAP/TAZ経路は肝臓がん治療の重要なターゲットになります。
臨床例での研究では、肝細胞がんと肝内胆管がんとヘパトブラストーマ(肝芽腫)において、免疫染色において細胞核内のYAPの量が増えていることが報告されています。そして、核内のYAPの量が多いほど、がん細胞の悪性度が高く、予後が不良であることが明らかになっています。
YAP発現と血清中のAFPレベルが相関するという報告もあります。AFPは肝細胞がんとヘパトブラストーマ(肝芽腫)の腫瘍マーカーです。
さらに、YAP発現の高いがん細胞では抗がん剤耐性が強くなることが報告されています。
【脳腫瘍(膠芽腫)ではYAPが活性化している】
脳や脊髄など神経組織には大きくわけて2種類の細胞が含まれています。神経細胞(ニューロン)とそれを支える神経膠細胞(グリア細胞)です。
神経膠細胞から発生する腫瘍を神経膠腫(グリオーマ)と言い、神経膠腫の中で最も悪性度の高い腫瘍が膠芽腫(グリオブラストーマ)です。
膠芽腫は増殖活性が高く、進行が早く、ヒトの悪性腫瘍の中で最も予後不良の腫瘍と言われています。手術や放射線治療や抗がん剤治療などが行われますが、このような集学的治療をおこなっても平均生存期間は12~14カ月程度であり,治療成績はここ30年以上、ほとんど改善がないと言われています。
膠芽腫は周囲の脳組織にしみ込むように広がっていくのが特徴で、腫瘍と正常脳との境界が不鮮明となり、そのため手術によって腫瘍を完全に摘出することは極めて困難です。したがって、手術でできるだけ摘出した後に放射線療法と抗がん剤治療が行われます。しかし、放射線治療や抗がん剤治療によって生き残るがん細胞がいるため、非常に再発しやすいのです。
膠芽腫に対する治療のターゲットとしてYAPが指摘されています。以下のような報告があります。
Yes-Associated Protein 1 (YAP1) Is Widely Expressed in Human Brain Tumors and Promotes Glioblastoma Growth.(Yes関連タンパク質1(YAP1)はヒト脳腫瘍に広く発現しており、膠芽腫細胞の増殖を促進する)J Neuropathol Exp Neurol. 2011 Jul; 70(7): 568–577.
【要旨】
Hippo経路とその下流のメディエーターであるYes関連タンパク質1(YAP1)は、前駆細胞数を調節することにより、哺乳類の臓器サイズを部分的に調節する。 YAP1は、複数のヒトがんにおいてがん遺伝子としても関与している。現在、正常なヒト脳組織または中枢神経系腫瘍におけるYAP1の発現についてはほとんど知られていない。
免疫組織化学を使用して、胎児および正常成人の脳および264例の脳腫瘍における核YAP1発現を評価した。
YAP1は、神経前駆細胞が存在することが知られている胎児および成人の脳領域で発現を認めたが、成人の大脳皮質ではYAP1の発現はほとんど認められなかった。
YAP1タンパク質は、人間の脳腫瘍の核で容易に検出された。
髄芽腫では、発現は組織学的サブタイプ間で異なり、結節性/線維形成性腫瘍(nodular/desmoplastic tumor)で最も顕著であった。
神経膠腫では、浸潤性星状細胞腫および乏突起膠腫で発現の亢進を認めたが、毛様細胞性星細胞腫(pilocytic astrocytomas)では発現は稀であった。
機能喪失アプローチを使用して、YAP1がin vitroで神経膠芽腫細胞株の成長を促進することを示す。
高レベルのYAP1 mRNA発現は、神経膠芽腫の浸潤性性状と相関し、ヒト星細胞腫患者の生存率低下と相関する傾向を認めた。
これらの結果は、YAP1が正常な人間の脳の発達に重要な役割を果たす可能性を示し、人間の脳腫瘍の新しいターゲットになることを示唆している。
神経細胞は増殖しない細胞です。したがって、成人の脳皮質でYAP1の活性化ほとんど認められません。しかし、神経細胞が増えている発達過程の胎児の脳や、成人でも神経幹細胞や前駆細胞の存在する領域ではYAP1の発現が認められています。さらに、増殖活性の高い脳腫瘍細胞にもYAP1活性の亢進が認められたという結果です。
つまり、Hippo経路の活性化やYAP1タンパク質の活性阻害が膠芽腫や髄芽腫など脳腫瘍の治療に役立つ可能性を指摘しています。
【膵臓がん細胞のYAP活性が高いと予後不良】
YAP/TAZ活性の亢進は肝臓がんや脳腫瘍だけでなく、膵臓がんや乳がんなど多くのがんで認められています。
膵臓がんではがん遺伝子のKRASの変異が高頻度に認められます。変異KRASがYAPを活性化して膵臓がんの発症を引き起こすことが報告されています。
以下のような報告があります。
Downstream of Mutant KRAS, the Transcription Regulator YAP Is Essential for Neoplastic Progression to Pancreatic Ductal Adenocarcinoma(変異KRASのシグナル伝達の下流に位置する転写共役因子YAPは膵臓腺管がんの発生に必須である)Sci Signal. 2014 May 6; 7(324): ra42.
膵臓がんではKRASの変異が高頻度で見つかります。KRASは、上皮成長因子受容体(EGFR)のシグナル伝達経路において働きます。
YAPはKRASが関与するシグナル伝達系の下流に存在し、YAPの働きを阻害すると、Kras変異による発がんが阻止されることが報告されています。実際に、動物実験でYAP遺伝子を欠損させると、Kras変異による膵臓がん発生が起こらなくなります。
つまりYAP経路は膵臓がんの臨床的悪性度を決定する働きがあります。
多くの臨床的研究で、YAP発現が膵臓がん患者の全生存期間と関連する独立した予後因子であることが報告されています。YAP発現が多いほど予後不良という結果です。
176例の膵臓がん患者を対象に、膵臓がん組織のYAPmRNAの発現量と生存との関係が検討されています。その結果、YAP発現量が多いグループでは生存期間が有意に短いことが報告されています。
YAPmRNA発現量が多い36例中5年以上の生存はゼロでしたが、YAPmRNA発現量が低いグループでは140例中32%が5年以上生存しました。(下図)

図:膵臓がんにおけるYAP発現量と生存率(Kaplan–Meier plots )の関連。YAP発現が高い(High)膵臓がんの患者は、YAP発現が低い(Low)膵臓がん患者より生存期間が短い。
【膵臓がん治療のターゲットとしてYAP阻害が重要】
膵臓がんの発生や悪性進展の阻害に、転写共役因子のYAPの活性阻害が有効であることが最近の多くの研究で明らかになっています。したがって、YAP自体の阻害の他に、YAP活性化の上流のシグナル伝達系およびYAPシグナル伝達系の下流の因子もターゲットとして重要になります。(下図)

図:多くのシグナル伝達系や因子によってYAPの活性は制御されている。さらに、YAPは多くの遺伝子の発現を制御している。YAP自身の活性の阻害の他に、YAP経路の上流と下流のシグナル経路や因子ががん治療のターゲットになる。
上の図には記載されていませんが、YAPの下流(YAPによって発現誘導される)にはシクロオキシゲナーゼ-2(COX-2)やmatrix metalloproteinase 7 (MMP7)やインターロイキン-6(IL-6)もあります。
COX-2活性はCOX-2選択的阻害剤のセレコキシブ(celecoxib)によって阻害でき、IL-6の活性はオーラノフィンやジインドリルメタンで阻害できます(620話参照)。
また、Krasシグナル伝達の下流エフェクターとして重要なp21活性化キナーゼ(PAK)は、複数の発がん性シグナル伝達経路の連結部に位置しており、細胞増殖、アポトーシス、浸潤/移動および化学療法抵抗性の調節に関与しています。
PAK阻害作用のあるイベルメクチン(674話参照)がYAP阻害に作用することが予測できます。
また、YAPの活性化に必要なRasファミリーのRhoの活性化はスタチンによって阻害されます。スタチンがRhoの活性化(イソプレニル化)に必要なゲラニルゲラニルグループの生成を阻害するためです。(594話参照)
実際に、スタチンの服用が膵臓がん患者の生存率を良くすることが報告されています。
【イベルメクチンはYes関連タンパク質1(YAP1)発現を阻害する】
寄生虫治療薬のイベルメクチンについては673話で解説しています。
イベルメクチン(ivermectin)はマクロライド類に属する物質で、腸管糞線虫症や糸状虫や疥癬など多くの寄生虫に有効です。
静岡県伊東市内のゴルフ場近くで採取した土壌から大村智博士により発見された新種の放線菌「ストレプトマイセス・アベルメクチニウス(Streptomyces avermitilis)」が生産するアベルメクチンを元に創製されました。大村智博士はこの発見で2015年にノーベル生理学・医学賞を受賞しています。
イベルメクチンのp21活性化キナーゼ(PAK)阻害作用については674話で解説しています。
PAK阻害作用があればYAPを阻害する作用も予測できます。
イベルメクチンが胃がん細胞でYAPを阻害する作用が報告されています。
以下のような報告があります。
Antitumor effects of the antiparasitic agent ivermectin via inhibition of Yes-associated protein 1 expression in gastric cancer.(胃がんにおけるYes関連タンパク質1発現の阻害を介した駆虫剤イベルメクチンの抗腫瘍効果)Oncotarget. 2017 Nov 21;8(64):107666-107677.
【要旨】
Yes関連タンパク質1(Yes-associated protein 1: YAP1)は脱リン酸化と核への移行を介してがん遺伝子として機能し、YAP1の核蓄積は胃がんの予後不良と関連付けられている。以前の研究で、YAP1阻害剤として、駆虫薬のイベルメクチンを同定した。
ここでは、イベルメクチンがYAP1の阻害を通じて胃がんに対して抗腫瘍効果を示すかどうかを検討した。まず、培養細胞を用いたin vitro増殖アッセイと異種移植マウスモデルを使用して、ヒト胃がん細胞に対するイベルメクチンの抗増殖効果を評価した。
イベルメクチンの増殖抑制効果がYAP1発現に依存しているかどうかを評価するために、YAP1-ノックダウンアッセイを実施した。
次に、イベルメクチンがYAP1および下流遺伝子CTGFの免疫ブロッティングおよび逆転写定量的ポリメラーゼ連鎖反応によってYAP1の発現または局在化を制御するメカニズムを検討した。
最後に、3つの独立した胃がんデータセットを使用して、YAP1発現の臨床的意義を調べた。
MKN1胃がん細胞はイベルメクチンに対して最も感受性が高いのに対し、MKN7細胞は最も耐性が高かった。 MKN1異種移植片では、イベルメクチンは腫瘍の成長を抑制し、イベルメクチンに対するMKN1細胞の感受性はYAP1ノックダウンにより低下した。
イベルメクチンは、MKN1細胞ではYAP1核発現およびCTGF発現を阻害したが、MKN7細胞では阻害しなかった。さらに、イベルメクチンはYAP1 mRNAの発現を低下させ、それによりMKN1細胞におけるYAP1の核蓄積を抑制した。
生存分析では、YAP1 mRNA発現の低さは、3つの独立したGCデータセットの予後良好と関連していた。
結論として、イベルメクチンを潜在的な抗腫瘍剤として特定し、YAP1発現を阻止することにより胃がん進行を抑制する有望な新規治療戦略を見出した。
この論文は九州大学の研究グループからの報告です。この九州大学の研究グループは、以前の論文でイベルメクチンが胆道がんの治療に有効であることを報告しています。この研究ではイベルメクチンがYAP1というタンパク質の働きを阻害することが報告されています(新聞記事は以下のリンクをクリック)
https://www.nikkei.com/article/DGXLASDG22H0Q_S5A221C1000000/
https://news.mynavi.jp/article/20151222-a141/
さらに、この論文では胃がんにもイベルメクチンが有効で、その作用機序としてYAP1の発現阻害が重要だという報告です。
【COX-2阻害剤はYAP発現を抑制する】
シクロオキシゲナーゼ-2(COX-2)活性がYAPの活性を高めることが報告されています。
つまり、COX-2阻害剤(celecoxibなど)はYAP活性の阻害に役立つ可能性があります。
以下のような報告があります。
COX-2 Forms Regulatory Loop with YAP to Promote Proliferation and Tumorigenesis of Hepatocellular Carcinoma Cells.(COX-2は、肝細胞がん細胞の増殖および腫瘍形成を促進するためのYAPとの調節ループを形成する。)Neoplasia. 2018 Apr;20(4):324-334.
【要旨】
シクロオキシゲナーゼ-2(COX-2)およびYAPは、肝細胞がんと高度に関連しており、肝細胞がんにおいてCOX-2とYAPの高発現が高い頻度で認められる。
しかしながら、COX-2とYAPの間に相互作用があるかどうか、そしてそれらが互いにどのように相互作用するかは、重要ではあるが明確ではない。この論文では、我々は、HCC細胞株におけるCOX-2の過剰発現が、YAPの mRNAとタンパク質、およびその標的遺伝子の発現レベルの増加をもたらすことを示した。
COX-2はHCC細胞株の増殖を促進し、YAP遺伝子の欠損はこの効果を阻止した。
さらに、我々の結果は、EP2(プロスタグランジンE受容体2)およびWnt /β-カテニンがCOX-2によるYAPの転写誘導を媒介することを示した。
一方、YAPは、COX-2プロモーターにおけるTEAD結合部位を介した転写レベルでCOX-2発現を増加させた。
まとめると、これらの所見は、COX-2がYAPを活性化するだけでなく、Hippo-YAP経路の標的でもあり、したがってCOX-2-PGE2-EP2-Gαs-β-カテニン-YAP-COX -2というフィードバック回路を形成している。
さらに、YAPおよびCOX-2の阻害が、肝臓がん細胞および腫瘍形成のいずれか単独よりも相乗的かつより効率的に増殖を低下させ、YAPおよびCOX-2の二重支配が発見を導くことを示唆したこの正のフィードバックループを遮断することによってHCC患者のための有望な治療戦略を提供する。
つまり、COX-2はYAPシグナル系を活性化することによって肝臓がんの発生に関与している可能性を示唆しています。さらに、COX-2はWnt/β-cateninを介してYAPのmRNAとタンパク質レベルを高めることを示しています。COX-2によるYAP発現はβカテニン欠損細胞では認められませんでした。
さらに、COX-2遺伝子にはTEAD結合部位がありYAPによって発現が亢進することが示されています。
つまり、COX-2とWnt/β-cateninとYAPは相互に作用してポジティブなフィードバック回路を形成して、増殖促進作用を強めていることを明らかにしています。
この回路が肝臓がんの発生と進展を促進している可能性を示唆しています。
βカテニンの活性を阻害する方法はYAP発現抑制に寄与する可能性があります。
つまり、COX-2阻害剤(セレコックス)と、Wnt/βカテニン阻害剤とYAP阻害剤(シンバスタチン)を組み合せると肝臓がんの治療効果を高めることができるかもしれません。
Wnt/βカテニン阻害剤としてはビタミンD3とスリンダクが使えます(462話参照)。
駆虫薬のメベンダゾールもWnt/βカテニン経路を阻害します(651話参照)。
【ジインドリルメタンはHippo経路を活性化する】
ブロッコリーやカリフラワーやキャベツなどのアブラナ科の野菜や植物に含まれるグルコシノレートの1種のグルコブラシシン(Glucobrassicin)は、細胞が壊れるとミロシナーゼによって加水分解してインドール-3-カルビノール(Indole-3-carbinol)になります。このインドール-3-カルビノールは植物の生体防御に働きますが、人間が摂取すると、胃の中の酸性の条件下では、インドール-3-カルビノールが2個重合したジインドリルメタン(3,3'-diindolylmethane, DIM)になります。(下図)。

ジインドリルメタンは消化管から容易に吸収され、体中の臓器や組織に移行することが知られています。
ジインドリルメタン(DIM)には様々なメカニズムによる抗がん作用が報告されています。
例えば、乳がんや前立腺がんをはじめ、多くのがん細胞の増殖を抑え、細胞死(アポトーシス)を誘導することが報告されています。
転写因子のNF-κB活性を阻害することによって、がん細胞の抗がん剤感受性を高めます。乳がん細胞のパクリタキセルに対する効果を高めることが報告されています。
がん組織の血管新生を阻害する作用、DNAトポイソメラーゼIIαを阻害してがん細胞の分裂を阻害する作用など多彩な抗がん作用が報告されています。
さらに最近の報告では、ジインドリルメタンがHippo経路を活性化する作用が報告されています。以下のような報告があります。
3,3’-Diindolylmethane suppresses the growth of gastric cancer cells via activation of the Hippo signaling pathway. (3,3'-ジインドリルメタンは、Hippoシグナル伝達経路の活性化を介して胃がん細胞の増殖を抑制する。)Oncol Rep. 2013;30:2419-2426.
【要旨】
最近の研究により、3,3-ジインドリルメタン(DIM)はインビボ(in vivo)およびインビトロ(in vitro)の実験系の両方において抗腫瘍効果を有することが明らかにされている。しかしながら、ヒト胃がん細胞におけるDIMの生物学的機能は不明である。
遺伝学的および生物学的研究により、哺乳動物における細胞増殖、アポトーシス、器官の大きさおよび腫瘍形成の調節において、新規な腫瘍抑制経路としても知られるHippo経路の重要性が確認されている。この研究の目的は、ヒト胃がん細胞におけるDIMの細胞傷害効果を調べ、Hippoシグナル伝達経路を活性化することによってDIMが細胞死を誘発するかどうかを解明することである。
2種類のヒト胃がん細胞株(SNU-1およびSNU-484)を用いてDIMに対する応答を調べた。
DIMは、ヒト胃がん細胞の増殖を用量依存的に有意に阻害した。 細胞周期のG1期細胞の割合は、DIM処置の24時間後に増加した。
DIMは、CDK2、CDK4、CDK6およびサイクリンD1タンパク質レベルを減少させ、p53タンパク質レベルを増加させた。
DIMは、切断されたポリ(ADP-リボース)ポリメラーゼ、切断されたカスパーゼ-9、およびプロカスパーゼ3タンパク質産生の低下を誘導した。さらに、DIMは、pLATS1、Mob1、pMob1、pYAPおよびRas関連ドメインファミリー1(RASSF1)タンパク質レベルを高め、Yapタンパク質産生レベルを低下させた。
DIMは、RIPF1とMst1 / 2-LATS1-Mob1複合体との結合を刺激し、活性なHippoシグナル伝達経路を促進し、細胞増殖を不活性化するYAPリン酸化(pYAP)を促進した。さらに、DIMは、異種移植マウスモデルにおけるヒト胃腫瘍の増殖を阻害した。
これらの結果は、Hippoシグナル伝達経路を活性化することによってDIMが胃癌細胞の増殖を抑制することを示している。
以下のような報告もあります。
Regulation of YAP through an Akt-dependent process by 3, 3'-diindolylmethane in human colon cancer cells.(ヒト大腸がん細胞における3,3’ジインドリルメタンによるAkt依存性機序を介するYAPの制御)Int J Oncol. 2013 Dec;43(6):1992-8.
この論文では、ジインドリルメタンはヒト大腸がん細胞において、Hippo経路を活性化してPI3K/Akt経路を阻害するメカニズムでアポトーシスを誘導することを報告しています。
Akt (プロテインキナーゼBまたはPKBとしても知られている) はセリン/スレオニンキナーゼです。多くのシグナル伝達経路のネットワークの中心的存在で、下流の幅広いターゲット分子や相互作用分子を介してさまざまな細胞内反応を引き起こします。
Hippo経路とAKT経路が相互作用することが知られています。
ジインドリルメタンはAKT活性を阻害する作用が報告されています。
詳細はまだ不明ですが、ジインドリルメタンはHippo経路とAKT経路の相互作用に影響してYAP活性を阻害すると思われます。
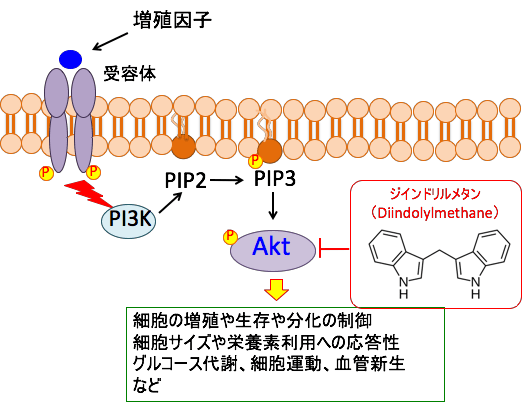
図:PI3キナーゼ/AKT経路は,細胞外からのシグナルを細胞内に伝える主要な経路の一つで、増殖因子やインテグリンを介した細胞接着など、様々な刺激により活性化され、細胞の生存促進,細胞増殖・大きさの制御、細胞運動、代謝の制御など多くの細胞機能に関与している。ホスファチジルイノシトール3-キナーゼ(PI3K)は,細胞膜の構成成分であるイノシトールリン脂質をリン酸化する酵素で,産生したPI3,4,5-三リン酸(PIP3)がAktをリン酸化する。Aktは多くのがん組織で活性しておりAKTシグナル伝達系は、細胞増殖や生存、細胞サイズや栄養素利用への応答性、グルコース代謝、組織浸潤および血管新生など多くの細胞プロセスを制御している。がん細胞の生存と増殖はAKTシグナル伝達系の活性に依存度が高いので、AKTシグナル伝達系の阻害はがん細胞の増殖抑制やアポトーシス誘導を引き起こす。ジインドリルメタンはAKT経路を阻害する。
ジインドリルメタンはがん細胞のシグナル伝達系に作用して、増殖や浸潤や転移を抑制し、細胞死(アポトーシス)を誘導し、抗がん剤感受性を高めるなどの抗がん作用を発揮します。ジインドリルメタンのターゲットとしてAktが重要だと言えます。
【シンバスタチンはTAZを抑制して肝細胞がんの増殖を抑える】
高脂血症の治療薬のスタチンがHippo-YAP/TAZ経路に作用して肝臓がんの増殖を抑えることが報告されています。以下のような報告があります。
Statin attenuates cell proliferative ability via TAZ (WWTR1) in hepatocellular carcinoma.(スタチンは、肝細胞がんにおけるTAZ(WWTR1)を介した細胞増殖能を弱める)Med Oncol. 2016 Nov;33(11):123.
熊本大学医学部の消化器外科の研究グループからの論文です。
メバロン酸経路とHippo経路には相互に関連(クロストーク)があることが報告されています。
高脂血症治療薬のスタチン(Statins)はメバロン酸経路を阻害します。
そこで、この研究では、肝細胞がんに対するスタチン(Statins)の抗腫瘍効果を検討しています。
肝細胞がん細胞株を用いた実験では、4種類のスタチン(atorvastatin, pravastatin, fluvastatin, simvastatin)のうち、シンバスタチン(Simvastatin)とフルバスタチン(Fluvastatin)の2つが最も強い増殖抑制作用とアポトーシス誘導作用を示し、TAZの発現がこの2種類のスタチンで抑制されることを示しています。
さらに、治癒切除を受けた肝細胞がん患者における検討で、スタチンを服用していた患者のグループは、スタチンを服用していない患者グループより無再発生存期間が有意に長いことを報告しています。
以上から、この論文の結論は「スタチンは肝細胞がん細胞に対して増殖抑制と細胞死(アポトーシス)を誘導し、肝細胞がん患者の予後を改善する」となっています。
つまり、肝臓がん患者はシンバスタチン(Simvastatin)かフルバスタチン(Fluvastatin)を服用するメリットがある可能性を示唆しています。
前述のように、Hippo-YAP/TAZシグナル伝達経路において、Hippoシグナル伝達経路が破綻すると転写共役因子のYAPおよびTAZが核内に移行して、細胞増殖に関連する遺伝子の転写を亢進します。
Hippo-YAP/TAZ経路は肝臓のサイズを制御するシグナル伝達経路の中心です。肝臓がんではHippo-YAP/TAZ経路の異常が高頻度に認められています。
たとえば,YAPは肝がんの患者の約60%、TAZは肝がんの患者の約50%で高発現や核への局在が認められるという報告があります。そしてYAPやTAZの高発現や核への局在亢進が予後不良と関連していることが報告されています。
YAP/TAZの活性化に必要なGTP結合タンパク質(Gタンパク質)のイソプレニル化はメバロン酸経路で産生される物質が必要です。したがって、メバロン酸経路を阻害するスタチンはYAP/TAZの活性化を阻害することになります。
メバロン酸経路の阻害によるYAP/TAZ阻害のメカニズムを以下に解説します。
【スタチンは肝臓でのコレステロールの合成を抑制する】
コレステロールは、アセチルCoA(グルコースや脂肪酸やグルタミンなどの分解によって生成される)から生成されるメバロン酸(Mevalonic acid)を経て生合成されます。
この生合成経路をメバロン酸経路と言い、この経路の律速酵素である3-ヒドロキシ-3-メチルグルタリルCoA還元酵素(3-hydroxy-3-methylglutaryl-CoA reductase ;HMG-CoA還元酵素)を阻害すると肝臓でのコレステロール生合成を抑制することができるため、多くのHMG-CoA還元酵素阻害剤が開発され高脂血症治療薬として臨床で使われています。
このようなHMG-CoA還元酵素の働きを阻害することによって血液中のコレステロ-ル値を低下させる薬(HMG-CoA還元酵素阻害剤)の総称をスタチン(Statin)といいます。
(下図)

図:スタチンは肝臓においてヒドロキシメチルグルタリル-CoA(HMG-CoA)からメバロン酸に変換するHMG-CoA還元酵素を阻害することによってコレステロール合成を抑制する。
最初のスタチンであるメバスタチンは1973年に青カビの一種から発見され、それ以降、様々な種類のスタチンが開発され、高コレステロール血症の治療薬として世界各国で使用されています。近年の大規模臨床試験により、スタチンは高脂血症患者での心筋梗塞や脳血管障害の発症リスクを低下させる効果があることが明らかにされています。
スタチンのHMG-CoA還元酵素に対する親和性(affinity)は本来の基質であるHMG-CoAの1000倍以上であるため、HMG-CoA還元酵素を強力に阻害します。
【スタチンはメバロン酸経路でのイソプレノイド生成を低下してGTP結合タンパク質の活性を阻害する】
メバロン酸はコレステロールの合成に必要なだけでなく、GTP結合タンパク質(Gタンパク質)のイソプレニル化に必要な物質(geranylpyrophophateやfarnesylpyrophosphate)を作ります。(下図)

図:ヒドロキシメチルグルタリル-CoA(HMG-CoA)からメバロン酸に変換するHMG-CoA還元酵素を阻害すると、コレステロール合成の抑制だけでなく、増殖を促進するG結合タンパク質の活性化に必要なゲラニルグループやファルネシルグループの産生ができなくなる。Gタンパク質のイソプレニル化が阻害されるとがん細胞の増殖が抑制される。
細胞内におけるシグナル伝達においてGTP結合タンパク質(Gタンパク質)が重要な役割を担っています。
GTP結合タンパク質(Gタンパク質)は内在性のGTP加水分解(GTPase)活性をもつタンパク質の総称で、この内、低分子量Gタンパク質群(Ras, Rho,など)は分子量が2万~3万のタンパク質で、これまで100種類以上報告されています。RasやRhoはがん遺伝子として知られています。
イソプレニル化を受けた後に細胞膜に移行し、GTP結合型(on)/GDP結合型(off)として細胞内シグナル伝達に関与しています。
すなわち、Gタンパク質はGDP結合不活性型とGTP結合活性型の間をサイクル(GTPaseサイクル)することにより、細胞外からの情報を細胞内に伝達します。
Rhoは細胞骨格の制御を通して細胞の形態調節に関わっています。
低分子量Gタンパク質はそのほとんどでC末端から4番目のアミノ酸残基がシステインであり、ファルネシル基やゲラニルゲラニル基などの脂肪酸でファルネシル化されており、この脂質修飾により、細胞膜に直接結合できると考えられています。
HMG-CoA還元酵素を阻害してイソプレノイド生成が低下すると、低分子量Gタンパク質の活性が低下して、増殖活性が低下します。イソプレノイドはRasやRhoなどの低分子Gタンパク質が細胞膜の脂質に接着するときに必要が生体分子で、それができないと活性化できないので、がん細胞の増殖が抑制されることになります。
【スタチンはイソプレノイド生成を低下してYAP/TAZの活性化を阻止する】
スタチンの抗がん作用については多くの基礎研究が行われており、スタチンによるメバロン酸経路の阻害は、がん細胞のシグナル伝達に影響し、がん細胞の増殖や転移の抑制、血管新生阻害、アポトーシス誘導などの抗がん作用が、培養細胞を使った実験や動物実験で報告されています。
メバロン酸経路でのイソプレノイド生成が低下するとYAP/TAZの活性化もできなくなります。
以下のような総説論文があります。
Metabolic control of YAP and TAZ by the mevalonate pathway.(メバロン酸経路によるYAPとTAZの代謝による制御)Nat Cell Biol. 2014 Apr;16(4):357-66.
【要旨】
Hippo経路のYAP/TAZは、組織の増殖および臓器の成長を促進する。しかしながら、それらの生物学的特性が細胞代謝とどのように関連するかは未解明のままである。
ここでは、YAP / TAZ活性がSREBP(Sterol regulatory element-binding protein) /メバロン酸経路によって制御されることを示す。
メバロン酸経路の律速酵素(HMG-CoAレダクターゼ)のスタチンによる阻害は、YAP / TAZの核局在および転写応答に阻害する。
作用機序的には、メバロン酸経路によって産生されるゲラニルゲラニルピロリン酸はRho GTPアーゼの活性化に必要であり、YAP/TAZのリン酸化を阻害して核蓄積を促進することによってYAP / TAZを活性化する。
このメバロン酸とYAP / TAZの関係は、乳がん細胞の増殖および自己再生に必要である。
ショウジョウバエにおいては、メバロン酸生合成およびゲラニルゲラニル化の阻害は、YAP / TAZの相等体であるYorkieによって誘発された眼の過成長を阻止する。
腫瘍細胞においては、p53変異によって誘導されるSREBP転写活性によって産生されるメバロン酸のレベルの増加によってYAP / TAZ活性化は促進される。これらの知見は、代謝信号によるYAP / TAZ調節の存在を明らかにする。
転写アクチベーターのステロール調節エレメント結合タンパク質(The sterol regulatory element binding protein=SREBP)ファミリーは、コレステロールと脂肪酸の恒常性を調節する重要な制御因子です。
SREBPはコレステロール・脂肪酸代謝に関与する酵素遺伝子の発現を亢進します。
つまり、がん細胞では、SREBP転写活性によって産生されるメバロン酸のレベルの増加によってYAP / TAZ活性化は促進されます。したがって、メバロン酸経路を阻害するスタチンはYAP/TAZの活性化を阻止して、増殖抑制効果を発揮します。
しかし、スタチンによる抗腫瘍効果は薬剤の種類によって異なる可能性があります。つまり、スタチンには水溶性のものと脂溶性のものがあり、がん細胞に対する効果を期待するには脂溶性のものを使う必要があるようです。
水溶性スタチンは肝臓細胞膜に存在する有機アニオン輸送担体によって細胞内に取り込まれるので、肝細胞に選択的に取り込まれます。
脂溶性スタチンは細胞膜透過性が良いので、あらゆる臓器・組織の細胞内へ移行し得えます。
つまり、肝臓におけるコレステロール産生を抑制する目的では、他の細胞に影響が少ない点で水溶性スタチンの方が良いのですが、がん細胞に取り込まれて、メバロン酸経路を阻害して増殖抑制効果を期待するには脂溶性のものである必要があるようです。
スタチンの中で最も脂溶性の高いのがシンバスタチン(simvastatin)で、乳がんの患者さんがシンバスタチンを服用すると再発率が顕著に低下することが報告されています。
スタチンでメバロン酸経路を阻害すると体内でのCoQ10の産生が阻害されるので、CoQ10をサプリメントで補うのが良いと思います。
また、デルタ・トコトリエノールはHMG-CoA還元酵素の分解を促進し、スタチンの抗腫瘍活性を増強することが報告されています。(639話参照)
以上のように、転写補助活性化因子であるYAP / TAZは、がん治療の有望な標的として注目されています。
YAP / TAZは、腫瘍抑制因子であるHippo経路によって負に制御されています。
ヒトのがんでは、Hippo経路の調節不全の結果として、YAP / TAZが頻繁に過剰に活性化されます。
YAP / TAZの活性化と予後不良との相関関係を示す臨床的証拠が増えています。
YAP / TAZおよびTEADは成人の組織の恒常性に必要ではないため、YAP / TAZ-TEADをターゲットにすることは安全であると考えられています。
つまり、トップの図に示したようなYAP / TAZの活性を抑制する方法の組み合わせは、がん細胞の増殖抑制と細胞死誘導の効果を発揮することが期待できます。
| « 675)カンナビ... | 677)ミトコン... » |



