がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
479)膠芽腫とフェノフィブラートとケトン体
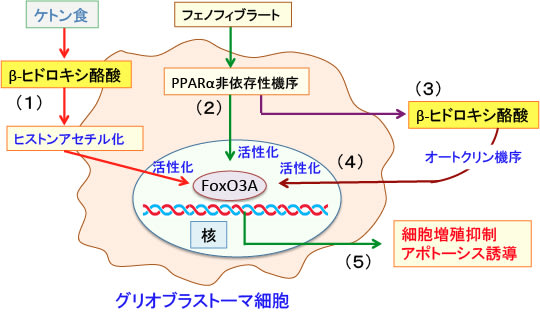
図:グリオブラストーマ(膠芽腫)細胞において、ケトン食で産生されるβ-ヒドロキシ酪酸はヒストン・アセチル化の機序で転写因子FoxO3Aを活性化する(1)。ペルオキシソーム増殖因子活性化受容体α(PPARα)の合成リガンドのフェノフィブラートはPPARα非依存性の作用機序でFoxO3Aを活性化する(2)。フェノフィブラートがグリオブラストーマからβ-ヒドロキシ酪酸の産生を亢進することが報告されている(3)。グリオブラストーマから産生されてβ-ヒドロキシ酪酸はオートクリン機序(ある細胞が産生し分泌した物質が、産生細胞自身に作用すること)によってさらにFoxO3A遺伝子の転写を誘導して活性化する(4)。FoxO3Aはグリオブラストーマ細胞の増殖を抑制し、アポトーシス(細胞死)を誘導する(5)。ケトン食とフェノフィブラートの併用はグリオブラストーマの治療に役立つ可能性が指摘されている。
479)膠芽腫とフェノフィブラートとケトン体
【グリオブラストーマ(膠芽腫)は神経膠細胞から発生する】
脳や脊髄など神経組織には大きくわけて2種類の細胞が含まれています。
神経細胞(ニューロン)とそれを支える神経膠細胞(グリア細胞)です。その他に血管を構成する細胞もあります。
ニューロンは感覚や運動などの情報を処理する主体で、複雑なネットワークを形成して、精神や運動の機能を制御しています。
そのニューロンに栄養を与え、神経組織を健全に維持するのがグリア細胞の役目です。
「グリア細胞」の日本語訳は「膠細胞」です。
「膠」は国語辞典によると、「獣や魚の皮•骨などを水で煮沸し、その溶液からコラーゲンやゼラチンなどを抽出し、濃縮・冷却し凝固させたもの。接着剤・写真乳剤・染色などに用いる」とあります。つまり、動物の腱などから作られた接着剤のようなもので、「膠細胞」は神経細胞の間の組織を埋めるような支持組織で不活性が細胞と考えられていました。
しかし、最近の研究でグリア細胞は脳機能やニューロンの制御に重要な役割を持っていることが明らかになっています。
ヒトの場合はグリア細胞はニューロンの10倍くらい存在します。
グリア細胞は主に3種類あり、アストロサイト、オリゴデンドロサイト、ミクログリアと呼ばれています。
アストロサイト(星状膠細胞)は多数の突起があり、星のように見えることからこの名があります。実際は、星状というよりスポンジ状の形態をしています。神経組織の形態維持、血液脳関門、栄養補給、神経伝達物質の輸送などの役割を担っています。
オリゴデンドロサイト(乏突起膠細胞)は神経細胞の軸策に巻き付いて髄鞘の形成や栄養補給の機能を持っています。
ミクログリア(小膠細胞)は骨髄系のマクロファージに由来し、病原菌の排除や死細胞の除去や傷害を受けた神経組織を修復する働きを担っています。アルツハイマー病など神経変性疾患ではミクログリアが炎症の増悪や神経細胞死に関わってきます。マクロファージと同様に組織の生体防御の第一線で働いていますが、慢性の炎症になると、その作用が有害に作用する場合もあります。
グリオブラストーマ(膠芽腫)はアストロサイト(星状膠細胞)から発生する悪性腫瘍で、非常に悪性度が高く、増殖や浸潤性が強く、ヒトの悪性腫瘍の中で最も予後不良の腫瘍の一つです。
手術や放射線治療や抗がん剤治療などが行われますが、このような集学的治療を受けても平均生存期間は12~14カ月程度であり,治療成績はここ30年以上ほとんど改善していないと言われています。
がんの代替医療でも、グリオブラストーマをターゲットにした治療が検討されています。例えば、ケトン食(296話)や医療大麻(455話)、FoxO3aを活性化する方法(339話)、ラパマイシンとレチノイド(イソトレチノン)の併用(361話)、再開発医薬品の組合せ(416話)、高脂血症治療薬のフェノフィブラート(326話)、メベンダゾール(401話)などがあります。

図:神経組織はニューロン(神経細胞)とそれを支えるグリア細胞(アストロサイト、オリゴデンドロサイト、ミクログリア)から構成される。脳腫瘍のグリオブラストーマ(膠芽腫)はアストロサイトが悪性化した腫瘍で、手術や放射線治療や抗がん剤治療が行われるが、予後は極めて悪い。
【フェノフィブラートは高脂血症治療薬】
ペルオキシソームはほぼ全ての真核細胞が持つ直径0.1-2マイクロメートルの球状の細胞小器官で、多様な物質の酸化反応を行っています。哺乳類の細胞では1個の細胞に数百から数千個が存在します。
ペルオキシソームでは、脂肪酸のベータ酸化、コレステロールや胆汁酸の合成、アミノ酸やプリン体の代謝などが行われています。
ペルオキシソーム増殖因子活性化受容体(Peroxisome Proliferator-activated Receptor :PPAR)は核内受容体の一種で、細胞内のペルオキシソームの増生を誘導する受容体として発見され、糖質や脂質やタンパク質などの物質代謝や細胞分化に密接に関連している転写因子群です。
フェノフィブラートはペルオキシソーム増殖因子活性化受容体α(PPARα)という核内受容体に結合して、PPARαを活性化することによって、コレステロールや中性脂肪を低下させる薬です。(ペルオキシソームとPPARについては437話参照)
フェノフィブラートなどのフィブラート系薬剤は、PPARαに作動してペルオキシソームを増やして脂肪酸のβ酸化を亢進し、グルコースの解糖系を抑制する働きがあるので、がん細胞のワールブルグ効果(酸素がある条件でも、がん細胞はグルコースの嫌気性解糖系でエネルギーを産生していること)を阻害して、がん細胞の増殖を抑える効果があります。
この作用以外にも、インスリン様成長因子-1のシグナル伝達系(PI3K/Akt)を抑制する作用や、抗炎症作用や血管新生阻害作用などの抗腫瘍効果が報告されています。
フェノフィブラートの抗腫瘍効果には、本来のペルオキシソーム増殖因子活性化受容体(PPARα)を介した機序と、それとは関係ない機序(PPARα非依存性)が知られています。
フェノフィブラートがグリオブラストーマ細胞のFoxO3Aを活性化し、アポトーシスを誘導するBimの発現を亢進し、グリオブラストーマを死滅させる作用が報告されています。
このようなフェノフィブラートの抗がん作用はケトン食との併用で相乗効果が期待できることが指摘されています。(326話参照)

図:フィブラート系の高脂血症治療薬のフェノフィブラートが神経膠芽腫(グリオブラストーマ)に対して抗腫瘍効果を示すことが報告されている。その作用機序は多彩で、PPARα(ペルオキシソーム増殖因子活性化受容体α)の活性化を介する脂肪酸β酸化の亢進とグルコースの解糖系の抑制はがん細胞のワールブルグ効果を抑制して抗腫瘍効果を示す(1)。さらに、PPARα依存性あるいは非依存性の機序で、PI3K/Aktシグナル伝達系の阻害(2)や、転写因子FoxO3Aの活性化(3)を引き起こす。FoxO3Aの活性化はアポトーシスを誘導するBimの発現を亢進し、グリオブラストーマを死滅させる(4)。フェノフィブラートには抗炎症作用や血管新生阻害作用も報告されている(5)。グリオブラストーマにケトン食が有効であることが報告されている(6)。ケトン食はβヒドロキシ酪酸によるヒストンアセチル化亢進(7)やアディポネクチン産生を介するAMP依存性プロテインキナーゼ(AMPK)の活性化(8)によってFoxO3Aを活性化する(9)。以上のことから、グリオブラストーマの治療にケトン食とフェノフィブラートの併用は相乗効果が期待できる。
【フェノフィブラートはケトン体産生を誘導する】
最近の論文で、フェノフィブラートが膠芽腫や悪性黒色腫においてケトン体産生を誘導することが報告されています。以下のような報告があります。
Fenofibrate Induces Ketone Body Production in Melanoma and Glioblastoma Cells(フェノフィブラートは悪性黒色腫と膠芽腫においてケトン体産生を誘導する)
Front Endocrinol (Lausanne). 2016; 7: 5.
Published online 2016 Feb 2. doi: 10.3389/fendo.2016.00005
PMCID: PMC4735548
【要旨】
ケトン体[βヒドロキシ酪酸(bHB)とアセト酢酸]は長期間の断食や飢餓状態において主に肝臓で産生される。bHBは末梢組織においてATP産生を維持するための効率の良いエネルギー源となっており、重要な点は、ケトン体はエネルギー源としてグルコースよりも好まれていることである。
しかしながら、悪性腫瘍の多く、特に膠芽腫(グリオブラストーマ)のような神経外胚葉由来の悪性腫瘍は、エネルギー源としてケトン体を利用できない。
この論文では、ペルオキシソーム増殖因子活性化受容体α(PPARα)の合成アゴニストのフェノフィブラートが、悪性黒色腫(メラノーマ)と膠芽腫(グリオブラストーマ)および非腫瘍性細胞から構成される神経球(ニューロスフェア;neurospheres;浮遊培養した球状の神経幹細胞塊)においてbHBの産生を誘導することを明らかにした。
予想に反して、この効果はPPARα活性と発現量に非依存的であった。
このフェノフィブラート誘導性のケトン症は増殖を停止させ、トランスケトラーゼの発現を低下させたが、NADP/NADPH比とGSH/GSSG比には影響しなかった。
これらの結果は、グリオブラストーマに対する標準治療あるいは食事療法(ケトン食)にフェノフィブラートを併用する価値があることを示している。
以下はこの論文のDiscussion(考察)の日本語訳です。
【考察】
今までの研究で、いかなるがん細胞もケトン体を産生し放出する現象は知られていなかった。
長期の飢餓やケトン食やカロリー制限したケトン食では、肝臓や、腎臓、小腸粘膜上皮細胞、アストロサイトでケトン体の産生が起こる。
神経上皮細胞由来(neuroepithelial origin)のがん、すなわち悪性黒色腫やグリオブラストーマにおいて、PPARαのアゴニストで高脂血症治療薬のフェノフィブラートを投与すると、βヒドロキシ酪酸の産生が顕著に増える。
フェノフィブラートはがん細胞だけでなく、神経細胞とグリア細胞から構成される神経球(ニューロスフェア;neurospheres;浮遊培養した球状の神経幹細胞塊)においてもケトン体産生が認められた。
PPARαは脂肪酸分解とケトン体産生を誘導する主要な転写因子と考えられているが、今回の実験系ではフェノフィブラートによるbHB産生はPPARα非依存性の現象と思われた。
PPARαたんぱく質の量をノックダウンしても過剰に発現させてもbHBの産生量と放出量は変化を受けなかった。
また、PPARαの転写活性を阻害しても、ケトン体産生に対するフェノフィブラートの作用は阻止されなかった。
フェノフィブラートによるケトン体産生の活性化は6時間後からスタートし、HMG-CoA合成酵素(HMGCS2)発現が上昇し、この現象がピークに達するのに48時間を要した。
興味深いことに、フェノフィブラートとPPARα阻害剤のMK886はコレステロール合成に関与する細胞質のHMGCS1のレベルを上昇させた。
この研究で示されたがん細胞のケトン体産生能は、乳がん組織における間質の線維芽細胞によるケトン体産生の可能性に関するLisantiのグループの一連の研究を含めて今までの報告と全く異なる。
これらの論文では、著者らは、がん組織の間質における線維芽細胞の代謝を変えることにがん細胞が積極的に加担して、線維芽細胞によって産生されるケトン体をがん細胞はエネルギー源として利用していると主張している。
これは、乳がんのような上皮由来の腫瘍の特徴かもしれない。というのは、他のがん細胞はケトン体をエネルギー源として利用できる酵素を発現していない。
神経芽細胞腫(neuroblastomas)や星細胞腫(astrocytoma)のような腫瘍は、むしろ、ケトン体をエネルギー源として使用するのではなく、脂肪合成に利用している。
ケトン体は単なるエネルギー源ではなく、シグナル伝達分子として作用するなど、より複雑な生理機能を持っていることが明らかになっている。
bHBの利用は、細胞内のNAD/NADH比を低下させ、サーチュイン(Sirtuins)の活性に影響し、あるいは、bHBはクラスIとクラスIIaのヒストン脱アセチル化酵素の活性部位の亜鉛イオンと結合することによって酵素活性を阻害する。ヒストン脱アセチル化酵素の活性阻害は、ヒストンのアセチル化を亢進して遺伝子発現に作用することによって多様な生理作用を発揮する。
例えば、ストレス応答に関与するFOXO3A遺伝子の発現を誘導する。FOXO3Aは細胞周期を停止させ、活性酸素の消去能を高め、様々なストレス状況におけるアポトーシスを制御することによってがん抑制遺伝子として作用する。
実際に、我々の以前の研究によって、フェノフィブラートはグリオブラストーマ細胞(LN229)において核内にFOXO3Aの蓄積と転写活性の亢進を認めている。さらに、フェノフィブラートを長期間投与することによってFOXO3Aがグリオブラストーマ細胞にアポトーシスを誘導することを確認している。
我々の研究結果は、フェノフィブラートで処理されたグリオブラストーマ細胞(LN229)によって放出されたbHBはオートクリン作用(ある細胞が産生し分泌した物質が、産生細胞自身に作用すること)によってさらにFOXO3A遺伝子の転写を誘導して活性化する。
メラノーマやグリオブラストーマ細胞は脂肪酸のβ酸化によるエネルギー産生はほとんど行わない。
今回の研究では、ミトコンドリアやペルオキシソームにおける脂肪酸酸化に関与する酵素、つまり、acyl-CoA dehydrogenase とacyl-CoA oxidaseのたんぱく質レベルに変化を認めなかった。
さらに、フェノフィブラートはミトコンドリアにおける酸素消費を顕著に減少させた。これは、ケトン体の合成に必要なアセチルCoAの産生はペルオキシソームにおけるβ酸化に依存していることを示している。
ミトコンドリア以外の酸素消費のレベルはフェノフィブラート投与で変化を認めなかった。
これは、フェノフィブラートはがん細胞にペルオキシソームでの脂肪酸の酸化を誘導し、ATP産生は引き起こさないことを示唆している(ペルオキシソームではATPは産生されない)。
この現象は、エネルギー産生低下によるストレス状態に誘導し、このエネルギーストレス(energetic stress)ががん細胞の増殖の抑制と停止に関与している。
フェノフィブラートはトランスケトラーゼ(ペントースリン酸経路の酵素で、ヌクレオチドや核酸合成に必要なリボースの合成に関与)の発現を顕著に減少させた。この作用もがん細胞の増殖抑制に関与している。
結論として、フェノフィブラートが悪性黒色腫(メラノーマ)と膠芽腫(グリオブラストーマ)の代謝経路に作用して、エネルギー量を欠乏させ、ケトン体の産生を増やすように仕向ける作用があることは非常に驚くべきことである。
我々が知る限り、がん細胞でケトン体が合成されることは今まで報告されておらず、そのメカニズムも不明であるため、今回の結果は重要である。
グリオブラストーマ細胞によって放出されるケトン体は、がん組織を取り巻く微小環境において、神経細胞(ニューロン)に対してエネルギー源となるだけでなく、神経細胞を保護するシグナル物質ともなっている。
神経外胚葉性腫瘍が、自分のエネルギー源としてケトン体を利用できないが、脳腫瘍にケトン食が有効であることの根拠として以前から理解されており、多くの基礎実験や臨床研究で支持されている。
今回の我々の研究結果はさらにこの事実を支持しており、ケトン食の抗腫瘍効果を高める方法としてフェノフィブラートの併用の有効性が示唆された。
内容は専門的で難解かもしれませんが、悪性黒色腫(メラノーマ)や膠芽腫(グリオブラストーマ)のような神経外胚葉系の悪性腫瘍にケトン食とフェノフィブラートを併用することは試してみる価値があると思います。
フェノフィブラートが膠芽腫に有効であることは326話と438話で解説しています。
さらにFoxO3aを活性化する方法(メトホルミン、中鎖脂肪ケトン食、L-カルニチンとアセチル-L-カルニチン、フェノフィブラート、イソトレチノインなど)の併用も有効です。(339話)
膠芽腫は極めて治療が困難で予後が不良な腫瘍です。標準的な手術+放射線治療+抗がん剤治療でも、ほとんどが1年くらいで亡くなっています。
可能性のある方法を組み合せるしかありません。
この時、ケトン食やフェノフィブラート、イソトレチノイン、カンナビジオール、L-カルニチン、アセチル-L-カルニチン、メトホルミン、メベンダゾールなどの組合せを試してみる根拠はあります(下図)。

新刊紹介:膠芽腫(グリオブラストーマ)の根治を目指す補完・代替医療
本書はプリント・オン・デマンド(Print on Demand)という出版形式で書店では販売していません。アマゾンからの購入になります。
アマゾンからの購入はこちらへ:
| « 478)医療大麻... | 480)ケトン体... » |





