がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
576)ミトコンドリアの酸化ストレスを高めるがん治療
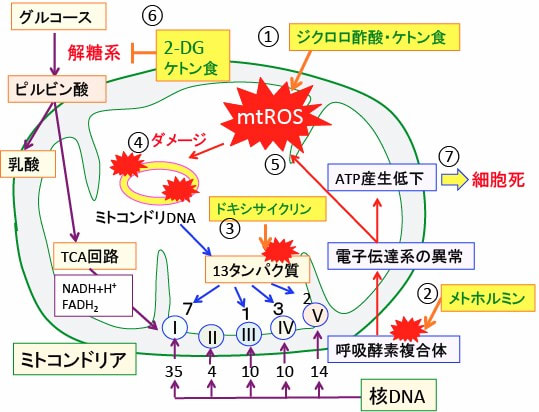
図:ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素を活性化してミトコンドリアでの酸素呼吸を亢進してミトコンドリアの活性酸素種(mtROS)の産生を増やす(①)。ケトン食もミトコンドリア代謝を促進して活性酸素の産生を高める(①)。メトホルミンは呼吸酵素複合体を阻害して、ATPの産生を減少させ、かつ活性酸素の産生を増やす(②)。ドキシサイクリンはミトコンドリアのリボソームを阻害してミトコンドリア由来のタンパク質合成を阻害し、呼吸酵素複合体の機能を障害する(③)。ミトコンドリアで産生が亢進した活性酸素はミトコンドリアDNAにダメージを与え、呼吸酵素複合体の合成を阻害する(④)。これらの結果によってミトコンドリアの活性酸素の産生はさらに増える(⑤)。ミトコンドリアでのATP産生低下はがん細胞では解糖系の亢進で補うことができ、この解糖系は2-デオキシ-D-グルコース(2-DG)やケトン食で阻害できる(⑥)。これらを組み合わせることによってミトコンドリアの活性酸素種(mtROS)の産生亢進によってがん細胞を死滅できる。
576)ミトコンドリアの酸化ストレスを高めるがん治療
【ミトコンドリアは体内に数千兆個存在する】
ミトコンドリアは赤血球以外の体内のほぼ全ての細胞に存在する細胞小器官です。酸素を使ってグルコース(ブドウ糖)や脂肪酸やアミノ酸を燃焼して細胞エネルギーのATP(アデノシン3リン酸)を産生する『細胞の発電所』のような働きをしています。
ATP産生以外に、カルシウムや鉄の細胞内濃度の調節、ステロイドやヘムの合成、様々な物質代謝の制御、アポトーシス(細胞死)の制御など重要な細胞機能を担っています。
つまり、細胞の生と死の制御において重要な働きをしています。
ミトコンドリアはかつて細菌であったので、その見かけは細菌に似ています。直径は1ミクロン(1ミクロンは1000分の1ミリ)以下で、長さは1〜4ミクロン程度で、俵型やいも虫様の立体構造をしています。(下図)
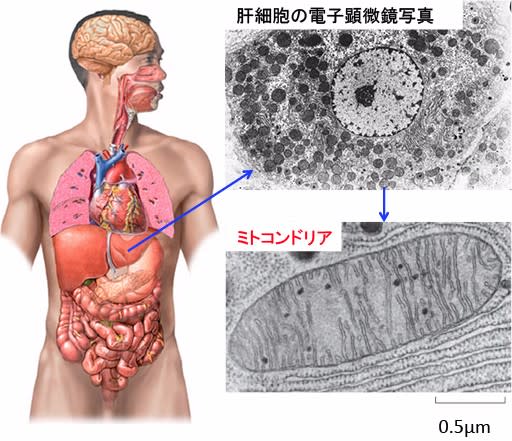
図:ミトコンドリアは、直径1ミクロン以下で、長さは1〜4ミクロン程度で、俵型やいも虫様の立体構造をしており、細胞内で酸素を使ってエネルギー(ATP)を産生している。肝細胞のような代謝が活発な細胞では細胞1個当たり数千個のミトコンドリアが存在し、細胞質の40%程度を占めている。
1個の細胞当たり平均で300〜400個のミトコンドリアが存在します。平均すると、細胞質の10〜20%程度を占めます。
肝臓や腎臓や筋肉や脳など代謝が活発な細胞には数千個のミトコンドリアが存在し、細胞質の40%程度を占めています。
一般的に人体の細胞の数は約60兆個と言われていますが、最近の論文では約37兆個と報告されています。(Annals of Human Biology, 40(6): 463-471, 2013年)
しかし、そのうちの20兆個ほどの細胞は赤血球です。したがって、10〜20兆個程度の細胞が1個の細胞当たり平均で300〜400個のミトコンドリアを持つとすると、体全体で5000兆個から1京個(1兆の1万倍)のレベルのミトコンドリアが存在することになります。つまり、一人の個体の体内には数千兆個のミトコンドリアが存在することになります。
ミトコンドリアは2枚の膜(内膜と外膜)によって細胞質から隔てられ、内膜は複雑に入り組んで「クリステ」という無数の襞や管を形成しています。内膜が襞上にくびれているのは表面積を増やすためで、この内膜でATPの産生が行われています。
内膜上に電子伝達系やATP合成にかかわる酵素群などが一定の配置で並んでいます。マトリックスには、TCA回路や物質合成に関わる酵素やミトコンドリア独自のDNAなどが含まれています(下図)。

図:細胞内には機能を分担するために、様々な小器官が存在する(左)。ミトコンドリアは酸素を使って糖質や脂肪酸を燃焼してATPを産生する細胞内の発電所である(右)。
【ミトコンドリアは元は細菌だった】
真核細胞のミトコンドリアは好気性細菌のαプロテオバクテリアが原始真核細胞に寄生したものという「細胞内共生説」が定説になっています。
まだ酸素が無い太古の地球に生きていた生物は解糖系のみでエネルギーを得ていました。ところが、二酸化炭素から酸素を作る光合成を行うシアノバクテリア(藍藻)が大量に発生して酸素が大気中に増えていくと、酸素の無い環境で生きていた生物は酸化力の強い酸素に触れることでダメージを受けるようになります。そのためこの時期には原始真核生物の多くが絶滅し、あるいは酸素の影響を受けることのない深海などに移動していきました。
このような状況で誕生したのが、酸素を使ってATPを生成する好気性細菌です。
そして、約20億年前に好気性細菌のα-プロテオバクテリアが原始真核細胞に寄生してミトコンドリアになったと考えられています。
好気性細菌は生体にダメージを与える酸素をブドウ糖に結合させ、二酸化炭素と水に分解し、さらにその過程でATPを大量に生成することができます。この細胞内共生によって酸素が豊富な環境で生物が急速に進化することになります。
つまり、原始真核生物は、酸素を利用できるα-プロテオバクテリアを細胞内に取り込んで、共生することによって、酸素分圧の高い環境で生きていけるようになったのです。

図:嫌気性の原始真核細胞に好気性細菌のαプロテオバクテリアが食作用で取り込まれ、共生するようになり、ミトコンドリアになった。αプロテオバクテリアに存在していた遺伝子の多くは真核細胞の核内に移動し、ミトコンドリアのたんぱく質の多くは核の遺伝情報によって作られるようになった。
【ミトコンドリアのパラサイト戦略】
嫌気性原始真核細胞と好気性細菌のα-プロテオバクテリアが共生を始めた初期の段階で、α-プロテオバクテリアのDNAの大半は核に移行してゲノムDNAに組み込まれました(下図)。

図:ミトコンドリアの祖先のα-プロテオバクテリアのDNAの多くは、原始真核生物の核ゲノムDNAに組み込まれた。ごく一部のDNAがミトコンドリアDNAとしてミトコンドリアに残った。
α-プロテオバクテリアの頃の遺伝子の大半は細胞の核のDNAに移行していますが、ミトコンドリア固有の遺伝子の一部はミトコンドリア内のDNAに存在しています。
ミトコンドリアDNAは16,569bpの環状の分子で、37個の遺伝子が存在し、22個のトランスファーRNA(tRNA)と2個のリボゾームRNA(rRNA)の遺伝子と、酸化的リン酸化に関与するたんぱく複合体の85種類のサブユニットのうち13種類のたんぱく質を作成する遺伝子が存在します。
ミトコンドリアのタンパク質の大半は核内DNA にコードされています。
核内DNA にコードされているタンパク質は、細胞質で合成された後、ミトコンドリア外膜と内膜を通過してミトコンドリア内部に輸送されて来ます。
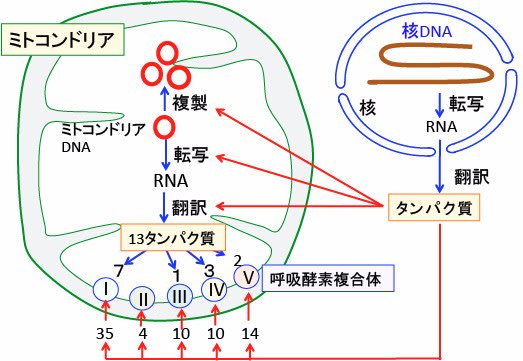
図:ミトコンドリアを構成するタンパク質の大半は核のゲノムDNAの遺伝情報で作られるが、呼吸酵素複合体を構成するタンパク質の内の13種類はミトコンドリアDNAでコードされていてミトコンドリア内で作られる。したがって、ミトコンドリアが正しく機能するには核のゲノムDNAとミトコンドリアDNAの両方の遺伝情報が必要。
ミトコンドリアの祖先のα-プロテオバクテリアと原始真核細胞が共生した初期の段階で、α-プロテオバクテリアの遺伝子(DNA)は核に移動しています。
それは、ミトコンドリアでは活性酸素が多く発生してDNAがダメージを受けるので、「細胞核に遺伝子を避難させた」というふうに理解されています。
ミトコンドリアでは、電子伝達の際に複合体Iや複合体IIIから漏れ出した電子によって、酸素分子が一電子還元され、スーパーオキシドが発生します。ミトコンドリアは生体内の約95%の酸素を消費し、そのうち1〜3%が活性酸素種に変換されると推測されています。

図:ミトコンドリアの呼吸酵素複合体のIとIIIでスーパーオキシド(O2-)が産生される。スーパーオキシドは膜を通過しないが、外膜のチャネルのVDACを通って細胞質に移行する。スーパーオキシドはマトリックスあるいは膜間腔に存在するスーパーオキシド・ディスムターゼ(SOD)によって過酸化水素(H2O2)に変換される。過酸化水素は膜を自由に通過でき、一部はFenton/ Haber-Weiss反応によってヒドロキシルラジカル(Hydroxyl radical)に変換される。ヒドロキシルラジカルは酸化傷害を引き起こすが、スーパーオキシドと過酸化水素はシグナル伝達物質としても働く。(出典:Mitochondria in cancer: at the crossroads of life and death. Chin J Cancer 30(8):526-39. 2011)
核のDNAはヒストンタンパク質などのクロマチンタンパク質と核膜が存在するので、活性酸素の害からDNAを守ることができますが、ミトコンドリアDNAはタンパク質に保護されることもなく露出した状態であるため、活性酸素のダメージを受けて変異を起こしやすいという弱点があります。したがって、αプロテオバクテリアの遺伝子情報を細胞核に避難させたというのは妥当な考えと言えます。
つまり、α-プロテオバクテリアが持っていた遺伝情報の大半を細胞核に移動させたのは、「活性酸素の害から自分の遺伝情報を守る」というミトコンドリアのパラサイト(寄生)戦略と言えます。
【ミトコンドリアは細胞に支配されているのか、細胞を支配しているのか?】
しかし、それではなぜ一部のDNAがミトコンドリアに残ったのかが疑問になります。
活性酸素の害から逃れるのが目的であれば、全ての遺伝情報を核に移動させても良かったはずです。
進化の過程では、そのような状況(ミトコンドリアDNAが全て核に移行する)も試されたと思われます。しかし、それが選ばれずに、一部のDNAを残しています。その方が、細胞にとって都合が良いのかもしれません。
22個のトランスファーRNA(tRNA)と2個のリボゾームRNA(rRNA)の遺伝子と、酸化的リン酸化に関与するたんぱく複合体の85種類のサブユニットのうち13種類のたんぱく質を作成する遺伝子が存在します。
全てのタンパク質を細胞質で作成してミトコンドリアに運搬するより、一部をミトコンドリアの中で作る方が効率が良いのかもしれません。
あるいは、ミトコンドリアと核における相互の密接で迅速な遺伝子発現の調節には、お互いの支配下の遺伝子が近くにある方が都合が良いという考えもあります。
ミトコンドリアの呼吸酵素複合体が核DNAとミトコンドリアDNAの協同によって作られるため、お互いの生産状況を調節するため、核とミトコンドリアの間にはシグナル伝達による制御機構が存在します。
つまり、ミトコンドリアは細胞の核から一方的に支配される立場ではなく、核の遺伝子発現をミトコンドリアが調節することによって、細胞を支配しているとも言えます。

図:細胞内において、核とミトコンドリアの間には密接な相互調節のメカニズムが存在する。
ミトコンドリアの電子伝達系の呼吸酵素複合体が、核のゲノムDNAとミトコンドリアDNAの両方が正しくないと作成できないという生物学的意味については不明です。
しかし、これは、ミトコンドリアの活性酸素の産生を高めて、ミトコンドリアDNAにダメージを与えれば、ミトコンドリアの機能を障害して、がん治療の方法となりうる可能性を示唆しています。

図:ミトコンドリアの電子伝達系を構成する呼吸酵素複合体は、核のDNAとミトコンドリアDNAの両方の遺伝情報で合成される。ミトコンドリアの活性酸素種(mtROS)の産生を高めるとミトコンドリアDNAがダメージを受けて、呼吸酵素複合体の生成も障害され、ATP産生が低下して、細胞死が誘導される。
【ミトコンドリアは細胞の生存と死の両方を制御している】
アポトーシスは、形態学上は核の凝集と細胞収縮、それにDNAの断片化などによって特徴づけられる細胞死の一種です。個体の発生段階で、過剰にできた細胞を選択的に除去し、器官形成を完成するのに必要なプロセスです。
また、老化した細胞や修復不能なダメージを受けた細胞を除去する際にも、アポトーシスのメカニズムで細胞死が起こります。
このアポトーシスの過程は極めて複雑ですが、ミトコンドリアに存在するたんぱく質が重要な役割を果たしています。
たとえば、電子伝達系で働く「チトクロームC」というたんぱく質は、ミトコンドリアから放出されると、たんぱく分解酵素群が次々に活性化されて、細胞死へと導きます。
アポトーシスは多数のタンパク質によって制御されていますが、中心になるのがBcl-2やBaxと呼ばれるタンパク質群(Bcl-2ファミリー蛋白質)です。
Bcl-2 ファミリー蛋白質には、アポトーシスを抑制するBcl-2-サブファミリー(Bcl-2, Bcl-Xlなど)と、アポトーシスを促進する Baxサブファミリー(Bax、Bakなど) および BH3-onlyサブファミリー (Bid、Bim、Badなど)があります
Bcl-2およびそのファミリー蛋白質の主な作用部位はミトコンドリア膜で、このミトコンドリア膜の透過性を制御することにより、細胞の生死を決定しています。
ミトコンドリアの膜透過性が亢進すると、膜間スペースに存在するアポトーシス誘導蛋白質(シトクロムcなど)が細胞質に漏出します。漏出したシトクロムcはカスパーゼと呼ばれる蛋白分解酵素群を段階的に活性化してアポトーシスが実行されます。
Baxはアポトーシス実行時のミトコンドリアの膜透過性亢進に必須の分子として働き、
Bcl-2はBaxと直接結合してBaxの働きを阻止します。
Bcl-2のようなアポトーシス促進蛋白質の活性が、Baxのような抑制蛋白質の活性を凌駕した場合に、ミトコンドリア膜透過性亢進が誘導され、アポトーシスが実行されます。Bcl-2サブファミリー蛋白質(Bcl-2やBcl-xL)を過剰発現したがん細胞は多くのアポトーシス刺激(抗がん剤治療など)に対して強い抵抗性を示します。したがって、Bcl-2サブファミリー蛋白質の活性や発現量を抑制したり、Baxサブファミリー蛋白質の活性や発現量を高める効果は、がん細胞の抗がん剤感受性を高め、死滅しやすくなります。

図:Bcl-2はBaxと結合してBaxの活性を抑制している。抗がん剤や放射線照射などによって細胞を傷害されるとBH3ドメインをもつ蛋白質がBcl-2に結合してBcl-2を不活性化する。その結果フリーになったBaxはミトコンドリア外膜にて二量体(ダイマー)になって内腔を形成してミトコンドリアからシトクロム C を含む様々なタンパク質が細胞質内に流出し、蛋白分解酵素のカスパーゼ(Caspases)が活性化されアポトーシスが実行される。
ミトコンドリアがエネルギー産生による生存過程だけでなく、細胞死にも深く関わっている意味は不明です。太古の昔に、真核細胞とミトコンドリアの元になった好気性細菌が共生するようになったとき、ミトコンドリアは生存に必要なエネルギー産生と細胞死を支配することによって、真核細胞と細菌の運命共同体としての関係を強化したのかもしれません。
がん治療においては、ミトコンドリアが細胞死の決定権を握っているという点が重要です。それは、ミトコンドリアのこの働きを利用することによって、がん細胞を死滅できるからです。がん細胞を死滅させるにはミトコンドリアをターゲットにするのが、最も合理的と言った方が適切かもしれません。
細胞のミトコンドリアは細胞が必要とするエネルギー(ATP)の大部分を産生しています。さらに、カルシウム恒常性の維持、ヘム合成、栄養素の代謝、ステロイドホルモンの合成、尿素合成によるアンモニアの除去、様々な物質代謝、アポトーシスやオートファジーのシグナル伝達系の制御など様々な機能を持っています。
ミトコンドリアが代謝や様々なシグナルに応じて細胞機能を制御する中心的な役割を担っています。
一般に細胞の司令塔は核と考えられています。しかし、ミトコンドリアも細胞機能において核以上に重要な働きを担っています。細胞の生存と死を握っているからです。
核は脳のような働きですが、ミトコンドリアは心臓と肺と消化管と肝臓を合わせたような働きです。細胞において、核とミトコンドリアはほぼ同等と言えるように思います。
【ミトコンドリアDNAが酸化傷害を受けると細胞周期は止まる】
核のゲノムDNAにダメージが起こると、細胞周期の調節に関わる様々なタンパク質が関与して細胞周期が停止します。ダメージを受けたDNAの修復を行うために細胞周期を停止すると考えられています。
例えば、DNAがダメージを受けると、がん抑制遺伝子の作用をもつp53が活性化されて細胞周期を停止させます。DNAを修復するために細胞分裂を一時的に停止させます。
そのようなタンパク質の一つにCheckpoint Kinase 2(Chk2)があります。Chk2は核DNAのダメージで活性化されて、細胞周期を停止させるタンパク質の一つです。
ミトコンドリアDNAのダメージもChk2が関与した機序で細胞周期が停止することが報告されています。以下のような報告があります。
Mitochondrial DNA damage initiates a cell cycle arrest by a Chk2-associated mechanism in mammalian cells.(哺乳動物細胞においてミトコンドリアDNAのダメージはChk2-関連の機序で細胞周期の停止を引き起こす)J Biol Chem. 2009 Dec 25;284(52):36191-201.
この論文では、ミトコンドリアDNAがダメージを受けると、Chk2がリン酸化して活性化し、S期(DNA合成期)で細胞周期を停止することを報告しています。
Checkpoint Kinase 2(Chk2)は核DNAのダメージで活性化されて、細胞周期を停止させるタンパク質です。ミトコンドリアDNAのダメージでも細胞周期の停止が起こるということです。
細胞が分裂するためには核のDNAが複製するだけでなく、細胞内小器官も2倍に増える必要があります。
ミトコンドリアは、自前のDNAとリボソームをもっています。
細胞分裂を達成するにはゲノムDNAとミトコンドリアDNAの間でタンパク合成の調整が必要です。
ミトコンドリアのリボソームを抗生物質で阻害すると、細胞の増殖も酸素呼吸も阻害されます。
増殖している細胞は解糖系でエネルギーを産生していますが、ミトコンドリアの働きが阻害されれば、増殖はできません。
そこで、ミトコンドリアのリボゾームを抗生物質(ドキシサイクリンなど)で阻害し、呼吸酵素を阻害するメトホルミンでATP産生を阻害しながら活性酸素の発生を増やし、同時に解糖系を阻害すると、がん細胞を死滅できる可能性があります(トップの図)。
| « 575)がん患者... | 577)ミトコン... » |



