がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
740)断酒薬ジスルフィラムの抗がん作用(その2):プロテアソーム阻害と小胞体ストレス誘導作用
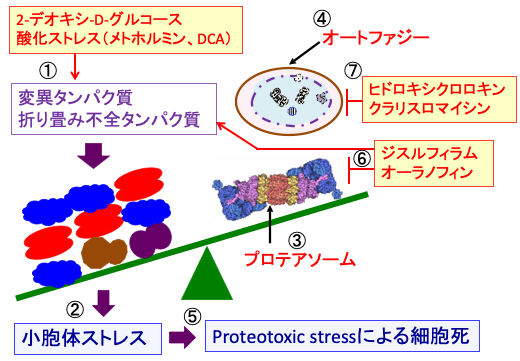
図: 2-デオキシ-D-グルコースは糖タンパク質の糖鎖の異常を引き起こし、メトホルミンとDCA(ジクロロ酢酸ナトリウム)はミトコンドリアからの活性酸素の産生を増やして酸化ストレスを引き起こし、変異タンパク質や折り畳み不全のタンパク質を増やし(①)、小胞体ストレスを誘導する(②)。これに対して、がん細胞はプロテアソーム(③)やオートファジー(④)のメカニズムによって異常タンパク質を分解して小胞体ストレスを軽減しようとするが、小胞体ストレスが軽減できず高度の小胞体ストレスが長期間持続すると、異常タンパク質の蓄積によるプロテオトキシック・ストレス(Proteotoxic stress)によって細胞死が誘導される(⑤)。ジスルフィラムとオーラノフィンは折り畳み不全タンパク質を増やすと同時に、プロテアソームによるタンパク質分解を阻害する(⑥)。ヒドロキシクロロキンとクラリスロマイシンはオートファジーを阻害する(⑦)。プロテオソームとオートファジーにおける異常タンパク質の分解が阻害されると、がん細胞はプロテオトキシック・ストレスによる細胞死が促進される。
740)断酒薬ジスルフィラムの抗がん作用(その2):プロテアソーム阻害と小胞体ストレス誘導作用
【ジスルフィラムはがんの再利用薬(転用薬)として注目されている】
ジスルフィラムはアルコール中毒の治療薬として60年間以上前から使用されています。ジスルフィラムはアルデヒド脱水素酵素を阻害し、アルコールの代謝でできるアセトアルデヒドの分解を阻害することによって、アセトアルデヒドの有害な症状が出るので、アルコールを飲めなくする薬です。
アルデヒド脱水素酵素はがん幹細胞のマーカーになるくらい、様々な種類のがんのがん幹細胞で過剰に発現しています。がん幹細胞に多く発現しているアルデヒド脱水素酵素を阻害すると抗がん剤に対するがん細胞の感受性を高めることができます。
ジスルフラムの抗がん作用に関する研究論文は最近増えています(下図)。
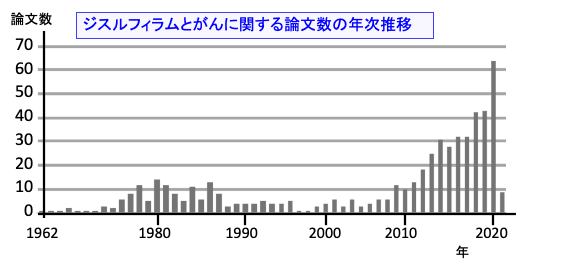
図: PubMed(アメリカ国立医学図書館の国立生物工学情報センターが運営する医学・生物学分野の学術文献検索サービス)で「disulfiram + cancer」で検索すると514件の論文がヒットする(2021年1月末の時点)。1962年に最初の論文が発表され、1970年代から1980年代は年間10件前後の論文が発表され、1990年代から2000年代は論文数は少なくなっていたが、2010年以降、急速に増えている。2020年には1年間に64件の論文数で2021年は1月末ですでに9件の報告がある。
ジスルフィラムはがんの代替医療でも使用頻度の高い薬です。医薬品の再利用(Drug RepositioningあるいはDrug Repurposing)によるがん治療薬として代表的な医薬品の一つです。
多くの基礎研究でジスルフィラムの抗がん作用が明らかになっています。このブロブでも5年前の416話(2014年12月5日)で最初に紹介して以降、ジスルフィラムの抗がん作用については頻回に話題にしています。
今年の1月に以下のような総説論文が報告されています。(論文報告される前のonlineでの発表)
Disulfiram: a novel repurposed drug for cancer therapy.(ジスルフィラム:がん治療のための新しい再利用薬)Cancer Chemother Pharmacol. 2021 Jan 10. doi: 10.1007/s00280-020-04216-8. Online ahead of print.
【要旨の抜粋】
薬の再利用(drug repurposing)は、がん治療薬の開発のコストを削減し、開発期間を短縮する有望なアプローチである。
アルコール中毒治療薬として承認されているジスルフィラムは、その安全性が証明されており、がんに対する効果も報告されている。
ジスルフィラムの抗腫瘍効果は、多くの前臨床研究で報告されており、最近では、非小細胞肺がん、肝臓がん、乳がん、前立腺がん、膵臓がん、膠芽腫、メラノーマの7種類のがんについて報告されている。しかし、そのメカニズム、特に細胞内シグナル伝達系に対する作用メカニズムに関してはまだ十分に解明されていない。
以前の研究で示されたように、ジスルフィラムはNF-kBシグナル伝達、プロテアソーム活性、およびアルデヒド脱水素酵素活性を阻害する。小胞体ストレスとオートファジーを誘発し、放射線治療や抗がん剤治療による補助療法として使用されてきた。
一方、ジスルフィラムは通常のがん細胞を死滅するだけでなく、がん幹細胞を標的とする能力も持っており、腫瘍の再発と転移を防ぐための新しいアプローチを提供する。
さらに、他の研究者は、ジスルフィラムが核タンパク質局在化タンパク質4(nuclear protein localization protein 4:NPL4)に結合し、その固定化と機能不全を誘発し、最終的に細胞死を引き起こす作用が報告されている。ここでは、ジスルフィラムのがん治療への再利用に関する前臨床試験および臨床試験の概要を示し、その抗腫瘍効果の根底にあるメカニズムを検討した研究をレビューする。
ジスルフィラムの抗がん作用は1970年代頃から研究されていますが、2010年代からその抗がん作用がかなり注目されるようになっています。
ジスルフィラムの断酒薬としての作用は、アルデヒド脱水素酵素の阻害によるためです。アルデヒド脱水素酵素はがん幹細胞のマーカーになるほど、がん幹細胞ではアルデヒド脱水素酵素は重要な働きをしており、この酵素を阻害すると、がん細胞の抗がん剤感受性が亢進することが明らかになっています。(739話参照)
さらにプロテアソームの阻害作用が2011年に報告されてから、ジスルフィラムの抗がん作用の報告が増えています。
私も2014年頃からがん治療にジスルフィラムを積極的に利用していますが、確実な抗がん作用を認めています。比較的安価であり、アルコールさえ飲まなければジスルフィラムは極めて副作用の少ない薬です。
(注:ドセタキセルのように溶解にエタノールを使う薬があるので、点滴を受けているときは、エタノールフリーであることを確認することが重要です)
【ジスルフィラムがプロテアソームを阻害する】
ジスルフィラムがプロテアソームを阻害することは10年くらい前から注目されています。以下の報告は2011年の論文です。
Disulfiram, and disulfiram derivatives as novel potential anticancer drugs targeting the ubiquitin-proteasome system in both preclinical and clinical studies.(前臨床試験および臨床試験の両方でユビキチン・プロテアソーム系をターゲットにする新規の抗がん剤としての可能性を持つジスルフィラムとジスルフィラム誘導体)Curr Cancer Drug Targets. 2011 Mar;11(3):338-46.
【要旨】
ジスルフィラムは、アルコール依存症の治療のためのFDA(米国食品医薬品局)認可の薬物であり、50年以上にわたり臨床で使用されてきた。 ジスルフィラムとその類似体は、抗がん剤の抗腫瘍効果を高める効果や化学予防剤としての有効性を示す研究結果が1970年代から80年代にかけて報告されたが、根底にある分子メカニズムは最近まで不明のままであった。
プロテアソームを阻害し、新規な抗がん剤として使用できる薬剤の大規模スクリーニングの結果、ジスルフィラムがプロテアソーム阻害活性を有することが明らかになった。
さらに、ジスルフィラムは発がんに重要な役割を果たすジンク・フィンガーおよびRINGフィンガー・ユビキチンE3リガーゼに対して特異的活性を有することも見出された。 ここでは、抗がん剤としてジスルフィラムを探索する前臨床および臨床研究、ならびにユビキチン - プロテアソーム系の阻害剤としてのジスルフィラム誘導体の開発に焦点を当てた研究プログラムを検討する。
以下の様な報告もあります。2012年の論文です。
High-throughput chemical screens identify disulfiram as an inhibitor of human glioblastoma stem cells.(ハイスループット化学スクリーニングは、ジスルフィラムをヒト膠芽腫幹細胞の阻害剤として特定する)Oncotarget. 2012 Oct;3(10):1124-36.
【要旨】
多形性膠芽腫は、最適な標準治療を行っても、患者の予後が不良であり続けている。膠芽腫幹細胞は、腫瘍の再発と治療への抵抗性の原因となっている。これを念頭に置いて、2,000の化合物の多様な化学ライブラリーをスクリーニングし、膠芽腫幹細胞の増殖を阻害し、患者の生存を延長する可能性のある治療薬を特定した。
ハイスループットスクリーニング(High-throughput screens)により、細胞増殖を繰り返し阻害する78の化合物が特定され、そのうち47は他の適応症で臨床的に承認されており、31は実験に使用される薬であった。
いくつかの化合物(ジギトキシン、デグエリン、パツリン、カフェイン酸フェネチルなど)は高い細胞毒性を示し、50%最大阻害濃度(IC50)が低ナノモル範囲であった。
特に、アルコール依存症の治療のためのFDA承認薬であるジスルフィラムは、複数の患者サンプルにおいて有意に強力であった(IC50は31.1nM)。
ジスルフィラムの抗腫瘍活性は、銅の併用によって強化され、細胞死を顕著に増加した。ジスルフィラム-銅は、培養膠芽腫幹細胞のキモトリプシン様プロテアソーム活性を阻害した。これは、ユビキチン-プロテアソーム経路の不活性化とそれに続く腫瘍細胞死の誘導と一致している。
ジスルフィラムは血液脳関門を通過できる比較的毒性のない薬剤であるため、ジスルフィラムをヒト膠芽腫幹細胞の前臨床モデルで(単剤療法または補助療法として)検討する必要がある。実験結果はまた、膠芽腫の治療においてユビキチン-プロテアソーム経路の阻害の可能性を支持している。
High-Throughput Screening(高速大量スクリーニング)というのは、「高度にシステム化した方法で短期間に多数の化合物を生化学的に評価して、薬効物質を見つける探索法(スクリーニング法)」です。
この論文では、2000種類の化合物をスクリーニングして、膠芽腫幹細胞の増殖を阻害し死滅させる効果が高い化合物としてジスルフィラムが同定されたという報告です。そのメカニズムとしてユビキチン-プロテアソーム経路の阻害の可能性を指摘しています。
ユビキチン・プロテアソーム系はタンパク質に付加されたユビキチン鎖をプロテアソームが認識し,ATP依存的で迅速かつ不可逆に標的タンパク質を分解するシステムです。
ユビキチン(Ubiquitin)は,アミノ酸76残基からなり,酵母からヒトまであらゆる真核細胞に存在する進化的に保存されたタンパク質です。
名前の由来は、ラテン語の“ubique=あらゆるところで”という形容詞を基にした英語 「ユビキタス(ubiquitous)」からきています。「至る所に存在する」という意味があります。
ユビキチンは不要なタンパク質、たとえば出来損なったタンパク質や古くなったタンパク質に複数個付加(ポリユビキチン化)されることで、「このタンパク質を壊してくれ」という分解シグナルとして働きます。
ユビキチン自体はあくまで目印なので、分解を行うのは他の物質です。ユビキチンが結合した不要たんぱく質をシュレッダーのように分解する酵素をプロテアソームといいます。
標的タンパク質へのユビキチン付加反応はユビキチン活性化酵素(E1)、ユビキチン結合酵素(E2)、ユビキチンリガーゼ(E3)によって行われます。
プロテアソームは真核生物のATP依存性プロテアーゼ複合体で、分解目印として働くユビキチンが結合したたんぱく質を選択的に壊す複雑な細胞内装置です。

図:分解されるタンパク質はユビキチンが複数個結合し、ユビキチンが結合したタンパク質をプロテアソームが認識して、タンパク質を分解する。
ユビキチン-プロテアソーム・システムは細胞周期やシグナル伝達やアポトーシスなど細胞内の様々な機能の制御に関わっています。プロテアソームの働きが阻害されると細胞内タンパク質の恒常性に異常が起こり、ユビキチン化されたタンパク質が細胞内に増え、毒性の強い凝集したタンパク質によってがん細胞に対して致死的に作用します。
すでに、プロテアソーム阻害剤は抗がん剤としても使用されています(ボルテゾミブなど)。
ジスルフィラムを経口摂取すると、消化管内および血液内で1分子のジスルフィラムは2分子のジエチルジチオカルバミン酸(diethyldithiocarbamate)に速やかに変換されます。
ジエチルジチオカルバミン酸は銅イオンや亜鉛イオンと複合体を形成し、この金属複合体がプロテアソームを阻害する事が報告されています。

図:ジスルフィラムの代謝産物のジエチルジチオカルバミン酸は二価の重金属(銅や亜鉛)と複合体を形成する。プロテアソームはタンパク質分解活性を持った巨大な酵素複合体で、ユビキチンにより標識されたタンパク質をプロテアソームで分解する。ジエチルジチオカルバミン酸と銅の複合体はプロテアソームにおけるタンパク質の分解機能を強力に阻害する。プロテオソームの働きが阻害されるとユビキチン化されたタンパク質が細胞内に増え、毒性の強い凝集したタンパク質によって致死的に作用する。
【ジスルフィラムはタンパク質と反応して阻害作用を発揮する】
超一流の科学雑誌のNatureにもジスルフィラムの抗がん作用に関する論文が掲載されています。
Alcohol-abuse drug disulfiram targets cancer via p97 segregase adaptor NPL4(アルコール依存症治療薬ジスルフィラムはp97セグレガーゼアダプターNPL4を介してがん細胞を標的化する)Nature 552, 194–199 (14 December 2017)
【要旨の抜粋】
がん治療を改善する有望な手法の1つに、既存薬の転用(drug repurposing)がある。今回我々は、古くから使われているアルコール嫌悪剤であり、これまでの前臨床研究でさまざまなタイプのがんに対して有効性が確認されているジスルフィラムの転用の可能性を示す。
我々が行った全国的な疫学研究からは、がんと診断された後もジスルフィラムの使用を継続した患者は、がんの診断時にジスルフィラムの使用を中止した患者よりも、がんによる死亡リスクが低いことが明らかになった。
さらに、ジスルフィラムの代謝産物であるジチオカルブ–銅複合体(ditiocarb–copper complex)が、この抗がん作用に関与していることを突き止めるとともに、この複合体のがん細胞における選択的蓄積を検出する方法、ならびに細胞と組織に対するこの複合体の作用を解析するためのバイオマーカー候補を提示する。
最後に、機能解析および生物物理学的解析から、ジスルフィラムの腫瘍抑制効果の分子標的が、細胞内の複数の調節経路およびストレス応答経路に関わるタンパク質の代謝回転に必須であるp97(別名VCP)セグレガーゼのアダプターNPL4であることが明らかになった。
ジスルフィラムがp97(別名VCP)セグレガーゼのアダプターNPL4に作用しているというメカニズムです。
p97はタンパク質の分解に重要な働きを行っているユビキチン・プロテアソーム系で重要なタンパク質です。最近、このp97ががん治療のターゲットとして注目されています。
p97はユビキチン化されたタンパク質と、そのタンパク質と結合している他のタンパク質から引き離す働きをしています。
ジスルフィラムはp97のアダプターのNPL4に作用してp97の働きを阻害し、ユビキチン・プロテアソーム系でのタンパク質の分解を阻害することによって、抗がん作用を発揮しているというメカニズムです。
実際は、ジスルフィラムは多くの物質に作用するので、p97のアダプターのNPL4もターゲットの一つだという認識で良いと思います。ジスルフィラムはアルデヒド脱水素酵素も阻害します。その他にもターゲット分子が知られています。

図:ジスルフィラムを経口摂取すると、消化管内および血液内で1分子のジスルフィラムは2分子のジエチルジチオカルバミン酸に変換され(①)、さらにジエチルチオカルバミン酸メチルエステル・スルホキシドに代謝される(②)。ジエチルチオカルバミン酸メチルエステル・スルホキシドは、アルデヒド脱水素酵素の酵素活性部位のシステインのスルフヒドリル基(-SH)と反応して結合し、酵素活性を阻害する(③)。同様なメカニズム(タンパク質のシステインに反応して活性を阻害する機序)によって、プロテインキナーゼCやP糖蛋白質やDNAメチルトランスフェラーゼを含む、様々ながん促進性のタンパク質を阻害する。
ジスルフィラムの代謝産物がタンパク質のシステインの反応して活性を阻害する作用はアミノ酸のセリン合成に関与するホスホグリセリン酸デヒドロゲナーゼ(phosphoglycerate dehydrogenase :PHGDH)でも報告されています。
Anti-alcohol abuse drug disulfiram inhibits human PHGDH via disruption of its active tetrameric form through a specific cysteine oxidation.(抗アルコール乱用薬のジスルフィラムは、特定のシステイン酸化による活性型四量体の破壊を介してヒトPHGDHを阻害する)Sci Rep. 2019 Mar 18;9(1):4737.
【要旨】
高額な開発費用と新しい標的の特定の難しさのために、医薬品再利用(転用)はがん治療薬の開発のための実行可能な戦略として注目されている。アルコール中毒治療薬のジスルフィラムはがん治療に有用であることが以前から報告されてきたが、最近1つの抗がん作用の機序が注目されている。
これには、細胞内シグナル伝達やストレス応答に関する複数の経路に関与するタンパク質の代謝回転に不可欠なp97セグレガーゼのアダプターNPL4(p97 segregase adaptor NPL4)の阻害が含まれる。
しかし最近、ジスルフィラムはホスホグリセリン酸デヒドロゲナーゼ(phosphoglycerate dehydrogenase :PHGDH)を阻害する作用があることが報告された。
PHGDHは、多くの種類のがんで高度に発現するセリン合成経路の初期段階を触媒する四量体酵素である。ここでは、ジスルフィラム類似体によるPHGDH阻害の構造活性相関と、酵素および細胞ベースの評価、質量分析および突然変異誘発実験を介して、PHGDHに対するジスルフィラムの作用機序を検討した。
アミノ酸のセリンの合成を阻害するとがん細胞の増殖を抑制できます。ジスルフィラムはセリンの合成を阻害してがん細胞の増殖を抑制する可能性を報告しています。
【ジスルフィラムは小胞体ストレスを亢進してアポトーシスを誘導する】
小胞体ストレス(Endoplasmic reticulum stress)とは、正常な高次構造にフォールディング(折り畳み)されなかったタンパク質(変性タンパク質; unfolded protein)が小胞体に蓄積し、それにより細胞への悪影響(ストレス)が生じることす。
小胞体ストレスは細胞の正常な生理機能を妨げるため、細胞にはその障害を回避し、恒常性を維持する仕組みが備わっています。この小胞体ストレスに対する細胞の反応を小胞体ストレス応答(unfolded protein response:UPR)といいますが、変性タンパク質が過剰に蓄積し、小胞体ストレスの強さが細胞の回避機能を越えると、細胞死(アポトーシス)が誘導されます。
ジスルフィラムは小胞体ストレスを亢進してがん細胞のアポトーシスを誘導する作用が指摘されています。以下のような論文があります。
Induction of autophagy-dependent apoptosis in cancer cells through activation of ER stress: an uncovered anti-cancer mechanism by anti-alcoholism drug disulfiram.(小胞体ストレスの活性化によるがん細胞のオートファジー依存性アポトーシスの誘導:アルコール中毒治療薬ジスルフィラムによる新規の抗がんメカニズム)Am J Cancer Res. 2019 Jun 1;9(6):1266-1281.
この論文では、ジスルフィラムの抗がん作用の新規のメカニズムとして、小胞体ストレスの誘導を報告しています。強い小胞体ストレスが長期間持続すると細胞は死滅するということです。。
細胞の死は生体の死とも似ています。細胞も生体も困難な状況やストレスが起こると、それを軽減し耐えるような応答が起こって、細胞や生体は恒常性を維持して生きようと必死に抵抗します。
しかし、ストレスの状況が強く長期に及ぶと、恒常性維持機能や抵抗力も限界を迎えて、死(アポトーシス)を選びます。
がん細胞は、正常な細胞に比べてストレスの多い状況で生きています。それは、低酸素や低グルコースや異常タンパク質の蓄積や活性酸素の産生増加などによって細胞内でストレスの高い状況が起こっているのです。
ストレスの代表が小胞体ストレスと酸化ストレスです。
この小胞体ストレスと酸化ストレスをがん細胞に特異的に高めることによってがん細胞を選択的に死滅させようという治療法が注目されています。
抗がん剤治療や放射線治療は、がん細胞に小胞体ストレスや酸化ストレスを高めて死滅させます。これに対して、がん細胞や小胞体ストレス応答や抗酸化システムを亢進して対抗します。
がん細胞の抵抗(小胞体ストレス応答や抗酸化システム)を阻害すると、抗がん剤治療や放射線治療の効果を高めることができます。(下図)

図:がん組織内ではがん細胞は低酸素や低グルコースによるストレスを受け、さらに抗がん剤や放射線もがん細胞にダメージを与える(①)。その結果、がん細胞は異常タンパク質や活性酸素種の産生増加と蓄積によって、小胞体ストレスと酸化ストレスを受ける(②)。これに対して、がん細胞は小胞体ストレス応答、抗酸化システム、オートファジーやプロテアソームにおけるタンパク質分解などのメカニズムで細胞内ストレスに対して応答して、生存を維持しようとする(③)。このバランスが崩れて、小胞体ストレスおよび酸化ストレスが増強すると、細胞傷害の増大によって細胞死(アポトーシス)が起こる(④)。2-デオキシグルコース、メトホルミン、ジスルフィラム、オーラノフィン、ジクロロ酢酸ナトリウム、ヒドロキシクロロキンは小胞体ストレス応答や抗酸化システムやオートファジーやプロテアソームを阻害することによってストレス応答を阻害する(⑤)。さらに、異常タンパク質や活性酸素の蓄積を亢進して小胞体ストレスと酸化ストレスを亢進する(⑥)。がん細胞内のストレスを増強し、ストレス応答による恒常性維持機構を破綻させると、がん細胞を死滅できる。
【ジスルフィラムの最近の報告】
ジスルフィラムの抗がん作用に関する研究報告が増えています。最近の報告を読むと、ジスルフィラムに関する研究の動向を知ることができます。
Disulfiram causes selective hypoxic cancer cell toxicity and radio-chemo-sensitization via redox cycling of copper(ジスルフィラムは、銅の酸化還元サイクリングを介して、選択的な低酸素がん細胞毒性と放射線化学療法感作を引き起こす)Free Radic Biol Med. 2020 Apr;150:1-11.
【要旨】
肺がんの治療は、最初は望ましい反応を引き出すが、腫瘍内における低酸素症と薬剤耐性細胞の存在が、最終的には治療の失敗を引き起こす。
ジスルフィラムはFDAが承認した薬剤で、銅キレート作用があり、酸化ストレスを高める作用によってがん治療の補助として再利用できる。生理的レベルのCu(15μMCuSO4)と組み合わせたジスルフィラム(50-150 nM)が、正常なヒト気管支上皮細胞(HBEC)と比較してH292非小細胞肺がん細胞に対して選択的に毒性があることが示された。さらに、がん細胞への毒性は、4%または21%の酸素濃度と比較して1%の酸素濃度の条件下で増強した。
ジスルフィラム/ Cuのこの選択的毒性は、異なるCuイオノフォア能力と関連していた。
ジスルフィラム / Cu処理により、非小細胞肺がんの細胞内Cuが20倍以上増加した。さらに、酸素濃度21%に比較して酸素濃度1%では約2倍のCuが存在した。
ジスルフィラムの毒性は、Cuの保持と、スーパーオキシドや過酸化物や脂質過酸化の産生、およびミトコンドリア損傷などの酸化ストレスに依存することが示された。
ジスルフィラムは正常ヒト気管支上皮細胞と比較して非小細胞肺がんに選択的に、放射線および化学療法によって誘発される細胞死を増強し、低酸素症における放射線および化学療法の耐性を低下させることが示された。
最後に、ジスルフィラムは、放射線およびカルボプラチンと組み合わせると、in vivoで異種移植腫瘍の成長を減少させた。
これらの結果は、ジスルフィラムががん細胞に選択的に作用し、がん治療を強化するための有望な補助療法である可能性を支持している。
Disulfiram Chelated With Copper Inhibits the Growth of Gastric Cancer Cells by Modulating Stress Response and Wnt/β-catenin Signaling.(銅でキレート化されたジスルフィラムは、ストレス応答とWnt /β-カテニンシグナル伝達を調節することにより、胃がん細胞の増殖を阻害する)Front Oncol. 2020 Dec 21;10:595718.
【要旨の抜粋】
ここ数十年の研究で、ジスルフィラムは抗腫瘍活性を示すことが実証されている。銅でキレート化されたジスルフィラムは、強化された抗腫瘍効果を示す。In vitroおよびin vivoの実験系で、胃がん細胞の増殖と転移に対するジスルフィラム-銅複合体の作用を検討した。
ジスルフィラム-銅複合体複合体は、MKN-45およびBGC-823胃がん細胞の増殖と移動を抑制した。さらに、ジスルフィラム-銅複合体治療により、マウスに胃がん細胞を移植した実験モデルにおいて腫瘍体積が48.24%に抑制された。
さらに、ジスルフィラム-銅複合体は、MKN-45およびBGC-823 胃がん細胞において、in vitroおよび異種移植腫瘍マウスモデルの両方において、用量および時間依存的にアポトーシスを誘導した。さらに、ジスルフィラム-銅複合体は胃がん細胞にオートファジーを誘導し、移植腫瘍の実験系でオートファジー関連のBeclin-1およびLC3タンパク質の発現を増加させた。
さらに、ジスルフィラム-銅複合体は、MKN-45細胞とBGC-823細胞で、酸素消費率と細胞外酸性化率を低下させることにより、好気性解糖と酸化的リン酸化を抑制した。
ジスルフィラム-銅複合体による治療は、in vitroとin vivoの両方の実験系において、活性酸素種の産生を高めて酸化ストレスとDNA損傷応答を誘発した。さらに、P53、P21、およびγ-H2AXタンパク質の発現を増加させ、Wnt /β-カテニンシグナル伝達を阻害した。
以上のように、ジスルフィラム-銅複合体は、ストレス応答とWnt /β-カテニンシグナル伝達系に作用することにより、胃がん細胞の増殖と転移を抑制した。したがって、ジスルフィラムは胃がんの治療のための潜在的な治療薬として使用できる可能性がある。
Disulfiram repurposing combined with nutritional copper supplement as add-on to chemotherapy in recurrent glioblastoma (DIRECT): Study protocol for a randomized controlled trial.(再発性膠芽腫における化学療法への追加治療としての銅のサプリメントと組み合わせたジスルフィラムの転用:ランダム化比較試験の研究プロトコル)
【要旨の抜粋】
背景:ジスルフィラムは、1950年代からアルコール依存症の治療に使用されてきた、忍容性が高く、安価なジェネリック医薬品である。 現在、抗がん剤としてジスルフィラムを支持する前臨床データがあり、実験データは、銅がその抗腫瘍特性を高める可能性があることを示唆している。
ジスルフィラムが頭蓋外腫瘍の治療に有望な抗がん剤であるといういくつかの臨床的証拠もある。 膠芽腫では、ジスルフィラムによって誘発されるO 6-メチルグアニンメチルトランスフェラーゼ(O 6-methylguanine methyltransferase)阻害により、アルキル化化学療法への反応が高まる可能性がある。
最近の第I相試験では、化学療法と一緒にジスルフィラムを500 mg /日未満の用量で投与した場合の、膠芽腫患者におけるジスルフィラムの安全性が実証された。 膠芽腫治療におけるアルキル化化学療法の補助薬として、ジスルフィラムと銅サプリメントを組み合わせた効果を評価する予定である。
方法:並行グループデザイン(1:1)を使用した、学術的で、業界に依存しない、多施設、非盲検ランダム化比較第II / III相試験で、膠芽腫治療におけるジスルフィラム-銅治療の有効性と安全性を評価する。 この研究には、膠芽腫の最初の再発時にアルキル化化学療法が計画されている142人の患者が対象となる。 患者はジスルフィラム-銅治療の併用を受ける群と受けない群にランダムに分けられる。 主要エンドポイントは6ヶ月での生存率で、 二次エンドポイントは、全生存期間、無増悪生存期間、生活の質、造影剤増強腫瘍体積および安全性である。
考察:再発性膠芽腫の治療を改善する必要がある。 膠芽腫におけるジスルフィラム-銅を用いたこのランダム化比較試験の結果は、膠芽腫治療におけるジスルフィラム-銅の将来の役割の予備的な証拠として、また将来の研究の設計と検出力の推定の基礎として役立つ。 この論文では、選択の根拠を示し、方法論の問題について説明する。
がん治療におけるジスルフィラムの有効性を検討する臨床試験は多数実施されています。
培養細胞を使った実験では、ジスルフィラムと銅を併用すると抗腫瘍効果を高めることができます。
臨床試験でも、銅のサプリメントと併用している場合があります。
しかし、食事から十分な量の銅を摂取していることと、がん細胞は銅を多く含むので、臨床でジスルフィラムをがん治療で使うときは銅のサプリメントは必要ないという意見が多い様です。
つまり、がん細胞は細胞内に銅を多く含むので、ジスルフィラムの抗がん作用が強く出ると考えられています。
【リュウマチ治療薬のオーラノフィンはユビキチン・プロテアソーム系を阻害する】
オーラノフィン(Auranofin)は、関節リュウマチにおける炎症反応や免疫異常を抑制して、寛解へと導く経口金製剤として1985年以降臨床で使用されています。
炎症細胞の機能抑制や、免疫細胞に作用して自己抗体の産生を抑制して、関節における炎症を抑制します。
最近、オーラノフィンの抗腫瘍効果が注目されています。米国ではがん治療へのオーラノフィンの効果を検討する第2相臨床試験の実施がFDA(食品医薬品局)から承認されています。
今まで報告されたオーラノフィンの抗がん作用のメカニズムは多様です。DNAやRNAやタンパク質の合成阻害、ミトコンドリアのチオレドキシン還元酵素やグルタチオン-S-トランスフェラーゼやプロテアソームの機能阻害、抗炎症作用(IL-6/STAT3経路の阻害、NF-κB活性化の阻害など)、ヒストン・アセチル化亢進など多くの作用機序が報告されています
オーラノフィンには脱ユビキチン化酵素阻害作用によってタンパク分解を阻害する作用が報告されています。以下のような報告があります。
Clinically used antirheumatic agent auranofin is a proteasomal deubiquitinase inhibitor and inhibits tumor growth(臨床的に使用されている抗リュウマチ薬のオーラノフィンはプロテアソームの脱ユビキチン化酵素の阻害剤でがん細胞の増殖を阻害する)Oncotarget. 2014 Jul; 5(14): 5453–5471.
【要旨】
プロテアソームは、がん治療のための魅力的な新たなターゲットである。慢性関節リウマチを治療するために臨床的に使用されている金含有化合物であるオーラノフィンは、最近、米国食品医薬品局(FDA)の承認を受けて抗がん作用に関して第2相臨床試験が実施されている。しかし、オーラノフィンの抗がん作用のメカニズムは十分に明らかになっていない。
この論文では我々は以下のことを報告する。
(i)オーラノフィンがボルテゾミブ(ベルケード)に匹敵するプロテアソーム阻害効果を示す。
(ii)ボルテゾミブとは異なり、オーラノフィンは20Sプロテアソームではなくプロテアソーム関連脱ユビキチン化酵素のUCHL5およびUSP14を阻害する。
(iii)プロテアソーム関連脱ユビキチン化酵素の阻害は、オーラノフィンの細胞傷害性に必要である。
(iv)オーラノフィンは、生体内(in vivo)で腫瘍増殖を選択的に阻害し、急性骨髄性白血病患者から採取した腫瘍細胞において細胞傷害性を誘導する。
この研究は、金属含有化合物のプロテアソーム阻害特性の理解に対する重要な新規な知見を提供する。いくつかの脱ユビキチン化酵素阻害剤が報告されているが、臨床で既に使用されているオーラノフィンがプロテアソーム関連脱ユビキチン化酵素の阻害作用を有しており、がん治療薬として有望であることを明らかにした。
ユビキチンが結合したタンパク質がプロテアソームで分解される前に脱ユビキチン化酵素によってユビキチンが分離される必要がありますが、オーラノフィンはこのプロテアソーム関連脱ユビキチン化酵素を阻害することによってプロテアソームの働きを阻害するという実験結果です。脱ユビキチン化酵素は多数の種類がありますが、オーラノフィンは19Sプロテアソームに関連したUSP14 とUCHL5と言う脱ユビキチン化酵素を阻害するということです。
【オーラノフィンとジスルフィラムの相乗効果】
オーラノフィンとジスルフィラムが抗がん作用において相乗効果を示すことが報告されています。以下のような報告があります。
Two clinical drugs deubiquitinase inhibitor auranofin and aldehyde dehydrogenase inhibitor disulfiram trigger synergistic anti-tumor effects in vitro and in vivo(脱ユビキチン化酵素阻害剤のオーラノフィンとアルデヒド脱水素酵素阻害剤のジスルフィラムの2つの薬剤はin vitroおよびin vivoの実験系において相乗的な抗腫瘍効果を引き起こす)Oncotarget. 2016 Jan 19; 7(3): 2796–2808.
【要旨】
プロテアソーム関連脱ユビキチン化酵素の阻害は、がん治療のための新規な戦略として注目を集めている。関節リウマチの治療に使われている金(I)含有化合物のオーラノフィンが、プロテアソーム関連脱ユビキチン化酵素の阻害剤であることが最近報告された。
アルデヒド脱水素酵素の阻害剤であるジスルフィラムはアルコール中毒の治療に使われている。ジスルフィラムが抗腫瘍活性を有することが最近の研究で明らかになっている。
本研究では、肝臓がん細胞を用いて、がん細胞のアポトーシス誘導と増殖抑制におけるジスルフィラムとオーラノフィンの相乗効果について検討した。
その結果、オーラノフィンとジスルフィラムはin vitroとin vivoの両方の実験系において、肝臓がん細胞に対して相乗的な抗腫瘍活性を示した。
さらに、オーラノフィンとジスルフィラムの併用は、カスパーゼの活性化、小胞体ストレス、活性酸素産生を亢進した。
汎カスパーゼ阻害剤z-VAD-FMKは、オーラノフィンとジスルフィラムの併用投与によって引き起こされるアポトーシスを阻害したが、プロテアソーム阻害作用は阻害しなかった。オーラノフィンとジスルフィラムの併用によるアポトーシス誘導には活性酸素は関与していなかった。
以上の結果から、肝臓がん細胞におけるアポトーシス誘導におけるジスルフィラムとプロテアソーム関連脱ユビキチン化酵素阻害剤のオーラノフィンとの間の相乗作用が確認され、新規ながん治療法となる可能性が示された。
この論文では、ジスルフィラム自体にプロテアソーム阻害作用があることが指摘されていませんが(すでに報告されている作用なので、なぜ言及していないのか不明です)、ジスルフィラムとオーラノフィンは異なる作用メカニズムでタンパク質分解を阻害し、さらにその他多くの作用メカニズムで抗がん作用を示すことが明らかになっています。
したがって、この2つの薬剤の組合せは、がんの代替療法として使用してみる価値は高いと思います。
私自身、数年前からこの2つを併用していますが、ジスルフィラムとオーラノフィンを併用しても、飲酒しなければ副作用はほとんど経験しません。
【2-デオキシ-D-グルコースは酸化ストレスと小胞体ストレスを引き起こす】
細胞はストレスが極限に達すると死滅します。がん細胞に選択的にストレスを高めて自滅させるがん治療法が注目されています。細胞にストレスを高める方法として酸化ストレスと小胞体ストレスがあります。
酸化ストレスと小胞体ストレスを同時に亢進すると、がん細胞は自滅します。
細胞内の酸化ストレスは、がん細胞の増殖や転移を抑制する方向で作用します。したがって、がん細胞の酸化ストレスを高めることはがんの治療に有効です。(505話、506話参照)
がん細胞の酸化ストレスを高める方法としてケトン食、2-デオキシ-D-グルコース、メトホルミン、レスベラトロール、ジクロロ酢酸ナトリウム、アルテスネイト、高濃度ビタミンC点滴、半枝蓮、オーラノフィン、ジスルフィラムなどがあります。(507話、508話、509話参照)
2-デオキシ-D-グルコース(2-DG)はがん細胞の解糖系とペントース・リン酸経路(Pentose Phosphate Pathway: PPP)を阻害し、がん細胞の酸化ストレスを高めます。(418話参照)
2-DGは小胞体ストレスを高めてがん細胞を死滅させる作用も報告されています。
小胞体(Endoplasmic reticulum)は、細胞内における分泌・膜タンパク質の品質管理において大切な小器官です。
2-DGは解糖系を阻害する以外に、タンパク質に糖鎖が着くN-グリコシル化の過程を阻害するので、糖タンパク質の生成を阻害します。
グリコシル化というのはタンパク質に糖類が付加する反応で、小胞体で行われて、正常に糖が付加したタンパク質はゴルジ体に運ばれます。
糖鎖異常の糖タンパク質は、折り畳みが不完全な異常タンパク質になり、小胞体に蓄積して小胞体ストレスを引き起こし、細胞死の原因にもなります。
ユビキチン・プロテアソーム系を阻害するジスルフィラム+オーラノフィンに、オートファジーを阻害するヒドロキシクロロキン、小胞体ストレスと酸化ストレスを高める2-デオキシグルコース、メトホルミンを併用する治療法は試してみる価値はあります。副作用はほとんどなく、がん細胞を比較的選択的に攻撃します。

図: 2-デオキシグルコースは糖鎖異常の糖タンパク質を増やして小胞体ストレスを誘導する(①)。これに対して、細胞は小胞体ストレス応答(②)で対抗し、さらにユビジチン・プロテアソーム系(③)とオートファジー・リソソーム系(④)で異常タンパク質を分解することによって小胞体ストレスを軽減する。メトホルミンは小胞体ストレス応答を阻害する(⑤)。ジスルフィラムとオーラノフィンはユビキチン・プロテアソオーム系を阻害し(⑥)、ヒドロキシクロロキンはオートファジー・リソソーム系を阻害する(⑦)。これらを組み合わせると、がん細胞の小胞体ストレスが亢進して細胞死(アポトーシス)を誘導できる(⑧)。
| « 739)断酒薬ジ... | 741)断酒薬ジ... » |



