がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
520) がん予防と糖質制限とケトン食
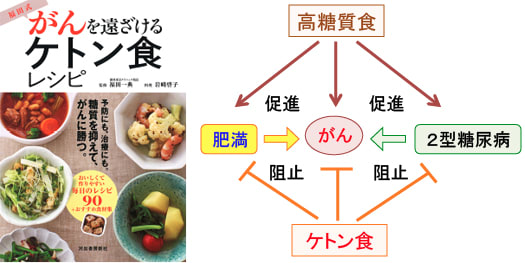
図:肥満と2型糖尿病はがんの発生と進行を促進する。高糖質食は肥満と2型糖尿病を増やす。さらに、高糖質食自体ががんの発生と進行を促進する。一方、ケトン食は肥満と2型糖尿病とがんのいずれの発病も予防する。がん予防の食事としてマイルドなケトン食は有用と考えられる。
520) がん予防と糖質制限とケトン食
【がん専門医はがんの第一次予防に消極的】
私は20年くらい前(平成7年〜平成10年)に国立がんセンター研究所のがん予防研究部第一次予防研究室の室長をしていました。
がんの第一次予防というのは、食生活や生活習慣の改善によってがんの発生を予防することです。
がん検診を使って早期診断・早期治療でがん死を減らそうというのが第二次予防で、がん治療後の再発を予防することを第三次予防と言います。
今の国立がん研究センターでは、がんの第一次予防の研究はほとんど行っていません。早期診断法の開発やがん検診の推進など第二次予防が中心です。
しかし、がん検診をいくら推進してもがん患者は減りません。むしろがん患者は増えます。治療の必要のない「悪性度の低いがん」を発見して、過剰診療の原因にもなっています(432話参照)。
第二次予防(早期診断と早期治療)ではがんの発生数を減らせないことは明らかですが、がん患者が減ると困るので第一次予防は行わないというのが、国立がん研究センターの方針のようです。
がんを減らすことを真剣に考えれば国民のためには良いのですが、がん患者を減らすことを積極的にすると、がん専門医は仕事が減るので、したくないというのが本音です。
早期診断・早期治療の第二次予防の推進であれば、がん専門医もがんセンターも仕事が増えて存在価値が増えます。しかし、国民には全くメリットはありません。医療費が増えるだけです。
糖質制限すれば糖尿病患者が減るのが分っているので、糖尿病専門医が糖質制限を受け入れたくないのと似たような理由です。
【日本食はがん予防に有効なのか?】
がん予防にどのような食事が良いという点に関しては、「精製度の低い穀物や大豆や野菜や果物を多く摂取する」、「肉と動物性脂肪は少なくする」というのが主流の意見です。
しかし、細かい点では異なる意見は数多くあります。
例えば、果糖(フルクトース)はがん細胞の増殖や悪性化を亢進するという点から、「果物を多く摂取することはがん予防に良い」という考えには反対の意見が多くあります。(378話参照)
最近のコホート研究の多くで、野菜や果物の摂取ががんを減らす効果は確認されていません。(304話参照)
乳がん治療後に「野菜と果物と食物繊維が非常に豊富で総脂肪摂取量を減らす食事」をしても、再発や新たな乳がんの発生や全死因死亡率を減らす効果が認めらていません。(334話参照)
「肉や乳製品ががんを促進する」という意見を支持する証拠も得られていません。(332話参照)
3大栄養素の炭水化物、脂質、蛋白質の摂取カロリーの適正比率は3:1:1と言われています。カロリー比率で、糖質が60%、脂肪が20%,蛋白質が20%程度が健康的な食事だと言われています。
一般的な日本食というのはこの比率に近く、「塩分を減らした伝統的日本食」はがん予防の理想の食事だという意見は、がん予防の研究分野では昔からあります。
赤身の肉や動物性脂肪の摂取が大腸がんや乳がんや前立腺がんなど欧米型のがんの発生リスクを高めると考えられており、近年の日本におけるこれら欧米型のがんの増加は食事が欧米化しているためだと言われています。
魚油に含まれるドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)や大豆に含まれるイソフラボンのがん予防効果に関しては多くの研究があります。
日本食の場合は塩分が多いのが欠点ですが、欧米の食事に比べて魚や大豆製食品やキノコ類や海草類が多く、赤身の肉や動物性脂肪が少ないという点では健康的と考えられています。
しかし、白米主体の主食や、砂糖やみりんなど糖質の多い味付けなど、糖質摂取量が多いという観点から、日本食のがん予防効果について疑問視する意見が増えています。
糖質は血糖を高めてインスリンの分泌を高めるので、がんを促進する作用があります。主食のご飯は発がんリスクを高める要因として無視できないことに、がん予防の研究者は最近気がついてきました。
米は日本人の主食なので、ご飯が発がんリスクを高めるという意見は長い間タブーになっていたのですが、最近になって糖質制限の健康作用が注目されるようになって、がんの予防や治療においても米食の是非について議論されるようになっています。
玄米であれば白米よりグリセミック指数(食後に血糖値を上昇させる程度)が低いので発がん促進作用は少ないと考えられ、玄米菜食ががんの予防や治療の分野では推奨されていますが、玄米でも糖質(ブドウ糖)の摂取(ブドウ糖負荷)が増えることが問題であることには変わりがなく、白米よりかはマシですが、糖質制限には及びません。
つまり、がんの発生や再発予防や治療の観点からは、「玄米を主食にした日本食」は「白米を主食にした日本食」より少しは良いのですが、米自体の摂取を減らした「糖質を減らした日本食」あるいは「ケトジェニックな日本食(Ketogenic Japanese Diet)」の方がより抗がん効果が高い可能性が示唆されます。
このような食事はがんに関してはまだエビデンスが少ないのですが、肥満や糖尿病やメタボリック症候群の治療においてはエビデンスが蓄積してきています。肥満や糖尿病やメタボリック症候群はがんのリスク要因として重要なので、ケトン食がこれらの疾患に有効であれば、がんにも有効と言えます。
【白米は糖尿病を増やし、糖尿病はがんを増やす】
日本を含めて世界中で糖尿病は増えています。
日本では糖尿病は1960年代くらいまでは極めて稀な病気でしたが、現在では5人に一人が糖尿病あるいは糖尿病予備軍と言われるくらいに増えています。
厚生労働省の平成26年の「国民健康・栄養調査」によると、「糖尿病が強く疑われる者」の割合は、男性15.5%、女性9.8%で、「糖尿病の可能性を否定できない人」の割合を加えると男女とも20%を超えています。
糖尿病ががんの発生を増やすことは多くの研究で確認されています。日本で行なわれた大規模調査では、糖尿病と診断されたことのある人はない人に比べ、20~30パーセントほどがんの発生率が高くなることが報告されています。
最近のメタアナリシスによると,糖尿病は非ホジキンリンパ腫,膀胱がん,乳がん,大腸がん,子宮内膜がん,肝がん,膵がんなどの発症リスクを高めることが示されています。
さらに、糖尿病があるとがんの進行が早く転移しやすいことも指摘されています。高血糖や高インスリン血症ががん細胞の増殖を促進するからです。
様々なメカニズムで、糖尿病はがんの発生や進展を促進することが明らかになっています。 (216話参照)
白米摂取量が多いほど2型糖尿病の発症が増えることが明らかになっています。以下のような報告があります。
White rice consumption and risk of type 2 diabetes: meta-analysis and systematic review.(白米の消費量と2型糖尿病のリスク:メタ解析と系統的レビュー)BMJ. 2012 Mar 15;344:e1454.
米国のハーバード大学からの報告です。2012年1月までに報告された研究の中から、白米摂取と2型糖尿病との関係を検討した4件の前向きコホート研究を抽出し、メタ解析を行っています。これらの研究は米国、オーストラリア、中国、日本で行われたもので、7コホートが含まれていました。
調査開始時に糖尿病でなかった352,384人を対象に4〜22年間の追跡で、13,284例が2型糖尿病を発症しました。白米の平均消費量は西洋諸国とアジア諸国で大きく異なり,西洋では1週間に5杯(1杯=調理した白米158g)未満であったのに対し、中国では1日平均4杯でした。
解析の結果,白米の最低摂取群と比較した最高摂取群の糖尿病の相対リスク(RR)は東洋人が1.55〔95%信頼区間(CI)1.20〜2.01〕、西洋人が1.12(同0.94〜1.33)で、両者の差は統計的に有意でした(P=0.038)。
これは、米を多く食べる東洋人では2型糖尿病リスクが55%高まったが、週に平均5杯と米の摂取量の少ない欧米ではリスク上昇率は12%にとどまるという結果です。
4研究の全参加者を対象とした用量反応性メタ解析では、白米摂取1日1皿増加当たりの糖尿病の相対リスクは1.11(95%CI 1.08〜1.14)でした。
つまり、白米の摂取量が多いほど2型糖尿病の発症リスクが増加し、この関係は東洋人(中国人と日本人)で顕著であるという結果です。そして、1日の白米摂取が1杯増えるごとに2型糖尿病の発症リスクが11%上昇するという結論です。
グリセミック指数が高い食事は2型糖尿病発症リスクの上昇に関連することが知られています。
グリセミック指数(GI値)は、炭水化物が消化されてグルコース(ブドウ糖)に変化する速さを相対的に表す数値で、GI値が高いほど食後血糖値が上昇しやすいことを意味します。
世界的に白米は消費量が多く、グリセミック指数が高い食材です。したがって、世界的な糖尿病患者の増加に白米の摂取が関連しているかどうかを検討した結果、白米摂取量と2型糖尿病発症リスクとの間に有意な関連が認められたということです。
この論文の結論は、「白米の消費量の増加は2型糖尿病の発症リスクの増加と有意に関連しており、特にアジア(中国と日本)の人々ではその関連は顕著である。」となっています。
中国では糖尿病が爆発的な勢いで増加していることが問題になっています。その原因の第一が白米摂取にあることは多くの研究者が指摘しています。
日本でも、国立がん研究センターによる多目的コホート研究(JPHC研究)で、白米の多量摂取が糖尿病の発症率を高めていることが指摘されています。
Low-carbohydrate diet and type 2 diabetes risk in Japanese men and women: the Japan Public Health Center-Based Prospective Study.(日本の男女における低炭水化物食と2型糖尿病の発症リスク:多目的コホート研究)PLoS One. 2015 Feb 19;10(2):e0118377.
この研究では、糖尿病の既往がない45~75歳の男性27,799人と女性36,875人を対象に、食物摂取量は食物摂取頻度調査票を用いて確認し、前向きに追跡し、5年間に診断された2型糖尿病のオッズ比を、ロジスティック回帰を用いて推定しています。
その結果、日本人女性において低炭水化物食と2型糖尿病リスク低下との関連が認められました。糖質摂取が多い上位5分の1のグループに比較して、糖質摂取が少ない下位5分の1のグループの2型糖尿病の多変量調整オッズ比は、0.63(95%CI:0.46~0.84)でした。この論文の著者らは、2型糖尿病の発症に白米の多量摂取が関連している可能性を指摘しています。
2型糖尿病は米をよく食べるアジア諸国で急増しています。
白米を多く食べるほど2型糖尿病の発症リスクが有意に上昇し、その結果、がんの発症も増えます。「白米摂取ががんを増やす」ということを示しています。
日本食は白米を主食にしている点でがん予防にマイナスと言えます。白米が認知症を増やすデータも報告されています。
【糖質摂取は肥満を増やし、肥満はがんの発症リスクを高める】
肥満ががんの発生を促進することは多くのエビデンスで支持されています。 肥満はインスリン抵抗性を高め、高インスリン血症を引き起こします。インスリンはインスリン様成長因子の活性も高めます。インスリンとインスリン様成長因子はがんの発生や進展を促進します。(155話参照)
多くの疫学研究から、大腸がん、乳がん、膵臓がん、子宮体がん、腎臓がん、胆のうがん、肝臓がんなど多くのがんの発生率が肥満によって増えることが示されています。
肥満ががん治療後の再発率を高め生存期間を短くすることも多くの報告で明らかになっています。
肥満ががんの発生や進展を促進する理由の第一は、インスリンの分泌が増えるからです。
インスリンの働きに影響する様々な生理活性物質が脂肪細胞から分泌されており、肥満によって体脂肪が増えるとインスリンの働きが低下します。脂肪組織から分泌されるアディポネクチンという蛋白質にはインスリンの働きを高める作用がありますが、内蔵脂肪が増えると分泌量が減り、アディポネクチンの血中濃度が低下するとインスリン抵抗性(インスリンの作用低下)が高まります。
インスリンの働きが弱くなると、それを補うために体はインスリンの分泌量を増やして血中のインスリン濃度を高めて代償しようとします。
インスリンは様々なメカニズムでがん細胞の発生や増殖を促進します。インスリンががん細胞の増殖促進や細胞死(アポトーシス)の抑制など、がんを悪化させる様々な作用が明らかになっています。インスリンの分泌を減らすこと自体にがん予防効果があります。(375話参照)
糖質摂取が肥満を促進することは良く知られています。インスリンは脂肪合成を増やし、肥満を促進するホルモンだからです。
日本人のインスリン分泌能は欧米人の半分程度と言われています。インスリンは血糖を下げる作用と肥満を促進する作用があります。
インスリン分泌能が高い欧米人は糖質摂取によって肥満になりやすい体質を持っていますが、糖尿病は発症しにくい体質です。欧米人は著明な肥満にならないと糖尿病は発症しません。
一方、インスリン分泌能の低い日本人は、高糖質食でも肥満になりにくい代わりに糖尿病になりやすい体質を持っています。実際に、日本人は欧米人に比べると肥満は非常に少ないのですが、糖質摂取量が増えて糖尿病が増えています。
米国では「肥満の流行(Obesity Epidemic)」と表現されるくらい急速に肥満が増加しています。米国ではこの30年間で肥満(BMIが30以上)は2倍以上、小児の肥満や成人の高度の肥満(BMI35以上)は約3倍になっています。米国の人口の3分の1が肥満(BMI30以上)、3分の1が過体重(BMIが25〜30)です。
BMIはBody Mass Indexの略(日本語ではボディマス指数)で、体重(kg)÷身長(m)÷身長(m)で求められます。肥満度の指標として使用されます。
精製した穀物や、高フルクトース・コーンシロップや砂糖のような単純糖質が増えたことが、米国における肥満と糖尿病の増加の元凶だと考えられています。
以前は肉と脂肪の摂取過剰が肥満の原因だと考えられ、1970年代以降は肉と脂肪を減らす食事指導が行われ、実際に脂肪とタンパク質の摂取が減っているのに、肥満が爆発的に増えています。最近では、糖質を減らし、タンパク質や脂質(特にオリーブオイルやω3系多価不飽和脂肪酸)を増やす方が良いと考えられています。
中国では大量の米が消費され食事中の糖質の割合が多いのが特徴です。体を多く動かすので、農村部の多い中国では今まで肥満はあまり問題になっていませんでしたが、経済成長とともにライフスタイルが変わり、中国の都市部では肥満が増加し、糖尿病も急激に増えています。
糖質摂取はインスリン分泌を増やして体脂肪を増加させやすいので、摂取カロリーが過剰になると、容易に肥満を発症します。肥満はさらにインスリン分泌を増やし、肥満をさらに助長します。食後の高血糖は酸化ストレスを高めます(後述)。このような状況はがん細胞の発生や増殖を促進することになります。

図:糖質の多い食事やグリセミック指数の高い食品は食後血糖値を高める(1)。血糖値の上昇はインスリン分泌を増やす(2)。インスリンは脂肪合成を亢進して肥満を促進する(3)。肥満になるとインスリン抵抗性が亢進し、さらにインスリン分泌を増やし、悪循環を形成する(4)。肥満は脂肪組織において炎症性サイトカインの産生を増やし、アディポネクチンの産生を減らす(5)。その結果、炎症や酸化ストレスを亢進する(6)。高インスリン血症と炎症と酸化ストレスはがん細胞の発生や増殖を促進する(7)。食後高血糖は酸化ストレスを亢進し、酸化ストレスも発がんを促進する(8)。つまり、糖質の多い食事はがんの発生と進展を促進する。
【グリセミック負荷ががんの発生率を増やす】
前述のように、「糖質の過剰摂取が糖尿病や肥満を増やす結果としてがんの発生や進展を促進する」という間接的な因果関係が存在します。さらに、糖質摂取と発がんの直接的な関係も指摘されています。
糖質摂取の状況によって発がんリスクへの影響が異なります。
例えば、糖質の量が同じでも、白米と玄米では体に対する影響が異なります。それは、糖質の摂取量が同じでも、食品によって血糖値の上昇の度合いやインスリンの分泌を刺激する度合いが異なるからです。食後の血糖値の上昇が早く、インスリンを多く分泌させる食品ほど、体に悪い影響を与えます。
グリセミック指数(glycemic index: GI)とは、食品がどれほど血糖値を上げやすいかを示す指標です。食品中に含まれる炭水化物が消化されてグルコース(ブドウ糖)に変化する速さを、グルコースを摂取した場合を100として相対値で表します。糖質として同じ分量を摂取しても、素材が異なると血糖値への影響は異なるという考えに基づいた指数です。
グリセミック指数の値(GI値)が高い食品は食後の血糖値の上昇が大きくインスリンの分泌量が多くなります。GI値が低い食品は血糖値の上昇が小さいのでインスリンの分泌も少なくて済みます。
インスリンはがん細胞の増殖を促進するので、GI値の高い食品はがん細胞の発生や増殖や転移を促進することになります。がん予防で精製度の低い穀物が推奨されるのは、精製度の低い穀物ほどGI値が低く、インスリンの分泌が少なくできるからです。
グリセミック負荷(Glycemic load:ブドウ糖負荷)は(グリセミック指数÷100 )× 糖質の量(g)で表されます。ある食品を100g食べたときの血糖上昇の程度が、グルコースを何グラム食べたのに相当するかを示す数値です(図)。

図:食事から摂取した糖質は、素材によってグルコース(ブドウ糖)として消化・吸収される速度が異なる。グリセミック指数(Glycemic index : GI)は食品がどれほど血糖値を上げやすいかを示す指標で、グリセミック指数の値(GI値)が高い食品は食後の血糖値の上昇が大きくインスリンの分泌量が多くなる。GI値と糖質の量の積をグリセミック負荷(Glycemic load:GL)と言う。
血糖値に対する食品の影響はその食品中に含まれる糖質のグリセミック指数と糖質の含量の積であるグリセミック負荷によって決まります。グリセミック指数が低い食品でも大量に摂取すればインスリンの分泌量は増えます。玄米のご飯でも多く食べればインスリンの分泌が増えます。

図;グリセミック指数の高い食品を多く食べると、食後の血糖値を上げやすい。
食後血糖値の急激な上昇はインスリン分泌を高める。
がん予防に有効な地中海料理の本場のイタリアのコホート研究で、グリセミック負荷の高い食事(インスリン分泌量を増やす糖質の多い食事)は乳がんの発生率を高めることが報告されています。
High glycemic diet and breast cancer occurrence in the Italian EPIC cohort.(イタリアのEPICコホートにおける高グリセミック食と乳がん発生率の関係)Nutr Metab Cardiovasc Dis. 2013 Jul;23(7):628-34.
EPIC(European Prospective Investigation into Cancer and Nutrition)は、国際がん研究機関がコーディネートし、欧州10カ国で被験者を募集した多施設試験です。日本語に訳すと「がんと栄養に関する欧州前向き研究」となります。総計約50万人を対象にした欧州の大規模疫学研究です。
コホート(cohort)というのは、疫学研究では「特定の地域や集団に属する人々」のことです。つまり、この報告は、「がんと栄養に関する欧州前向き研究(EPIC)」で研究対象になった集団のうちのイタリアに住む集団を解析した疫学研究です。
この論文では、11年間の追跡調査で発生した879例の乳がんを解析した結果が報告されています。
この報告では、グリセミック負荷の多い上位20%のグループは、グリセミック負荷が少ない下位20%に比べて、乳がんの発生率が1.45倍であったと報告されています。食品のグリセミック指数や糖質の量には関係せず、グリセミック負荷が関連するということです。
つまり、グリセミック指数が高くても摂取量が少なければ良く、糖質の量が多くでもグリセミック指数の低いものであれば良いということです。すなわち、(グリセミック指数 X 糖質)÷100で示されるグリセミック負荷が乳がんの発生に相関するという結果です。糖質の摂取が多いとがんの発生率が高くなるということです。
グリセミック負荷の大きい糖質の多い食事はインスリン分泌を増やし、インスリン様成長因子-1(IGF-1)のシグナル伝達系を活性化して、乳がんを含め多くのがんの発生を高める可能性が示唆されています。
同じコホート(EPIC-Italy study)の研究でグリセミック負荷が結腸直腸がんの発症リスクと関連することが報告されています。
Dietary glycemic index and glycemic load and risk of colorectal cancer: results from the EPIC-Italy study.(食事のグリセミック指数とグリセミック負荷と結腸直腸がんの発症リスク:EPIC-イタリア研究)Int J Cancer. 2015 Jun 15;136(12):2923-31.
この疫学研究では、47,749人の成人を平均11.7年間追跡し、421人の結腸直腸がんが発症しています。
グリセミック指数の低い下位4分の1のグループに比べて、グリセミック指数の高い上位4分の1のグループの結腸直腸がんの発症リスクは1.35倍でした。グリセミック指数の高い糖質摂取量が多いほど結腸直腸がんが多いという結果です。
グリセミック負荷が多い食事(高糖質食)は、大腸がん治療後の再発率を増やし生存期間を短くすることが報告されています。
Dietary Glycemic Load and Cancer Recurrence and Survival in Patients with Stage III Colon Cancer: Findings From CALGB 89803.(ステージIIIの大腸がん患者における食事のグリセミック負荷とがんの再発と生存:CALGB 89803からの結果)J Natl Cancer Inst. 104(22):1702-11, 2012年
この研究は、ボストンのダナ・ファーバーがん研究所やニューヨークのメモリアル・スローン・ケタリングがんセンターなど8施設が参加した多施設協同研究です。
ステージIIIの大腸がん患者1011名を対象に、術後補助化学療法の臨床試験に参加中および臨床試験の終了6ヶ月後に食事の調査を行い、がんの再発率と死亡率に対するグリセミック負荷、グリセミック指数、フルクトース、炭水化物摂取量の影響を統計学的に検討しています。
グリセミック負荷が多い方から少ない方に5段階に分けて、再発率や無病生存期間や生存率などを比較しています。
その結果、グリセミック負荷と全炭水化物摂取量が、再発率および死亡率と正に相関することが示されています。
グリセミック負荷が多い上位20%のグループは、下位20%のグループに比べて、無病生存期間の調整ハザード比は1.79(95%信頼区間:1.29〜2.48)でした。
つまり、グリセミック負荷と全炭水化物摂取量が多いほど、再発率と死亡率が高くなるという結果です。
以下のような報告もあります。
Higher glycemic index and glycemic load diet is associated with increased risk of esophageal squamous cell carcinoma: a case-control study.(高グリセミック指数食と高グリセミック負荷食は食道の扁平上皮がんの発症リスク上昇と関連する:症例-対照研究)Nutr Res. 2013 Sep;33(9):719-25.
イランからの研究で、47例の食道扁平上皮がん患者と、95例の対照を比較しています。その結果、食事のグリセミック指数とグリセミック負荷が食道扁平上皮がんの発症と関連することが示されています。
グリセミック指数が高い上位3分の1のグループでは、下位3分の1のグループに比較して食道がんの発症リスクが2.95倍(95%信頼区間:1.68-3.35)でした。
グリセミック負荷が高い上位3分の1のグループでは、下位3分の1のグループに比較して食道がんの発症リスクが3.49倍(95%信頼区間:2.98-4.41)でした。
グリセミック指数やグリセミック負荷が高い食事が食道の扁平上皮がんの発症リスクを高めるという結論になっています。そのメカニズムとして糖質の多い食事がインスリンやインスリン様成長因子-1の血中濃度を高め、食道がんの発症を促進することを言及しています。
肺がんでも同様な結果が報告されています。以下のような報告があります。
Glycemic Index, Glycemic Load, and Lung Cancer Risk in Non-Hispanic Whites.(非ヒスパニック系白人におけるグリセミック指数とグリセミック負荷と肺がんリスク)Cancer Epidemiol Biomarkers Prev. 2016 Mar;25(3):532-9.
テキサス大学のMDアンダーソンがんセンターで診断された肺がん患者1905人と対照の健常人2413人を比較しています。グリセミック指数の低い下位5分の1のグループに比較して、グリセミック指数の高い上位5分の1のグループは、肺がんの発症率が1.49倍(95%信頼区間:1.21-1.83)でした。非喫煙者のみを対照にするとこの比率は2.25倍(95%信頼区間:1.42-3.57)でした。
この他にも、多くの疫学研究で、グリセミック指数やグリセミック負荷の高い食事が多くのがんの発症リスクを高めることが報告されています。そのメカニズムとして、高血糖と高インスリン血症ががん細胞の発生と増殖を促進することが挙げられています。
【食後血糖値の上昇は酸化ストレスを高める】
糖尿病における高血糖状態の持続が体内の酸化ストレスを高めることは多くの報告で明らかになっています。糖尿病で酸化ストレスが高まる原因には様々なメカニズムが関与しています。
高血糖状態は細胞のミトコンドリアでの活性酸素の産生を増やします。高血糖はジアシルグリセロールの産生を高めてプロテインキナーゼCを活性化し、活性化されたプロテインキナーゼCはNAD(P)Hオキシダーゼを活性化して活性酸素の産生を増やします。
糖化最終生成物(AGEs)が結合したタンパク質がAGE受容体を刺激すると、炎症性サイトカインや活性酸素の産生が増えることが明らかになっています。さらに、高血糖状態で細胞内で亢進するポリオール経路(グルコースがソルビトールからフルクトースになる経路)でNADPHが消費されると抗酸化物質の還元型グルタチオンの量が減ります。
このような高血糖状態における酸化ストレスの亢進は糖尿病だけでなく、非糖尿病の健常人でも、食後の高血糖によって引き起こされることが明らかになっています。
健常人を対象にした研究で、グリセミック指数やグリセミック負荷の高い食事をすると、体内の活性酸素の産生が増え、抗酸化力が低下し、体内の酸化ストレスが高まることが報告されています。(詳細は373話で解説しています)
高GI値の食事や糖質摂取量が多いGL値の高い食事が酸化ストレスや炎症のマーカーを高めることが報告されています。
糖尿病患者ではグリセミック指数やグリセミック負荷が酸化ストレスの亢進に関与していることは良く知られていますが、耐糖能に異常がない健常人でも、食後に血糖が急激に上がる状況(グリセミック指数の高い食品の摂取)や、糖質摂取量が高い状況(グリセミック負荷の高い食事)が体内の活性酸素の産生を増やし、抗酸化力を減弱させることが明らかになっています。
簡単にいうと、「糖質摂取は酸化ストレスを高める」ということになります。酸化ストレスの高い状態は発がんを促進します。
以上の多くの研究から得られたエビデンスにより、糖質摂取は肥満と2型糖尿病を増やして間接的にがんの発症を増やす経路や、糖質摂取自体がインスリン分泌や酸化ストレスを高めることによって直接的にがん細胞の発生や増殖を促進することが、論理的に証明できます。

図:肥満と2型糖尿病はがんの発生と進行を促進する。高糖質食は肥満と2型糖尿病を増やす。さらに、糖質自体ががんの発生と進行を促進する。
【ケトン食はアディポネクチンの産生を増やす】
アディポネクチンは脂肪細胞から分泌される善玉ホルモンのような蛋白質で、肝臓や筋肉細胞のアディポネクチン受容体に作用してAMP活性化プロテインキナーゼ(AMPK)を活性化し、インスリン抵抗性を改善し、動脈硬化や糖尿病を防ぐ作用があります。
ケトン食がアディポネクチンの産生を増やす効果があることが報告されています。
肥満した小児および青年を対象にして、低カロリー食とケトン食の代謝に対する影響を比較した研究が報告されています。(J Pediatr Endocrinol Metab. 25(7-8):697-704.2012年)
この研究では、58人の肥満者をケトン食と低カロリー食のどちらかに振り分けて6ヶ月間の食事療法を行いました。
食事療法の開始前と終了時(6ヶ月後)の比較において、低カロリー食とケトン食の両方のグループにおいて体重、体脂肪量、腹囲、空腹時インスリン値、インスリン抵抗性指数の著明な減少あるいは低下が認められました。しかし、効果はケトン食の方が高かったということです。両グループともインスリン感受性は統計的有意に上昇しましたが、活性の高い高分子量アディポネクチンの増加を認めたのはケトン食のグループだけでした。
この論文の結論は、「ケトン食療法は、体重の減量や代謝数値の改善において低カロリー食よりも効果が高く、肥満小児の体重減量の治療法として、安全で実施可能な食事療法であることが明らかになった」と記載されています。
この研究で最も注目すべき点は、高分子量アディポネクチンの値が、低カロリー食では有意な上昇を認めず、ケトン食でのみ増加が認められた点です。
アディポネクチンは血中に1分子ずつバラバラにではなく、複数個がくっついた形で存在しています。低分子量(3量体)、中分子量(6量体)、高分子量(12~18量体)です。中でも高分子量アディポネクチンが生理活性が強いことが知られていますので、活性の高い高分子量のアディポネクチンの値がケトン食で増加したことは、ケトン食が寿命の延長やがんの予防に効果があることを示唆しています。
また、ラットを使った実験で、ケトン食が、脂肪組織におけるアディポネクチンmRNAの量を増やすことが報告されています。(J Clin Neurosci. 17(7):899-904.2010年 )
アディポネクチンには、がん細胞の増殖や転移の抑制など様々な抗がん作用があることが報告されています。人の胃がん細胞を移植したマウスにアディポネクチンを注射すると、がんが著しく縮小したという報告があります。
ケトン食は、がん細胞へのブドウ糖(グルコース)の供給を減らし、さらにインスリンやインスリン様成長因子の産生を減らすことによって増殖シグナルを低下させるメカニズムなどによって抗がん作用を発揮します。
ケトン体のβヒドロキシ酪酸は抗炎症作用(NLRP3インフラマソーム阻害作用など)や抗酸化力の増強作用などによってがん予防や抗老化や寿命延長作用が報告されています。(467話、480話参照)
さらに、ケトン食が寿命延長作用と抗がん作用のある高分子量アディポネクチンの産生を増やすという臨床試験の結果は、ケトン食の抗がん作用と寿命延長効果をさらに支持することになります。

図:超低糖質ケトン食(低糖質食+高脂肪食)はがん予防効果や抗老化作用や寿命延長作用が確認されている。そのメカニズムとして、①糖質摂取量が少ないと、酸化ストレスが軽減し、インスリン/インスリン様成長因子-1(IGF-1)シグナル伝達系が抑制される。②低糖質・高脂肪食はケトン体の産生を増やす。③ケトン体のβヒドロキシ酪酸は、NLRP3インフラマソームの活性阻害などによる抗炎症作用、酸化ストレスに対する抵抗性の亢進、アディポネクチン産生の亢進などの作用を有する。これらのメカニズムによる総合作用の結果、がん予防や老化抑制や寿命を延ばす作用がある。
【ケトン食はがん細胞の発生や増殖や転移を抑制する】
人間では、ケトン食のがん予防効果やがん治療における有効性はまだ証明されていません。大規模な臨床試験の結果がまだ得られていないからです。しかし、症例報告や小規模な臨床試験のレベルでは、ケトン食の抗がん作用が報告されています。
動物実験ではケトン食の抗腫瘍効果を示唆する結果が数多く報告されていますが、動物実験の個体数が少なかったり、結果が一致しなかったりという理由で、まだ確定的な結論は出せない状況です。
そこで、複数の実験をまとめて解析するメタ解析で、動物実験におけるケトン食の有効性を検証することが行われています。以下のような論文があります。
Roles of Caloric Restriction, Ketogenic Diet and Intermittent Fasting during Initiation, Progression and Metastasis of Cancer in Animal Models: A Systematic Review and Meta-Analysis(動物実験モデルにおけるがん細胞の発生と進展と転移の過程におけるカロリー制限とケトン食と間歇的断食の効果:系統的レヴューとメタ解析)PLoS One. 2014; 9(12): e115147.
動物を使った発がん実験で、カロリー制限やケトン食や間歇的断食(intermittent fasting)などの食事療法のがん予防効果が研究されています。しかし、結果が一致しない報告もあるので、それらの有効性については、まだ結論が出せない状況です。
そこで、今まで報告された実験結果をメタ解析で統計的に解析してみたという研究報告です。
最近20年間に報告された「食事と発がん」に関する59件の論文の実験結果を統計的に解析しています。その結果、カロリー制限とケトン食では発がん予防効果が認められ、間歇的断食では発がん予防効果は認められなかったという結論になっています。
カロリー制限は代謝と酸化ストレスを低下させる機序で発がん予防効果を発揮します。
間歇的な断食はがん細胞への短期間のグルコース供給の制限によりがん細胞の増殖を遅らせると考えられています。
ケトン食は、超低糖質+高脂肪食で、がん細胞に対するグルコース供給の制限と、ケトン体による抗腫瘍効果によってがん予防効果を発揮すると考えられています。
この論文でのメタ解析の結果では、カロリー制限とケトン食ではがん予防効果が認められ、間歇的断食ではがん予防効果は認められなかったという結論になっています。
以下のような論文もあります。
Anti-Tumor Effects of Ketogenic Diets in Mice: A Meta-Analysis(マウスにおけるケトン食の抗腫瘍効果:メタ解析)PLoS One. 2016; 11(5): e0155050.
ケトン食単独の抗腫瘍効果を検討したマウスの実験の結果をメタ解析しています。マウスの実験では、ケトン食は腫瘍の増大速度を遅くする効果が認められています。
【全粒穀物(玄米・雑穀米など)のがん予防効果】
進行がんを消滅させることを目的とするケトン食では糖質をできるだけ減らすことを目標にするため、玄米や雑穀などグリセミック指数の低い穀類でも制限するのが基本です。糖質摂取量を1日10〜20グラムを目標にします。
しかし、腫瘍が目に見えない状況で再発予防を目的とする場合は、糖質制限を緩めることはできます。すなわち、マイルドなケトン食です。
糖質10〜20gの厳密なケトン食を長期にわたって継続するのは大変なので、がんの発生予防や再発予防の場合は適しないとも言えます。
中鎖脂肪酸中性脂肪(MCTオイル)を多く摂取する場合は、糖質からのカロリー摂取を15%くらいまで増やすことも可能になります。1日2000カロリーとして300カロリーで、糖質を約80グラムくらいがマイルドケトン食の場合の目安になります。
この際、精白した穀類でなく、無精白の全粒穀物(whole grain)を食べることが基本になります。
玄米とは、稲の果実である籾(もみ)から籾殻(もみがら)を除去した状態で、まだ精白されていない段階の米です。精白とは、玄米から糠(ぬか)と胚芽を取り除き白米にすることです。白米は糠と胚芽を取り除いた胚乳という部分で、ほとんどがデンプン(澱粉)です。糠や胚芽の部分にはビタミン・ミネラル・食物繊維を多く含むので、玄米の方が白米よりも栄養成分が豊富で健康作用も高いことになります。
玄米を精白する主な目的は、米の消化吸収を助け、味を良くするためです。玄米は圧力釜で炊く必要があり、白米に比べると消化が悪いという欠点もあり、胃腸が極端に弱って食欲がない場合には向かない場合もあります。
全粒穀物(whole grains)とは、精白などの処理で糠となる果皮・種皮・胚・胚乳表層部といった部位を除去していない穀物や、それを使った製品です。玄米や、玄米を発芽させた発芽玄米、ふすま取っていない麦、全粒粉の小麦を使った食品、オートミール、アワ、ヒエなどがあります。
全粒穀物は精白したものよりも、食物繊維やビタミンヤミネラルが多く栄養価に富みます。さらにホルモン様作用や抗酸化作用など重要な生物活性を持つ様々な成分(フィトケミカル)を多く含みます。例えば、全粒穀物は、フェノール酸、フラボノイド、トコフェノールのような抗酸化作用を持つ成分、リグナンのように弱いホルモン作用を持つ成分、フィトステロールや不飽和脂肪酸のように脂肪代謝に影響する成分などを含んでいます。
食物繊維が多いため消化吸収が遅いので、長時間に渡って空腹感を避けられ、標準体重の維持にも役立ちます。標準体重の維持はがん予防の基本になります。血糖値を急激に上げないためインスリンの分泌が抑えられ、がんの再発や進行の予防にも役立ちます。高インスリン血症はがん細胞の増殖を促進します。
多くの研究で、全粒穀物ががんの発生や再発予防に有効であることが示されています。たとえば、未精製の穀物は大腸がんのリスクを下げることが明らかになっています。糖尿病や心臓病などの生活習慣病のリスクを低下させることも、大規模な疫学研究で明らかになっています。
米国では、51%以上の全粒穀物を含む食品にがんや心臓病のリスクを減らす可能性があると表示できることがFDA(米国食品医薬品局)から許可されています。全世界的に、穀物の半分以上を精製されていないものにすることが指導されています。
玄米やその他の雑穀などの全粒穀物を主食にすることは、健康増進を含め、がんの発生や再発の予防に有効であることは間違いないようです。このような全粒穀物に、さらに豆類を加えた雑穀は、栄養補助と健康増進に効果が高まります。豆類に含まれるイソフラボンなどのフラボノイドは抗がん作用があるからです。
【がん予防における糖質制限やマイルドケトン食の勧め】
がんの予防や治療において、血糖やインスリン分泌を高める糖質の摂り過ぎにもっと注意を払うべきだと思います。
がん予防においては、ご飯を主食にするという常識から離れた方が良い時期にきているように思います。欧米では糖質が主食という概念はありません。メインディッシュは肉や魚料理で、パンやイモや豆は付け合わせのような位置づけです。
また、がんの食事療法で多くの人が実践しているニンジンジュースの大量飲用も、ニンジンには100g当たり糖質が5g程度含まれ、しかもグリセミック指数は白米と同じレベルなので、カロテノイドが多くてもグリセミック負荷を高める点が気になります。糖質が少ない葉っぱものの野菜を多く摂取する方が良いように思います。カロテノイドががんを予防するというエビデンスはありません。
糖質を減らした分のカロリーを油脂で補う場合、抗がん作用や健康増進作用のあるω3系不飽和脂肪酸の豊富な亜麻仁油やエゴマ油や魚油(DHA, EPA)、オリーブオイル、ココナッツオイル、MCTオイルを主体にすると、脂肪を増やしても健康に問題ありません。動物性の飽和脂肪酸は循環器疾患を増やすというデータは多くありますが、ω3系多価不飽和脂肪酸やオリーブオイルは多く摂取するほど健康作用があります。
人間での大規模な臨床試験や疫学研究によるエビデンスはありませんが、多くの基礎研究と小規模な臨床研究から、糖質制限やケトン食ががん予防の食事療法として有効である可能性はかなり高いと言えます。
私は20年間以上前からがんの一次予防を専門に研究し、この15年間はクリニックを開業して、がんの一次予防と三次予防(再発予防)に関する患者指導を行っています。
糖質制限やケトン食によるがん予防効果の可能性を知り、私自身の診療で実践しだしたのは5年くらい前からで、それ以前は糖質制限やケトン食ががん予防に有効であるという意見は私を含めて皆無だったと思います。
しかし、がんの予防や治療にケトン食を使ってみて、「糖質制限やケトン食はがん予防法として有効」であるという確信を持つようになりました。
河出書房新社から本日出版された「福田式 がんを遠ざけるケトン食レシピ」の監修を行っています。
20年前に国立がんセンター研究所でがん予防を研究していて、何の成果も結論を出せずにいましたが、糖質制限やケトン食ががん予防の結論のように思っています。
がん治療の目的では、糖質摂取を10〜20g程度に制限する厳密なケトン食を推奨していますが、がんの発生や再発の予防の目的であれば、糖質摂取を80グラム程度まで許容し、中鎖脂肪酸(MCTオイル)やオメガ3系不飽和脂肪酸やオリーブオイルを増やしたマイルドなケトン食で十分に目標を達成できると思っています。
がん予防の基本は「糖質の取り過ぎに注意する」ことが最も重要だと思います。

詳細はこちらへ:
| « 519)がん細胞... | 521)甘い果物... » |



