がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
519)がん細胞の物質合成(同化)を促進するピルビン酸キナーゼM2
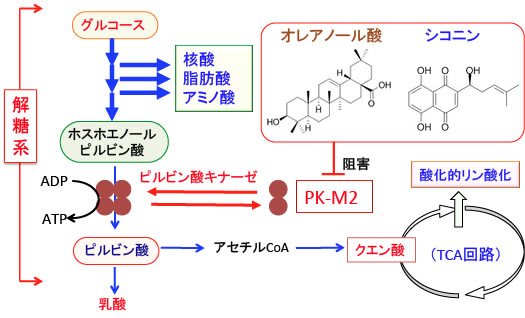
図:ホスホエノールピルビン酸からピルビン酸への変換を行うピルビン酸キナーゼは解糖系の律速酵素で、正常では4量体として存在する。がん細胞では腫瘍特異的な2量体のM2というアイソフォーム(PK-M2)が多く発現している。2量体のピルビン酸キナーゼ-M2はホスホエノールピルビン酸からピルビン酸の変換ができない。解糖系の途中におけるグルコースの代謝産物は、核酸や脂肪酸やアミノ酸の材料になる。細胞分裂によって増殖するがん細胞は、エネルギー産生と同時に細胞を構成する核酸や脂肪酸やアミノ酸の合成を増やす必要がある。腫瘍特異的に発現するピルビン酸キナーゼ-M2はがん細胞におけるエネルギー産生と物質合成のバランスを調節している。多くの植物や生薬に含まれるオレアノール酸や紫根に含まれるシコニンがピルビン酸キナーゼ-M2を特異的に阻害し、がん細胞の増殖を抑制する効果が報告されている。
519)がん細胞の物質合成(同化)を促進するピルビン酸キナーゼM2
【がん細胞では同化が亢進している】
がん細胞では正常細胞に比べてエネルギー(ATP)産生や物質合成が亢進しています。
がん細胞では、増殖シグナル伝達系が持続的に活性化し、細胞増殖の抑制や停止の制御系が故障し、アポトーシスに対する抵抗性を獲得し、無制限の細胞分裂を行っています。
その結果、グルコース(ブドウ糖)やアミノ酸(グルタミンなど)の取込みが亢進し、解糖系やペントース・リン酸経路での代謝が亢進し、核酸やアミノ酸や脂肪酸の合成が亢進しています。
がん細胞が増大するためには細胞の数を増やす必要があります。細胞分裂して数を増やすためには、細胞構成成分を合成する必要があります。つまり、がん細胞はエネルギー(ATP)産生と同時に、核酸やアミノ酸や脂肪酸などの物質合成を高める必要があります。
がん細胞においてエネルギー産生と物質合成(同化)のバランスを制御しているのがピルビン酸キナーゼM2という酵素で、がん細胞の代謝異常の正常化を目指す治療において重要なターゲットになっています。

図:がん細胞が増殖するためには、グルコースやグルタミンの取込みを亢進し、エネルギー(ATP)産生と物質合成(タンパク質、核酸、脂質など)の両方を増やす必要がある。
【がん細胞ではグルコースの取込みと解糖系が亢進している】
解糖系というのは、1分子のグルコース(ブドウ糖)が2分子のピルビン酸になるまでの過程です。この酵素反応は細胞質で行われます。炭素数6個のグルコース(C6H12O6)1分子が、数段階の酵素反応を経て炭素数3個のピルビン酸(C3H4O3)2分子に分解される過程で2分子のATPが生成されます。
この反応過程では、グルコース → グルコース-6-リン酸 → フルクトース-6-リン酸 → フルクトース-1,6-ビスリン酸 → 1,3-ビスホスホグリセリン酸(2分子) → 3-ホスホグリセリン酸(2分子) → 2-ホスホグリセリン酸(2分子) → ホスホエノールピルビン酸(2分子) → ピルビン酸(2分子)と変換されます。
ピルビン酸は酸素が十分にある状態では、ミトコンドリアに入ってアセチルCoAに変換されてTCA回路で代謝されます。
酸素が無い状態では乳酸脱水素酵素の働きで乳酸になります。これを「嫌気性解糖(Anaerobic glycolysis)」と言います。
がん細胞では酸素が十分に存在する条件でも、ミトコンドリアでの酸素を使った代謝が抑制され、乳酸の産生が増えています。これを「好気生解糖(Aerobic glycolysis)」と言います。

図:グルコースがピルビン酸になる過程を「解糖」と言う。ピルビン酸は酸素の供給がある状態ではミトコンドリア内に取り込まれてアセチルCoAに変換され、TCA回路と電子伝達系によってさらにATPの産生が行われる。TCA回路はミトコンドリアのマトリックス(内膜に囲まれた内側)で行われる。TCA回路ではアセチルCoAが段階的に代謝される過程でエネルギーの元になる電子が発生し、NADH(還元型ニコチンアミドアデニンジヌクレオチド)やFADH2(還元型フラビンアデニンジヌクレオチド)が生成される。NADHやFADH2の持っている高エネルギー電子をATPに変換する一連の過程を酸化的リン酸化と呼び、ミトコンドリア内膜の蛋白質や補酵素間で電子のやり取りを行うシステムを電子伝達系と呼ぶ。電子伝達系は呼吸鎖とも呼ばれ、酸素の存在下に電子伝達体(NADHとFADH2)の再酸化によって大量のATPが合成される。
がん細胞では酸素が十分にある状態でもミトコンドリアでの酸化的リン酸化は抑制され、解糖系が亢進して乳酸産生が増えています。
正常細胞では、酸素が少ない状況になると低酸素誘導性因子-1(Hypoxia Inducible Factor-1: HIF-1)が活性化されます。
HIF-1はピルビン酸から乳酸に変換する乳酸脱水素酵素(LDH)の発現を亢進します。ヘキソキナーゼなどのいくつかの解糖系酵素も発現と活性を亢進します。
一方、HIF-1はピルビン酸脱水素酵素キナーゼの発現を亢進します。ピルビン酸脱水素酵素キナーゼは、ピルビン酸をアセチルCoAに変換するピルビン酸脱水素酵素をリン酸化してその活性を阻害します。その結果、低酸素でHIF-1が活性化されると、乳酸産生が増加し、ミトコンドリアでの酸素呼吸は抑制されます。
がん細胞では、c-Mycなどのがん遺伝子の活性化などによって、低酸素の状況でなくてもHIF-1が活性化されているので、低酸素がない状況でも乳酸脱水素酵素の活性が亢進し、ピルビン酸脱水素酵素の活性が低下しているので、乳酸産生が増え、ミトコンドリアでの酸素呼吸が低下しています。これはワールブルグ効果として知られています。
がん細胞ではピルビン酸から乳酸に変換する乳酸脱水素酵素の活性が高く、TCA回路に向かう最初の段階のピルビン酸脱水素酵素の活性が低下していることが知られています。
これはがん細胞ではHIF-1が恒常的に亢進しているからです。
HIF-1の活性を阻害する方法はがん細胞の代謝異常を是正する方法として重要です。

図:がん細胞では低酸素誘導因子-1(HIF-1)の活性亢進によって解糖系酵素(ヘキソキナーゼなど)や乳酸脱水素酵素の発現が亢進している。さらにHIF-1はピルビン酸脱水素酵素キナーゼの発現を誘導する。このキナーゼはピルビン酸脱水素酵素を阻害する。したがって、HIF-1の活性亢進によってミトコンドリアでのピルビン酸の代謝と酸素呼吸が抑制される。つまり、がん細胞における解糖系亢進とミトコンドリアでの酸素呼吸の抑制はHIF-1の活性亢進によってもたらされている。
【がん細胞は酵素活性の低いピルビン酸キナーゼを発現して物質合成を亢進する】
解糖系だけだとグルコース1分子当たり2分子のATPしか産生できません。
しかし、グルコースをミトコンドリアで二酸化炭素と水に完全に分解すると、グルコース1分子当たり32〜38分子のATPを産生できます。
がん細胞はミトコンドリアでのエネルギー産生が抑制されているので、正常細胞の数倍から十倍以上のグルコースの取込みが増えています。
しかし、解糖系が亢進して乳酸が増えるだけでは、がん細胞にとって大したメリットはありません。
乳酸の産生が増えると、組織が酸性化して、がん細胞の浸潤や転移が亢進し、免疫細胞の活性が低下するので、がん細胞の生存と増殖には有利になります。
しかし、取込んだグルコースを他の中間代謝産物(アミノ酸や脂肪酸や核酸など)の合成に利用する方法も必要になります。
それが、ピルビン酸キナーゼ-M2の発現亢進です。
ピルビン酸脱水素酵素と乳酸脱水素酵素は、ピルビン酸から先の話(アセチルCoAからTCA回路に行くか、乳酸産生に行くか)になりますが、解糖系の最終段階のホスホエノールピルビン酸をピルピン酸に変換する際に働くピルビン酸キナーゼもがん細胞のグルコース代謝の制御に重要な働きを行っています。
ピルビン酸キナーゼは1分子のブドウ糖から2分子のピルビン酸に変換される解糖系の最終段階で働く酵素です。
ピルビン酸キナーゼ(PK)は、哺乳動物では L型、R型、M1型、M2型と呼ばれる4種類のアイソフォームがあります。
アイソフォームというのは、基本的な機能に関連するアミノ酸残基は共通しているが、他の部分の アミノ酸配列は異なるタンパク質です。
ピルビン酸キナーゼのアイソフォームは酵素学的な性質と発現の制御機構が異なっています。
成体では L型は肝臓、腎臓、小腸、膵β細胞で、R型は赤血球で、M1型は骨格筋、心筋、脳で特異的に発現していますが、M2型は多くの組織に存在します。
骨格筋と心筋と脳は、細胞分裂はせずにATP産生を高めるために異化(catabolism)が亢進している組織です。M1はミトコンドリアでのグルコース代謝を促進し、M2はミトコンドリアでのグルコース代謝を抑制する働きがあると言えます。
胎児期の初期においてはどの組織も細胞分裂が盛んなので M2型のみが発現していますが、組織の分化・発達が進むにつれて上記の組織特異的アイソフォームに置き換わっていきます。
細胞ががん化すると、逆に組織特異的アイソフォームは減少あるいは消失して、細胞分裂に有利なM2型が出現あるいは増加します。
ピルビン酸キナーゼ-M2は一つのタンパク質が4つ重合した4量体と、4量体が2つに分かれた2量体があり、2量体になるとホスホエノールピルビン酸をピルビン酸に変換する酵素活性がありません。
がん細胞では2量体のピルビン酸キナーゼ-M2が多く発現しており、腫瘍マーカーとしても利用されています。
解糖系の最終段階でピルビン酸に代謝されないと、その上流の代謝産物が蓄積しますが、これらの代謝産物は核酸や脂肪酸やアミノ酸の合成の材料になります。
つまり、がん細胞の細胞分裂で増殖するとき、大量のグルコースを取り込み、エネルギー産生と同時に、細胞の構成成分である核酸や脂肪酸やアミノ酸を増やす必要があります。
ピルビン酸キナーゼ-M2は、4量体と2量体の比率を変えることによって、エネルギー産生と物質合成のバランス調節を行うことによって、がん細胞の増殖に重要な役割を担っていると言えます。
つまり、がん細胞におけるエネルギー産生と物質合成のバランスの調整において、腫瘍性のピルビン酸キナーゼ-M2は中心的な役割を担っているのです。
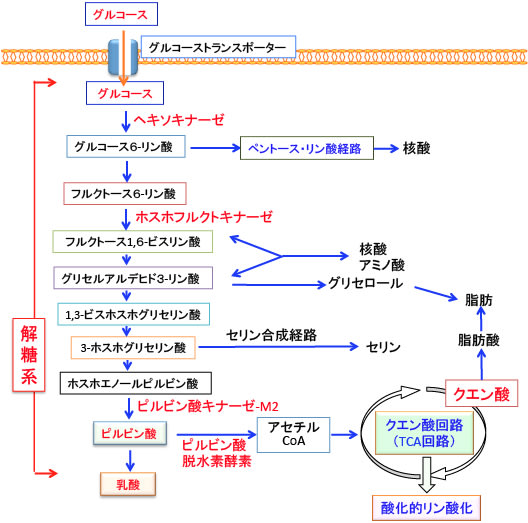
図:ピルビン酸キナーゼ-M2は、酵素活性の低いピルビン酸キナーゼのアイソフォームである。ピルビン酸キナーゼは解糖系の最終段階のホスホエノールピルビン酸をピルビン酸に変換する酵素で、がん細胞ではピルビン酸キナーゼ-M2の発現が亢進しているので、ホスホエノールピルビン酸をピルビン酸に変換する段階で代謝が停滞する。その結果、解糖系の上流の代謝中間産物が蓄積し、それらが核酸やアミノ酸や脂肪などの細胞構成成分の合成に回されるので、同化が亢進して、細胞増殖が促進される。
発見者であるOtto Warburg博士に因んで命名されたワールブルグ効果(Warburg effect)は、がん細胞の特徴的な代謝状態を示すものです。これは、がん細胞が正常細胞よりも高速で大量にグルコースを取り込むにもかかわらず、ミトコンドリアにおける酸化的リン酸化に用いるグルコース量が少ないという現象のことを指します。
このワールブルグ効果におけるピルビン酸キナーゼのM2アイソフォーム(PKM2)の関与が近年明らかになっています。
例えば、RNA干渉法によって内在性ピルビン酸キナーゼをノックダウンしたがん細胞にピルビン酸キナーゼ1(PKM1)ないしPKM2を発現させて比較すると、正常な酸素濃度の状態では両者の増殖速度に差はありませんが、低酸素条件にするとPKM2を発現している細胞の方が増殖が早いことが認められています。
さらに、ヌードマウスにがん細胞を移植する実験でも、PKM1を発現しているがん細胞に比べて、PKM2を発現しているがん細胞から生じる腫瘍の方が増殖が早いことが確かめられています。このように、腫瘍の形成においては、PKM2アイソフォームの発現が必要であることが示されています。
また、低酸素になると発現が誘導される低酸素誘導因子-1(HIF-1)やがん遺伝子のc-MycがPKM2の発現を誘導することが報告されています。
HIF-1はピルビン酸脱水素酵素キナーゼ遺伝子の転写を促進することにより、TCA回路を介した代謝を能動的に抑制しています。ピルビン酸脱水素酵素キナーゼは、ピルビン酸脱水素酵素を阻害することによってピルビン酸をアセチルCoAへの変換を阻害し、TCA回路を回らなくします。HIF-1はmTOR(哺乳類ラパマイシン標的蛋白質)によって発現が誘導されます。
がん細胞のエネルギー代謝の特徴であるワールブルグ効果を是正するような治療薬はがん細胞の増殖を抑制し、細胞死を誘導できる可能性があります。ピルビン酸キナーゼM2も重要なターゲットとして注目されています。
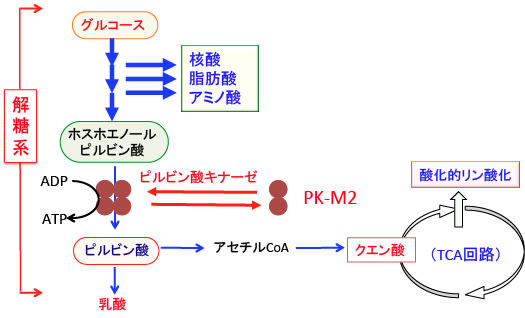
図:ピルビン酸キナーゼは解糖系の律速酵素で、正常では4量体として存在する。がん細胞では腫瘍特異的な2量体のM2というアイソフォーム(PK-M2)が多く発現している。2量体のPK-M2(ピルビン酸キナーゼ-M2)はホスホエノールピルビン酸からピルビン酸の変換ができない。解糖系の途中におけるグルコースの代謝産物は、核酸や脂肪酸やアミノ酸の材料になる。細胞分裂によって増殖するがん細胞は、エネルギー産生と同時に細胞を構成する核酸や脂肪酸やアミノ酸の合成を増やす必要がある。腫瘍特異的に発現するピルビン酸キナーゼ-M2はがん細胞におけるエネルギー産生と物質合成のバランスを調節している。
【オレアノール酸がピルビン酸キナーゼ-M2を阻害する】
PI3K/Akt/mTOR経路、低酸素誘導因子-1(HIF-1)、ピルビン酸脱水素酵素、乳酸脱水素酵素、ピルビン酸キナーゼ-M2などをターゲットにした治療を組み合わせることはがん治療として有望です。この目的において、漢方薬に使われる生薬の成分でも有効なものが数多く報告されています。
がんの漢方治療の方法として、ワールブルグ効果を阻害する生薬の利用が注目されています。ワールブルグ効果に作用する生薬やその成分が多く見つかっており、そのような成分を組み合わせることによってがん細胞を死滅させる効果を高めることができます。
多くの生薬に含まれ様々な抗がん作用が知られているオレアノール酸が、ピルビン酸キナーゼのM2アイソフォームを変化させることによってがん細胞の好気性解糖を抑制する作用が報告されています。以下のような報告があります。
Oleanolic acid suppresses aerobic glycolysis in cancer cells by switching pyruvate kinase type M isoforms.(オレアノール酸はピルビン酸キナーゼのタイプMアイソフォームを変化させることによってがん細胞の好気性解糖を抑制する)PLoS One. 2014 Mar 13;9(3):e91606.
【要旨】
がん細胞の特徴の一つであるワールブルグ効果は、ミトコンドリアでの酸化的リン酸化から好気性解糖へのエネルギー代謝の変換によって特徴づけられる。
最近の研究によって、ピルビン酸キナーゼM2(PKM2)の発現亢進が、がん細胞における好気性解糖を引き起こす主要な原因となっていることが明らかになっている。
しかしながら、PKM2をターゲットにして好気性解糖を阻害する薬品は知られていない。
本研究では、オレアノール酸がピルビン酸キナーゼをM2からM1タイプに変換させる作用によって、がん細胞におけるワールブルグ効果を是正することを明らかにした。
オレアノール酸による好気性解糖の抑制は、ピルビン酸キナーゼのアイソフォーム(訳者注:基本的な機能に関連するアミノ酸残基は共通しているが、他の部分の アミノ酸配列は異なるタンパク質)のM1とM2のタイプの変換によって引き起こされている。
さらに、オレアノール酸はmTORシグナル伝達系を阻害する作用があり、このmTORシグナル伝達系の阻害がピルビン酸キナーゼのM2タイプからM1への移行に必要であった。
c-Myc依存性のhnRNPA1の発現抑制が、オレアノール酸によるピルビン酸キナーゼのM2からM1へのアイソフォームの移行に関与していた。
以上の結果から、オレアノール酸はがん細胞における好気性解糖を阻害することによって抗腫瘍効果を示すことが明らかになった。がん細胞における好気性解糖の阻害を目的にした治療においてピルビン酸キナーゼM2は重要なターゲットになることが示された。
オレアノール酸(Oleanolic acid)は、多くの植物に含まれる五環系トリテルペノイドで、様々なメカニズムで抗がん作用を発揮することが報告されています。
中国伝統医学で多くのがんの治療に使用されている白花蛇舌草(ビャッカジャゼツソウ)の抗腫瘍成分としてもオレアノール酸やウルソール酸などの五環系トリテルペノイドが重視されています。
生薬としては夏枯草(シソ科ウツボグサの花穂)、大棗(クロウメモドキ科ナツメの果実)、女貞子(モクセイ科トウネズミモチの果実)、連翹(モクセイ科レンギョウの果実)、枇杷葉(バラ科ビワの葉)、柿蔕(柿のヘタ)などにも、五環系トリテルペノイドが多く含まれます(219話参照)。オリーブの葉にも多く含まれています(207話参照)。
白樺に寄生するチャーガ(カバノアナタケ)にはベツリン酸(betulic acid)という五環系トリテルペノイドが多く含まれています。
このような五環系トリテルペノイドを多く含む生薬を多く加えると、抗がん作用を高めることができます。(206話参照)
この論文ではオレアノール酸がmTORシグナル伝達系の阻害を介してピルビン酸キナーゼのM2タイプからM1への移行を促進して、がん細胞の増殖活性を抑制する効果を報告しています。
【紫根に含まれるシコニンのピルビン酸キナーゼM2阻害作用】
漢方薬に使われる生薬の「紫根(しこん)」は日本各地や中国・朝鮮半島に自生するムラサキ科の多年草「ムラサキ(Lithospermum erythrorhizon)」の根を乾燥してもので、ナフトキノン誘導体のシコニン、アセチルシコニンなどの紫色色素が含まれています。
シコニンやアセチルシコニンには抗菌・抗炎症作用や肉芽促進作用などの創傷治癒促進作用があり、紫根を主薬とした紫雲膏(しうんこう)は、火傷や凍傷、痔などの外用薬として有名です。
経験的に紫根には抗がん作用が認められており、がんの治療にも古くから使用されています。
紫根に牡蛎(ぼれい)や忍(にんどう)冬などを配合した紫根牡蛎湯(しこんぼれいとう)という処方は乳がんなどのがんの治療に使われています。
培養細胞を使った実験で、紫根の抗がん成分のシコニンが、様々な種類のがん細胞の増殖を抑え、アポトーシスや壊死性の細胞死を誘導する作用があることが報告されています。
その作用機序に関しては様々な報告があり、細胞増殖や細胞死のシグナル伝達における複数のターゲット(NF-κB、トポイソメラーゼ、プロテアソームなど)に作用することが報告されています。
紫根あるいはシコニンの抗がん作用には様々な作用機序が報告されていますが、がん細胞のエネルギー産生と増殖・生存において重要な役割を果たしている腫瘍特異的なピルビン酸キナーゼ-M2に対して阻害作用を示すことが報告されています。以下のような報告があります。
Shikonin and its analogs inhibit cancer cell glycolysis by targeting tumor pyruvate kinase-M2.(シコニンとその類縁成分は腫瘍特異的ピルビン酸キナーゼ-M2に作用してがん細胞の解糖系を阻害する)Oncogene 30 (42): 4297-4306, 2011
中国の浙江大学(Zhejiang University)医学部のがん研究所からの報告です。
【要旨】
紫根(シコン)の成分であるシコニン(shikonin)はがん細胞に壊死性の細胞死を誘導し、抗がん剤抵抗性を回避できることが報告されている。しかし、がん細胞内におけるシコニンのターゲット分子については明らかにされていない。
この論文では、シコニンとその類縁成分が、ピルビン酸キナーゼの腫瘍特異的なアイソフォームであるピルビン酸キナーゼ-M2(PKM2)の阻害剤であり、その中でも特に、シコニンとその光学異性体であるアルカンニン(alkannin)が最も強い阻害活性と特異性を示した。すなわち、シコニンとアルカンニンは、ピルビン酸キナーゼ-M2(PKM2)の活性を50%阻害する濃度では、正常細胞で発現する他のアイソフォームのピルビン酸キナーゼ-M1(PKM1)とピルビン酸キナーゼ-L(PKL)の活性は阻害しなかった。
シコニンとアルカンニンは解糖の速度を顕著に低下させ、ピルビン酸キナーゼ-M2を発現しているがん細胞における乳酸の産生とグルコースの消費を低下させた。
正常タイプのピルビン酸キナーゼ-M1(PKM1)を導入したHeLa細胞ではシコニンとアルカンニンによる細胞死の誘導は抑制された。(つまり、シコニンとアルカンニンは、PKM2を発現しているがん細胞において、PKM2を特異的に阻害することによって、がん細胞を死滅させるということ)
PKM2の活性を阻害する作用において、シコニンとアルカンニンは、今まで報告された中で、最も強力で特異性が高い物質であることが示された。
ピルビン酸キナーゼ-M2は多くのがん細胞に過剰発現しており、この酵素は解糖系の最後の段階で働き、解糖系の速度を調節する律速酵素として働いている、解糖系でのエネルギー産生はがん細胞の増殖と生存に不可欠であるため、シコニンとアルカンニンの2つの光学異性体は、がんの治療薬として使用できる可能性を持っている。
この論文では、生薬として漢方治療に使用される紫根(シコン)に含まれるシコニンとその光学異性体のアルカンニンが、がん細胞に特異的に発現して、がん細胞に特徴的なエネルギー産生に重要な働きをもつピルビン酸キナーゼ-M2という酵素を阻害する、ということを報告しています。
この論文が発表されているOncogeneという雑誌は分子生物学の領域ではレベルの非常に高い学術雑誌です。このようなレベルの高い雑誌に天然成分のシコニンに関する論文が掲載された理由は、ピルビン酸キナーゼ-M2ががんの治療のターゲットとして近年注目されているからだと思います。つまり、多くのがん細胞に特異的かつ普遍的に発現しているピルビン酸キナーゼのアイソフォーム(isoform)であるピルビン酸キナーゼ-M2(PKM2)を阻害するとがん細胞を死滅させることができることが明らかになっており、その阻害剤に関する研究はインパクトが高いからです。
シコニンとその類縁成分が、ピルビン酸キナーゼの腫瘍特異的なアイソフォームであるピルビン酸キナーゼ-M2(PKM2)の阻害剤であり、その中でも特に、シコニンとその光学異性体であるアルカンニン(alkannin)が最も強い阻害活性と特異性を示すことが報告されています。
すなわち、シコニンとアルカンニンは、ピルビン酸キナーゼ-M2(PKM2)の活性を50%阻害する濃度では、正常細胞で発現する他のアイソフォームのピルビン酸キナーゼ-M1(PKM1)とピルビン酸キナーゼ-L(PKL)の活性は阻害しませんでした。
シコニンとアルカンニンは解糖の速度を顕著に低下させ、ピルビン酸キナーゼ-M2を発現しているがん細胞における乳酸の産生とブドウ糖の消費を低下させました。
正常タイプのピルビン酸キナーゼ-M1(PKM1)を導入したHeLa細胞ではシコニンとアルカンニンは細胞死を誘導しませんでした。
つまり、シコニンとアルカンニンは、PKM2を発現しているがん細胞において、PKM2を特異的に阻害することによって、がん細胞を死滅させるということです。PKM2の活性を阻害する作用において、シコニンとアルカンニンは、今まで報告された中で、最も強力で特異性が高い物質であるということです。
以上のことから、シコニンとアルカンニンを含む紫根は、ピルビン酸キナーゼ-M2を過剰発現しているがん細胞のエネルギー産生と物質合成を阻害して死滅させる効果が期待できます。
【ワールブルグ効果を正常化するがん治療】
ピルビン酸キナーゼは解糖系の最終段階のホスホエノールピルビンとADPをピルビン酸とATPに変換する酵素です。
ピルビン酸キナーゼM2はホスホエノールピルビン酸からピルビン酸への変換を低下させることによって、取り込んだグルコースの炭素骨格を使って核酸やアミノ酸や脂肪酸などの物質合成を増やす同化(anabolism)を亢進し、細胞分裂を促進します。
したがって、ピルビン酸キナーゼM2をM1に移行させると、物質合成(同化)が抑制され、細胞分裂を低下させることができます。
M1タイプは細胞分裂に必要に物質合成(同化)を抑制し、ミトコンドリアでの酸素呼吸を増やします。M2タイプは細胞を増やすために物質合成(同化)を高める働きがあります。
ピルビン酸キナーゼM2は基本的に全てのヒトがん細胞において発現していると報告されています。ピルビン酸キナーゼM2は腫瘍マーカーとしても利用されています。
ピルビン酸キナーゼのタイプMの遺伝子(PKM遺伝子)はmRNAのスプライシングの違いによってPKM1とPKM2の2つの遺伝子産物ができます。
スプライシング(splicing)というのは、ある直鎖状ポリマーから一部分を取り除き、残りの部分を結合することです。
DNAから転写されたmRNA前駆体には、イントロンと呼ばれる直接タンパク質のアミノ酸配列を決定していない部分が存在します。pre-mRNA スプライシングは、このイントロンを除き、残りの部分を結合して完全なタンパク質配列を示すmRNAを作ることを言います。このmRNA前駆体のスプライシングの違いによって、一つの遺伝子からアミノ酸配列の異なるタンパク質ができます。
ヒトやラットやマウスのPKM遺伝子は12個のエキソン(exon)から構成され、9番目と10番目のエキソンの長さは同じですが、アミノ酸配列が少し異なります。
PKM1は9番目のエキソンを含み、PKM2は10番目のエキソンを含むタンパク質となります。
このmRNAのスプライシングに関与するタンパク質として、polypyrimidine tract binding protein (PTB), heterogeneous nuclear ribonucleoprotein A1 (hnRNPA1), heterogeneous nuclear ribonucleoprotein A2 (hnRNPA2) があります。
つまり、ピルビン酸キナーゼの遺伝子のmRNAのスプライシングの段階で、正常細胞とがん細胞に違いが生じて、その結果、グルコース代謝に重大な違いが発生しているのです。
がん細胞のワールブルグ効果を是正することによって、エネルギー産生と物質合成の状況を正常細胞に近づけることは、がん細胞の増殖を阻止し、細胞死を誘導することができます。
その具体的方法として、ケトン食、2−デオキシ-D-グルコース、ジクロロ酢酸、メトホルミンなどの組み合わせがあります。(517話参照)
さらに、がん細胞に特徴的なピルビン酸キナーゼM2を正常細胞型のM1に移行させる方法を併用すると、ミトコンドリアでの酸素呼吸をさらに亢進し、同化(anabolism)を抑制し、細胞増殖を抑制できます。

図:(上)がん細胞ではグルコースの取込みと解糖系が亢進し、ミトコンドリアでの酸素呼吸が低下している。ピルビン酸キナーゼは、がん細胞では腫瘍特異的な2量体のM2というアイソフォーム(PK-M2)が多く発現している。2量体のピルビン酸キナーゼ-M2はホスホエノールピルビン酸からピルビン酸の変換ができない。その結果、解糖系の途中におけるグルコース(ブドウ糖)の代謝産物は、核酸や脂肪酸やアミノ酸の材料になる。
(下)ケトン食や2-デオキシーD-グルコース(2-DG)はグルコースの取込みや解糖系での代謝を阻害する。オレアノール酸やシコニンはピルビン酸キナーゼM2を阻害する。ジクロロ酢酸はピルビン酸脱水素酵素を活性化してミトコンドリアでの酸素呼吸を亢進する。これらを組み合せると、がん細胞の解糖系を抑制し、ミトコンドリアでの酸素呼吸を亢進し、物質合成(同化)を抑制して、細胞増殖を抑制できる。
| « 518) がん細胞... | 520) がん予防... » |





