がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
516)酸化ストレスと小胞体ストレスを高めれば、がん細胞は自滅する
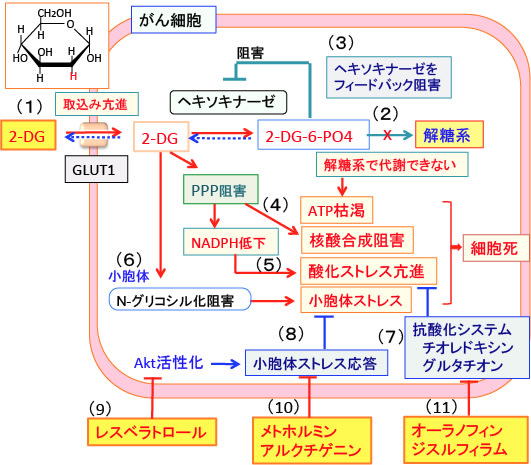
図:2-デオキシ-D-グルコース(2-DG)はグルコース(ブドウ糖)の2位のOHがHに変わっているグルコース類縁物質で、グルコースと同様にグルコーストランスポーター(GLUT1)によって細胞内に取り込まれる(1)。ヘキソキナーゼで2-DG-6リン酸(2-DG-6-PO4)になるが、それから先の解糖系酵素では代謝できないので細胞内に蓄積する(2)。蓄積した2-DG-6リン酸はヘキソキナーゼをフィードバック的に阻害するので、グルコースの解糖系での代謝を阻害してATP産生を阻害する(3)。2-DGはペントースリン酸経路(PPP: Pentose Phosphate Pathway)を阻害して核酸合成を阻害する(4)。さらにNADPHの産生を低下させ、抗酸化力を低下させて酸化ストレスを高める(5)。2-DGは小胞体でのタンパク質のN-グリコシル化(糖鎖の結合による修飾)を阻害し、折り畳みの不完全な異常タンパク質(unfolded protein)を増やして小胞体ストレスを引き起こす(6)。酸化ストレス亢進に対して、がん細胞はチオレドキシンやグルタチオンなどの抗酸化システムを亢進して細胞死に抵抗性を示す(7)。小胞体ストレスに対しては、セリン・スレオニン・リン酸化酵素のAktを活性化して小胞体ストレス応答を亢進して、細胞死に抵抗性を示す(8)。レスベラトロールはAktの活性を低下させる作用によって小胞体ストレス応答を阻害する(9)。メトホルミンや牛蒡の種(牛蒡子)に含まれるアルクチゲニンは小胞体ストレス応答を阻害する作用がある(10)。オーラノフィンとジスルフィラムは抗酸化システムを阻害して細胞死を誘導する(11)。2-DGの抗腫瘍活性はレスベラトロールやメトホルミンや牛蒡子やオーラフィンやジスルフィラムを併用すると増強できる。
516)酸化ストレスと小胞体ストレスを高めれば、がん細胞は自滅する
【2-デオキシ-D-グルコースは酸化ストレスと小胞体ストレスを引き起こす】
細胞はストレスが極限に達すると死滅します。がん細胞に選択的にストレスを高めて自滅させるがん治療法が注目されています。
細胞にストレスを高める方法として酸化ストレスと小胞体ストレスがあります。
酸化ストレスと小胞体ストレスを同時に亢進すると、がん細胞は自滅します。
細胞内の酸化ストレスは、がん細胞の増殖や転移を抑制する方向で作用します。したがって、がん細胞の酸化ストレスを高めることはがんの治療に有効です。(505話、506話参照)
がん細胞の酸化ストレスを高める方法としてケトン食、2-デオキシ-D-グルコース、メトホルミン、レスベラトロール、ジクロロ酢酸ナトリウム、アルテスネイト、高濃度ビタミンC点滴、半枝蓮、オーラノフィン、ジスルフィラムなどがあります。(507話、508話、509話参照)
2-デオキシ-D-グルコース(2-DG)はがん細胞の解糖系とペントース・リン酸経路(Pentose Phosphate Pathway: PPP)を阻害し、がん細胞の酸化ストレスを高めます。(418話参照)
2-DGは小胞体ストレスを高めてがん細胞を死滅させる作用も報告されています。
小胞体(Endoplasmic reticulum)は、細胞内における分泌・膜タンパク質の品質管理において大切な小器官です。
2-DGは解糖系を阻害する以外に、タンパク質に糖鎖が着くN-グリコシル化の過程を阻害するので、糖タンパク質の生成を阻害します。
グリコシル化というのはタンパク質に糖類が付加する反応で、小胞体で行われて、正常に糖が付加したタンパク質はゴルジ体に運ばれます。
糖鎖異常の糖タンパク質は、折り畳みが不完全な異常タンパク質になり、小胞体に蓄積して小胞体ストレスを引き起こし、細胞死の原因にもなります。
【抗がん剤治療や放射線治療に2-デオキシグルコースを併用すると抗腫瘍免疫が誘導される】
2-DGによる小胞体ストレスの存在下で、抗がん剤や放射線治療でがん細胞が死滅すると、抗腫瘍免疫(がん細胞を排除する免疫応答)が誘導されることが報告されています。以下のような報告があります。
Combination of glycolysis inhibition with chemotherapy results in an antitumor immune response.(抗がん剤治療に解糖系阻害を併用すると抗腫瘍免疫応答が引き起こされる)PNAS 109 (49): 20071-20076, 2012年
【要旨】
細胞のDNAにダメージを与える抗がん剤の多くは、抗腫瘍免疫を誘導する作用がある。解糖系の亢進はがん細胞の最も良く知られた特徴の一つである。そこで、解糖系を阻害する2-デオキシグルコース(2-DG)と細胞傷害性の抗がん剤を併用した場合、抗腫瘍免疫の誘導にどのような影響を及ぼすかを検討した。
2-DGと抗がん剤のエトポシドは、免疫機能の正常なマウスにおいては相乗的に作用して寿命を延長した。しかし、免疫機能不全のマウスに対しては寿命延長効果は認められなかった。
2-DGとエトポシドの両方を投与したマウスにおいてのみ、がん細胞特異的なT細胞の十分な活性化が認められた。
さらに、2-DGとエトポシドの両方の処理によって死滅したがん細胞をマウスに免疫すると、同じ腫瘍の再度の移植に対して拒絶した。
この効果の少なくとも一部は、細胞膜上のERp57/calreticulinの出現が関連していた。
これらの結果は、がん細胞の解糖系をターゲットにすると、死滅がん細胞による通常の免疫寛容誘発性の刺激を、腫瘍免疫誘発性の刺激に変換できることを示している。このメカニズムを利用すると免疫化学療法の新しい戦略を作りだすことができる。
がん細胞の性質は多様で不均一ですが、ほとんどのがん細胞に共通しているのは、エネルギー産生(ATP産生)をミトコンドリアにおける酸素呼吸(酸化的リン酸化)ではなく、細胞質における解糖系に依存していることです。これはワールブルグ効果(Warburg effect)として知られています。
解糖系阻害剤の一つが、代謝されないグルコース類縁物質の2-デオキシ-D-グルコース(2-DG)です。
2-DGはグルコースと同じトランスポーター(輸送担体)で取り込まれるので、細胞内の取込みの段階でグルコースの拮抗阻害剤として作用します。
細胞内では、ヘキソキナーゼによってリン酸化されて、2-デオキシグルコース-6リン酸(2-DG-6リン酸)に変換されますが、この2-DG-6リン酸は解糖系の先の代謝系には進めない(ヘキソキナーゼの先の解糖系酵素で代謝できない)ので、細胞内に蓄積します。
蓄積した2-DG-6リン酸は解糖系酵素のヘキソキナーゼとグルコースリン酸イソメラーゼをフィードバックで阻害する作用があり、取り込まれたグルコースの解糖系やペントースリン酸回路での代謝を阻害し、ATPやNADPHや核酸の産生を低下させます。
さらに、2-DGはタンパク質のN-グリコシル化(N-glycosylation)を阻害するので小胞体ストレス応答を誘導します。(2-DGがタンパク質のO-結合型Nアセチルグルコサミンの除去を阻害する作用もあることは515話で紹介)
ある種の抗がん剤が、腫瘍特異的な免疫応答を誘導するようながん細胞の死(immunogenic cancer cell death:免疫原性細胞死)を誘導することは、多くの実験で示されています。このようながん細胞に対する免疫応答の誘導は、抗がん剤耐性のがん細胞やがん幹細胞の排除に役立ちます。
この免疫原性の高い細胞死は、死滅したがん細胞がカルレチキュリン(calreticukin)を含むダメージ関連分子パターン(danger-associated molecular patterns:DAMP)を細胞膜に発現させている場合に誘導されます。
死滅したがん細胞の表面にDAMPが露出していると、このDAMPが樹状細胞のような抗原提示細胞に認識され、がん細胞特異的な抗腫瘍免疫が誘導されます。
この論文では、解糖系の阻害剤(2-DG)とDNA傷害性の抗がん剤(エトポシド)を併用すると、抗腫瘍免疫応答を十分に誘導できることを指摘しています。
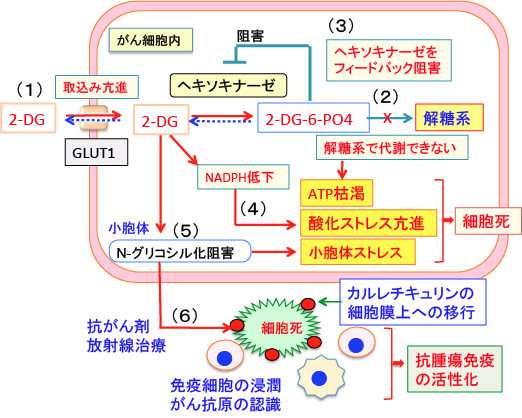
図:2-デオキシ-D-グルコース(2-DG)はグルコース(ブドウ糖)と同様にグルコーストランスポーター(GLUT1)によって細胞内に取り込まれる(1)。細胞内のヘキソキナーゼで2-DG-6リン酸になるが、それから先の解糖系には進めない(2)。さらに2-DG-6リン酸はヘキソキナーゼを阻害するので、解糖系でのATP産生を阻害する(3)。2-DGはペントースリン酸経路を阻害してNADPHの産生を低下させ、抗酸化力を低下させて酸化ストレスを高める(4)。2-DGは小胞体でのタンパク質のN-グリコシル化(糖鎖の結合による修飾)を阻害し、小胞体ストレスを引き起こす(5)。この状態で、抗がん剤や放射線でがん細胞にダメージを与えると、小胞体のカルレチキュリンというタンパク質が死滅したがん細胞の細胞膜上に移行して「ダメージ関連分子パターン(danger-associated molecular patterns:DAMP)」として免疫細胞に認識され、抗腫瘍免疫が活性化される(6)。以上のメカニズムで、2-DGは酸化ストレスと小胞体ストレスを高めて抗がん剤や放射線の治療効果を高め、さらに抗腫瘍免疫を活性化する。
【タンパク質は小胞体で折り畳まれる】
タンパク質なしでは生命は存在しません。このタンパク質が正しく機能するためには、3次元的に正しく折り畳まれる必要があります。
タンパク質はアミノ酸が複数結合した直鎖状の分子で、可能な立体構造は無数に存在しますが、細胞内では熱力学的に最も安定な立体構造を自発的にとります。このようにタンパク質が機能するために特定の立体構造に折り畳まれることを「タンパク質折り畳み(Protein Folding)」と言っています。(下図)

遺伝子発現においてもっともエラーが起こるステップはこのタンパク質折り畳みのところです。
タンパク質折り畳みは小胞体で行われます。
小胞体は真核生物の細胞内小器官の一つで、一重の生体膜に囲まれた板状あるいは網状の膜系の器官です。リボソームで合成された膜タンパク質や分泌タンパク質は、小胞体内やゴルジ装置で「タンパク質の折り畳み」や、糖鎖の結合などたんぱく質の翻訳後修飾を受けて正しい機能を発揮できるたんぱく質として完成します。
小胞体はタンパク質の折り畳み以外にも、脂肪合成、解毒、エネルギー代謝、細胞内カルシウムの制御、酸化還元反応を制御など多彩な機能を果たしています。
小胞体内におけるタンパク質折り畳みは「タンパク質の品質管理」のような仕事です。
異常なタンパク質を監視し、正常に折り畳まれて完成したタンパク質だけを小胞体から他の部位(細胞膜や細胞内小器官など)に移動させる働きを担っています。
小胞体におけるタンパク質折り畳みは、様々な状況(カルシウム濃度、糖鎖結合、エネルギー状態、酸化還元状態、代謝異常、炎症など)で影響を受けやすい過程です。
【折り畳みの異常なタンパク質が増えると小胞体ストレスを起こす】
細胞内のリボソームで合成されたタンパク質は、小胞体で修飾を受け、高次構造(折り畳み)を形成します。正常な折り畳みがなされたタンパク質はゴルジ体へ送られ、糖鎖がついて糖タンパク質が作られます。分泌タンパク質は細胞外へ搬出されます。

図:リボソームで作られた蛋白質は、小胞体で修飾を受けて高次構造(折り畳み)を形成し、さらにゴルジ体で糖鎖の結合などによって成熟蛋白質となって細胞外へ搬出、あるいは細胞内で利用される。
折り畳みに失敗した異常なタンパク質は小胞体にとどまります。
このような正常な高次構造に折り畳まれなかった異常タンパク質が小胞体内に蓄積して、細胞への悪影響(=ストレス)が生じることを小胞体ストレス(ERストレス:Endoplasmic reticulum stress)と言います。
小胞体ストレスの原因となる変性タンパク質は、遺伝子変異、ウイルス感染、炎症、有害化学物質、栄養飢餓、低酸素(虚血)などにより生じます。
変性タンパク質が過剰に蓄積し、小胞体ストレスの強さが細胞の回避機能を越えると、細胞死(アポトーシス)が誘導されます。小胞体ストレスはアルツハイマー病などの神経変性疾患などさまざまな疾患の原因となると考えられています。
がん細胞においては、小胞体ストレスが強度で長期に及んだり、小胞体ストレス応答が阻害されたりすると、細胞はアポトーシスのシグナルのスイッチが入り、自滅します。
酸化ストレスは小胞体におけるタンパク質の折り畳み異常をきたし、小胞体ストレスを亢進します。
小胞体ストレスが亢進するとミトコンドリアでの活性酸素産生も増加して酸化ストレスがさらに亢進します。
細胞の酸化ストレスと小胞体ストレスを同時に亢進すると、がん細胞は自滅します。
【小胞体ストレスを軽減する分子シャペロン】
小胞体ストレスは細胞の機能を妨げるため、細胞にはその障害を回避する仕組みが備わっています。この小胞体ストレスに対する細胞反応を小胞体ストレス応答 (unfolded protein response: UPR) といいます。
折り畳みの不完全な異常タンパク質(unfolded protein)に対する細胞内応答です。
変性タンパク質は小胞体ストレスセンサー(IRE1alpha, ATF6, Perk など)によって感知され、小胞体ストレス応答を誘導します。
小胞体ストレス応答は、タンパク質の産生量を低下させることで小胞体におけるタンパク質の折りたたみを軽減したり、分子シャペロンの量を増やすことで折りたたみ機能を向上させたり、変性タンパク質の除去効率をあげることで小胞体ストレスを取り除くよう働きます。
すなわち、翻訳開始因子の活性を阻害し、メッセンジャーRNAの分解を亢進して、タンパク質の合成を抑制します。オートファジーが亢進して凝集したタンパク質塊や損傷した小胞体を分解して除去します。さらに、遺伝子発現に作用して、分子シャペロンのGRP78やGRP94の発現を亢進して正常な折り畳みを促進し、異常タンパク質の分解を促進して、異常タンパク質の蓄積を抑制します。
このように、異常タンパク質の蓄積によって生じた小胞体ストレスが引き金になって、細胞内のシグナル伝達系が活性化されて引き起こされる細胞応答が、小胞体ストレス応答(unfolded protein response: UPR)です。
分子シャペロン (Molecular chaperone) とは、他の蛋白質分子が正しい折りたたみ(3次元構造)をして機能を獲得するのを助ける蛋白質の総称です。シャペロンとはフランス語で介添人のことで、社交界にデビューする若い婦人に付き添い、世話監督する人のことです。タンパク質が正常な3次構造と機能を獲得するのを助ける役割から、シャペロン(介添人)になぞらえた命名です。
分子シャペロンには多くの種類がありますが、小胞体ストレスが負荷されたときに特異的に発現が誘導される分子シャペロンの一つがGRP78です。GRP78とは78-kDa glucose-regulated proteinのことで、分子量が78000のグルコース制御性蛋白質という意味の蛋白質で、その発現量は小胞体ストレス応答 (unfold protein response: UPR)の指標となります。
固形がんは生体内において低酸素・低栄養という環境に適応するための様々なストレスに対する耐性を獲得しています。その中でも小胞体 (ER) 内で分子シャペロンとして働くGRP78の発現亢進は、ストレス耐性において最も大きな役割を担っていることが明らかになっています。
すなわち、本来であれば、低酸素・低栄養の環境で、小胞体ストレスの増大によってがん細胞は死滅するのですが、がん細胞内ではGRP78の発現が亢進してERストレス応答が増強しているために死ななくなっていると考えられています。
つまり、GRP78はグルコース欠乏など細胞にストレスがかかった際に細胞死を避けるために誘導されるたんぱく質と言えます。
したがって、GRP78の発現誘導などの小胞体ストレス応答を特異的に阻害する物質は、抗がん剤治療が困難な固形癌に対して抗がん作用を発揮することが期待されています。また、抗がん剤の効き目(感受性)を高めることも報告されています。
がん細胞に強い小胞体ストレスを与えることができれば、がん細胞は死滅できます。
例えば、プロテアソーム阻害剤ボルテゾミブは、異常タンパク質の分解を阻害することによって、小胞体に異常タンパク質を大量に蓄積させ、その結果、小胞体機能を破綻させ、細胞を死滅させます。
プロテアソームはタンパク質分解活性を持った巨大な酵素複合体で、ユビキチンにより標識されたタンパク質をプロテアソームで分解する系はユビキチン-プロテアソーム・システムと呼ばれ、細胞周期やシグナル伝達やアポトーシスなど細胞内の様々な機能の制御に関わっています。
プロテオソームの働きが阻害されると細胞内タンパク質の恒常性に異常が起こり、ユビキチン化されたタンパク質が細胞内に増え、毒性の強い凝集したタンパク質によってがん細胞に対して致死的に作用するのです。
腫瘍組織内での低酸素、グルコース飢餓、低pHなど、がん細胞は小胞体ストレスを受けやすい状況にあります。したがって、小胞体ストレス応答を阻害する方法は、がん細胞を選択的に死滅させる治療法になります。

図:低酸素やグルコース枯渇や栄養飢餓状態が起こると、折り畳みに異常をきたした不良タンパク質が小胞体に蓄積する。これを『小胞体ストレス』という。小胞体ストレスに対して細胞はGRP78などのシャペロン蛋白の発現が亢進して小胞体ストレスを回避し、アポトーシス(細胞死)が起こらないようにしている。この小胞体ストレス応答を阻害するとがん細胞はグルコース枯渇や栄養飢餓や低酸素によって死にやすくなる。
【GPR78の発現が多いがん細胞は死ににくい】
乳がんのステージII~IIIの腫瘍サンプルを分析したところ、グルコース制御性タンパク質78 (GRP78)が多く発現するがん細胞は、塩酸ドキソルビシン(アドリアマイシン)をベースにした治療に反応せず、再発しやすいことが報告されています。
この報告では、塩酸ドキソルビシン治療前の127のサンプルでは、3分の2でGRP78の発現量が多く検出され、GRP78が陽性であれば、再発までの期間が短いことが示されました(ハザード比は1.78; P = 0.16)。
さらに、GRP78の濃度が高く、塩酸ドキソルビシン治療にタキサン系薬剤を追加していない場合は、再発リスクはさらに高くなっていました(ハザード比は3.00; P = 0.022)。
つまり、この研究では、GRP78の発現量が多い乳がん細胞では、細胞死が回避されるため、再発の可能性が高くなることになることを示しています。(Cancer Res. 66: 7849-53,2006)
乳がんでは、GRP78の発現が高いとホルモン療法に対する感受性(効き目)が低下し、GRP78の発現を阻害するとホルモン感受性が高まることも報告されています。
その他、多くのがんでGRP78の発現が亢進しており、GRP78の発現量が多いがんは抗がん剤が効きにくく、転移や再発しやすく、生存期間が短いことが報告されています。
GRP78の発現を阻害すると、小胞体ストレスを誘導する微小管阻害剤に対する乳がん細胞の感受性を高めます。お茶に含まれるエピガロカテキンガレートはGRP78の発現を阻害して微小管阻害剤の効果を高めることが報告されています。
タキサン系やビンブラスチンのような微小管を阻害する抗がん剤は多くのがんの治療に使用されていますが、耐性を獲得すると効果が弱くなります。
微小管阻害剤は小胞体ストレスを高めるため、GRP78発現などの小胞体ストレス応答が亢進し、そのためにがん細胞は死ににくくなって抗がん剤に抵抗性になります。緑茶成分のエピガロカテキンガレートは、GRP78の発現を阻害して、微小管阻害剤に対する乳がん細胞の感受性を高めました。小胞体ストレス応答を阻害する方法は微小管阻害剤による抗がん剤治療の効果を高めることが示されています。(J. Cell and Mol Med. 13: 3888-3897, 2009)
以上のことから、GRP78の発現阻害など小胞体ストレス応答を阻害する薬は、様々な抗がん剤の効き目を高め、さらにがん細胞のグルコースの利用を阻止することを目標とした糖質制限やケトン食の効果を高めることも予想されます。
【小胞体ストレス応答を阻害すると低酸素・低栄養のがん細胞は死滅する】
がん細胞は主に解糖系でエネルギーを産生するため、グルコースを大量に消費しながら増殖します。しかし、腫瘍組織では、血管形成不全などによって正常組織とは異なる微小環境にあり、グルコースの供給が必ずしも十分ではありません。
がん細胞はグルコース枯渇などの栄養飢餓の状態になると、細胞死を起こさないようにするメカニズムが活性化します。そのようなメカニズムの一つとして「小胞体ストレス応答」があります。
この小胞体ストレス応答の鍵となる分子が分子シャペロンGRP78という蛋白質です。そして、このGRP78を阻害すると、低酸素・低栄養のがん細胞が死滅することが明らかになっています。
GRP78蛋白の活性を阻害すると、抗がん剤治療や放射線治療の抗腫瘍効果を高めることが報告されています。小胞体ストレス応答の阻害は、グルコースの枯渇によってがん細胞を兵糧攻めする治療法の効果を増強する方法としても有効です。
小胞体ストレスが過剰になったり、長時間持続すると、細胞はストレスに耐えられなくなり、最終的にアポトーシスによる細胞死が誘導されるのです。
小胞体ストレス応答を阻害する生薬成分として牛蒡子(ゴボウシ)に含まれるアルクチゲニンが注目されています。以下のような報告があります。
Arctigenin suppresses unfolded protein response and sensitizes glucose deprivation-mediated cytotoxicity of cancer cells.(アルクチゲニンは小胞体ストレス応答を抑制しグルコース枯渇によるがん細胞死の感受性を高める)Planta Med. 2011 Jan;77(2):141-5.
【要旨の抜粋】
牛蒡子に含まれるアルクチゲニンにはグルコースが枯渇した条件でがん細胞を選択的に死滅させることが最近明らかになっているが、そのメカニズムは不明である。
この研究で我々は、グルコース枯渇によって発現が誘導されるglucose-regulated protein-78(GRP78)とその類縁のGRP94の遺伝子転写誘導を、アルクチゲニンが特異的に阻害することを見つけた。
グルコース枯渇によって活性化されるXBP-1やAFT4といった他の小胞体ストレス応答経路の蛋白質の活性化もアルクチゲニンで抑制された。
遺伝子導入実験で、GRP78遺伝子を導入して発現させると、アルクチゲニンとグルコース枯渇によって誘導されるがん細胞の増殖阻害効果が部分的に阻止された。
これは、グルコース枯渇下でのアルクチゲニンによるがん細胞に対する殺細胞作用に小胞体ストレス応答の抑制が関連していることを示唆している。
Arctigenin preferentially induces tumor cell death under glucose deprivation by inhibiting cellular energy metabolism.(アルクチゲニンは細胞のエネルギー代謝を阻害することによってがん細胞に選択的に細胞死を誘導する)Biochem Pharmacol. 2012 Aug 15;84(4):468-76.
【要旨の抜粋】
血管が乏しい固形がんではがん細胞は栄養素が枯渇しやすい状態にある。このようながん細胞における栄養供給が制限された状況は、がん細胞に特異的に作用する治療法の開発に役立つ可能性がある。
アルクチゲニンはグルコースを枯渇させたA549細胞を選択的に、ミトコンドリアでの酸化的リン酸化を阻害して壊死を誘導した。グルコースを枯渇させたがん細胞に対して、アルクチゲニンは細胞内の活性酸素種の産生を高め、エネルギー産生を阻害した。細胞内の活性酸素種の産生はグルコースが枯渇した状況下で、細胞内ATPの枯渇によって引き起こされた。
さらに、グルコース類似体の2-デオキシグルコースとアルクチゲニンを同時に投与すると、正常細胞と比べて、がん細胞に特異的に細胞死を誘導した。アルクチゲニント2-デオキシグルコースの組合せは、正常細胞に対する毒性が軽微ながん治療法として有望と思われる。
1番目の論文は、アルクチゲニンがグルコース枯渇によって誘導されるGRP78の発現を阻害して小胞体ストレス応答を阻害することを報告しています。
2番目の論文の実験で使われた2-デオキシグルコースはグルコースと類似の構造で、グルコースと同じように細胞に取り込まれますが、解糖系で代謝されず、解糖系の酵素を阻害する作用があります。つまり、グルコースを枯渇させ、がん細胞のグルコース取り込みを阻害しているのと同じような作用です。
このような状況でアルクチゲニンを併用すると、がん細胞が特異的に死滅するという報告です。
つまり、この2つの論文は、グルコース枯渇を目指すケトン食療法や2-デオキシ-D-グルコースにアルクチゲニン(牛蒡の種に含まれる)を併用すると抗腫瘍効果が高まることを示唆しています。
牛蒡子(ゴボウシ)はキク科のゴボウArctium lappa L. の果実(種子)です。牛蒡(ゴボウ)の根は食用に供されますが、種子は牛蒡子という生薬名で薬用に用いられます。
牛蒡子には抗炎症作用や抗菌作用、抗腫瘍作用が報告されています。牛蒡子の抗炎症作用や抗腫瘍作用は、それに含まれるアルクチイン(arctiin)やアルクチゲニン(arctigenin)などのリグナン誘導体によるものと考えられています。
アルクチゲニンには様々ながんの増殖を抑制する効果があることが報告されています。がん細胞がグルコース不足の状態に耐えるために活性化されるAktという酵素を阻害することによって、栄養飢餓に対する耐性の獲得を阻止する効果があることも報告されています。(Cancer Res. 66:1751-1757. 2006)
つまり、アルクチゲニンはがん細胞のグルコース枯渇に対して抵抗するために作動する小胞体ストレス応答の阻害だけでなく、Akt活性の阻害など複数の作用機序で、栄養飢餓に対するがん細胞の耐性獲得を阻止する作用があると言えます。
膵臓がんを移植されたマウスの実験で、アルクチゲニンが生存期間を著明に延長させることが報告されています。
生薬の枳実にGRP78阻害作用があることが報告されています。
枳実(キジツ)はミカン科のダイダイやナツミカンなどのミカン類の未成熟果実を乾燥した生薬です。枳実が、グルコース欠乏の膵臓がん細胞(PANC-1)細胞に、GRP78の活性を阻害することによって選択的な細胞傷害作用を示すことが報告されています。
435種類の生薬を探索した結果、枳実(きじつ)のメタノール抽出エキスがグルコース欠乏状態で培養した膵臓がん細胞(PANC-1)に対してアポトーシス誘導作用を示すことを報告しています。
グルコースの欠乏が無い状態で培養した膵臓がん細胞に対しては、枳実エキスはアポトーシスを誘導しませんでした。作用機序としてグルコース欠乏によって誘導されるGRP78の発現を阻止する作用が示されています。すなわち、枳実に含まれる成分が、GRP78の発現を阻害することによって、グルコース欠乏状態の膵臓がん細胞に選択的にアポトーシスを誘導することが示されています。(Biosci Biotechnol Biochem, 73:2167-2171, 2009)
がんの中には動脈が乏しいのに増殖し続けるがんもあります。たとえば、膵臓がんや胆管細胞がんなどは血管が乏しいのに、着実に増殖していきます。これは、これらのがん細胞が、栄養や酸素が不足した状態でも生存し、増殖を続けることができる性質をもっているからだと考えられます。したがって、栄養飢餓や低酸素(虚血)に対するがん細胞の耐性のメカニズムを阻害する成分を含む生薬(牛蒡子や枳実)は、このような血管に乏しいがんの増殖を抑える可能性も示唆されます。
(48話、298話、311話参照)
【2-DGはAkt阻害を併用すると抗腫瘍効果が増強する】
2-DGはがん細胞の解糖系の阻害と酸化ストレスの増強と小胞体ストレスを誘導する作用によって抗がん作用を示します。2-DGはリン酸化酵素のAktの活性を亢進する作用があります。
インスリンやインスリン様成長因子-1(IGF-1)などの増殖シグナルは、ホスホイノシチド3-キナーゼ(PI3K)というリン酸化酵素を活性化し、これがさらにAktというセリン・スレオニンリン酸化酵素をリン酸化して活性化します。
活性化したAktは、細胞内のシグナル伝達に関与する様々な蛋白質の活性を調節することによって細胞の増殖や生存(死)の調節を行います。
多くのがん細胞はPI3-K/AKTシグナル伝達系が持続的に活性化して、増殖シグナルが恒常的にオンになっています。
2-DGはがん細胞の解糖系を阻害し、酸化ストレスを亢進し、小胞体ストレスを誘導して、がん細胞のアポトーシスを誘導する方向に作用するので、それを阻止するメカニズムが作用してAkt活性が高まると考えられています。Aktはアポトーシスを阻止し、細胞生存を高める作用があります。
そこで、Aktを阻害する方法を併用すると、2-DGの抗がん作用は増強すると考えられています。以下のような論文があります。
Inhibition of Akt potentiates 2-DG-induced apoptosis via downregulation of UPR in acute lymphoblastic leukemia.(Aktの阻害は、急性リンパ芽球性白血病の小胞体ストレス応答を抑制することによって、2-デオキシグルコース誘導性のアポトーシスを増強する)Mol Cancer Res. 2012 Jul;10(7):969-78.
この論文では、2-デオキシグルコース(2-DG)は急性リンパ芽球性白血病(ALL)の細胞死を誘導しますが、その細胞死はD-マンノース(D-mannose)の添加によって阻止されました。D-マンノースはN-結合型グリコシル化に必要な糖です。つまり、ALLに対する2-DGの細胞毒性は、2-DGがN-結合型グリコシル化を阻害して小胞体ストレスを誘導することを意味しています。
2-DGで誘導される小胞体ストレス応答に対してALL細胞はAktを活性化し、小胞体ストレス応答を高めます。
そこで、Aktを阻害すると、小胞体ストレス応答が抑制され、2-DGによる細胞死が増強されたという結果を報告しています。
Aktを阻害すると2-DGは極めて低い濃度(0.5 mmol/L)で、85%の細胞にアポトーシスを誘導しました。
つまり、2-DGとAkt阻害薬を併用すると、抗腫瘍効果を高めることができるという結論になります。
【レスベラトロールはAkt阻害作用によって2-DGの抗がん作用を増強する】
レスベラトロールがAktを阻害する作用があることは513話で紹介しています。
レスベラトロールが活性酸素種(reactive oxygen species:ROS)の産生を高め、がん細胞で持続的に活性化しているAKTを阻害し、その下流のシグナル伝達系を阻止することによって細胞死(アポトーシス)を誘導することが報告されています。

図:がん細胞はPI3K/AKTシグナル伝達系が恒常的に活性化されている。レスベラトロールは活性酸素種の産生を増やしてAktの活性を阻害する作用がある。Aktが阻害されると、がん細胞は増殖が停止し細胞死(アポトーシス)が誘導される。
したがって、レスベラトロールは2-DGの小胞体ストレスを増強して抗腫瘍効果を高める可能性が推測されます。実際にそのような実験結果が報告されています。以下のような報告があります。
Resveratrol augments ER stress and the cytotoxic effects of glycolytic inhibition in neuroblastoma by downregulating Akt in a mechanism independent of SIRT1(レスベラトロールはサーチュイン1とは関係ないメカニズムでAkt発現を減少させることによって神経芽細胞腫における解糖系阻害による小胞体ストレスと細胞毒性作用を増強する)Exp Mol Med. 2016 Feb; 48(2): e210.
【要旨】
多くのがん細胞は好気性解糖が亢進しており、好気性解糖が亢進しているがん細胞ほど浸潤性が高く、予後が不良である。
解糖系の阻害をターゲットにした治療は、正常細胞への影響が少ないと考えられるので、有望ながん治療と考えられている。
この報告では、神経芽細胞種の細胞株を用いて、解糖系の阻害とレスベラトロールを併用した場合の抗腫瘍効果を検討した。
2-デオキシ-D-グルコースを用いて解糖系を阻害すると、培養した神経芽細胞種の細胞の生存が有意に減少し、この細胞死誘導作用は小胞体ストレスとAkt活性の亢進と関連していた。
2-DGの投与によって、小胞体の分子シャペロンGRP78とGRP94、細胞死誘導性のタンパク質であるC/EBP homology protein (CHOP)と、Aktのセリン473とスレオニン450とティースレオニン308のリン酸化が増加した。
レスベラトロールと2-DGを同時投与すると、2-DGの単独投与の場合に比べて、GPR78とGPR94とAktのリン酸化は減少したが、CHOPと細胞死は増加した。
Aktの選択的阻害も同様に、2-DG誘導性のGPR78とGPR94の発現を減少させ、CHOP発現を増加した。これは、Akt活性が小胞体ストレスを制御していることを示している。
プロテイン・フォスファターゼ1α(Protein phosphatase 1α:PP1α) はレスベラトロールによって活性化され、これはPP1αのスレオニン320のリン酸化の減少によって示された。
PP1αの選択的阻害剤のトートマイシン(tautomycin)で前処理すると、レスベラトロールによるAktリン酸化は阻止された。これは、レスベラトロールはPP1を活性化し、Akt発現を抑制することによって2-DG誘導性の細胞死を亢進することを示唆している。
レスベラトロールはサーチュイン1(SIRT1)を活性化する作用があるが、2-DG存在下でのレスベラトロールによるAkt阻害作用はSIRT1の選択的阻害剤では阻止できなかった。これは、レスベラトロールによるAkt阻害作用と2-DG誘導性細胞死亢進作用は、レスベラトロールによるサーチュイン1活性化とは関係しないことを意味している。
レスベラトロールはフォスファターゼのPPIα活性を亢進することによってAkt活性を阻害し、その結果、2-DG誘導性の小胞体ストレスと神経芽細胞腫の細胞死を亢進することが示唆された。
Aktはリン酸化されて活性化されますが、脱リン酸化酵素(フォスファターゼ)のPPIαはAktを脱リン酸化して活性を阻害します。レスベラトロールはPP1αの活性を亢進することによってAkt活性を阻害し、2-DG誘導性の小胞体ストレスを増強し、細胞死を誘導するという機序です。
2-DGとレスベラトロールの併用が抗がん剤作用を示すということです。
がん組織におけるがん細胞の性状は不均一ですが、多くのがん細胞に共通しているのが、「がん細胞では酸素が十分に利用できる状況でも酸素呼吸を抑制し、解糖系を亢進している」という代謝の特徴です。これを好気性解糖やワールブルグ効果と言います。
がん細胞はグルコースの取込みが多いという特徴を利用した検査法がPET(ポジトロン・エミッション・トモグラフィー:陽電子放射線断層撮影)検査です。
解糖系の阻害作用で最も研究されているのが、グルコース類縁体の2-デオキシ-D-グルコース(2-DG)です。
2-DGは解糖系の阻害だけでなく、小胞体ストレスを誘導する作用もあります。2-DGは構造的にマンノースに似ているので、N-結合型グリコシル化のときに、マンノースの代わりに間違って取込まれ、タンパク質の折り畳みの異常を来して、小胞体ストレスを誘導するのです。
この小胞体ストレスに対して、細胞はAktを活性化して小胞体ストレス応答を亢進し、細胞死を免れようとします。そこで、Akt活性を阻害すると2-DG誘導性の小胞体ストレスを増強し、細胞死を誘導できます。
レスベラトロールはプロテイン・フォスファターゼを活性化してAktを不活性化する機序で小胞体ストレス応答を抑制して、2-DGの細胞傷害作用を増強するというメカニズムです。
糖尿病治療薬のメトホルミンも小胞体ストレス応答を阻害する作用が報告されています。
2-DGとレスベラトロールを併用するがん治療を試してみる価値はありそうです。さらに、メトホルミンや牛蒡子やオーラノフィンやジスルフィラムの併用も有効です。(トップの図)
レスベラトロールは通常では生体利用率が低いので、リポソーム化などの生体利用率を高めた製品を利用するのが大切です。(513話参照)
西洋医学では、単独で腫瘍縮小効果が認められないと治療薬として認可しない傾向があります。2-DGやレスベラトロールやメトホルミンや牛蒡子やオーラノフィンやジスルフィラムはそれぞれ単独では十分な腫瘍縮小効果を示しませんが、それらを組み合せると、抗腫瘍作用を示すようになります。しかも、がん細胞に選択性が高いので、正常細胞へのダメージが少なく、副作用の少ないがん治療になります。
このように、単独では抗がん作用の弱い物質を組み合わせてがん治療に使う工夫も重要です。
| « 515)チオレド... | 517)ワールブ... » |



