がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
517)ワールブルグ効果を是正するとがん細胞は自滅する
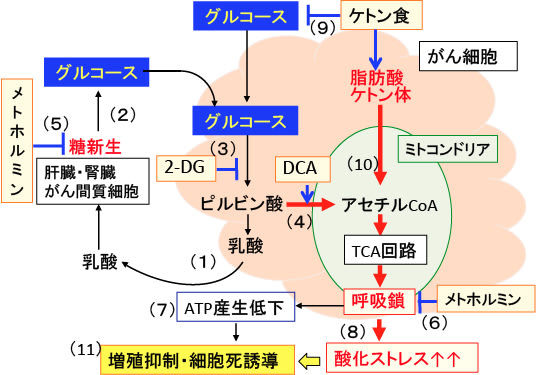
図: がん細胞は解糖系が亢進して乳酸の産生が増えている(1)。乳酸は肝臓や腎臓やがん間質細胞で糖新生によってグルコースに変換され再利用される(2)。2-デオキシ-D-グルコース(2-DG)はがん細胞の解糖系を阻害し(3)、ジクロロ酢酸ナトリウム(DCA)はピルビン酸脱水素酵素を活性化してピルビン酸からアセチルCoAへの変換を促進する(4)。メトホルミンは糖新生を阻害する(5)。メトホルミンは呼吸鎖を阻害して(6)、ATP産生を低下させ(7)、さらにミトコンドリアでの活性酸素の産生を増やして酸化ストレスを亢進する(8)。ケトン食はグルコースの利用を阻害し(9)、脂肪酸とケトン体はミトコンドリアでの代謝を亢進して酸素呼吸(酸化的リン酸化)を亢進する(10)。これらの組み合せは、酸化ストレスを高め、ATP産生を低下させて、がん細胞の増殖を抑制し、細胞死を誘導する(11)。2-DGとDCAはメトホルミンによる乳酸アシドーシスを防ぐので、副作用も少なくなり、抗腫瘍活性を高めることができる。
517)ワールブルグ効果を是正するとがん細胞は自滅する
【断食はワールブルグ効果を是正して、がん細胞を自滅させる】
がん細胞では、酸素が十分に利用できる状況でもミトコンドリアでの酸素呼吸が抑制され、グルコース(ブドウ糖)の取込みと解糖系が亢進し、乳酸の生成が増えているという物質代謝の特徴を持っています(下図)。
これを好気性解糖(Aerobic glycolysis)あるいはワールブルグ効果(Warburg effect)と言います。

図:がん細胞ではグルコースの取り込みと解糖系が亢進し、ミトコンドリアでの酸素呼吸(酸化的リン酸化)は抑制されている。そのレベルはがん細胞によって異なるが、一つの平均的な数値として、正常細胞のグルコースの取込み量を1とした相対値を記載している。正常細胞では取り込まれたグルコースの8割くらいがミトコンドリアでの代謝に使われている(上図)。がん細胞でもミトコンドリアでの代謝は正常細胞と同程度に起こっているが、グルコースの取込みは10倍程度に亢進し、その多く(9割程度)は解糖系で代謝され、乳酸の産生が顕著に増えている(下図)。(参考:Free Radic Biol Med 2015 Feb; 0: 253-263)
解糖系を阻害して酸素呼吸を亢進すると、がん細胞は自滅します。その一つの方法として断食があります。以下のような報告があります。
Fasting induces anti-Warburg effect that increases respiration but reduces ATP-synthesis to promote apoptosis in colon cancer models(大腸がんの実験モデルにおいて、断食は酸素呼吸を亢進し、ATP合成は低下させることによってワールブルグ効果を是正し、アポトーシスを亢進する)Oncotarget. 2015 May 20; 6(14): 11806–11819.
【要旨】
がん細胞における抗がん剤耐性は、好気性解糖の亢進と酸化的リン酸化の低下というがん細胞の代謝の特徴(ワールブルグ効果)と関連が深く、このワールブルグ効果を是正すると、多くのがん細胞において、抗がん剤耐性が低下できることが知られている。
以前の研究において、短期間の絶食が、抗がん剤によるダメージから正常細胞を保護し、がん細胞に対してはダメージを高める効果があることを報告したが、そのメカニズムに関しては、十分に解明されていない。
今回の研究では、抗がん剤のオキサリプラチンと48時間の絶食の併用が、大腸がん細胞CT26細胞株の増殖にどのような影響を及ぼすかを検討した。
細胞培養によるin vitro(試験管内)の実験と、動物を使ったin vivo(生体内)の実験系の両方において、48時間の絶食はオキサリプラチンの抗腫瘍効果を増強した。
CT26大腸がん細胞において、48時間の絶食は好気性解糖系とグルタミン代謝(glutaminolysis)を低下させ、ミトコンドリアでの酸化的リン酸化を亢進した。
絶食はミトコンドリアの呼吸酵素複合体-I(Complex I)と複合体II(Complex II)における酸素消費を増やし、活性酸素の産生を高めて酸化ストレスを高めたが、ATP産生は減少した。
抗がん剤治療は、コハク酸/複合体IIによる酸素消費を増やし、酸化ストレスと亢進してアポトーシスを誘導することによって、さらに細胞毒性を高める。
これらの結果は、短期間(48時間)の絶食によるグルコースとアミノ酸の欠乏はワールブルグ効果を是正し、ミトコンドリアでの酸素消費を増やすがATP産生は増やせず、その結果、酸化ストレスによる酸化傷害を引き起こしてアポトーシスが誘導されることを示している。
がんの食事療法において断食があります。断食はグルコースの利用を低下させ、ケトン体産生やオートファジーの亢進などによって抗腫瘍効果を発揮します。ただし、断食の長期間の実施は体重や体力や栄養状態を低下させるデメリットがあります。
しかし、2〜3日程度の短期間の断食が抗がん剤や放射線治療の副作用を軽減し、抗腫瘍効果を高めることは人間でも証明されています。(391話参照)
がん細胞が増殖するための2大栄養素はグルコースとグルタミンです。がん細胞では、グルコースとグルタミンの取込みが増えています。
がん細胞の解糖系とグルタミン代謝を阻害し、ミトコンドリアの酸化的リン酸化を亢進すると、がん細胞の増殖を抑制できることが明らかになっています。

図:増殖活性の高いがん細胞はグルコースとグルタミンの取込みと代謝が亢進している。
この論文では、2日間の水だけの短期間の絶食を行うと、グルコースとアミノ酸の利用が低下し、抗がん剤治療に対して、正常細胞へのダメージは軽減し、がん細胞へのダメージは増強することを示しています。
臨床試験でも、絶食自体には副作用はなく、抗がん剤の副作用を軽減することが報告されています。
絶食すると、日頃細胞分裂を行っている正常細胞も一時的に増殖を止めるか分裂速度を低下させます。
抗がん剤は細胞分裂をしている細胞を死滅させるので、正常細胞の分裂が低下すれば、それだけダメージを受けにくくなります。
しかし、がん細胞は体の制御から外れた状態での自律増殖を行っているので、短期間の絶食では増殖速度は変わらないので抗がん剤や放射線に対する感受性は変化しません。
また、正常細胞は絶食やカロリー制限によって様々なストレスや毒物に対する抵抗性が高まります。これも抗がん剤や放射線による正常細胞のダメージの軽減にも関連しています。
「絶食は、正常細胞のストレス抵抗性を高め、細胞分裂を一時的に低下させて抗がん剤や放射線によるダメージを軽減する」ということです。
この論文では、絶食はがん細胞の解糖系とグルタミン代謝を抑制し、ミトコンドリアでの酸素呼吸を亢進し、活性酸素の産生を増やして酸化ストレスを高め、ATP産生を低下させる効果によってがん細胞にアポトーシスを誘導することを明らかにしています。
がん細胞のワールブルグ効果を是正すると、がん細胞は酸化ストレス亢進とATP枯渇によって死滅するということを示しています。

図:絶食(断食)はがん細胞におけるグルコースの取込みと解糖系とペントースリン酸経路とグルタミン代謝(グルタミノリシス)を抑制し、ミトコンドリアでの酸素呼吸(酸化的リン酸化)を亢進し、活性酸素の産生を増やして酸化ストレスを高め、ATP産生を抑制して細胞増殖を抑制し、アポトーシスを誘導する。
【ワールブルグ効果を是正するとがん性悪液質が改善する】
前述のように、がん細胞の2大栄養素はグルコースとグルタミンです。
グルコースは解糖系が亢進して乳酸の産生が増えています。グルタミンもグルタミン酸からαケトグルタル酸に変換されてTCA回路に入り、その50%くらいが乳酸に変換されると報告されています。
このようにして、がん細胞内では、乳酸の産生が増え、モノカルボン酸トランスポーター(MCT)を通って細胞外に移行し、周囲のがん間質細胞(線維芽細胞や炎症細胞)や血流にのって肝臓や腎臓を使って、糖新生でグルコースに変換されて、がん細胞に再利用されます。
この糖新生では宿主(正常細胞)はエネルギーを使って、がん細胞のためにグルコースを再生することになります。2分子の乳酸から1分子のグルコースを作るのに6分子のATPを消費します。つまり、がん細胞は宿主の代謝系をハイジャックし、自分の増殖に利用しているのです。
このがん細胞の代謝を阻止しないと、宿主はがん細胞によって無駄にエネルギーを消費して、体力と栄養を消耗することになります。
進行がんにおける倦怠感や体重減少などのがん性悪液質の症状の改善には「がん細胞における解糖系亢進と乳酸産生」を阻止することが重要であることが理解できます。
メトホルミンがグルタミン代謝を阻害することが知られています。
ケトン食やジクロロ酢酸ナトリウムや2-デオキシグルコースもワールブルグ効果を是正することによってがん性悪液質を改善する効果があります。
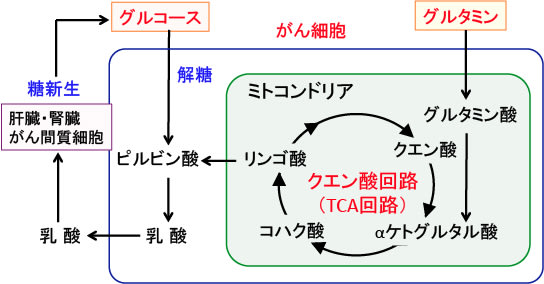
図:がん細胞ではグルコース(ブドウ糖)とグルタミンの取込みが増え、乳酸の産生が増えている。乳酸は肝臓や腎臓やがん組織の間質細胞などで糖新生によってグルコースへ変換され、再度、がん細胞に利用される。がん細胞は宿主の代謝系をハイジャックして、自分の生存と増殖に利用している。この状況を阻止するためには、がん細胞からの乳酸の産生を抑制することが重要である。
ケトン食はがん性悪液質を改善する効果があることが報告されています。
以下のような論文があります。
Metabolic reprogramming induced by ketone bodies diminishes pancreatic cancer cachexia. (ケトン体によって誘導される代謝の再プログラム化は膵臓がんの悪液質を軽減する)Cancer & Metabolism. 2014;2:18. doi:10.1186/2049-3002-2-18.
【要旨】
背景:エネルギー代謝の異常はがん細胞の最大の特徴である。がん細胞は増大するエネルギー要求を満たすために、サイトカインや様々な因子を分泌し、筋肉や脂肪の分解を促進し、これががん性悪液質と言われる状況である。
がん関連死の20%程度が悪液質によると考えられている。しかし、がん性悪液質のメカニズムやその治療法に関しては十分に解明されていない。
高脂肪・低糖質食のケトン食では、ケトン体(アセト酢酸、βヒドロキシ酪酸、アセトン)の血中濃度が増加し、代替エネルギー源となる。さらに、ケトン食は全身的な代謝の変化を引き起こす。
がんでは代謝の異常が重要な役割を果たしている点を踏まえ、ケトン食はがん細胞におけるグルコース取り込みを減らし、悪液質状態を軽減し、有効な治療法になる可能性がある。
結果:複数の膵臓がん細胞を用いた実験で、培養がん細胞にケトン体を投与すると、がん細胞のグルコースとグルタミンの取込みと総ATP量を減少させ、細胞死を誘導した。
代謝の制御に重要な働きをしているがん遺伝子のc-Mycの細胞内量と、解糖系酵素の遺伝子のプロモーター領域へのc-Mycの結合が減少し、これががん細胞における代謝の変化と関連していることが示唆された。
このようなケトン体によって誘導された膵臓がん細胞内の代謝の再構成は、がん細胞を用いた実験モデルでがん性悪液質を顕著に軽減することが示された。すなわち、マウスに膵臓がん細胞を移植した実験モデルにおいて、ケトン食が腫瘍の増殖と悪液質を抑制する効果があることが確認された。
結論:以上の結果から、がん性悪液質はがん細胞における特有の代謝異常によって引き起こされ、このがん細胞における代謝異常はケトン食によって是正でき、その結果、がん細胞の増殖を抑制し、筋肉と体重の減少を阻止した。
膵臓がん患者の83%ががん性悪液質の状態になり、膵臓がん関連の死亡の主要な原因となっていると報告されています。がん性悪液質では、脂肪だけでなく筋肉も減少します。膵臓がんの治療では、がん細胞の増殖と悪液質の進展を阻止する有効な治療手段が必要です。この目的にケトン食は有効だという報告です。
【絶食と同じ抗がん作用を示すケトン食+2-デオキシグルコース+メトホルミン+ジクロロ酢酸】
がん細胞におけるワールブルグ効果を抑制し、エネルギー代謝を正常に是正すれば、がん細胞の増殖を抑制し、細胞死を誘導できます。
前述のように、絶食はがん細胞のワールブルグ効果を是正してがん細胞を死滅させる効果が期待できます。しかし、長期間の絶食は体力や栄養状態を低下させる欠点があります。
体力や栄養状態を低下させないで絶食と同じような効果が期待できる方法としてケトン食があります。

図:糖質摂取を極力減らし、脂肪の摂取を増やしてケトン体の産生を増やすケトン食は、グルコースの取込みや解糖系を抑制(=正常化)し、NADPHの産生を低下させ、がん細胞内の活性酸素消去能を低下させる。さらに、ケトン食の主要なエネルギー源となる脂肪酸とケトン体はミトコンドリアでアセチルCoAに変換されて代謝されるため、これらをエネルギー源として利用すると活性酸素の産生が亢進してダメージを受けることになる。つまり、ケトン食はがん細胞に対してエネルギー産生を抑制し、活性酸素の産生を高めて酸化ストレスを亢進する2つの機序によってがん細胞を自滅させることができる。(参考:Redox Biology 2: 963-970, 2014年)
2-デオキシ-D-グルコース(2-DG)は解糖系を阻害することによって乳酸とATPの産生を阻害します。
経口糖尿病薬のメトホルミンはミトコンドリアの呼吸酵素を阻害してATPの産生を阻害する作用があります。最近の研究では、メトホルミンが2-DGと同様に解糖系酵素のヘキソキナーゼの活性を阻害する作用も明らかになっています。
したがって、2-DGとメトホルミンを併用すると、がん細胞のエネルギー産生を阻害する効果を高めることができます。
マウスの移植腫瘍の実験モデルで、2-DGとメトホルミンを併用すると相乗的な抗腫瘍効果が得られることが報告されています。(Mol Cancer Ther. 10(12): 2350-2362, 2011年)
培養がん細胞を用いた実験では、2-DGで解糖系を阻害しても、がん細胞を死滅させるだけの効果は得られませんが、メトホルミンを同時に投与すると、がん細胞は死滅しました。様々な種類のがん細胞をマウスに移植した動物実験において、2-DGとメトホルミンはそれぞれ単独では抗腫瘍効果は弱いのですが、この2つを併用すると強い腫瘍縮小効果が認められています。
がん細胞が増殖するためには、増殖のシグナルと、エネルギー産生と物質合成のための材料が必要です。増殖シグナル伝達系は、インスリン/インスリン様成長因子-1(IGF-1)とそれらの受容体の結合によって刺激されるPI3K/Akt/mTORC1伝達系が重要です。
メトホルミンはミトコンドリアの呼吸鎖(電子伝達系)と解糖系のヘキソキナーゼを阻害してATP産生を阻害する作用がありますが、さらにAMP活性化プロテインキナーゼ(AMPK)を活性化してmTORC1(哺乳類ラパマイシン標的蛋白質複合体-1)の活性を阻害することによってがん細胞の増殖を抑制します。
一方、2-DGはグルコースの解糖系とペントース・リン酸経路での代謝を阻害することによって、エネルギー産生と物質合成を抑制し、その結果、がん細胞の増殖が抑えられます。
すなわち、2-DGとメトホルミンの同時投与は、がん細胞のエネルギー産生と物質合成と増殖シグナル伝達を効率的に阻害することによって、がん細胞の増殖を阻害することができるのです。
メトホルミンには乳酸アシドーシスを引き起こす副作用があります。乳酸が増えて、血液が酸性になる状態です。
大きながん組織があると乳酸の産生が増えています。乳酸アシドーシスを防ぐために、肝臓では乳酸をブドウ糖に変換する糖新生が亢進します。メトホルミンは糖新生を阻害する効果があるので、乳酸産生の増加した状態でメトホルミンを服用すると乳酸アシドーシスを起こしやすくなります。
この場合、がん細胞の解糖系を抑制し、ミトコンドリアでの酸素呼吸を増やす2-デオキシグルコースやジクロロ酢酸ナトリウムやケトン食を併用するとメトホルミンによる乳酸アシドーシスの発生を防ぐことができます。
特にジクロロ酢酸ナトリウムは乳酸アシドーシスの治療に古くから使用されています。

図: がん細胞は解糖系が亢進して乳酸の産生が増えている(1)。乳酸によるアシドーシス(酸性血症)を防ぐため、肝臓で乳酸をグルコースに変換する。これをコリ回路という(2)。メトホルミンは糖新生を阻害するので、乳酸アシドーシスの副作用を起こしやすい(3)。ケトン食はグルコースの利用を阻害し、脂肪酸とケトン体はミトコンドリアの酸素呼吸(酸化的リン酸化)を亢進する(4)。2-デオキシ-D-グルコース(2-DG)はがん細胞の解糖系を阻害し(5)、ジクロロ酢酸ナトリウム(DCA)はピルビン酸脱水素酵素を活性化してピルビン酸からアセチルCoAへの変換を促進する(6)。その結果、2-DGとDCAはメトホルミンによる乳酸アシドーシスを防ぎ、活性酸素の産生を高めて酸化ストレスを亢進する(7)。これらは相乗効果で、がん細胞の増殖を抑制できる。
ケトン食だけでは抗腫瘍効果は弱いのですが、2-デオキシグルコース(2-DG)とメトホルミンとジクロロ酢酸ナトリウムを併用すると、がん細胞の増殖を抑制できます。さらに抗酸化システムを阻害するジスルフィラムやオーラノフィンを併用すると、がん細胞を酸化ストレスで自滅できます。(510話参照)
【ケトン体はがん細胞のミトコンドリアの酸化的リン酸化を活性化する】
がん細胞はケトン体や脂肪酸をエネルギー源として利用しにくい状態にあります。それは、がん細胞は酸素を使ったエネルギー産生を行いたくない理由があるからです。
したがって、酸素を使わない解糖系を亢進し、ミトコンドリアの酸素呼吸をできるだけ抑制します。
脂肪酸もケトン体もミトコンドリアでしか代謝できないので、ミトコンドリアの代謝が抑制されているがん細胞では脂肪酸もケトン体も利用できない(利用したくない)状況にあります。
しかし、がん細胞でもミトコンドリアの機能は維持されています。したがって、解糖系を阻害すると、ミトコンドリアでのエネルギー産生を高めるしかありません。
実際、がん細胞もケトン体や脂肪酸を分解してエネルギー産生はできます。ただ、したくないだけです。
そこで、ケトン体や脂肪酸をエネルギー源としてがん細胞に使用させるように仕向けると、がん細胞の酸化ストレスを高めて、死滅できます。
つまり、がん細胞がエネルギー産生のためにケトン体や脂肪酸を使用させて、自滅させるように仕掛けるのです。
ケトン体はモノカルボン酸トランスポーター(monocarboxylate transporters)の MCT1と2を使って、細胞質とミトコンドリアに入ることができます。
ケトン食はがん細胞の解糖系を阻害し、酸化的リン酸化を亢進する結果、ワールブルグ効果を是正して抗腫瘍効果を発揮します。
しかし、がん細胞はグルタミンの取込みを増やしてTCAでの物質代謝(脂肪酸合成など)を維持し、ケトン体もエネルギー源として利用しようとします。したがって、ケトン食単独では、抗腫瘍効果に限界があり、場合によってはがん細胞を助けることにもなります。
がん細胞におけるミトコンドリアでの酸化的リン酸化を亢進するときには、活性酸素の産生を高めるメトホルミンやレスベラトロール、抗酸化システムを阻害するジスルフィラムやオーラノフィン、解糖系を阻害する2-デオキシグルコースなどの併用が重要になります。
つまり、がん細胞の酸化ストレスを徹底的に高めることが重要です。中途半端では逆効果になる(がん細胞の増殖を促進する)ので、注意が必要です。(508話)
【がん細胞に酸化ストレスを高める治療とケトン食の併用効果について】
がん細胞に酸化ストレスを与えると細胞はダメージを受けます。このとき、グルコースが十分にあれば、解糖系で産生されるエネルギーとペントース・リン酸経路で生成されるNADPHによって酸化傷害に対して抵抗性と回復力を高めることができます。
NADPH(ニコチンアミドアデニンジヌクレオチドリン酸) は、細胞内の過酸化水素や過酸化脂質の消去に必要なグルタチオンの還元に必要です。つまり、がん細胞のグルコース供給が不十分でペントース・リン酸経路でのNADPHの生成が不足すると、還元型グルタチオンの量が不足して、酸化傷害で死にやすくなります。
ケトン食はがん細胞のグルコースの利用を妨げ、エネルギー産生やNADPH生成を減らすので、酸化ストレスが高くなると死滅することになります。
ケトン食の効果を高める2-デオキシ-D-グルコースの併用も有効です。2-デオキシ-D-グルコースは解糖系と同時にペントース・リン酸経路も阻害してHADPHの生成を減らします。
ペントース・リン酸経路では2カ所でNADPHが産生され、2-デオキシ-D-グルコース-6リン酸は最初のNADPH産生の代謝は受けますが2個目は反応が進まないため、NADPHの産生は半分になります。ただし、2-デオキシ-D-グルコース-6リン酸はヘキソキナーゼの活性を阻害するので、グルコース-6リン酸の生成を阻害するので、NADPHの産生を効率よく阻害することになります。(2-DGに関しては337話を参照)
高濃度ビタミンC点滴と解糖系を阻害する治療の併用が相乗効果で、非小細胞性肺がんのアポトーシスを促進することが報告されています。この2つの治療法の組合せが、がん細胞の酸化ストレスと高めてアポトーシスを誘導するという結果が報告されています。
Ascorbic acid and a cytostatic inhibitor of glycolysis synergistically induce apoptosis in non-small cell lung cancer cells.(アスコルビン酸と増殖抑制性の解糖系阻害剤は相乗的に作用して非小細胞性肺がんのアポトーシスを誘導する)PLoS One. 2013 Jun 11;8(6):e67081.
ケトン食は酸化ストレスを高めて肺がんの放射線化学療法の効果を高めるという論文が報告されています。以下のような報告があります。
Ketogenic diets enhance oxidative stress and radio-chemo-therapy responses in lung cancer xenografts.(ケトン食は移植肺がんの実験モデルにおいて、酸化ストレスと放射線化学療法の奏功率を高める)Clin Cancer Res. 2013 Jul 15;19(14):3905-13.
【要旨】
目的:ケトン食は脂肪が多く、糖質とタンパク質が少ない食事で、細胞のエネルギー(ATP)供給源を解糖系からではなく、脂肪酸の酸化とミトコンドリアでの呼吸によるATP産生を強制する食事である。
正常細胞に比べてがん細胞は、ミトコンドリアでの代謝によって慢性的な酸化ストレスの状態にあると考えられている。本研究では、移植肺がんの動物実験モデルを用いて、「ケトン食が酸化ストレスを高めることによって放射線化学療法(radio-chemo-therapy)の奏功率を高める」という仮説を検証した。
実験方法: NCI-H292とA549の2種類の肺がん細胞株を移植したマウスを通常食かケトン食(脂肪:タンパク質+糖質のカロリー比が4:1)で飼育し、通常の分割照射(1回1.8~2グレイ)か少分割照射(1回6グレイ)か通常の分割照射にカルボプラチンを併用した治療を行った。
マウスの体重と腫瘍のサイズを測定した。腫瘍組織の酸化ストレスのレベルは過酸化脂質生成物のヒドロキシノネナールで修飾されたタンパク質の量で、細胞増殖の程度はPCNA(proliferating cell nuclear antigen:増殖性細胞核抗原)の量で、DNAダメージの程度はリン酸化ヒストンH2AX(γH2AX)の量で、それぞれ評価した。
結果:NCI-H292細胞とA549細胞を移植したマウスの両方において、放射線治療単独群に比べて、放射線治療とケトン食を併用した群の方が、腫瘍の増殖速度はより低下した(P < 0.05)。
放射線治療とカルボプラチンの化学療法を併用した場合も、ケトン食を与えた群の方が通常食(コントロール)群より腫瘍の増殖速度が低下した。放射線治療とケトン食を併用したマウスの腫瘍組織では、ヒドロキシノネナールで修飾されたタンパク質の量で測定される脂質酸化による酸化障害の程度が高く、PCNAの免疫染色で評価される細胞増殖のレベルは低下した。
結論:これらの実験結果は、肺がんを移植したマウスの実験系において、ケトン食は酸化ストレスを高めることによって、放射線化学療法の効果を高めることを示している。
この結果は、放射線治療や抗がん剤治療を受けているときのケトン食の有効性を示唆しており、さらに抗酸化力を低下させるために2-デオキシグルコースやオーラノフィンやジスルフィラムを併用するとさらに効果が高まる可能性を示唆しています。(オーラノフィンとジスルフィラムについては509話参照)
がん細胞により選択的に酸化ストレスを高める方法と、がん細胞の還元型グルタチオンの量を減らす方法を組み合わせれば、がん細胞の増殖抑制やがんの縮小効果が期待できます。そのような方法として、中鎖脂肪ケトン食、2-デオキシ-D-グルコース、ジクロロ酢酸ナトリウム、メトホルミン、オーラノフィン、ジスルフィラム、アルテスネイト、高濃度ビタミンC点滴、半枝蓮などの組合せが想定されます。
実際にこのような組合せで多くのがん患者さんを治療していますが、副作用はあまり経験しません。抗腫瘍効果も確認しています。
がん細胞は酸化ストレスを避けるためにいろんな手段を使っているようです。ミトコンドリアの活性を抑えたり、グルタチオンの産生を増やしたりしています。グルコースの取込みを亢進して解糖系とペントースリン酸回路を亢進しているのも酸化ストレスの軽減に役立っています。
このようながん細胞の代謝の特徴をターゲットにすれば、がん細胞を自滅に追いやることができます。

図:がん細胞の代謝の特徴であるワールブルグ効果(解糖系の亢進と酸化的リン酸化の抑制)を正常化し、がん細胞の酸化ストレスを高める方法として、がん細胞の解糖系やペントース・リン酸回路を阻害するケトン食と2-デオキシグルコース(2-DG)、ワールブルグ効果を引き起こしてる低酸素誘導因子-1(HIF-1)を阻害するシリマリンとジインドリルメタン、ミトコンドリアでの代謝を促進するジクロロ酢酸、呼吸鎖を阻害して活性酸素の産生を高めるメトホルミンやレスベラトロール、細胞質でフリーラジカルを産生するアルテスネイトや半枝蓮や高濃度ビタミンC点滴、グルタチオンやチオレドキシンによる抗酸化システムを阻害するオーラノフィンやジスルフィラムがある。さらに、メトホルミンはグルタミンの利用を阻害し、PPARリガンドのベザフィブラートとケトン食とメトホルミンとレスベラトロールはミトコンドリア新生を促進して活性酸素の産生を増やす。これらを組み合わせると、がん細胞のエネルギー産生と物質合成を阻害し、さらに酸化ストレスを高めてがん細胞を死滅させることができる。
先週の日曜日(11月20日)に韓国のソウルで「がん細胞の代謝をターゲットにしたがん治療」に関する講演を行いました。韓国のClinical Society for Integrative Oncology(CSIO)が主催する全国学術研究セミナーです。CSIOは標準治療(手術や抗がん剤や放射線治療)に加えて、漢方治療や食事治療やサプリメントなどを加えた統合的ながん治療を目指している学会です。
発表したスライドと内容は以下のサイトで公開しています。
http://www.ketogenic-diet.org/cancer-metabolism-targeting-therapy/Warburg-effect.html
ブドウ糖を絶てばがん細胞は死滅する
今あるがんが消えていく「中鎖脂肪ケトン食」
 (詳しくはこちらへ)
(詳しくはこちらへ)
画像をクリックするとサイトに移行します。
| « 516)酸化スト... | 518) がん細胞... » |





