がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
662)メラトニンとがん治療(その2):メラトニンは放射線や抗がん剤の治療効果を高める
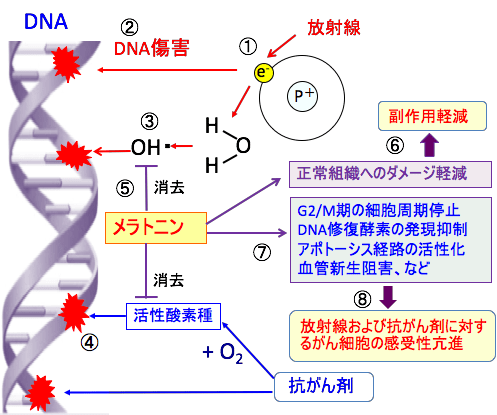
図:放射線がDNAを構成する分子の電子をはじき飛ばす(電離)ことによって(①)、分子間の結合を切断して直接的にDNAを傷害する(②)。さらに、放射線は組織の水分子(H2O)を電離してヒドロキシルラジカル(OH・)を発生し、このヒドロキシルラジカルがDNA分子に間接的にダメージを与える(③)。抗がん剤の多くも、細胞死を誘導する過程で活性酸素の発生が関与している(④)。メラトニンは強力な抗酸化作用とフリーラジカル消去活性を持つ(⑤)。その結果、正常組織へのダメージを軽減して副作用を軽減する(⑥)。一方、メラトニンは活性酸素の産生量を減らす作用はあるが、がん細胞に対してG2/M期の細胞周期停止、DNA修復酵素の発現抑制、アポトーシス経路の活性化、血管新生阻害などの作用によって(⑦)、放射線および抗がん剤に対するがん細胞の感受性を亢進する(⑧)。したがって、メラトニンは放射線治療と抗がん剤治療と併用して、副作用を軽減し、抗腫瘍効果を高めることができる。
662)メラトニンとがん治療(その2):メラトニンは放射線や抗がん剤の治療効果を高める
【メラトニンはユニークな性質を有する最強の抗酸化物質】
メラトニンが強力な抗酸化作用とフリーラジカル消去作用を有することは前回(661話)解説しました。
メラトニンは、睡眠を誘導し、概日リズムを制御する松果体ホルモンとして、1958年に単離されました。
メラトニンの抗酸化作用が指摘されたのは1993年です。メラトニンがヒドロキシル・ラジカルの強力な内因性の消去物質であることが以下の論文で報告されました。
Melatonin : a potent, endogenous hydroxyl radical scavenger(メラトニン:強力な内因性のヒドロキシル・ラジカル消去剤)Endocrine Journal (1993)1:57-60
その後多くの研究で、メラトニンが生物最古の抗酸化物質であること、他の抗酸化物質と異なるユニークな性質を有することが明らかになっています。
メラトニンは細菌や藍藻から、真菌や線虫や昆虫や植物やヒトまでほとんどの生物に存在しています。生物が酸素を利用するようになった25億年前から存在していることが指摘されています。
約25億年前に光合成を行うシアノバクテリアが出現し、地球上の大気に酸素の量が増え、酸素を使ってエネルギーを産生する好気性細菌が出現します。このようにして生物が酸素を利用するようになったとき、発生する活性酸素の害を消去する目的でメラトニンが生成されるようになったと考えられています。つまり、メラトニンは生物最古の抗酸化剤です。
そして、生物の進化の過程で、抗酸化作用以外の様々な機能(概日リズムの制御、免疫調節など)を新たに獲得して生物に利用されています。
抗酸化物質としてはビタミンCやビタミンE、グルタチオンなどよりも強力で生物学的に有用な性質を持っています。
通常の抗酸化物質は1分子が1分子のフリーラジカルを消去するのに、メラトニンは1分子が10分子くらいのフリーラジカルを消去します。これは、メラトニンがフリーラジカルと反応して生成する産物が、さらにフリーラジカル消去活性を示すというカスケード反応を示すからです。
メラトニンは、ヒドロキシルラジカル(HO·)、過酸化水素(H2O2)、スーパーオキシド・アニオン(O2-)などの活性酸素、一酸化窒素(NO)やパーオキシナイトライト(ONOO-)などの一酸化窒素ラジカルを消去します。
そして、これらのフリーラジカルと反応して生成するcyclic 3‐hydroxymelatonin (C‐3HOM) 、N1‐acetyl‐N2‐formyl‐5‐methoxy‐knuramine (AFMK), N‐acetyl‐5‐methoxy‐knuramine (AMK)などもフリーラジカル消去活性を有します。
C‐3HOM や AMK はメラトニンよりもフリーラジカル消去活性が強いと言われています。
このようなカスケード反応によって、メラトニン1分子は10分子程度のフリーラジカルを消去することができます。つまり、活性酸素や一酸化窒素ラジカルや脂質ラジカルなどのフリーラジカルと反応して生成されたメラトニン代謝産物がさらにフリーラジカル消去活性を持つのです。これをメラトニンカスケードと言います。
メラトニンは太古に発生した単細胞生物から現代の哺乳類や高等植物までの全ての生物において、生物を酸化ストレスから守る生体物質と言えます。

図:メラトニンとその代謝産物によるフリーラジカル消去のカスケード反応(cascade reaction)。R・はフリーラジカルでRHは還元された物質を示す。メラトニンとフリーラジカルが反応してできた代謝産物もフリーラジカル消去活性を持つ。したがって、1分子のメラトニンは10分子におよぶフリーラジカルを消去できる。
AMCC: 3-acetamidomethyl-6-methoxycinnolinone
AMNK: N1-acetyl-5-methoxy-3-nitrokynuramine
(参考:Molecules. 2015 Oct 16;20(10):18886-906. )
米国では、1994年から1995年にかけて「メラトニ ンフィーバー」と呼ばれるような社会現象が起こりました。1995年には「The Melatonin Miracle」などのメラトニンに関する書籍が出版され、Newsweekにも取り上げられ、 スーパーマーケットやドラッッグストアーにメラトニンが所狭しと陳列されていました。
メラトニンは ヒトの睡眠誘導作用を持つことから、夢の 睡眠薬として不眠症に悩む多くのアメリカ人の注目を集めました。
メラトニンの抗老化作用や寿命延長作用も誇大広告気味に宣伝されていました。
このようなメラトニンフィーバーに対して、メラトニンの効能に対して懐疑的な意見も多く発表されています。
しかし、25億年くらい前に生物が酸素を利用するようになったときに、活性酸素による酸化傷害から生命体を守るためにメラトニンが生成されるようになったこと、細菌から人間まで存在すること、動物と植物のミトコンドリアで生成され、ミトコンドリアを様々なストレスや傷害から保護していること、さらに免疫機能や炎症反応の調節や概日リズムの調節など、多彩な生理機能にメラトニンが関わっていることが明らかになり、メラトニンの健康作用や抗がん作用がさらに注目されるようになっています。
【放射線照射と抗がん剤の多くは細胞内の酸化ストレスを高めてがん細胞を死滅させている】
さて、放射線治療ががん細胞を死滅するメカニズムの一つは放射線が活性酸素を産生するためです。
放射線治療による副作用も、放射線照射によって発生する活性酸素が正常細胞にダメージを与えるためです。
したがって、メラトニンの抗酸化作用は、放射線治療の副作用を軽減することは直ぐに理解できます。
しかし、がん細胞に対する放射線の効き目を弱めるのではないかという疑問も出てきます。通常、抗酸化剤は放射線照射によるがん細胞を死滅作用を阻害することが知られています。
そこで、メラトニンと放射線治療との併用が有益なのかどうかを検討する必要があります。
結論は、現時点の研究結果をまとめると、「メラトニンは放射線照射や抗がん剤治療の効き目を高め、副作用を軽減する効果がある」ということになります。その理由を以下に解説します。
がん細胞に対する放射線治療の効果は、主に細胞のDNA分子の傷が多く蓄積することによって現れます。
DNA傷害に際しては、放射線が直接DNA鎖を傷害する直接作用と、 DNA近傍で発生する活性酸素(ヒドロキシル・ラジカル)を介してDNA鎖を傷害する間接作用の二つが関係していると考えられています。
さらに、タキサン系(パクリタキセル、ドセタキセルなど)、ビンカアルカロイド(ビンブラスチン、ビンクリスチン、ビンデシン、ビノレルビン)、白金製剤(シスプラチン、カルボプラチン)、アントラサイクリン系(ドキシルビシン、エピルビシン、アムルビシン、ブレオマイシン、マイトマイシンCなど)、イリノテカンなど多くの抗がん剤においても、細胞に傷害を与え、細胞死(アポトーシス)が実行される過程で活性酸素種が関与しています。(下図)
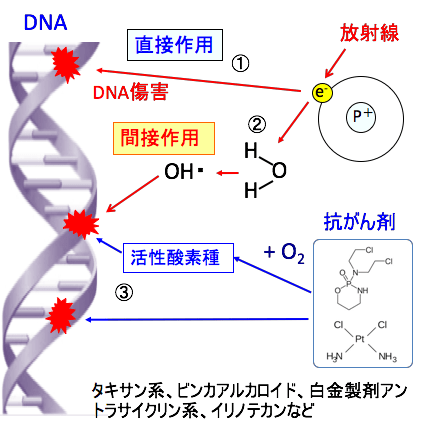
図:放射線がDNAを構成する分子の電子をはじき飛ばす(電離)ことによって、分子間の結合を切断して直接的にDNAを傷害する(①)。さらに、放射線は組織の水分子(H2O)を電離してヒドロキシルラジカル(OH・)を発生し、このヒドロキシルラジカルがDNA分子に間接的にダメージを与える(②)。抗がん剤の多くも、細胞死を誘導する過程で活性酸素の発生が関与している(③)。
例えば、シスプラチン(cisplatin : CDDP)は白金錯体に分類される抗がん剤で、多くの種類のがんの治療薬として使用されています。
シスプラチンは、DNAの構成塩基であるグアニンとアデニンに結合します。2つの塩素原子部位でDNAと結合するため、DNA鎖内には架橋(クロスリンク)が形成され、その結果、DNAの複製を阻害したり、mRNAの転写を阻害して、細胞にダメージを与え、死滅させます。がん細胞だけでなく、細胞分裂している正常細胞の分裂も阻害するため、副作用も非常に強い薬です。
シスプラチンの抗がん作用のメカニズムは、前述のようにDNAに付加体を結合させることによるDNAの複製や転写の阻害がメインだと考えられていました。
しかし、最近の研究では、シスプラチンの抗がん作用はDNAに結合することより、細胞内で酸化ストレスを高める機序の関与が大きいと考えられています。その理由は、シスプラチンの抗がん作用は抗酸化剤の投与で減弱すること、シスプラチン耐性細胞では抗酸化システムの増強が起こっていること、などが明らかになっているからです。
細胞内でDNA結合のシスプラチンはわずか(10%以下)であって、大半はDNAに結合せずに、活性酸素の産生を高めて、タンパク質やDNAの傷害を引き起こしていることが報告されています。このように、細胞質内のシスプラチンが活性酸素を産生して、酸化ストレスを高めていることが、最近の多くの研究で明らかになっています。
培養がん細胞にシスプラチンを添加すると細胞周期の停止や細胞死(アポトーシス)の誘導が起こりますが、抗酸化剤のN-アセチルシステインを加えるとシスプラチンの増殖抑制作用が阻止されることが示されています。
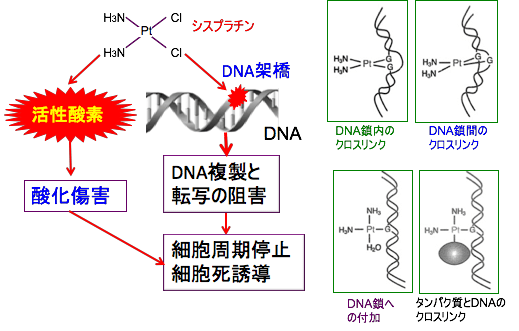
図:シスプラチンの2つの塩素(Cl)原子が、DNAの塩基の水酸基に結合し、DNA鎖内に架橋(クロスリンク)が形成され、DNAの複製やmRNAの転写を阻害して細胞にダメージを与え、細胞周期の停止(増殖抑制)と細胞死(アポトーシス)を誘導する。さらにシスプラチンは細胞内で活性酸素の産生を高め、酸化傷害によって細胞の増殖を抑制し細胞死を誘導する。最近の研究では、シスプラチンの殺細胞作用は、DNAのクロスリンクより活性酸素の産生を高めて細胞傷害を引き起こす作用の方が大きいと考えられている。
【抗酸化剤は放射線や抗がん剤の抗腫瘍効果を弱める可能性がある】
抗酸化作用のあるサプリメントとして、抗酸化性ビタミン(ビタミンA、ビタミンC、ビタミンE、カロテノイド、コエンザイムQ10、αリポ酸など)やミネラル(セレン)やその他の抗酸化剤(カテキン、フラボノイド、グルタチオン、N-アセチルシステイン、メラトニンなど)など多数の成分が販売され、がんの治療にも利用されています。
これらの中には、抗酸化作用以外の効能も持つために、総合的にがん治療にメリットのあるものも多くあります。
例えば、メラトニンは免疫増強作用や直接的な抗がん作用を持ち、抗がん剤や放射線治療や免疫療法との併用での有用性が多数の臨床試験で示されています。
カテキンやフラボノイドなどのポリフェノール類も、抗酸化作用以外の抗がん作用があるので、がん治療に併用する有用性があります。
がん治療と抗酸化剤の関係では、抗酸化作用が主体のビタミンA、ビタミンC、ビタミンE、カロテノイド、グルタチオン、N-アセチルシステインなどが議論の対象になっています。
放射線治療中や抗がん剤治療中の抗酸化剤の併用の是非に関しては、20年以上前から議論されていますが、いまだにコンセンサスは得られていません。放射線と抗がん剤の抗腫瘍効果と副作用の両方にフリーラジカルが関与するため、抗酸化剤は副作用を軽減する効果が期待できる一方、がん細胞に対する放射線や抗がん剤の効き目を弱める可能性もあるからです。
この問題に関する論文の総説では、「併用を懸念する」意見の論文が多いようです。
たとえば2008年のJ Natl Cancer Instという学術雑誌に掲載された論文(Should supplemental antioxidant administration be avoided during chemotherapy and radiation therapy? J Natl Cancer Inst. 100(11):773-783, 2008)では、それまでに報告された臨床試験をもとに、「抗がん剤や放射線治療中の抗酸化剤の併用は、がん細胞を保護し抗がん作用を弱める可能性があるので推奨できない」という結論になっています。
抗酸化剤ががん細胞の増殖を促進することも報告されています。
Antioxidants accelerate lung cancer progression in mice.(マウスにおいて抗酸化剤は肺がんを促進する)Sci Transl Med. 2014 Jan 29;6(221):221ra15. doi: 10.1126/scitranslmed.3007653.
【要旨】
活性酸素種によって引き起こされるダメージから細胞を守る目的で抗酸化剤が広く利用されている。
抗酸化剤ががん治療に役立つという考えが一般の人々に広く認識され、サプリメント関連の企業によって宣伝され、幾つかの科学的研究で支持されている。
しかしながら、臨床試験の結果は相反しており一致していない。
がん遺伝子のB-RASとK-RASで誘導した肺がんのマウスの実験モデルにおいて、抗酸化剤のN-アセチルシステインとビタミンEは腫瘍の増殖を促進し、生存期間を短縮した。
N-アセチルシステインとビタミンEは構造は全く異なるが、遺伝子発現の解析の結果、この両者は腫瘍組織内の内因性の抗酸化酵素の発現を減少させた。
ヒトとマウスの肺がん細胞において、N-アセチルシステインとビタミンEは活性酸素種(ROS)を減少し、DNA傷害を減らし、p53の発現を抑制した。
この実験系でp53の活性を阻害すると、抗酸化剤投与と同じレベルで腫瘍の増殖を亢進した。
このように、抗酸化剤は活性酸素種とp53の関連を妨げることによって腫瘍の増殖を促進した。
p53遺伝子の変異は発がん過程の遅い段階で起こるので、抗酸化剤摂取は発がん段階の初期や前がん状態での腫瘍化進展を促進する可能性がある。
このように、がん治療中の抗酸化剤の使用は、副作用を軽減するメリットはありますが、治療効果を妨げるデメリットがある可能性が指摘されています。
しかし、抗酸化剤による放射線治療や抗がん剤治療への影響は、抗酸化剤の種類によって大きく異なります。
例えばメラトニンに関しては、その強力な抗酸化作用があるにも拘らず、放射線照射や抗がん剤治療の効き目を高めるという研究結果が数多く報告されています。
【メラトニンは様々なメカニズムで放射線治療の効果を高める】
前述のようにメラトニンは非常に強力な抗酸化作用・フリーラジカル消去作用を持っています。抗酸化作用・フリーラジカル消去作用は放射線照射の抗がん作用を弱める可能性があります。しかし、メラトニンは様々な機序での抗がん作用を有しており、その結果、むしろ放射線治療の効果を高めることが明らかになっています。
以下のような報告があります。
Melatonin Sensitizes Human Colorectal Cancer Cells to γ-ray Ionizing Radiation In Vitro and In Vivo.(メラトニンは、in vitroおよびin vivoにおいてヒト大腸がん細胞をγ線電離放射線に対する感受性を高める)Int J Mol Sci. 2018 Dec 10;19(12). pii: E3974. doi: 10.3390/ijms19123974.
【要旨】
結腸直腸がんは最も多い消化管腫瘍であり、年間発生率が世界中で最近急速に増加している。がん細胞の放射線感受性を高めながら、正常細胞のダメージを軽減することは、臨床放射線生物学における最も重要な課題の1つである。
しかしながら、結腸直腸がん細胞の放射線療法に対する耐性は、治療結果を大幅に低下させる。脳の松果体が生成するメラトニン(N-アセチル-5-メトキシトリプタミン)は、抗がん作用を有することが報告されている。
この研究では、大腸がんの治療としてメラトニンと放射線療法の併用の有効性を検討した。
まず、in vitroで大腸がん細胞に対する電離放射線とメラトニンを併用した場合の抗腫瘍活性を検討した。
メラトニンは、電離放射線照射後のヒト結腸直腸がん細胞株HCT 116の細胞増殖、コロニー形成率および細胞遊走数を効果的に阻害した。
メラトニンによる結腸直腸がん細胞の放射線感受性の増加は、G2 / M期の細胞周期停止、DNA二本鎖切断修復に関与するタンパク質の発現低下、およびカスパーゼ依存性アポトーシス経路の活性化に関連していた。
さらに、in vivoでの大腸がんに対する電離放射線とメラトニンの併用効果も検討した。
異種移植腫瘍を使った実験の結果は、メラトニンまたは電離放射線をそれぞれ単独で治療した場合と比較して、メラトニンと電離放射線の併用治療が、腫瘍抑制率がはるかに高いことを示した。
これらの実験結果は、メラトニンと電離放射線を組み合わせることにより、結腸直腸がん細胞の放射線感受性を改善し、その結果、患者の治療効果を高めることができることを示唆した。
つまり、メラトニンはがん細胞の放射線感受性を高める機序で、放射線治療の効き目を高めるという報告です。以下のような報告もあります。
Melatonin as an adjuvant in radiotherapy for radioprotection and radiosensitization.(放射線防護および放射線増感のための放射線療法の補助療法としてのメラトニン)Clin Transl Oncol. 2019 Mar;21(3):268-279.
【要旨】
がん患者の半数以上が、治療中に放射線療法を受けていると推定されている。腫瘍細胞に対する有益な治療効果にもかかわらず、高線量の電離放射線への曝露はいくつかの副作用と関連している。
放射線療法の技術と機器の改善により、これらの副作用を軽減できる可能性があるが、がん患者には依然として重要な懸念事項である。電離放射線に対するがん組織および正常組織への作用を制御することによって治療効率を高めようとしている。これまでに、いくつかのタイプの放射線防護剤および放射線増感剤が実験研究で検討されてきた。
しかし、化学増感剤の高い毒性または放射線防護剤によるがん細胞保護の可能性は、それらの臨床応用を困難にしている。一方、これらの放射線防護剤の防護効果または放射線増感剤の増感剤効果により、ある種のがんに対する治療効果が高まる場合がある。
したがって、腫瘍細胞に対する保護作用がない放射線防護剤、または低毒性の放射線増感剤の開発は、副作用を軽減し、治療効率の改善に役立つ。
天然の生体ホルモンであるメラトニンは、いくつかの機序による抗がん作用を有する強力な抗酸化剤および抗炎症剤である。 メラトニンは電離放射線によって生成する様々なタイプのフリーラジカルを消去し、また電離放射線の照射によって活性化される酸化促進酵素によって生成されるフリーラジカルの産生を阻止する。これらは、電離放射線に対する正常組織の保護に重要な役割を果たす。
さらに、メラトニンはさまざまなレベルで炎症反応の長期的な変化を阻害する作用があり、それにより放射線療法の晩期後遺症の発生を予防する。
幸いなことに、古典的な抗酸化物質とは対照的に、一部のin vitro研究では、メラトニンが放射線照射と併用すると強力な抗腫瘍活性を持つことが明らかになっている。ただし、その放射線感受性効果のメカニズムはまだ解明されていない。
研究では、p53などのプロアポトーシス遺伝子の活性化、腫瘍細胞の代謝の変化、DNA修復反応の抑制、および乳がん細胞におけるエストロゲンの生合成の変化がこのプロセスに関与していることが示唆されている。このレビューでは、メラトニンの放射線防護および放射線増感剤効果の分子メカニズムについて説明する。さらに、関与する可能性のあるいくつかの他の提案されたメカニズムが提示される。
まだ正確なメカニズムは解明されていませんが、メラトニンは放射線治療の副作用を軽減し、抗腫瘍効果を高める効果があるようです。抗腫瘍効果を高めるメカニズムとして、p53などのプロアポトーシス遺伝子の活性化、腫瘍細胞の代謝の変化、DNA修復反応の抑制など様々なメカニズムが関与しているようです。
前述の2つの論文は最近の論文です。つまり、メラトニンは、放射線治療の副作用を軽減する放射線防護剤と、抗腫瘍効果を高める放射線増感剤の2つの作用を持つ物質として最近注目されていることを示しています。
【メラトニンは血管新生を阻害する】
血管新生阻害作用は放射線治療や抗がん剤治療の効き目を高めます。メラトニンは血管新生阻害作用があります。
メラトニンの血管新生阻害作用が最初に報告されたのは2001年です。以下の論文で、メラトニンの血管新生阻害作用が指摘されました。
Anti-angiogenic activity of melatonin in advanced cancer patients.(進行がん患者におけるメラトニンの抗血管新生活性)Neuro Endocrinol Lett. 2001;22(1):45-7.
【要旨】
目的:メラトニンの抗がん活性は、その免疫調節作用、増殖抑制作用および抗酸化作用に起因すると説明されているが、腫瘍播種の主な生物学的メカニズムである血管新生に対する作用についての研究は現時点では見当たらない。血管内皮増殖因子(VEGF)は最も活性な血管新生因子であり、VEGFの血中濃度の高値とがん患者における予後不良が関連することが証明されている。血管新生に対するメラトニンの影響を検討するために、この予備研究では、進行がん患者のVEGF血中濃度に対するメラトニン投与の効果を検討した。
材料と方法:この研究には20人の転移がん患者を対象とした。これらの患者はこれまでに従来の抗腫瘍療法を受けており、他の有効な治療法がない状態の患者であった。メラトニンは少なくとも2か月間、夕方に20 mg /日で経口投与された。VEGFの血清レベルは、15日間隔で集められた静脈血サンプルについて酵素免疫測定法によって測定された。
結果::臨床反応は、2人に軽度の反応(minor response)、6人に病状安定(stable disease)、および残りの12人の患者はがんの進行(progressive diseasse)であった。 VEGF値の平均は治療によって減少したが、治療前の値に対して統計的な差はなかった。
しかし、臨床反応に関連してVEGFレベルの変化を評価すると、非進行患者(軽度の反応 + 病状安定)はVEGFの平均濃度の有意な減少を示したが、がんの進行を認めた患者ではVEGFの減少は認めなかった。
結論:この研究は、メラトニンによるがん細胞の増殖の抑制がVEGF分泌の減少と関連していることを示しており、メラトニンが血管新生阻害物質として、がん細胞の増殖抑制に関わっている可能性を示唆している。
まだ可能性の段階ですが、メラトニンが血管内皮増殖因子(VEGF)の産生を抑制して血管新生を阻害する作用を指摘しています。その後も、メラトニンの血管新生阻害作用に関する報告は多数あります。最近の総説で以下のような論文があります。
Melatonin as an angiogenesis inhibitor to combat cancer: Mechanistic evidence.(がんと戦うための血管新生阻害剤としてのメラトニン:メカニズム的証拠)Toxicol Appl Pharmacol. 2017 Nov 15;335:56-63.
【要旨】
松果体から産生されるインドールアミンであるメラトニンは、さまざまな身体機能に関与し、抗腫瘍作用などの多様な生物学的活性を有することが示されている。血管新生阻害は、メラトニンがその抗腫瘍効果を発揮するメカニズムの1つである。
血管新生の増加は腫瘍進行の主な特徴であり、したがって血管新生阻害はがん治療における重要なステップである。メラトニンは、がん細胞への栄養素と酸素供給を標的にするためにさまざまなメカニズムで作用している。転写レベルでは、低酸素誘導因子-1α(HIF-1α)およびその制御下にある遺伝子、例えば血管内皮増殖因子(VEGF)は、血管新生の阻害のためのメラトニンの主な標的である。
メラトニンは、HIF-1αの核内への移行を妨げ、それによってVEGFの発現を妨げ、また血管新生関連遺伝子の発現に関与するHIF-1α、リン酸化-STAT3およびCBP / p300複合体の形成も妨げる。
メラトニンの血管新生抑制作用はまた、VEGFR2の活性化および発現を阻害する作用も関与している。
さらに、メラトニンのその他の血管新生抑制メカニズムには、内皮細胞遊走と浸潤と脈管形成の阻害が含まれる。本研究では、メラトニンによって媒介される血管新生阻害の経路と、in vitroとin vivoの両方における様々な種類のがんにおける原因となる血管新生阻害のメカニズムを検討した。
メラトニンは低酸素誘導因子-1αの活性化を阻害します(後述)。その結果、血管内皮増殖因子(VEGF)の発現を抑制して、血管新生を阻害するという機序です。
Melatonin Enhances the Usefulness of Ionizing Radiation: Involving the Regulation of Different Steps of the Angiogenic Process.(メラトニンは電離放射線の有用性を高める:血管新生プロセスの様々な段階での制御の関与)Front Physiol. 2019 Jul 11;10:879.
【要旨の抜粋】
放射線療法はがん治療の一つである。その有効性を改善するために、血管新生阻害剤などの放射線増感剤と組み合わされている。メラトニンの抗腫瘍作用のメカニズムには、血管新生阻害作用がある。この研究の目的は、メラトニンが血管内皮細胞の電離放射線に対する感受性に影響するかどうかを調べることである。
メラトニン(1 mM)は、細胞増殖、遊走、および脈管ネットワーク形成など血管新生過程の様々な段階における放射線照射による阻害作用を強化した。
メラトニンの血管新生阻害作用は、AKTおよびERK経路、血管内皮細胞の成長、細胞増殖、生存、移動、および血管新生に関与するタンパク質を介して媒介される可能性がある。
放射線は血管新生においていくつかの副作用があり、腫瘍縮小効果に対する有効性を低下させる可能性があり、メラトニンはこれらの放射線の負の作用を阻止することができる。
さらに、メラトニンは、血管新生プロセスのいくつかのステップで放射線による血管新生阻害作用を強化し、その抗腫瘍作用を強化した。我々の発見は、メラトニンががん治療における放射線療法の補助として有用な分子であることを示している。
メラトニンは血管新生を様々なレベルで阻害する作用があり、その結果、放射線治療の効果を増強するということです。
【低酸素になると低酸素誘導因子-1(HIF-1)が活性化される】
生物は外界の酸素濃度を認識する巧みな仕組みを保持しています。酸素濃度が低下すると、生物は低酸素シグナルを活性化し低酸素状態に適応します。
この低酸素応答の中心的分子が低酸素誘導因子-1(Hypoxia inducible factor-1: HIF-1) およびプロリル・ヒドロキシラーゼ(prolyl hydroxylase)と呼ばれるタンパク質です。
HIF-1は、細胞が酸素不足に陥った際に誘導されてくる転写因子です。αとβの2つのサブユニットからなるヘテロ二量体であり、βサブユニットは定常的に発現して細胞核にいますが、 HIF-1αは細胞質で酸素濃度依存的な分解を受けます。
すなわち、HIF-1αは、正常酸素濃度下では、HIF-1αタンパク質中の2カ所のプロリン残基がプロリル・ヒドロキシラーゼにより水酸化されることによりVHL(von Hippel-Lindau)タンパク質が結合します。
VHLが結合するとHIF-1αのユビキチン化が促進されて26Sプロテアソームで分解されます。したがって、酸素が十分にある状況ではHIF-1は不活性の状態に維持されます。
VHLはフォンヒッペル・リンドウ(von Hippel-Lindau)病の原因遺伝子として発見されています。
フォンヒッペル・リンドウ病は常染色体優性遺伝疾患で、脳・脊髄・網膜の血管芽腫や腎臓がんや褐色細胞腫などの腫瘍が多発します。VHLたんぱく質が欠損するとHIF-1αが分解されないので、HIF-1転写活性が亢進した状態になり、VEGF(血管内皮細胞増殖因子)のタンパク量が増え、血管の豊富な腫瘍が発生します。
プロリル・ヒドロキシラーゼ(prolyl hydroxylase)は酸素濃度感受性のタンパク質で、酸素濃度が低下するとプロリル・ヒドロキシラーゼの酵素活性が著しく低下します。すると、HIF-1αのプロリン残基の水酸化が起きないので、HIF-1αは分解を受けずに安定化します。安定化したHIF-1αは核内に移行し、HIF-1βと二量体を形成して低酸素応答配列(Hypoxia Responsive Element)に結合して、低酸素応答に必要な様々な遺伝子の発現を活性化します。
すなわち、HIF-1は各種解糖系酵素、グルコース輸送蛋白、血管内皮細胞増殖因子(VEGF)、造血因子エリスロポイエチンなど、 多くの遺伝子の発現を転写レベルで制御し、細胞から組織・個体にいたる全てのレベルの低酸素適応反応を制御しています(下図)。

図:酸素濃度が高い状態では、HIF-1αは酸素濃度感受性タンパク質のプロリル・ヒドロキシラーゼによって水酸化され、VHL(von Hippel-Lindau)タンパク質が結合して26Sプロテアソームで分解される。低酸素状態ではプロリル・ヒドロキシラーゼの活性が低下してHIF-1αの分解が阻止されるので、蓄積したHIF-1αは核内に移行してHIF-1βとヘテロダイマー(ヘテロ二量体)を形成して遺伝子の低酸素応答配列に結合し、コアクチベーター(CBP/p300)やRNAポリメラーゼがリクルートされて、低酸素状態の適応に必要な様々な遺伝子の発現を誘導する。
【メラトニンは低酸素誘導因子-1の活性化を阻止する】
HIF-1αは解糖系酵素の発現を亢進してがん細胞のエネルギー産生に影響します。すなわち、解糖系に関与する10種類の酵素のうち9種類がHIF-1αによって制御されています。
HIF-1αはピルビン酸脱水素酵素キナーゼの発現を誘導することによってピルビン酸脱水素酵素(ピルビン酸からアセチルCoAを作る酵素)を阻害し、ミトコンドリアでの酸化的リン酸化を阻害します。
したがって、HIF-1αの活性を低下させ、核への移行を阻止し、HIF-1αの転写活性を抑制すれば、ワールブルグ効果や血管新生を抑制できます。
HIF-1α誘導性のVEGF発現誘導をメラトニンが阻害することが多くの研究で示されていますが、その分子メカニズムに関しては幾つかの説があります。
他の多くの抗酸化剤と異なり、メラトニンには脳や様々な末梢組織の細胞の細胞膜に受容体が存在します。
すなわち、メラトニンには、受容体に依存性の作用と非依存性の作用が知られています。
メラトニンには受容体とは非依存性の機序で、腎臓がん細胞において、HIF-1αの分解を促進してタンパク量を減らし、血管新生阻害作用を示すことが報告されています。
このHIF-1αとVEGFの発現を抑制するメラトニンの作用は、主に受容体非依存性の抗酸化作用が関連しています。抗酸化作用によって、メラトニンはHIF-1αたんぱく質の分解を促進します。
メラトニンはフリーラジカルを消去することによって、活性酸素によるPHD酵素の不活性化(PHD酵素の二価鉄イオンを酸化することによって)を阻止し、HIF-1αの分解を亢進してHIF-1αの量を減らします。
すなわち、メラトニンはHIF-1αのmRNA量には影響せず、HIF-1αの核への移行を阻止し、HIF-1αとそのco-activatorであるCBPとp300の相互作用を阻害します。
VEGF遺伝子のプロモーター領域のHREにおいて、HIF-1αとコアクチベーターの結合を阻害する作用も知られています。
メラトニンには免疫増強作用やがん細胞の直接的な抑制作用がありますが、がん細胞のHIF-1αの分解を促進してワールブルグ効果と血管新生を阻害する効果もメラトニンの抗腫瘍効果のメカニズムとして重要です。最近の報告として以下のような論文があります。
Melatonin restricts the viability and angiogenesis of vascular endothelial cells by suppressing HIF-1α/ROS/VEGF.(メラトニンは、HIF-1α/ ROS / VEGF経路を抑制することによって血管内皮細胞の生存と血管新生を阻止する)Int J Mol Med. 2019 Feb;43(2):945-955.
【要旨】
血管新生は、胎盤形成を含む様々な生理的過程、ならびにがんおよび子宮内膜症を含む病的過程に関与する必須の過程である。メラトニンは、主に松果体から分泌される天然ホルモンであり、血管新生の制御に関わり、肺がんや乳がんを含む様々ながんの発生の抑制に関与している。しかしながら、その抗血管新生作用の具体的なメカニズムは十分に解明されていない。
本研究では、正常酸素圧または低酸素下でのヒト臍帯静脈内皮細胞の生存率および血管新生に及ぼすメラトニンの作用、ならびに血管内皮成長因子(VEGF)および活性酸素種(ROS)の産生に対するメラトニンの影響を分析した。
低酸素条件下では、ヒト臍帯静脈内皮細胞からの血管内皮成長因子(VEGF)が有意に増加したが、メラトニンは低酸素下での血管内皮成長因子の分泌と活性酸素種の産生を抑制した。
さらに、メラトニンは用量依存的にヒト臍帯静脈内皮細胞の生存率を抑制し、低酸素/ 血管内皮成長因子 / H2O2によって誘導された細胞生存率および脈管形成の増加を抑制した。
さらに、低酸素誘導因子-1α(HIF−1α)の阻害剤(KC7F2)およびメラトニンの2剤での処置は、ヒト臍帯静脈内皮細胞からの活性酸素種および血管内皮成長因子(VEGF)の放出を相乗的に減少させ、そして細胞生存率および血管形成を阻害した。
これらの結果は、メラトニンが抗酸化剤およびフリーラジカル捕捉剤として、血管形成の阻害において二重の役割を果たし得ることを実証する。メラトニンは、HIF-1α/ ROS /VEGFの下方制御を介してヒト臍帯静脈内皮細胞の生存率および血管新生を抑制する。まとめると、本研究結果は、メラトニンが豊富な血管を有する固形腫瘍における潜在的な抗がん剤であり得ることを示しており、特にHIF-1α阻害薬のKC7F2と組み合わせることにより抗腫瘍効果が高まる。
【メラトニンはがん細胞のアポトーシスを誘導する】
以下のような論文があります。
Modulation of apoptosis by melatonin for improving cancer treatment efficiency: An updated review.(がん治療の効果を改善するためのメラトニンによるアポトーシスの調節:最新のレビュー)Life Sci. 2019 Jul 1;228:228-241.
【要旨】
放射線療法および化学療法は、最も一般的ながん治療法である。これらは正常組織に急性および後期の副作用を引き起こすので、腫瘍細胞に高線量の放射線の照射または高用量の薬物の投与を妨げている。さらに、腫瘍細胞は放射線と化学療法に対して適応性のある応答を達成し、治療に対する抵抗性を獲得し、再増殖する。
放射線療法と化学療法に対する抵抗性は、免疫細胞だけでなく他の腫瘍微小環境中の細胞による多数の細胞間および細胞内メディエーターの放出が原因である適応反応の後に発生する。
メラトニンは、放射線と化学療法の毒性副作用から保護する強力な天然抗酸化剤および抗炎症剤である。さらに、一部のがん細胞では、メラトニンががん細胞の治療に対する感受性を高める。
アポトーシスは、放射線照射と抗がん剤投与後の細胞死の主要なメカニズムの1つである。腫瘍細胞におけるアポトーシス誘導は、がん細胞の増殖を抑制し、個体の生存率を高める。
メラトニンは、ミトコンドリア、Bax、Bcl-2、内因性活性酸素種、アポトーシス受容体などのいくつかのメディエーターの制御を通じてアポトーシスを促進する。
このレビューの目的は、放射線および化学療法薬への曝露後のアポトーシス誘導のメカニズムを説明することである。また、アポトーシスシグナル伝達経路に対するメラトニンの調節効果を検討した。
以下のような報告もあります。
Melatonin Enhances Cisplatin and Radiation Cytotoxicity in Head and Neck Squamous Cell Carcinoma by Stimulating Mitochondrial ROS Generation, Apoptosis, and Autophagy.(メラトニンは、ミトコンドリアの活性酸素種生成、アポトーシス、およびオートファジーを刺激することにより、頭頸部扁平上皮癌のシスプラチンおよび放射線細胞毒性を増強する)Oxid Med Cell Longev. 2019 Feb 28;2019:7187128.
【要旨】
頭頸部がんは、世界中では6番目に多いがんである。残念ながら、多くの患者は薬剤耐性と再発によって従来の治療法は失敗することが多い。したがって、副作用を増強することなく、従来の治療法の抗腫瘍効果を高めるために、新しい治療標的および薬物を見つけることが重要である。
作用メカニズムと必要な用量は不明のままであるが、メラトニンは腫瘍増殖抑制効果がある。この研究の目的は、がん細胞に対する細胞毒性を高めるメラトニンの作用機序を明らかにすることであり、放射線および化学療法に耐性となるプロセスを阻止するための新しいメラトニン治療を提案することである。
頭頸部扁平上皮がん細胞株(Cal-27およびSCC-9)に対するメラトニンの効果を検討した。これらの細胞は、0.1、0.5、1、および1.5 mMのメラトニンと8Gyの照射または10μMのシスプラチンノ組み合わせで処理された。
治療の細胞毒性効果やオートファジーおよびアポトーシスに対する作用を評価した。ミトコンドリア機能は、ミトコンドリア呼吸、ミトコンドリアDNA含有量、およびミトコンドリア重量を測定することにより評価された。活性酸素種生産、抗酸化酵素活性、およびGSH / GSSGレベルは蛍光法を使用して分析した。
高濃度のメラトニンは、頭頸部扁平上皮がん細胞における放射線照射とシスプラチンの細胞毒性効果を増強することを示した。この作用はミトコンドリア機能の亢進と関連していた。
頭頸部扁平上皮がん細胞では、メラトニンが細胞内の活性酸素種の産生を誘導し、その蓄積がミトコンドリアを介したアポトーシスとオートファジーを引き起こす。我々の発見は、メラトニンが高濃度で、シスプラチンや放射線療法と組み合わせてその有効性を改善することは、潜在的な補助剤であることを示している。
メラトニンの免疫増強作用については454話で解説しています。
リンパ球を刺激する作用があるため、自己免疫疾患(慢性関節リュウマチなど)や悪性リンパ腫や白血病など免疫細胞の腫瘍の場合は、メラトニンの服用は病気を悪化させる可能性があるため使用できません。血液凝固を抑える作用があるため、血液凝固に異常がある場合や、ワーファリンのような血液凝固を阻害する薬を服用中は注意が必要です。
血圧を低下させる作用があるため、降圧剤を服用中は注意して服用します。
これらの点に注意していれば、副作用はほとんど無く、がん治療にメラトニンの使用はメリットが高いと言えます。がん治療には1日1回、就寝前に10〜40mgを目安に服用します。
| « 661)メラトニ... | 663)β-カリオ... » |



