がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
341)抗がん剤/放射線+2-デオキシグルコース→抗腫瘍免疫誘導
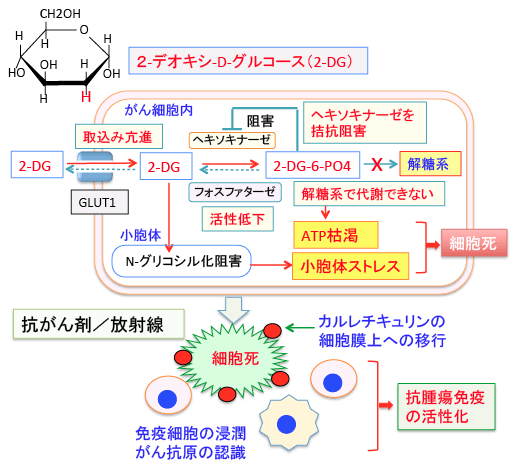
図:2-デオキシ-D-グルコース(2-DG)はグルコース(ブドウ糖)の2位のOHがHに変わっているグルコース類縁物質で、グルコースと同様にグルコーストランスポーター(GLUT1)によって細胞内に取り込まれてヘキソキナーゼで2-DG-6リン酸になるが、それから先の解糖系には進めない。さらに2-DG-6リン酸はヘキソキナーゼを阻害するので、解糖系でのATP産生を阻害する。さらに、2-DGは小胞体でのタンパク質のN-グリコシル化(糖鎖の結合による修飾)を阻害し、小胞体ストレスを引き起こす。この状態で、抗がん剤や放射線でがん細胞にダメージを与えると、小胞体のカルレチキュリンというタンパク質が死滅したがん細胞の細胞膜上に移行して「ダメージ関連分子パターン(danger-associated molecular patterns:DAMP)」として免疫細胞に認識され、抗腫瘍免疫が活性化される。
341)抗がん剤/放射線+2-デオキシグルコース→抗腫瘍免疫誘導
【抗がん剤治療に2-デオキシグルコースを併用すると抗腫瘍免疫が誘導される】
放射線やある種の抗がん剤でがん細胞が死滅すると、この死滅したがん細胞によって免疫細胞が刺激され、がん細胞に対する免疫応答が誘導されます。
したがって、抗がん剤治療や放射線治療の時に、適切な漢方薬やサプリメントを使って免疫細胞を活性化すると、がん細胞を排除する免疫応答を増強できます。
つまり、免疫力を高める漢方薬やサプリメントを抗がん剤治療や放射線治療に併用する目的は、副作用の軽減だけでなく、抗腫瘍免疫の増強効果もあります。
このとき、2-デオキシ-D-グルコースを併用すると、抗腫瘍免疫(がん細胞を排除する免疫応答)をさらに増強できる可能性があります。以下のような論文があります。
Combination of glycolysis inhibition with chemotherapy results in an antitumor immune response.(抗がん剤治療に解糖系阻害を併用すると抗腫瘍免疫応答が引き起こされる)PNAS 109 (49): 20071-20076, 2012年
【要旨】
細胞のDNAにダメージを与える抗がん剤の多くは、抗腫瘍免疫を誘導する作用がある。解糖系の亢進はがん細胞の最も良く知られた特徴の一つである。そこで、解糖系を阻害する2-デオキシグルコース(2-DG)と細胞傷害性の抗がん剤を併用した場合、抗腫瘍免疫の誘導にどのような影響を及ぼすかを検討した。
2-DGと抗がん剤のエトポシドは、免疫機能の正常なマウスにおいては相乗的に作用して寿命を延長した。しかし、免疫機能不全のマウスに対しては寿命延長効果は認められなかった。
2-DGとエトポシドの両方を投与したマウスにおいてのみ、がん細胞特異的なT細胞の十分な活性化が認められた。
さらに、2-DGとエトポシドの両方の処理によって死滅したがん細胞をマウスに免疫すると、同じ腫瘍の再度の移植に対して拒絶した。
この効果の少なくとも一部は、細胞膜上のERp57/calreticulinの出現が関連していた。
これらの結果は、がん細胞の解糖系をターゲットにすると、死滅がん細胞による通常の免疫寛容誘発性の刺激を、腫瘍免疫誘発性の刺激に変換できることを示している。このメカニズムを利用すると免疫化学療法の新しい戦略を作りだすことができる。
この論文が発表されたPNASは「Proceedings of the National Academy of Sciences of the United States of America」の略で、日本語訳は「米国科学アカデミー紀要」と言い、自然科学分野ではNatureやScienceと並んで非常に権威の高い学術雑誌です。
最近、がん細胞の解糖系の阻害を目標にしたがん治療が注目されており、2−デオキシ-D-グルコース(2-DG)の抗腫瘍効果に関する論文が増えています。2-DGの論文がPNASに掲載されたということも、2-DGの抗がん作用がそれだけ注目されていることを示しています。
以下この論文のイントロダクションの部分を日本語訳しておきます。
[イントロダクション]
がん細胞の性質は多様で不均一であるが、ほとんどのがん細胞に共通しているのは、エネルギー産生(ATP産生)をミトコンドリアにおける酸化的リン酸化ではなく、細胞質における解糖系に依存していることで、これはワールブルグ効果(Warburg effect)として知られている。
がん細胞のエネルギー産生におけるこの特徴を利用して、多くの研究者は解糖系の阻害剤を新しいがん治療薬として開発しようとしている。
解糖系阻害剤の一つが、代謝されないグルコース類縁物質の2-デオキシグルコース(2-DG)である。
2-DGはグルコースと同じトランスポーター(輸送担体)で取り込まれるので、細胞内の取込みの段階でグルコースの拮抗阻害剤として作用する。
細胞内では、ヘキソキナーゼによってリン酸化されて、2-デオキシグルコース-6リン酸(2-DG-6リン酸)に変換されるが、この2-DG-6リン酸は解糖系の先の代謝系には進めない(ヘキソキナーゼの先の解糖系酵素で代謝できない)ので、ATP産生量が減る。
(この論文には記述されていないが、蓄積した2-DG-6リン酸はヘキソキナーゼを阻害する作用もある)
さらに、2-DGはタンパク質のN-グリコシル化(N-glycosylation)を阻害するので小胞体ストレス応答を誘導する。
2-DGは動物実験や臨床試験で多くの検討が行われており、がん患者への使用においても十分に耐え得ることが示されている。
ある種の抗がん剤が、腫瘍特異的な免疫応答を誘導するようながん細胞の死(immunogenic cancer cell death)を誘導することは、多くの実験で示されている。このようながん細胞に対する免疫応答の誘導は、抗がん剤耐性のがん細胞やがん幹細胞の排除に役立つ。
しかしながら、腫瘍免疫を十分に刺激できる細胞死(免疫原性の高い細胞死)を誘導できるのは、がん治療に使われている抗がん剤のうち一部しかない(主に、アントラサイクリンとガンマ線照射)。
この免疫原性の高い細胞死は、死滅したがん細胞がカルレチキュリン(calreticukin)を含むダメージ関連分子パターン(danger-associated molecular patterns:DAMP)を細胞膜に発現させている場合に誘導される。
死滅したがん細胞の表面にDAMPが露出していると、このDAMPが樹状細胞のような抗原提示細胞に認識され、がん細胞特異的な抗腫瘍免疫が誘導される。
この研究においては、解糖系の阻害剤とDNA傷害性の抗がん剤を併用したときに、その抗腫瘍効果を高めることができるかどうかを検討した。
細胞の代謝経路をターゲットにする分子は多数あるが、がんの治療薬として検討されているのは少数しかない。グルコース代謝の阻害が細胞傷害性薬剤(=抗がん剤)の細胞死誘導作用を増強することが多くの研究で示されている。
本研究では、この組合せ(解糖系阻害剤+抗がん剤)が、抗腫瘍免疫応答を十分に誘導できることを示し、がん細胞の代謝が抗腫瘍免疫と関連している可能性を指摘した。
【2-DG+抗がん剤は細胞障害性T細胞を活性化する】
この論文では、悪性リンパ腫を発症するように遺伝子を改変したマウスや悪性リンパ腫細胞を移植したマウスの実験系を用いて検討しています。
悪性リンパ腫を発症したマウスに抗がん剤としてエトポシドを用いた治療を行っています。2-DG単独ではわずかな抗腫瘍効果しかみとめませんでしたが、エトポシドと併用すると、エトポシドの抗がん作用を相乗的に増強しました。
悪性リンパ腫の増大によって30日程度で死ぬような実験系で、2-DG単独投与では生存期間を延ばす効果はありませんでした。抗がん剤のエトポシドで治療を行ったマウスは最大84日まで生存期間が延びました。
エトポシドに2-DGを併用したマウスでは147日まで生存期間が延長しました。つまり、エトポシド単独での治療の場合より、エトポシド+2-DGのマウスでは43%も生存期間を延長できたという結果が示されています。
さらに、免疫機能が正常なマウスと免疫不全のマウスを使ってエトポシド+2-DGの効果を比較しています。
エトポシド単独の場合は、免疫系が正常なマウスと免疫不全のマウスの両方において、同等の延命効果が認められました。しかし、エトポシド+2-DGの抗腫瘍効果は免疫不全マウスよりも免疫機能が正常なマウスで顕著に認められました。
免疫機能が正常なマウスでは、2-DGとエトポシドを併用した場合には、リンパ節の腫瘍細胞にCD8+の細胞障害性T細胞(cytotoxic T cell)の浸潤が顕著に認められました。
そこで培養リンパ球を使った実験や移植腫瘍の実験などをいろいろと行い、次のようなメカニズムを提唱しています。
①2-DGは糖タンパク質のN-グルコシル化を阻害することによって小胞体ストレスを引き起こす。
②2-DGによって小胞体ストレスが起こった状態でエトポシドで細胞死が起こると、カルレチキュリン(calreticukin)を含むダメージ関連分子パターン(danger-associated molecular patterns:DAMP)が細胞膜に発現させて、免疫原性が高まる。
③死滅したがん細胞の表面にDAMPが露出していると、このDAMPが樹状細胞のような抗原提示細胞に認識され、さらに細胞障害性T細胞を活性化して、がん細胞特異的な抗腫瘍免疫が誘導される。
つまり、抗がん剤でがん細胞を死滅させるときに2−DGを投与しておくと、死滅したがん細胞は免疫原性が高くなるので、がん抗原特異的な抗腫瘍免疫を誘導でき、延命効果を高めることができるというメカニズムです。
【2-DGはダメージ関連分子パターンの発現を高める】
細胞の死に方にもいろいろあるようです。
体を構成する正常細胞は毎日約200分の1の細胞がアポトーシスで死滅し、組織幹細胞が細胞分裂して組織の細胞を供給しています。
このような生理的な死に対して、体がいちいち反応して炎症や免疫応答を行えば、大変なことになります。しかし、このような生理的な細胞死は、炎症や免疫応答を引き起こさない死に方をするので、問題は起こりません。
一方、何らかのダメージやストレスで細胞が傷害されたときは、それを認識して対応する必要があります。
例えば、神経が熱や痛みを感じるようになっているのは、体に危害を与える傷害を認識してそれを避ける必要があるからです。
同様に、細胞がダメージを受けたとき、そのような細胞からは通常であれば細胞内に隠れている成分が放出され、炎症細胞や免疫細胞を活性化するメカニズムが存在します。
このような炎症を引き起こす細胞内にある成分をDAMPs(damage-associated molecular patterns; ダメージ関連分子パターン)と総称しています。細胞傷害に伴って細胞から放出され、周囲の組織や細胞に危険を知らせるアラームのような役割を担う因子のことです。
DAMPsが細胞外や細胞膜上に露出するような細胞死が起こると、炎症反応が引き起こされ、ダメージを受けた組織の修復が起こります。このメカニズムは自己免疫疾患などの慢性炎症性疾患の原因ともなります。
しかし、抗がんや放射線を使ったがん治療の場合は、このダメージ関連分子パターン(DAMPs)を誘導する細胞死のメカニズムを利用すると、がん特異免疫を増強できることが知られています。
つまり、放射線照射や一部の抗がん剤が免疫原性の高い細胞死を誘導することが知られており、このような細胞死をもっと効率的に行う手段があれば、がん治療の効果を高めることができます。
DAMPsは、細胞質や核やミトコンドリアや小胞体などに存在する成分が放出されたもので、炎症細胞や免疫細胞を刺激します。例えば、ミトコンドリアのATP, DNA, フォルミルペプチド、核のヒストンやHigh-mobility group box 1 protein(HMGB1)、High-mobility group nucleosome binding protein 1(HMGN1)、細胞質のATPやF-アクチン、小胞体のカルレチキュリン(Calreticulin)などが知られています。(下図)

2-DGと抗がん剤を併用した場合は、小胞体のカルレチキュリン(Calreticulin)というタンパク質が細胞膜上に露出して免疫原性を高めるという結果が報告されています。
小胞体(Endoplasmic reticulum)細胞内における分泌・膜タンパク質の品質管理において大切な小器官です。
カルレチキュリンは、小胞体内腔における主要なカルシウム結合(蓄積)タンパク質として機能する多機能タンパク質です。分子シャペロンとして分泌タンパク質の品質管理の働きも行っています。また核では転写調節の働きを行っています。
2-DGは解糖系を阻害する以外に、タンパク質に糖鎖が着くN-グリコシル化の過程を阻害するので、糖タンパク質の生成を阻害します。
グリコシル化というのはタンパク質に糖類が付加する反応で、小胞体で行われて、正常に糖が付加したタンパク質はゴルジ体に運ばれます。
糖鎖異常の糖タンパク質は小胞体に蓄積して小胞体ストレスを引き起こし、細胞死の原因にもなります。(小胞体ストレスについては298話参照)
2-DGの場合は、糖タンパク質のグリコシル化が阻害され、小胞体ストレスが起こり、その状態で死滅すると死滅した細胞の細胞膜の表面にカルチキュリンが移行してダメージ関連分子パターンとなり、免疫細胞を活性化する結果、抗腫瘍免疫が活性化されるということです。
抗がん剤治療や放射線治療のときに、2-デオキシグルコースを摂取すると、がん細胞の解糖系を阻害してエネルギー産生阻害の観点から抗腫瘍効果を高めると同時に、ダメージ関連分子パターンを誘導して、抗腫瘍免疫を増強し、免疫監視機構を介したがん細胞の排除も期待できるということになります。
| « 340)大豆製食... | 342)がんとケ... » |



