がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
805)がん細胞のフェロトーシス誘導(その4):まとめ
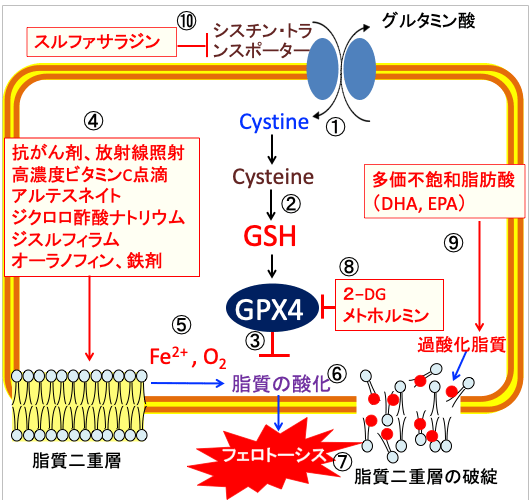
図:シスチン・トランスポーターはシスチン/グルタミン酸交換輸送体とも呼ばれ、細胞内のグルタミン酸との交換により細胞外のシスチン(Cystine)を細胞内に輸送する(①)。シスチンはグルタチオンの構成成分であるシステイン(Cysteine)が2個結合したアミノ酸で、シスチンが細胞内に取り込まれると、システインに変換されて還元型グルタチオン(GSH)の合成が増える(②)。グルタチンペルオキシダーゼ4(GPX4)は細胞膜の脂質の酸化を防ぐ(③)。抗がん剤、放射線照射、高濃度ビタミンC点滴、アルテスネイト、ジクロロ酢酸ナトリウム、ジスルフィラム、オーラノフィン、鉄剤は活性酸素の産生を増やし(④)、二価の鉄イオン(Fe2+)と酸素(O2)が介在した機序で(⑤)、脂質酸化を促進し(⑥)、脂質二重層の破綻によってフェロトーシスによって死滅する(⑦)。2-デオキシ-D-グルコース(2-DG)とメトホルミンはATPとNADPHの産生を減らしてグルタチンペルオキシダーゼ4(GPX4)の活性を低下する(⑧)。ドコサヘキサエン酸(DHA)とエイコサペンタエン酸(EPA)は多価不飽和脂肪酸で酸化されやすいので、細胞膜の脂質過酸化を促進する(⑨)。スルファサラジンはシスチン・トランスポーターの働きを阻害してグルタチオンの合成を阻害する(⑩)。これらを組み合わせると、がん細胞に選択的にフェロトーシスによる細胞死を誘導できる。
805)がん細胞のフェロトーシス誘導(その4):まとめ
【活性酸素は細胞を傷害する】
酸素の働きの一つに「酸化」というものがあります。鉄くぎがいつのまにか赤くさびたり、ゴムが古くなると弾力を失ってボロボロになったりするのも酸化の結果です。私たちの体内でも、呼吸によって取り入れられた酸素の一部が「活性酸素」と呼ばれる酸化力の強い分子に変化し、細胞を酸化することによって、がんや動脈硬化など多くの病気の原因となっています。機械もサビついてくると故障が多くなるのと同じことです。
全ての物質は原子からできています。原子というのは物質を構成する最小の単位であり、原子核を中心にその周りを電気的に負(マイナス)に帯電した電子が回っているという形で現されます。
通常、電子は一つの軌道に2個づつ対をなして収容されますが、原子の種類によっては一つの軌道に電子が一個しか存在しないことがあります。このような「不対電子」を持つ原子または分子をフリーラジカル(遊離活性基)と定義しています。
本来、電子は軌道で対をなっている時がエネルギー的に最も安定した状態になります。そのためにフリーラジカルは一般的には不安定で、他の分子から電子を取って自分は安定になろうとします。フリーラジカルとは、不対電子をもっているために、非常に反応性の高まっている原子や分子なのです。
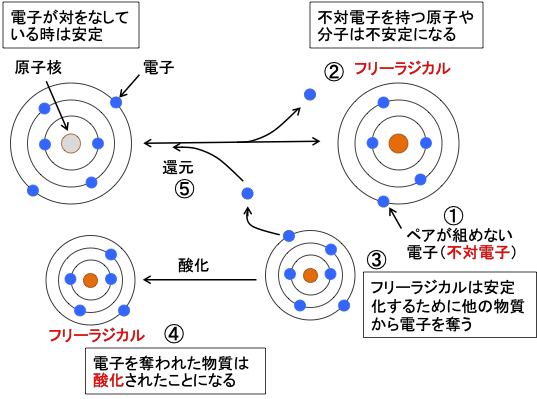
図:不対電子(①)をもつ原子や分子はフリーラジカルと呼ばれ(②)、他の物質から電子を奪おうとする(③)。電子を奪われた物質は酸化されたことになる(④)。電子を受け取ると還元されたことになる(⑤)。
「酸化」するというのは活性酸素やフリーラジカルが、ある物質の持っている電子を奪い取ることを意味します。酸化の本来の定義は「電子を奪うこと」なのです。
一方、ある物質が別の物質から電子をもらうことを「還元」といいます。フリーラジカルというのは、言い換えれば相手の電子を奪う(酸化する)性質が非常に強い性質のものです。

図:ある物質が水素(電子)を奪われると「酸化された」という。逆に、水素(電子)を与えられると「還元された」という。体内ではこの電子のやり取りが繰り返し行われている。
DNAから電子が奪われると誤った遺伝情報が作られ、がん細胞の発生につながります。DNA以外にも、体の土台をなしている蛋白質や脂肪からも電子を奪い酸化して細胞の機能の障害を引き起こし、ひいては組織や臓器の機能の低下を招いて、がんになりやすい体になるのです。
私たちが呼吸によって取り込んだ酸素がエネルギーを産生する過程でスーパーオキシド・ラジカルという活性酸素が発生します。ふつうの酸素分子は16個の電子の持っていますが、スーパーオキシド・ラジカルは17個の電子をもっており、そのうち1個が不対電子になりフリーラジカルとなるのです。
スーパーオキシド・ラジカルは体内の消去酵素(スーパーオキシド・ディスムターゼ、略してSOD)によって過酸化水素(H2O2)に変わり、過酸化水素はカタラーゼという消去酵素によって除去されます。
しかし、スーパーオキシドや過酸化水素の一部は鉄イオンや銅イオンと反応して、ヒドロキシルラジカル(・OH)が発生します。本来、鉄や銅などの遷移金属はタンパク質を結合して存在しますが、がん組織や炎症が起こっている部位ではこれらの遷移金属はイオンの形で存在するようになり、これら遷移金属イオンが触媒となって、大量のヒドロキシラジカルが産生されるようになるのです。
ヒドロキシルラジカルも一つの不対電子をもっており、その酸化力は活性酸素のなかで最も強力で、細胞を構成する全ての物質を手当たりしだいに酸化して障害を起こします。
また、誘導型一酸化窒素合成酵素(iNOS)によって炎症細胞から産生される一酸化窒素(NO)とスーパーオキシド・ラジカル(O2-)が反応すると、ペルオキシナイトライト(・ONOO2-)という酸化力の強いフリーラジカルが発生します。ペルオキシナイトライトは炎症疾患における組織の酸化障害や発がん促進の原因となります。

図:酸素(O2)がエネルギーを産生する過程や酵素反応や炎症などで1電子還元されて スーパーオキシド(O2-)が発生する(①)。スーパーオキシドは体内の消去酵素(スーパーオキシド・ディスムターゼ)によって過酸化水素(H2O2)に変わり(②)、過酸化水素はカタラーゼやグルタチオン・ペルオキシダーゼという消去酵素によって水(H2O)と酸素(O2)に変換されて無毒化される(③)。スーパーオキシドや過酸化水素の一部は鉄イオンや銅イオンと反応して、ヒドロキシルラジカル(・OH)が発生する(④)。さらに、誘導型一酸化窒素合成酵素によって炎症細胞から産生される一酸化窒素(NO)とスーパーオキシドが反応すると、ペルオキシナイトライト(・ONOO2-)という酸化力の強いフリーラジカルが発生する(⑤)。ヒドロキシルラジカルとペルオキシナイトライトは細胞や組織を酸化してダメージを与える(⑥)。
【活性酸素を利用してがん細胞を死滅する】
体内で発生する活性酸素は、体の構成成分を酸化することによって、老化を促進し、動脈硬化性疾患やがんなど多くの疾患の原因となっています。また、慢性関節リュウマチや潰瘍性大腸炎などの自己免疫疾患や慢性炎症性疾患では、組織の炎症によって産生される活性酸素が疾患の進行や増悪を引き起こしています。したがって、一般的に活性酸素は体に有害と言えます。
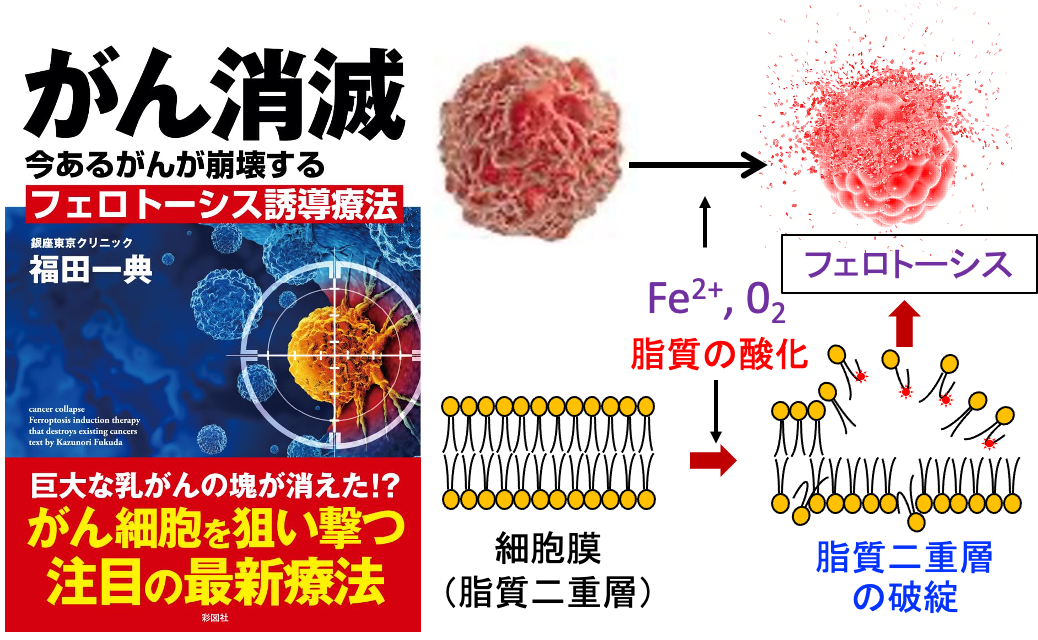
一方、がん治療においては、がん細胞を死滅する手段として活性酸素を利用する方法が研究されています。すなわち、がん細胞内に活性酸素を増やし、細胞膜の脂質の酸化を促進してフェロトーシスのメカニズムでがん細胞を死滅する治療法です。
そもそも放射線治療と一部の抗がん剤(ビンブラスチン、シスプラチン、マイトマイシンC、ドキソルビシン、カンプトテシンなど)は、がん細胞に酸化傷害を引き起こして細胞にダメージを与えて死滅させます。
このような治療に対して、がん細胞は抗酸化酵素を誘導したりグルタチオンの産生量を増やして、細胞の酸化傷害に対する抵抗性を高めます。これが、薬剤耐性の一つのメカニズムになっているので、抗酸化酵素の誘導やグルタチオンの産生を阻害すると、これらの治療に対する効果を高め、さらに抵抗性獲得を阻害することができます。
放射線治療や抗がん剤治療以外で、がん細胞に活性酸素の発生量を増やす方法として、高濃度ビタミンC点滴、アルテスネイト、ジクロロ酢酸ナトリウムなどがあります。
高濃度ビタミンC点滴は、1 回に50~100グラムという大量のビタミンCを1~3 時間かけて点滴するという治療法です。がん細胞に取込まれたビタミンCが過酸化水素を発生することで細胞にダメージを与えます。ビタミンCはブドウ糖を構造が似ており、同じ糖輸送担体( グルコーストランスポーター) によって細胞内に取込まれます。がん細胞はブドウ糖の取込みが亢進しているので、大量のビタミンCががん細胞に取込まれ、がん細胞が選択的に死滅させることができるという治療法です。
アルテスネイト(Artesunate)は中国で古くからマラリアなどの感染症の治療に使われていた青蒿(セイコウ:Artemisia annua)というキク科の薬草から分離された成分で、現在ではマラリアの特効薬として使用されています。アルテスネイトは分子の中に鉄イオンと反応してフリーラジカルを産生するendoperoxide bridge を持っています。がん細胞は鉄を多く取り込んでいるので、その鉄と反応してフリーラジカルを産生してがん細胞を死滅させるという作用機序が提唱されています。(図)

図:がん細胞は細胞内に鉄を多く含む(①)。アルテスネイトは分子内にエンドペルオキシド・ブリッジ(endoperoxide bridge)を持つ(②)。このエンドペルオキシド・ブリッジは細胞内の鉄と反応してフリーラジカルを産生し、フェロトーシスの機序で細胞死を誘導する(③)。一方、正常細胞は鉄の含有が少ないので、アルテスネイトによる細胞傷害を受けない(④)。
がん遺伝子のc-Mycや低酸素状態によって発現が誘導される低酸素誘導性因子1α(HIF−1α)という転写因子はトランスフェリンレセプターの発現を高めています。鉄は細胞増殖に必要なため、がん細胞はトランスフェリンレセプターを多く発現して鉄を多く取り込んでいます。細胞分裂の早いがん細胞ほど鉄を多く取り込んでいると言われています。したがって、がん細胞内の鉄と反応してフリーラジカルを発生するアルテスネイトは、正常細胞を傷つけずにがん細胞に選択的に障害を与えることができるのです。
ミトコンドリアにおける酸化的リン酸化が活性化して活性酸素の産生が高まるとがん細胞内で酸化ストレスが増大します。ピルビン酸脱水素酵素を活性化してピルビン酸からアセチルCoAへの変換を促進してTCA回路を回せば、酸化的リン酸化による活性酸素の産生が増え、酸化ストレスの増大によってがん細胞が死滅することが報告されています。ピルビン酸脱水素酵素を活性化する方法としてジクロロ酢酸ナトリウムがあります。
ジクロロ酢酸ナトリウム(sodium dichloroacetate)は酢酸(CH3COOH)のメチル基(CH3)2つの水素原子が塩素原子(Cl)に置き換わったジクロロ酢酸(CHCl2COOH)のナトリウム塩です。構造式はCHCl2COONaになります。
ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによってピルビン酸脱水素酵素の活性を高める作用があります。ミトコンドリアの異常による代謝性疾患、乳酸アシドーシス、心臓や脳の虚血性疾患の治療などに、医薬品として古くから(25年以上前から)使用されています。がん治療の場合は、体重1kg当たり10~15mgを水に溶かして服用します。

図:低酸素誘導因子-1(HIF-1)はピルビン酸脱水素酵素キナーゼの発現を誘導して(①)、ピルビン酸脱水素酵素(ピルビン酸をアセチルCoAに変換する)の働きを阻害するので(②)、ミトコンドリアでの酸化的リン酸化によるATP産生が抑制されている。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼの活性を阻害することによってピルビン酸脱水素酵素の活性を高め(③)、R体αリポ酸とビタミンB1はピルビン酸脱水素酵素の補因子として働き(④)、ピルビン酸脱水素酵素の活性を高めてピルビン酸からアセチルCoAの変換を促進し、TCA回路での代謝と酸化的リン酸化を亢進する(⑤)。ミトコンドリアでの酸化的リン酸化が亢進すると、活性酸素の産生が増え、乳酸産生が減少し、アポトーシスが起こりやすくなって、抗がん剤感受性が亢進する(⑥)。
【フェロトーシスは細胞膜の脂質の過酸化によって細胞を死滅する】
初期の生物の細胞膜は単純な飽和脂肪酸で構成されていたと思われますが、やがて不飽和脂肪酸が細胞膜に利用されるようになります。不飽和脂肪酸に二重結合を挿入するには酸素原子が必要なので、大気中に酸素が増え、酸化的代謝が盛んになるまでは不飽和脂肪酸は少なかったと思われます。細胞膜の不飽和脂肪酸は膜流動性の調節可能性を高めることを可能にし、生物が進化するために必要でした。
しかし、不飽和脂肪酸を有する細胞膜を有する生物にとって大気中の大量の酸素の存在は、デメリットもあります。不飽和脂肪酸は酸素の存在下で脂質過酸化を受けやすいからです。そしてこの過酸化反応は、二価金属、特に二価の鉄イオン(Fe2+)によって劇的に加速されます。
そこで、生物は酸素と鉄イオンによる細胞膜の酸化傷害を阻止するために、グルタチオンとグルタチオン・ペルオキシダーゼによる抗酸化システムを発達させました。
現在、複数の細胞死経路が発見されており、そのうちの1つがフェロトーシスです。フェロトーシスは2012年に発見され、鉄依存性で脂質過酸化反応によって制御される細胞死経路として説明されています。過去10年間で、フェロトーシスは腫瘍細胞死を誘発することが示されており、腫瘍治療の新しいアイデアを提供しています。
カスパーゼ依存性のアポトーシス誘導は、抗がん剤でがん細胞を殺すための最も重要な方法と長い間考えられていました。しかし、近年、がん細胞は薬剤に耐性があり、アポトーシスに対して一定の耐性があることが明らかになりました。したがって、他の形態の非アポトーシス細胞死を標的とすることは、がん細胞を排除し、がん細胞の薬剤耐性を克服するための新しい治療アプローチになりました。
脂質過酸化はフリーラジカルによって引き起こされる反応であり、主に細胞膜の多価不飽和脂肪酸に影響を及ぼします。多価不飽和脂肪酸は過酸化反応を起こしやすく、脂質二重層の破壊を引き起こし、膜機能に影響を及ぼします。脂質過酸化の生成物には、最初の脂質ヒドロペルオキシド(LOOH)とそれに続く反応性アルデヒド(例えば、マロンジアルデヒド(MDA)および4-ヒドロキシノネナール(4-HNE))が含まれ、これらはフェロトーシス中に増加します。
活性酸素種は細胞膜の多価不飽和脂肪酸の酸化を開始します。二価鉄イオン(Fe2+)の存在下で、フェントン反応によってヒドロキシルラジカルを生成します。ヒドロキシルラジカルは、多価不飽和脂肪酸から脂質ラジカルを形成し、分子状酸素(O2)は脂質ラジカルと迅速に反応して脂質ペルオキシラジカル(LOO .)を生成します。
増殖活性の高いがん細胞は、細胞膜のトランスフェリン受容体の発現量が増え、正常細胞に比べて鉄の取込みが増えています。さらに、細胞内の鉄イオンの調節に破綻をきたし、酸化還元活性のあるフリーの2価鉄(Fe2+)が過剰に存在する状況になっています。
【2価鉄イオン(Fe2+)はフリーラジカルを発生して細胞を傷害する】
鉄は様々な生体反応に必須の物質ですが、過剰になると活性酸素発生の触媒作用を発揮することによって細胞の酸化傷害を引き起こします。2価のフリーの鉄は過酸化水素(H2O2)と反応してより有毒なヒドロキシルラジカルを生じ(フェントン反応)、DNA障害、脂質酸化、細胞死などを引き起こします。
慢性炎症組織やがん組織では、この鉄イオンの調節に破綻をきたし、フリーの2価鉄(Fe2+)が過剰に存在する状況になっています。がん細胞内に過剰な2価鉄イオンが存在することを利用して、がん細胞を死滅させる治療がフェロトーシスの誘導です。
フリーの2価鉄は酸化還元活性があるので、過酸化水素(H2O2)と反応して酸化作用の強いヒドロキシルラジカル(・OH)を発生させ、さらに脂質と反応して脂質ラジカルを発生させて強い細胞傷害を引き起こします。
正常細胞に比べてがん細胞は、不安定鉄プールにおける2価鉄イオンの量が極めて多いので、2価鉄イオンと反応してヒドロキシルラジカルや脂質ラジカルを発生させる化合物は、正常細胞にダメージ(酸化傷害)を与えず、がん細胞に特異的にダメージを与えることができます。
【がん細胞がドコサヘサエン酸(DHA)を多く取り込むとフェロトーシスが起こりやすくなる】
がん細胞は細胞分裂をして数を増やし、増殖します。細胞数を増やすために、細胞膜に使う脂肪酸の合成が亢進しています。さらに、がん細胞は自分で作った脂肪酸以外に、食事から摂取して血液中に存在する脂肪酸を積極的に取り込んで、細胞膜の合成に使います。つまり、食事からのDHAやEPAの摂取を増やすと、がん細胞の細胞膜にDHAやEPAが多く取り込まれます。
EPAは二重結合が5個、DHAは二重結合が6個存在する多価不飽和脂肪酸です。不飽和脂肪酸は酸化されて過酸化脂質になります。
EPAやDHAは酸化されやすいので、鉄を多く含み、活性酸素の産生が増加しているがん細胞では、EPAとDHAは過酸化脂質を増やし、細胞膜の酸化障害を増強します。つまり、EPAやDHAを多く取り込んだがん細胞はフェロトーシスを起こしやすくなるのです。
抗がん剤の多くは、がん細胞に活性酸素を産生してフェロトーシスで最終的に死滅することが明らかになっています。したがって、食事からのDHAとEPAの摂取を増やすと、抗がん剤による細胞死を起こしやすくなります。
さらに、活性酸素の産生を高める高濃度ビタミンC点滴、アルテスネイト、ジクロロ酢酸ナトリウム、ジスルフィラム、オーラノフィン、鉄剤、グルタチオンの産生を阻害するスルファサラジン(サラゾピリン)、抗酸化システムのグルタチオン・ペルオキシダーゼ4の活性を抑制する2-デオキシ-D-グルコースとメトホルミンなどを併用すると、がん細胞に比較的選択的にフェロトーシスを誘導できます(トップの図)。
◉ がんのフェロトーシス誘導療法については以下のサイトで解説しています。
http://www.f-gtc.or.jp/ferroptosis-induction/ferroptosis.html
| « 804)がん細胞... | 806)再利用薬... » |