がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
806)再利用薬を用いた胆道がんの治療
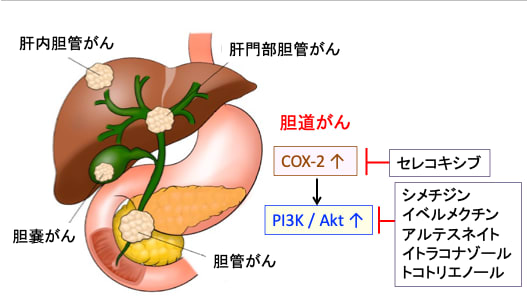
図:肝臓で作られる胆汁を十二指腸に運ぶ通路を胆道と言う。胆道にできるがんを胆道がんと言い、発生する場所によって肝内胆管がん、肝門部胆管がん、胆管がん、胆嚢がんなどに分けれ、発生する場所によって症状や手術法が異なる。しかし、がん細胞の性状は同様であり、抗がん剤治療に使われる薬剤やその効果(感受性)は似ている。すなわち、使用できる抗がん剤の種類は少なく、抗がん剤は効果が出にくい特徴がある。胆道がんの多くはシクロオキシゲナーゼ-2(COX-2)の活性が亢進し、PI3K/Akt経路が活性化している。COX-2 / PI3K / Akt経路を阻害する作用があるセレコキシブ、シメチジン、イベルメクチン、アルテスネイト、イトラコナゾール、トコトリエノールなどが「再利用薬を用いた胆道がんの治療」として報告されている。
806)再利用薬を用いた胆道がんの治療
【胆道は胆汁が流れる通路】
胆管は、肝臓の中に張り巡らされた細い管(肝内胆管)として始まり、それらが木の枝が幹に向かうように合流しながら次第に太くなって、肝臓からの出口(肝門部)で一本にまとまります。これを総肝管といいます。
総肝管は、胆のうとつながる胆のう管が合流して総胆管となり、膵臓の中を通って、膵液を運ぶ膵管とともに小腸の一部である十二指腸につながります。このつなぎ目が十二指腸乳頭です。肝臓の中の胆管を肝内胆管、肝臓の外の胆管を肝外胆管ともいいます。
肝内胆管と肝外胆管と胆のうと十二指腸乳頭を合わせて胆道と言います。つまり、胆道は肝臓で作られる胆汁を十二指腸に運ぶ通路です。
食べたものが十二指腸に届くと、胆のうに一時的にためられて濃縮された胆汁が、胆のう管、総胆管を通って十二指腸に送り出され、小腸での脂肪の消化を助けます。胆汁にはビリルビンという黄色の色素が含まれます。これが便と混じって排泄されるため、正常な便の色は茶褐色になります。

図:胆汁は肝臓で作られ、肝内胆管の左肝管と右肝管が肝門部で合流して総肝管になる。胆汁は胆のう(胆嚢)に一時的に貯留されて濃縮され、食事が十二指腸に入ってくると、胆のうが収縮して、胆汁が総胆管を通って膵液(膵管から合流)と一緒になって、十二指腸乳頭部から十二指腸に送り出される。
【胆道がんは治療が困難で、最近増えている】
胆道がんは、胆道にできるがんの総称で、発生した部位によって分類されます。胆管がんは、がんが発生した場所が肝臓の中か外かによって肝内胆管がんと肝外胆管がんに分類されます。さらに、肝外胆管がんは、胆管のどの部分に発生したかによって肝門部領域胆管がんと遠位胆管がんに分類されます。
肝内胆管がんは肝臓に発生するため、原発性肝がんに分類されますが、原発性肝がんの大部分を占める肝細胞がんと区別するために、胆管細胞がんともよばれます。肝臓の中に発生しますが、肝細胞がんとは性質が異なり、検査や治療法には肝外胆管がんと共通するものもあります。

図:肝内胆管がん(胆管細胞がん)は原発性肝臓がんに分類されるが、がん細胞の性状は肝外胆管がんや胆嚢がんと類似する。
最近のデータでは、胆嚢・胆管がんの死亡者数は 約18000 例で、乳頭部がんの死亡が約2800例、肝内胆管がんの死亡が約1200例と概算され、胆管系全体のがんの死亡者は年間22,000人程度と推測されています。
最近のデータでは、年間のがん死亡数(男女計)は、肺がん(75000)、大腸がん(54000)、胃がん(42000)、膵臓がん(38000)、肝臓がん(24000)、胆嚢・胆管がん(18000)の順です。6位です。
肝内胆管がんと乳頭部がんを加えると、肝細胞がん(肝臓がんから肝内胆管がんを差し引いたがん)と同じくらいになります。肝炎ウイルスの感染が減少しているので、肝細胞がんは年々減少しています。一方、胆道ガンが増加しているので、近いうちに膵臓がんに次いで5位になるのは確実です。
罹患数(発生数)では、大腸、胃、肺、前立腺、乳房、膵臓、肝臓、悪性リンパ腫、腎・尿路、子宮、食道、皮膚、膀胱、胆嚢・胆管の順で14位です。発生数が少ないのに死亡数が多いことは、胆道系のがんが難治性であることを意味します。
膵臓がんと同様に、解剖学的に早期診断が困難で、手術が困難な進行がんで見つかるのが多いという特徴があります。
手術ができる段階で見つかるのは20%程度です。腫瘍が限局していて手術で切除できても、再発が極めて高いのが特徴です。
5年生存率は局所限局型で6〜26%程度、転移がある状態では1-2%程度と、極めて予後の悪い悪性腫瘍です。
抗がん剤治療はゲムシタビン(gemcitabine)+シスプラチン( cisplatin)がファーストラインとして使用されています。しかし、切除不能あるいは転移がある症例では、gemcitabine + cisplatin治療での全生存期間の中央値は1年以下。つまり、半数以上が1年以内に死亡しています。
発生数自体が少ないので、抗がん剤治療の開発も遅れています。肺がんや乳がんや前立腺がんなど症例の多いがんでは毎年のように新薬がでていますが、胆道ガンの抗がん剤治療はゲムシタビン、シスプラチン、S1の単独あるいは併用療法が行われているくらいです。承認されている薬物は非常に少なく、すぐ手詰まりになります。
死亡数が多くても、症例数(発生数)が少なければ、製薬会社は新薬の開発のインセンティブが低いといえます。そこで、医薬品の再利用によるがんの代替療法では、胆管がんがよく対象になっています。
新薬開発研究の行き詰まりを打開する方法として,ドラッグ・リポジショニング(Drug Repositioning)あるいはドラッグ・リパーポジング(Drug Repurposing)と呼ばれる方法があります。
「Repositioning」や「Repurposing」というのは、位置や立場(position)や目的や意図(purpose)を新たにする(re-)という意味です。医薬品の「再開発」や「再利用」という意味です。
がん以外で使用されている既存薬を胆管がんの治療に使えないかという研究です。
【胆管がんはシクロオキシゲナーゼ-2活性が亢進している】
以下のような報告があります。
Elevated expression of cyclooxygenase-2 is a negative prognostic factor for overall survival in intrahepatic cholangiocarcinoma.(シクロオキシゲナーゼ-2の発現上昇は、肝内胆管がんの全生存率の負の予後因子である)Virchows Arch. 2007 Feb; 450(2): 135–141.
【要旨】
プロスタグランジンの産生は、シクロオキシゲナーゼ(COX)によって調節される。シクロオキシゲナーゼは、胆管がんを含むさまざまなヒトの悪性腫瘍における腫瘍の発生と進行にも関与している。
肝内胆管がんにおけるCOX-2タンパク質の発現と予後の相関関係に関する情報は限られている。本研究の目的は、肝内胆管がんにおけるCOX-2発現の臨床的重要性を明らかにすることである。さらに、COX-2発現とアポトーシス/増殖の相関関係を分析した。
COX-2の発現は、切除された62個の肝内胆管がんで免疫組織化学的に測定された。増殖はKi67免疫組織化学を使用して評価され、アポトーシスはTdTを介したdUTPニックエンドラベリング技術を使用して測定された。
切除された肝内胆管がんのCOX-2レベルと生存との関係の検討で、COX-2は独立した予後因子として同定された(P = 0.028)。高レベルのCOX-2発現は、アポトーシスの減少と腫瘍細胞の増殖亢進の両方に関連していることが示された。
この研究は、切除された肝内胆管がんにおけるCOX-2発現の独立した予後的価値を実証し、したがって、COX-2阻害剤による補助療法の有用性を示唆している。
COX-2はAktのリン酸化を促進することが報告されています。以下のような報告があります。
The cyclooxygenase-2 inhibitor celecoxib blocks phosphorylation of Akt and induces apoptosis in human cholangiocarcinoma cells.(シクロオキシゲナーゼ-2阻害剤セレコキシブはAktのリン酸化を阻害し、ヒト胆管がん細胞のアポトーシスを誘導する)Mol Cancer Ther. 2004 Mar;3(3):299-307.
【要旨】
胆管がんを含む多くのヒトがんにおいて、シクロオキシゲナーゼ(COX)-2の発現が亢進している。この研究は、ヒト胆管がん細胞の増殖制御における選択的COX-2阻害剤セレコキシブの効果とメカニズムを検討するために行った。
ヒト胆管がん組織を使用した免疫組織化学的分析は、ヒト胆管がん細胞において、COX-2発現の亢進、およびCOX-2によって産生されるプロスタグランジンによって活性化されるプロテインキナーゼであるAktのリン酸化のレベルの増加を示した。
培養ヒト胆管がん細胞(HuCCT1、SG231、およびCCLP1)をCOX-2阻害剤のセレコキシブで処理すると、用量および時間に依存して細胞生存率が低下した。セレコキシブがチトクロームCの放出を亢進し、カスパーゼ-9およびカスパーゼ-3を活性化し、アポトーシスの形態学的特徴を誘導することを示した。
セレコキシブによって誘発された細胞死は、広域スペクトルのカスパーゼ阻害剤であるN-ベンジルオキシ-カルボニル-Val-Ala-Asp-フルオロメチルケトンによって有意に阻止された。さらに、セレコキシブで処理された胆管がん細胞は、Aktリン酸化の有意な減少を示したが、Bcl-2およびBaxのレベルは変化しなかった。LY294002によるAkt活性化の阻害は、ヒト胆管がん細胞の生存率を有意に低下させた。
これらの発見は、セレコキシブがアポトーシスの誘導およびAktリン酸化の阻害を介して胆管がんの増殖を阻害することを示唆している。
【抗ヒスタミン薬のシメチジンはAktリン酸化を抑制する】
消化性潰瘍の治療に使用される薬剤であるシメチジンは、Aktリン酸化の抑制により胆管がん細胞のアポトーシス死を誘発することが報告されています。
Repurposing cimetidine for cholangiocarcinoma: Antitumor effects in vitro and in vivo(胆管がんのためのシメチジンの転用:in vitroおよびin vivoでの抗腫瘍効果)Oncol Lett. 2017 Mar; 13(3): 1432–1436.
【要旨】
シメチジンはヒスタミン2型(H2)受容体拮抗薬であり、さまざまな種類の悪性腫瘍に対して抗腫瘍効果があることが実証されている。しかし、化学療法抵抗性の胆管腫瘍である胆管がんに対する効果はまだ調査されていない。
本研究では、in vitroおよびin vivoでのシメチジンの抗腫瘍活性を評価した。
胆管がん細胞株を用いた培養細胞の実験で、シメチジンはプロテインキナーゼBシグナル伝達経路の抑制を介してカスパーゼ依存性アポトーシスを誘導する機序で胆管がん細胞の増殖を抑制した。
胆管がん細胞をマウスに移植した動物実験では、シメチジンは観察可能な悪影響なしに胆管細胞の増殖を阻害した。
これらの結果は、シメチジンが胆管がんの治療に効果的な抗腫瘍剤になる可能性があることを示唆している。
生体内アミンであるヒスタミンは、炎症反応や胃酸分泌、アレルギー反応など様々な生理反応に関与しています。ヒスタミンは細胞表面にある受容体に結合することによって細胞にヒスタミンの刺激を伝えます。
ヒスタミンの受容体は現在までに 3 種類のサブタイプ(H1~H3)が見つかっていますが、そのうち H2 受容体は胃酸分泌において中心的な役割を担っており、その拮抗薬であるシメチジンやラニチジンなどは胃酸の分泌を抑える効果により胃炎や消化性潰瘍や逆流性食堂炎などの治療薬として使用されています。
1980 年代後半に デンマークのTonnesen らにより、シメチジンが胃がん患者に対し延命効果を示すことが報告され、その後、大腸がん、悪性黒色腫に対しても同様の効果を示すことが報告されています。
例えば、治癒切除術後5-FU(200mg/日)投与を受けている原発性大腸がん患者(シメチジン800mg/日併用群34例、非併用群30例の計64例)において、平均10.7年の観察期間での10年生存率は、シメチジン併用群で84.6%、シメチジン非併用群で49.8%でした(P<00001)。
たった7日間のシメチジン投与(手術前5日間と手術後2日間)で、大腸がん患者の3年後の死亡率を41%から7%に低下させたという報告もあります。
腎がんにおいても、進行例に対してインターフェロンα+シメチジンを併用した場合、インターフェロン単独よりも抗腫瘍効果が高いことが報告されています。
切除手術を受けた大腸がん患者を対象にした臨床試験のメタ解析によると、シメチジンを服用することによって死亡リスクが0.53に低下すると報告されています。
ヒスタミンにはがん細胞の増殖を促進する作用や、細胞性免疫を抑制するリンパ球(骨髄由来抑制細胞や制御性T細胞)を活性化することなどが報告されており、そのためシメチジンの延命効果は、がん細胞に対するヒスタミンの細胞増殖促進作用を阻害する機序や、がん細胞に対する免疫力を活性化させ る可能性などが指摘されています。
さらに近年では、シメチジンが接着因子 E-セレクチンの発現を抑 制することによりがんの転移を抑制する抑える機序や、インターロイキン 12の発現上昇を介したナチュラルキラー細胞活性化、血管新生阻害作用によって腫瘍組織の増大を阻止する可能性、がん細胞にアポトーシス(細胞死)を誘導する作用など、新たなメカニズムも報告されています。
前述の論文では、胆管がん細胞に対してプロテインキナーゼBを阻害してアポトーシスを誘導するという機序を報告しています。プロテインキナーゼBはAktとも呼ばれます。
【PI3K-Akt経路はがん細胞の増殖を促進する】
細胞の増殖は、増殖因子受容体が細胞外ドメインで増殖シグナルを受け取ることから始まります。
細胞内で機能している多数のシグナル伝達経路の中で、がん細胞の増殖と生存で最も重要なのが、PI3K-Akt経路(生存シグナル経路)とERK-MAPK経路(増殖シグナル経路)です。
細胞膜の増殖因子受容体にリガンド(増殖因子)が結合し2量体化すると、PI3Kのリン酸化活性からAktのリン酸化を通して、アポトーシス(細胞死)の誘導を阻害します。(PI3K-Akt経路)
増殖因子による刺激は、低分子量G蛋白質Rasを経由して、Raf→MEK→ERKとリン酸化反応するMAPK経路(MAPKカスケード)によりシグナルが伝達されます。活性化したERKは最終的に核へ移行し、転写因子が活性化され、細胞増殖関連の遺伝子が発現します。(ERK-MAPK 経路)

図:チロシンリン酸化型受容体にリガンド(増殖因子や成長因子)が結合し2量体化すると、受容体がリン酸化されて活性化する(①)。受容体が活性化されるとPI3Kのリン酸化活性からAktがリン酸化されて活性化する(②)。一方、受容体の活性化は、低分子量G蛋白質Rasを経由して、Raf→MEK→ERKとリン酸化反応するMAPK経路によりシグナルが伝達される(③)。PI3K/Akt経路とMAPK経路の活性化は、最終的に核の転写因子の活性化を介して、がん細胞の増殖や転移を亢進し、アポトーシスに抵抗性(死ににくくなる)の性質を持つようになる(④)。
PI3k/Aktシグナル伝達系が阻害されると、細胞はアポトーシスで死にやすくなります。
Akt (プロテインキナーゼBとしても知られている) はセリン/スレオニンキナーゼです。多くのシグナル伝達経路のネットワークの中心的存在で、下流の幅広いターゲット分子や相互作用分子を介してさまざまな細胞内反応を引き起こします。
Aktは、CDK阻害因子のp21及びp27に対する直接作用や、サイクリンD1 (Cyclin D1) 及びp53のレベルに対する間接的な作用によって細胞周期と細胞分裂を調節するとともに、mTORとp70 S6キナーゼ経路に対する効果を通じて細胞増殖を調節します。
Aktは、BadやForkheadファミリーの転写因子のようなアポトーシス促進性のシグナルを直接阻害することによって、細胞の生存を媒介する主要なメディエーターです。したがって、Aktの活性化を阻害することはがん細胞の増殖を抑制し、細胞死(アポトーシス)を誘導します。
PI3K-Akt経路は、乳がん、卵巣がん、大腸がん、前立腺がん、神経膠芽腫など多くの腫瘍において恒常的機能亢進が認められています。PI3K-Akt経路の活性抑制は多くのがん細胞の増殖や転移を抑制します。

図:PI3キナーゼ-AKT経路は,細胞外からのシグナルを細胞内に伝える主要な経路の一つで、増殖因子やインテグリンを介した細胞接着など、様々な刺激により活性化され、細胞の生存促進,細胞増殖・大きさの制御、細胞運動、代謝の制御など多くの細胞機能に関与している。ホスファチジルイノシトール3-キナーゼ(PI3K)は,細胞膜の構成成分であるイノシトールリン脂質をリン酸化する酵素で,産生したPI3,4,5-三リン酸(PIP3)がAktをリン酸化する。Aktは多くのがん組織で活性しておりAKTシグナル伝達系は、細胞増殖や生存、細胞サイズや栄養素利用への応答性、グルコース代謝、組織浸潤および血管新生など多くの細胞プロセスを制御している。がん細胞の生存と増殖はAKTシグナル伝達系の活性に依存度が高いので、AKTシグナル伝達系の阻害はがん細胞の増殖抑制やアポトーシス誘導を引き起こす。
ホスファチジルイノシトール3-キナーゼ(PI3K)は,細胞膜の構成成分であるイノシトールリン脂質をリン酸化する酵素です。ホスファチジルイノシトール4,5-二リン酸(PIP2)の3位のOHをリン酸化してホスファチジルイノシトール3,4,5-三リン酸(PIP3)を生成する酵素です。PIP3がAktをリン酸化して活性化します。
PTENは脱リン酸化する酵素でPIP3をPIP2に変化することによってAktの活性化を阻止します。

図:ホスファチジルイノシトール3-キナーゼ(PI3K)は,細胞膜の構成成分であるイノシトールリン脂質をリン酸化する酵素で,産生したPI3,4,5-三リン酸(PIP3)がAktをリン酸化する。Aktは多くのがん組織で活性しておりAKTシグナル伝達系は、細胞増殖や生存、細胞サイズや栄養素利用への応答性、グルコース代謝、組織浸潤および血管新生など多くの細胞プロセスを制御している。PTENはPIP3を脱リン酸化してPIP2に変換し、Akt活性化を阻止する。
PI3K-Aktシグナル伝達系は細胞の生存と増殖の制御の中心です。活性化したAktがシグナル伝達の下流に位置する様々なタンパク質をリン酸化して生存や増殖を制御しています。

図:ホスファチジルイノシトール3-キナーゼ(PI3K)は,細胞膜の構成成分であるイノシトールリン脂質をリン酸化する酵素で,産生したPI3,4,5-三リン酸(PIP3)がAktをリン酸化する。Aktは多くのがん組織で活性しておりAKTシグナル伝達系は、細胞増殖や生存、細胞サイズや栄養素利用への応答性、グルコース代謝、組織浸潤および血管新生など多くの細胞プロセスを制御している。PTENはPIP3を脱リン酸化してPIP2に変換し、Akt活性化を阻止する。
PI3K-Aktシグナル伝達系は細胞の生存と増殖の制御の中心です。活性化したAktがシグナル伝達の下流に位置する様々なタンパク質をリン酸化して生存や増殖を制御しています。
【イベルメクチン、アルテスネイト、イトラコナゾール、トコトリエノールはAktのリン酸化を阻害する】
イベルメクチンは、抗寄生虫薬として使用される大環状ラクトンであり、Ser473でのAktリン酸化を大幅に減少させることが示されています。
九州大生体防御医学研究所の研究グループはイベルメクチンが肝内胆管がんの抑制にも効果があることをマウス実験で確認したと発表しています。(プレスリリースはこちら)
Akt / mTORシグナル伝達の阻害作用は抗マラリア薬のアルテスナート、抗真菌剤であるイトラコナゾール、ビタミンEのトコトリエノールでも報告されています。例えば、トコトリエノールに関して以下のような研究があります。
Tocotrienols target PI3K/Akt signaling in anti-breast cancer therapy.(トコトリエノールは、乳がん治療においてPI3K / Aktシグナル伝達を標的にする)Anticancer Agents Med Chem. 2013 Sep;13(7):1039-47.
PI3K / Aktシグナル伝達経路は、さまざまなタイプのがん細胞の増殖刺激依存性の成長と生存を仲介し、この経路の阻害は腫瘍細胞の成長停止とアポトーシスを引きおこします。
トコトリエノールは、正常細胞の細胞生存率にほとんどまたはまったく影響を及ぼさない治療用量で強力な抗癌活性を示す天然のビタミンEです。メカニズム研究により、トコトリエノールの抗がん効果がPI3K / Aktシグナル伝達の抑制と関連していることが複数の研究で報告されています。
胆管がんは有効な治療法がありません。
COX-2 / PI3K / Akt経路を阻害する作用があるセレコキシブ、シメチジン、イベルメクチン、アルテスネイト、イトラコナゾール、トコトリエノールなどの「再利用薬」を用いた胆道がんの治療を試してみる価値はあると思います。(トップの図)
| « 805)がん細胞... | 807) 魚油はが... » |



