がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
595) Hippo経路をターゲットにしたがん治療(その2):膵臓がんとYAPとジインドリルメタン
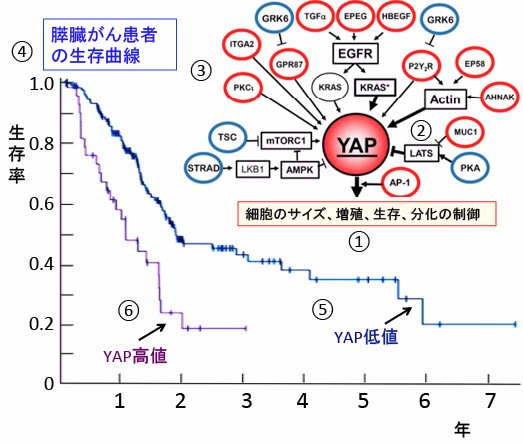
図:転写共役因子のYAPは様々な遺伝子の発現を誘導して、細胞のサイズ、増殖、生存、分化などを制御している(①)。YAPはHippo経路で負に制御されているが(②)、その他多くのシグナル伝達系で、正あるいは負に制御されている(③)。グラフは膵臓がん患者の生存曲線を示す(④)。YAPの発現が低値の患者は生存率が高いが(⑤)、YAPの発現が高い患者は生存期間が短い(⑥)。したがって、膵臓がんの治療にYAP活性の阻害は有望なターゲットと考えられている。
595) Hippo経路をターゲットにしたがん治療(その2):膵臓がんとYAPとジインドリルメタン
【細胞の増殖や生存は複雑なシグナル伝達系ネットワークで制御されている】
天然成分や化合物による抗腫瘍効果のメカニズムの研究は、以前(10年くらい前まで)は「細胞周期を停止する」「DNA複製を阻害する」「アポトーシス(細胞死)を誘導する」「転移を抑制する」など、がん細胞の細胞機能の変化を言及するだけで通用していました。
しかし最近は、増殖や細胞死や転移のシグナル伝達が具体的にかなり解明されてきたので、「PI3K/AKTシグナル伝達系を阻害する」「IκBキナーゼを阻害する」「YAP/TAZの転写活性を阻害する」「Wnt/βカテニン経路を阻害する」などと、具体的なターゲット分子に対する作用を解明しないと通用しなくなっています。
つまり、がん治療に関する論文を読むときは、がん細胞のシグナル伝達系や物質代謝を十分に理解していないと、論文が読めなくなっています。
しかし、がん細胞に関連するシグナル伝達経路や代謝経路は、代表的なものだけでも数十種類あり、しかも一つのシグナル伝達系や代謝経路には何十種類というタンパク質が関与しており、さらにそれらが複雑に相互作用(クロストーク)しています。解明されている部分だけでも複雑すぎて理解することも困難な状況ですが、解明されていない部分の方が多いので、理論的に治療法を考えてもまだかなりの限界があります。
いずれはシグナル伝達系の多くが解明され、がん細胞の遺伝子解析によるシグナル伝達系の異常が個人毎に解析され、AI(人工知能)によって個別のがんに対する適切な治療薬の組合せが提供されるプレシジョン・メディシン(Precision Medicine:精密医療)が行われるようになると思われます。しかしまだ数年の間は、限られた情報の中で、人間の頭で考えて、試行錯誤するがん治療が続くように思います。
いずれにしても、がん治療を行うためには、細胞の増殖や生存に関するシグナル伝達系や代謝経路を勉強するしかありません。
がん細胞におけるシグナル伝達系や代謝の異常を制御できれば、毒でがん細胞を死滅させるような野蛮な方法ではなく、がん細胞の増殖を抑制できます。
【がん抑制経路として働くHippo経路】
Hippo 経路は器官のサイズを制御するシグナル経路としてショウジョウバエで発見されました。
Hippo 経路は哺乳類にも高度に保存され、器官のサイズや形の制御の他にも、がん抑制や細胞分化に重要な経路であることが明らかになり、がん治療のターゲットとして近年注目されています。
典型的な哺乳類Hippo 経路ではMST、LATS の2つのキナーゼとそれぞれアダプター分子SAV、MOB1の4つをコア構成分子とし、転写共役因子であるYAP(Yes-associated protein)やTAZ(transcriptional co-activator with PDZ-binding motif) がその下流で作動します。
刺激をうけて活性化したMSTキナーゼはLATSキナーゼをリン酸化し、活性化されたLATS キナーゼは,主に細胞増殖促進に働く転写共役因子のYAP/TAZ をリン酸化します。リン酸化されたYAP/TAZ は核から細胞質へ排出されるとともに、タンパク質分解を受けます。
すなわち,Hippo 経路の活性化はYAP/TAZ を負に制御し、細胞増殖抑制に働くのです。
YAPとTAZ自身はDNAと結合しないので転写活性はありませんが、転写因子のTEADs(TEA domain transcription factors)に作用して、転写を促進する作用を発揮します。つまり、転写共役因子として働きます。
Hippo経路が働かないと、転写共役因子のYAP/TAZがリン酸化を免れて、核に移行して、増殖に関与する遺伝子の発現を促進します。

図:(左)Hippoシグナル経路がONのとき、LATS1/2がYAP/TAZをリン酸化する。リン酸化したYAP/TAZは分解するか、14-3-3と結合して細胞質内に保持される。この場合は、YAP/TAZによる遺伝子転写は阻止される。(右)Hippoシグナル経路が不活性化されると、YAP/TAZは核内に蓄積し、転写因子のTEADと相互作用して、YAP/TAZのターゲット遺伝子の発現を誘導する。(参考:Genes 2016, 7(9), 55;Targeting the Hippo Signaling Pathway for Tissue Regeneration and Cancer Therapy)
YAP/TAZは、細胞増殖や組織傷害後の組織再生を促進する遺伝子の発現を亢進します。したがって、再生医学ではYAP/TAZの活性化が治療に使われます。
しかし、がん細胞においては、アポトーシス抵抗性、増殖促進、幹細胞の性状(stemness)に関与する遺伝子の発現を亢進するので、YAP/TAZはがん細胞の増殖を促進することになり、YAP/TAZの活性化を阻害することが治療になります。
Hippoシグナル伝達系を活性化してYAP/TAZを不活性化すれば、がん細胞の増殖を抑制できます。さらに、Hippo経路とは関係なく、YAP/TAZの活性を直接的に阻害する方法などもあります。
【生存と増殖の中心となるPI3K-Akt経路とERK-MAPK経路】
細胞の増殖は、増殖因子受容体が細胞外ドメインで増殖シグナルを受け取ることから始まります。
細胞内で機能している多数のシグナル伝達経路の中で、がん細胞の増殖と生存で最も重要なのが、PI3K-Akt経路(生存シグナル経路)とERK-MAPK経路(増殖シグナル経路)です。
細胞膜の増殖因子受容体にリガンド(増殖因子)が結合し2量体化すると、PI3Kのリン酸化活性からAktのリン酸化を通して、アポトーシス(細胞死)の誘導を阻害します。(PI3K-Akt経路)
増殖因子による刺激は、低分子量G蛋白質Rasを経由して、Raf→MEK→ERKとリン酸化反応するMAPK経路(MAPKカスケード)によりシグナルが伝達されます。活性化したERKは最終的に核へ移行し、転写因子が活性化され、細胞増殖関連の遺伝子が発現します。(ERK-MAPK 経路)

図:チロシンリン酸化型受容体の上皮成長因子受容体(EGFR)にリガンド(EGFやTGF-α)が結合し2量体化すると(①)、受容体が自己リン酸化されて活性化する(②)。受容体が活性化されるとPI3Kのリン酸化活性からAktがリン酸化されて活性化する(PI3K/Akt経路 ③)。一方、受容体の活性化は、低分子量G蛋白質Rasを経由して、Raf→MEK→ERKとリン酸化反応するMAPK経路によりシグナルが伝達される(④)。PI3K/Akt経路とMAPK経路の活性化は、最終的に核の転写因子の活性化を介して、がん細胞の増殖や転移を亢進し、アポトーシスに抵抗性(死ににくくなる)の性質を持つようになる(⑤)。
上皮成長因子受容体(Epidermal Growth Factor Receptor; EGFR)は、細胞膜を貫通して存在する分子量170キロダルトンの糖蛋白質で、チロシンキナーゼ型受容体の一種です。細胞外(血液や体液中)にある上皮成長因子(EGFやTGF-αなど)のシグナルを細胞内に伝える働きをします。
EGFRは621個のアミノ酸から構成される細胞外領域(リガンド結合ドメイン)、23アミノ酸の膜貫通領域、542アミノ酸の細胞内領域(チロシンキナーゼ・ドメイン)を持ちます。
細胞外領域に上皮成長因子(EGF)やTGF-αなどのリガンドが結合すると、受容体は細胞膜上を移動して、EGFR同士、あるいは他のErbBファミリー受容体と二量体を形成します。
二量体を形成すると、細胞内領域にあるチロシンキナーゼ部位はATP(アデノシン三リン酸)を利用して受容体の細胞内領域にあるチロシン残基を自己リン酸化します。
チロシンのリン酸化が起こると、さらに細胞内のシグナル伝達系の蛋白質が次々に活性化され、増殖シグナルが核まで伝わり、増殖に関連する遺伝子の発現が起こります。その結果、細胞増殖、アポトーシス抑制、血管新生、浸潤・転移などが起こります。
EGFRは正常組織において細胞の分化や増殖の調節に重要な役割を演じていますが、このEGFRに遺伝子異常(増幅や変異や構造変化)や過剰発現が起きると、細胞のがん化や、増殖、浸潤、転移などに関与するようになります。実際に多くのがんでEGFRの遺伝子異常や過剰発現が認められています。
【膵臓がん細胞のYAP活性が高いと予後不良】
前回(594話)、肝臓がんではYAP/TAZ活性が亢進し、高脂血症治療薬のシンバスタチンやCOX-2阻害剤のcelecoxibがYAP/TAZ活性を抑制して抗腫瘍活性を示す可能性を解説しました。
YAP/TAZ活性の亢進は肝臓がんだけでなく、膵臓がんや乳がんなど多くのがんで認められています。
膵臓がんではがん遺伝子のKRASの変異が高頻度に認められます。変異KRASがYAPを活性化して発がんを引き起こすことが報告されています。以下のような報告があります。
Downstream of Mutant KRAS, the Transcription Regulator YAP Is Essential for Neoplastic Progression to Pancreatic Ductal Adenocarcinoma(変異KRASのシグナル伝達の下流に位置する転写共役因子YAPは膵臓腺管がんの発生に必須である)Sci Signal. 2014 May 6; 7(324): ra42.
膵臓がんではKRASの変異が高頻度で見つかります。KRASは上皮成長因子受容体(EGFR)のシグナル伝達経路において働きます。
YAPはKRASが関与するシグナル伝達系の下流に存在し、YAPの働きを阻害すると、Kras変異による発がんが阻止されることが報告されています。実際に、動物実験でYAP遺伝子を欠損させると、Kras変異による膵臓がん発生が起こらなくなります。
つまりYAP経路は膵臓がんの臨床的悪性度を決定する働きがあります。
多くの臨床的研究で、YAP発現が膵臓がん患者の全生存期間と関連する独立した予後因子であることが報告されています。YAP発現が多いほど予後不良という結果です。
176例の膵臓がん患者を対象に、膵臓がん組織のYAPmRNAの発現量と生存との関係が検討されています。その結果、YAP発現量が多いグループでは生存期間が有意に短いことが報告されています。
YAPmRNA発現量が多い36例中5年以上の生存はゼロでしたが、YAPmRNA発現量が低いグループでは140例中32%が5年以上生存しました。(下図)

図:Kaplan–Meier plots for YAP expression in PDAC.
YAP発現が高い(High)膵臓がんの患者は、YAP発現が低い(Low)膵臓がん患者より生存期間が短い。
【膵臓がん治療のターゲットとしてYAP阻害が重要】
膵臓がんの発生や悪性進展の阻害に、転写共役因子のYAPの活性阻害が有効であることが最近の多くの研究で明らかになっています。したがって、YAP自体の阻害の他に、YAP活性化の上流のシグナル伝達系およびYAPシグナル伝達系の下流の因子もターゲットとして重要になります。

図:多くのシグナル伝達系や因子によってYAPの活性は制御されている。さらに、YAPは多くの遺伝子の発現を制御している。YAP自身の活性の阻害の他に、YAP経路の上流と下流のシグナル経路や因子ががん治療のターゲットになる。
上の図には記載されていませんが、YAPの下流(YAPによって発現誘導される)にはシクロオキシゲナーゼ-2(COX-2)やmatrix metalloproteinase 7 (MMP7)やインターロイキン-6(IL-6)もあります。
また、YAPの活性化に必要はRasファミリーのRhoの活性化はスタチンによって阻害されます。スタチンがRhoの活性化(イソプレニル化)に必要なゲラニルゲラニルグループの生成を阻害するためです。(594話参照)
実際に、スタチンの服用が膵臓がん患者の生存率を良くすることが報告されています。
【ジインドリルメタンはHippo経路を活性化する】
ブロッコリーやケールなどのアブラナ科の植物や野菜には抗がん作用のある成分が多く含まれていますが、その代表的な成分がGlucobrassicin(グルコブラシシン)です。
グルコブラシシンは加水分解してインドール-3-カルビノール(Indole-3-carbinol)になり、さらに胃の中の酸性の条件下では、インドール-3-カルビノールが2個重合したジインドリルメタン(3,3'-diindolylmethane, DIM)になります(下図)。

インドール-3-カルビノールは不安定で、胃の中の酸性の条件下でジインドリルメタンになります。ジインドリルメタンは消化管から容易に吸収され、体中の臓器や組織に移行することが知られています。
ジインドリルメタン(DIM)には様々なメカニズムによる抗がん作用が報告されています。
例えば、乳がんや前立腺がんをはじめ、多くのがん細胞の増殖を抑え、細胞死(アポトーシス)を誘導することが報告されています。
転写因子のNF-κB活性を阻害することによって、がん細胞の抗がん剤感受性を高めます。乳がん細胞のパクリタキセルに対する効果を高めることが報告されています。
がん組織の血管新生を阻害する作用、DNAトポイソメラーゼIIαを阻害してがん細胞の分裂を阻害する作用など多彩な抗がん作用が報告されています。
さらに最近の報告では、ジインドリルメタンがHippo経路を活性化する作用が報告されています。以下のような報告があります。
3,3’-Diindolylmethane suppresses the growth of gastric cancer cells via activation of the Hippo signaling pathway. (3,3'-ジインドリルメタンは、Hippoシグナル伝達経路の活性化を介して胃がん細胞の増殖を抑制する。)Oncol Rep. 2013;30:2419-2426.
【要旨】
最近の研究により、3,3-ジインドリルメタン(DIM)はインビボ(in vivo)およびインビトロ(in vitro)の実験系の両方において抗腫瘍効果を有することが明らかにされている。しかしながら、ヒト胃がん細胞におけるDIMの生物学的機能は不明である。
遺伝学的および生物学的研究により、哺乳動物における細胞増殖、アポトーシス、器官の大きさおよび腫瘍形成の調節において、新規な腫瘍抑制経路としても知られるHippo経路の重要性が確認されている。
この研究の目的は、ヒト胃がん細胞におけるDIMの細胞傷害効果を調べ、Hippoシグナル伝達経路を活性化することによってDIMが細胞死を誘発するかどうかを解明することである。
2種類のヒト胃がん細胞株(SNU-1およびSNU-484)を用いてDIMに対する応答を調べた。 DIMはヒト胃がん細胞の増殖を用量依存的に有意に阻害した。 細胞周期のG1期細胞のパーセンテージは、DIM処置の24時間後に増加した。
DIMは、CDK2、CDK4、CDK6およびサイクリンD1タンパク質レベルを減少させ、p53タンパク質レベルを増加させた。 DIMは、切断されたポリ(ADP-リボース)ポリメラーゼ、切断されたカスパーゼ-9、およびプロカスパーゼ3タンパク質産生の低下を誘導した。
さらに、DIMは、pLATS1、Mob1、pMob1、pYAPおよびRas関連ドメインファミリー1(RASSF1)タンパク質レベルを高め、Yapタンパク質産生レベルを低下させた。 DIMは、RIPF1とMst1 / 2-LATS1-Mob1複合体との結合を刺激し、活性なHippoシグナル伝達経路を促進し、細胞増殖を不活性化するYAPリン酸化(pYAP)を促進した。さらに、DIMは異種移植マウスモデルにおけるヒト胃腫瘍の増殖を阻害した。
これらの結果は、DIMがHippoシグナル伝達経路を活性化することによって胃がん細胞の増殖を抑制することを示している。
以下のような報告もあります。
Regulation of YAP through an Akt-dependent process by 3, 3'-diindolylmethane in human colon cancer cells.(ヒト大腸がん細胞における3,3’ジインドリルメタンによるAkt依存性機序を介するYAPの制御)Int J Oncol. 2013 Dec;43(6):1992-8.
この論文では、ジインドリルメタンはヒト大腸がん細胞において、Hippo経路を活性化してPI3K/Akt経路を阻害するメカニズムでアポトーシスを誘導することを報告しています。
Akt (プロテインキナーゼBまたはPKBとしても知られている) はセリン/スレオニンキナーゼです。多くのシグナル伝達経路のネットワークの中心的存在で、下流の幅広いターゲット分子や相互作用分子を介してさまざまな細胞内反応を引き起こします。
Hippo経路とAKT経路が相互作用することが知られています。
ジインドリルメタンはAKT活性を阻害する作用が報告されています。
詳細はまだ不明ですが、ジインドリルメタンはHippo経路とAKT経路の相互作用に影響してYAP活性を阻害すると思われます。

図:PI3キナーゼ-AKT経路は,細胞外からのシグナルを細胞内に伝える主要な経路の一つで、増殖因子やインテグリンを介した細胞接着など、様々な刺激により活性化され、細胞の生存促進,細胞増殖・大きさの制御、細胞運動、代謝の制御など多くの細胞機能に関与している。ホスファチジルイノシトール3-キナーゼ(PI3K)は,細胞膜の構成成分であるイノシトールリン脂質をリン酸化する酵素で,産生したPI3,4,5-三リン酸(PIP3)がAktをリン酸化する。Aktは多くのがん組織で活性しておりAKTシグナル伝達系は、細胞増殖や生存、細胞サイズや栄養素利用への応答性、グルコース代謝、組織浸潤および血管新生など多くの細胞プロセスを制御している。がん細胞の生存と増殖はAKTシグナル伝達系の活性に依存度が高いので、AKTシグナル伝達系の阻害はがん細胞の増殖抑制やアポトーシス誘導を引き起こす。ジインドリルメタンはAKT経路を阻害する。
594話では高脂血症治療薬のシンバスタチンとCOX-2阻害薬(celecoxib)によるYAP/TAZ活性の阻害作用を紹介しました。さらにジインドリルメタンを追加するとYAP/TAZの活性抑制を増強できるかもしれません。ジインドリルメタンは欧米ではサプリメントとして販売されています。
◎ ジインドリルメタンについてはこちらへ:
◎ 膵臓がんの補完・代替医療についてはこちらへ
◎ 漢方煎じ薬の解説はこちらへ
膵臓がんの補完・補完代替療法は多数の種類があります。その一部を以下の書籍でまとめています。
| « 594) Hippo経... | 596)腫瘍微小... » |