がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
879)カンナビジオールとがん治療(その2):鎮痛作用
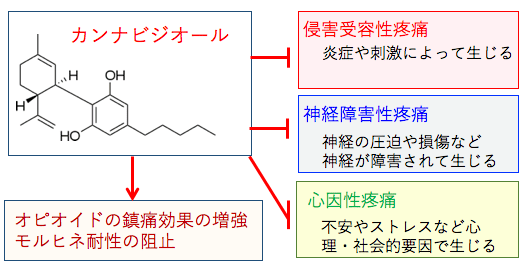
図:疼痛は様々な原因で生ずる。外傷や火傷や炎症などによって末梢神経の侵害受容体が刺激されて生じる「侵害受容性疼痛」、坐骨神経痛や多発性硬化症や脊髄損傷による痛みや糖尿病神経障害による痛み・しびれなど、神経の圧迫や損傷などによって生じる「神経障害性疼痛」、不安やストレスなど心理・社会的な要因で起こる心因性疼痛に大別される。がん性疼痛では、これら複数の原因が関与していることが多い。カンナビジオールはこのような様々な機序で起こる疼痛を軽減する作用がある。さらに、オピオイドの鎮痛効果を増強し、モルヒネ耐性を阻止する作用もある。
879)カンナビジオールとがん治療(その2):鎮痛作用
【侵害受容性疼痛と神経障害性疼痛と心因性疼痛】
モルヒネや大麻やカンナビジオールの鎮痛効果のメカニズムを理解するためには、痛みが発生するメカニズムを理解する必要があります。
切り傷や打撲や火傷などで組織が傷害を受けて炎症が起こると、ブラジキニンやヒスタミンやプロスタグランジンなどの炎症性メディエーターと呼ばれる痛みを起こす化学物質が産生され、これらの物質が末梢神経にある「侵害受容器」という部分を刺激することで痛みを感じます。このような炎症や刺激により発生する疼痛は「侵害受容性疼痛」と呼ばれています。
がんや神経変性や物理的傷害などによって末梢神経や中枢神経が障害されて痛みが発生する場合があります。このような神経の直接的な障害による痛みを「神経障害性疼痛」と言います。見た目には傷や炎症はないものの、神経が傷つくことによって起こる痛みです。
神経障害性疼痛の原因として、神経組織へのがん細胞の浸潤、帯状疱疹ヘルペスやHIVなどのウイルスの感染による神経細胞のダメージ、多発性硬化症のような脱髄性疾患、糖尿病などの代謝障害、抗がん剤による神経のダメージ、事故や怪我などによる神経の切断や障害、脊柱管狭窄やヘルニアによる神経の圧迫などがあります。
知覚神経の末端には熱刺激や化学刺激や機械的刺激などそれぞれの刺激に反応する受容体が存在し、それらの受容体が刺激されると、電位依存性Naチャンネルが活性化されて活動電位が発生し、その信号が脊髄を経由して脳に伝達され、脳はこの信号を疼痛と認識します。
脊髄では、感覚神経は後方(後角)に集まります。末梢からの痛みのシグナルは脊髄の後角で別の神経にシナプスを介して伝達されます。
シナプスは神経細胞と神経細胞を結ぶ接合部位で、神経細胞の軸索を伝って刺激(活動電位)がシナプスに達すると、シナプス間隙に神経伝達物質が放出され、それがシナプス後細胞に存在する受容体に結合することによって細胞間の情報伝達が行われます。
脊髄後角の神経細胞に伝達された疼痛シグナルは、上行性に脳幹、中脳、視床を経て大脳皮質と大脳辺縁系に到達します。辺縁系からは下行性の神経細胞が、中脳水道周囲灰白質や吻側延髄腹内側部を通って脊髄の後角に伸びます。この神経伝達系は「下行性疼痛抑制系」と呼ばれ、脊髄後角でのシナプス伝達に作用して、痛みを軽減したり増強したりする役割を持ちます。(図)
すなわち、脊髄後角における末梢神経と脊髄神経の間での痛みの伝達は上位の脳により制御されているのです。特定の脳領域を刺激すると痛みが軽減することが知られています。このように脳内には痛みを軽減する仕組みが備わっており、この仕組みを利用して痛み和らげる薬物がいくつか開発され、臨床で使われています。

図:神経障害や炎症などによって発生した痛み刺激は、末梢感覚神経から脊髄後角で脊髄の神経細胞に伝達され(①)、さらに脳幹、中脳、視床を経て(②)大脳皮質に達して痛みとして認知される(③)。大脳辺縁系からは下行性のニューロンが、中脳周囲灰白質や吻側延髄腹内側部を通って脊髄の後角に伸び、脊髄後角における末梢神経と脊髄神経の間のシナプス伝達を制御することによって痛みを調節している(④)。これを下行性疼痛抑制系という(⑤)。
さらに、不安やストレスなど、心理・社会的な要因で起こる痛み(心因性疼痛)もあります。神経障害性疼痛などで慢性的に強い痛みが続くと、不眠や不安や抑うつ状態になり、心因的要因も重なってますます症状が重くなるという悪循環に陥ることもあります。(図)

図:疼痛は様々な原因で生ずる。外傷や火傷や炎症などによって末梢神経の侵害受容体が刺激されて生じる「侵害受容性疼痛」、坐骨神経痛や多発性硬化症や脊髄損傷による痛みや糖尿病神経障害による痛み・しびれなど、神経の圧迫や損傷などによって生じる「神経障害性疼痛」、不安やストレスなど心理・社会的な要因で起こる心因性疼痛に大別される。長引く痛みでは、これら複数の原因が関与していることが多い。
【オピオイドはμオピオイド受容体を刺激して鎮痛作用を発揮する】
モルヒネなどのオピオイド系鎮痛剤はオピオイド受容体に作用して効果を発揮します。
オピオイド受容体にはデルタ(δ)、カッパ(κ)、ミュー(μ)などのサブタイプがありますが、モルヒネの鎮痛作用は主にミュー受容体が関与しています。ミュー(μ)受容体はモルヒネ(Morphine)の頭文字をとってμ受容体と呼ばれるようになった経緯があり、モルヒネの鎮痛作用に最も関連がある受容体です。
オピオイド受容体はGタンパク質共役型受容体(7回膜貫通型受容体)で、神経細胞や免疫細胞に分布しています。μオピオイド受容体は末梢感覚神経においては、侵害受容線維であるC線維やAδ線維の前シナプス末端部に存在し、リガンド(受容体に結合して作用する作動薬)の結合により膜電位依存性のカルシウムチャネルの機能を抑制し、疼痛伝達物質(サブスタンスPなど)の放出抑制によって鎮痛効果を示します。
中枢神経系では、μオピオイド受容体は脊髄後根、大縫線核、中脳水道周囲灰白質、視床などに局在しています。これは下降性疼痛抑制系において痛覚情報伝達・制御系に関与している部位です。つまり、モルヒネはμオピオイド受容体に結合することで痛覚の伝達を遮断あるいは痛覚抑制系の増強を介して、鎮痛作用を発現すると理解されています。(図)

図:神経障害や炎症などによって発生した痛み刺激は、末梢感覚神経から脊髄後角で脊髄の神経細胞に伝達され(①)、さらに脳幹、中脳、視床を経て(②)大脳皮質に達して痛みとして認知される(③)。大脳辺縁系からは下行性のニューロンが、中脳周囲灰白質や吻側延髄腹内側部を通って脊髄の後角に伸び、脊髄後角における末梢神経と脊髄神経の間のシナプス伝達を制御することによって痛みを調節しており、これを下行性疼痛抑制系という(④)。オピオイド系鎮痛薬が作用するμオピオイド受容体(⑤)は、感覚神経終末や脊髄後角や下降性疼痛抑制系のシナプスにおける神経伝達物質の放出を抑制する作用機序で鎮痛作用を発揮する(⑥)。
【カンナビジオールはシグマ-1受容体を阻害してオピオイドの鎮痛効果を増強する】
鎮痛薬開発においてシグマー1(Sigma-1)受容体がターゲットとして注目されています。シグマ-1受容体は一部のオピオイドや覚せい剤の結合分子でもあることから以前はオピオイド受容体の一つと考えられていました。しかし近年の研究により,シグマ-1受容体が様々なタンパク質に結合し,その機能や発現を調節することが明らかとなってきました。
シグマ1-受容体は223アミノ酸からなる2回膜貫通型タンパク質で、全身で発現しています。細胞内では小胞体膜に局在しますが,小胞体の中でもとりわけミトコンドリアに接するMAM(mitochondria-associated ER membrane)に豊富に存在しています。MAMは小胞体とミトコンドリアの近接した領域で、様々なタンパク質が局在しており、シグマ-1受容体はこれらの機能分子に結合し、小胞体–ミトコンドリア間のCa2+輸送やエネルギー産生,脂質輸送など多彩な生理機能を調節していると考えられています。
シグマ-1受容体は極めて多彩な働きを担っていますが、特に神経細胞内での様々な生理学的プロセスに関与していることが知られています。シグマ-1受容体は神経伝達に関わる幾つかの受容体やチャネルの機能を制御しており、疼痛緩和の医薬品開発のターゲットとして近年注目されています。実際に、シグア-1受容体の阻害剤が鎮痛剤として開発されています。
シグマ-1受容体の阻害剤がオピオイドの鎮痛作用を増強することは1990年代から報告されています。シグマ-1受容体はオピオイド受容体と結合して複合体を形成してオピオイド受容体を阻害しています。したがって、シグマ-1受容体阻害剤はオピオイド受容体の鎮痛効果を増強します。
シグマ-1受容体はオピオイドによる鎮痛作用を阻害する作用がありますが、その理由は不明です。生体反応は常に刺激(促進)と阻害(抑制)の2つのメカニズムで調節されています。炎症部位で疼痛を起こると、生体は内因性オピオイドを産生して痛みを軽減しようとします。しかし、疼痛は生体に対する侵害であり、痛みが簡単に除去できると困る側面もあります。したがって、内因性オピオイドの鎮痛作用を阻害するメカニズムも存在します。このようなオピオイド受容体の鎮痛作用を阻害するメカニズムとしてシグマ-1受容体が存在するという考えもあります。
オキサリプラチンなどの抗がん剤による神経障害性疼痛を緩和する効果も報告されています。
オキサリプラチン誘発性末梢神経障害の改善における新規シグマ-1受容体阻害剤(MR309)の効果を検討した無作為化二重盲検プラセボ対照臨床試験が実施されています。
Efficacy of a Novel Sigma-1 Receptor Antagonist for Oxaliplatin-Induced Neuropathy: A Randomized, Double-Blind, Placebo-Controlled Phase IIa Clinical Trial.(オキサリプラチン誘発性神経障害に対する新規シグマ-1受容体アンタゴニストの有効性:無作為化二重盲検プラセボ対照第IIa相臨床試験)Neurotherapeutics. 2018 Jan;15(1):178-189.
この多施設共同臨床試験では、オキサリプラチンを投与されている124人の結腸直腸がん患者を対象にシグマ-1受容体阻害剤(MR309)またはプラセボに1:1で無作為に振り分けられました。その結果、シグマ-1受容体阻害剤の併用が、オキサリプラチンによる神経障害を軽減し、神経障害性疼痛を緩和することが示されました。
一般的に、シグマ-1受容体の活性化は疼痛を増強しオピオイドによる抗侵害受容を抑制します。一方、シグマ-1受容体の阻害は疼痛過敏症を抑制し、中枢神経系および末梢神経の両方でオピオイドの鎮痛効果を増強します。カンナビジオールがシグマ-1受容体を阻害し、モルヒネの鎮痛効果を増強する作用が報告されています。
Cannabidiol enhances morphine antinociception, diminishes NMDA-mediated seizures and reduces stroke damage via the sigma 1 receptor.(カンナビジオールはモルヒネの抗侵害受容を増強し、シグマ1受容体を介してNMDA媒介性発作を減少させ、脳卒中ダメージを軽減する)Mol Brain. 2018 Sep 17;11(1):51.

図:オピオイド系鎮痛薬はオピオイド受容体に作用して鎮痛作用を発揮する。シグマ-1受容体はオピオイド受容体の働きを阻害してオピオイドの鎮痛効果を減弱する。カンナビジオールはシグマ-1受容体とオピオイド受容体の相互作用を阻害することによってオピオイドの鎮痛効果を増強する。
【カンナビジオール(CBD)はTHCとは異なる機序で抗不安作用を発揮する】
不安やストレスの軽減は心因性疼痛の軽減に効果があります。カンナビジオール(CBD)がアナンダミドを増やして気分を楽にし、不安を軽減する作用は複数の動物実験モデルで示されています。
Δ9テトラヒドロカンナビノール(THC)はカンナビノイド受容体CB1に直接作用して抗不安作用を発揮します。一方、カンナビジオール(CBD)はCB1受容体に結合する作用はありませんが、内因性カンナビノイドのアナンダミド(anandamide)の分解を阻害してアナンダミドの血中濃度を高め、CB1受容体を間接的に活性化することによって抗不安作用や睡眠改善作用を示す作用機序が報告されています。
カンナビジオールはアナンダミドの細胞内輸送体として作用する脂肪酸結合タンパク質(fatty acid-binding proteins)と結合します。カンナビジオールは脂肪酸結合タンパク質の結合においてアナンダミドと競合することにおいて、アナンダミドの分解を減少させるのです。脂肪酸結合タンパク質がカンナビジオールによって占拠されれば、アナンダミドは小胞体に存在するFAAH(脂肪酸アミドハイドロラーゼ)に輸送されないので、分解されずに、血中のアナンダミドの濃度は上昇するという機序です。
さらに、CBDはセロトニン受容体5-HT1Aに作用してセロトニン神経伝達を促進して抗不安作用や抗うつ作用を発揮します。その他にも、TRPV1受容体、アデノシン受容体、GPR55などを介する機序も報告されています。
カンナビジオールの抗不安作用は多くの動物実験で示されています。臨床研究でも有効性が報告されています。
【モルヒネは長期使用で耐性ができる】
モルヒネおよびその他のオピオイド系鎮痛薬はμオピオイド受容体に作用して鎮痛、傾眠、呼吸抑制、消化管運動抑制、自律神経系変化などの薬理作用を発現しますが、モルヒネを長期に使用すると次第に作用の低下が起こり、同じ効果を得るのにより多くの服用が必要になってきます。このような現象を耐性(tolerance)と言います。
薬物耐性のメカニズムの一つは、薬剤を反復使用しているうちにその薬物の薬物代謝系が賦活されて、分解が促進するので、服用量を増やさないと同じ効果が得られないという作用機序です。
さらに、受容体作動薬の場合は、受容体機能の変化による感受性低下(脱感作)によって耐性が生じることが知られています。特にGタンパク質共役型受容体ファミリーの場合については、受容体のリガンド(作動薬)に対する親和性の低下、受容体とGタンパク質の脱共役、受容体の細胞内移行による細胞表面からの受容体の消失、受容体の数の減少などが耐性発現に関与しています。
さらに、最近の研究では、オピオイドの長期使用によって中脳水道周囲灰白質領域や脊髄後角のミクログリアやアストロサイトの活性化などによって、疼痛抑制系が抑制される結果、オピオイドの鎮痛効果が減弱するという報告があります。
例えば、モルヒネの慢性投与によって中脳水道周囲灰白質領域においてミクログリアの活性化が観察され、ミクログリアの活性を阻害する薬を投与するとモルヒネ耐性が抑制されるという報告があります。
モルヒネ耐性によって必要な鎮痛効果を得るためにモルヒネの服用量が増えると、次第に依存性(dependence)を引き起こし、さらに服用量が増えるという悪循環を形成します。
モルヒネには延髄の呼吸中枢に作用して呼吸抑制を引き起こす副作用があり、これがモルヒネなどのオピオイド系鎮痛薬による死亡の原因になっています。
前述のように、モルヒネの反復使用が脊髄後角のミクログリアやアストロサイトの活性化を引き起こして、疼痛抑制系が抑制される結果、オピオイドの鎮痛効果が減弱するという機序が報告されています。
カンナビジオールはミクログリアやアストロサイトの活性化を抑制する作用があり、モルヒネ耐性を軽減する効果が指摘されています。
新刊紹介

| « 878)カンナビ... | 880)カンナビ... » |



