がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
553)抗がん剤でがんが悪化する理由(その2):抗がん剤は遺伝子変異を引き起こす
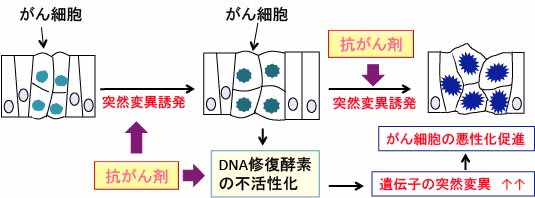
図:がん細胞は遺伝子変異の蓄積により悪性化が進行する。抗がん剤は遺伝子の突然変異を引き起こして、より悪性度の強いがん細胞の出現を促進する。DNAミスマッチ修復酵素などのDNA修復系に異常をきたすような遺伝子変異は、突然変異の発生率を高める結果、がん細胞の悪性化進展を促進する。つまり、抗がん剤治療は遺伝子変異を誘発して、悪性度の高いがん細胞を増やしていくデメリットがある。
553)抗がん剤でがんが悪化する理由(その2):抗がん剤は遺伝子変異を引き起こす
【遺伝子変異とは】
DNAの遺伝情報には、細胞を形作り機能させるための蛋白質の作り方と、その発現の量や時期を調節するために必要なマニュアルが組み込まれています。したがって、この遺伝子情報に誤りが生じるとその細胞の働きに異常が生じます。
正常な細胞であれば、止めどなく分裂増殖を繰り返すということはありません。それはDNAの情報によって、分裂増殖のペースや限度がコントロールされているからです。
しかし、この細胞増殖をコントロールしている遺伝子に異常が生じると細胞は際限なく分裂を繰り返すがん細胞となるのです。
誤りを起こす原因は、DNAに傷がついて間違った塩基に変換したり、遺伝子が途中で切れたりするためです。これをDNAの「変異」と呼び、DNA変異を引き起こす物質を変異原物質とよびます。環境中には、たばこ・紫外線・ウイルス・食品添加物など変異原物質が多く存在しています。
変異原物質は、体内でのエネルギー産生や物質代謝の過程でも作られます。酸素呼吸をすると細胞のミトコンドリアで活性酸素が発生し、この活性酸素はDNAを酸化して遺伝子変異の原因になっています。つまり、私たちが酸素を吸って呼吸していること自体が、がんを発生させる原因の一つになっています。
変異原物質の共通の性質は強い化学反応性を持ち、フリーラジカルを生成する点にあります。フリーラジカルとは反応性の高まって他の物質を酸化する原子や分子のことです。化学反応性に富むため、DNAと反応してDNA変異を生じさせるのです。
抗がん剤といわれる薬品の中にはDNAと反応したり、フリーラジカルを発生させるため、変異原物質となるものが多くあります。放射線も活性酸素を発生してDNA変異を起こします。したがって、抗がん剤や放射線は発がん剤の性格も持っているのです。

図:体内で発生する活性酸素や、放射線やウイルスや紫外線などが遺伝子に変異を起こしてがん細胞が発生する。多くの抗がん剤も遺伝子に変異を起こす。遺伝子の変異を修復するメカニズムが存在する。遺伝子変異が高度の場合は、細胞死が誘導される場合もある。がん遺伝子の活性化やがん抑制遺伝子の不活性化などが蓄積するとがん細胞になる。
【抗がん剤治療による2次がん】
抗がん剤の中にはフリーラジカルの破壊力を利用して、がん細胞の核のDNAを破壊し、がん細胞を殺すものが多くあります。例えば、アドリアマイシン、マイトマイシンC、ダウノルビシン、ブレオマイシンなど多くの抗がん剤がフリーラジカルを産生します。
抗がん剤の中のアルキル化剤はDNAの塩基の構造を変えて、遺伝子変異を誘発します。
このような抗がん剤は、正常な細胞のDNAにも変異(異常)を引き起こします。さらに、抗がん剤は、骨髄や免疫組織や肝臓などの臓器にダメージを与えて免疫力や抵抗力や体力を低下させます。
つまり、正常細胞に遺伝子変異を引き起こし、がん細胞の発生を防ぐ免疫力や治癒力を低下させる結果、新しいがんを誘発するのです。
実際多くの抗がん剤の発がん性が証明されています。
アルキル化剤による治療後1~2年目くらいから白血病の発症率の上昇がみられ、5~10年後をピークにして以降は減少します。使用した抗がん剤の量と期間に比例して発症率は上昇します。
シスプラチンなどの白金製剤はDNA鎖にクロスリンクを形成して細胞分裂を阻害して抗がん作用を発揮しますが、正常細胞の遺伝子変異も引き起こします。
シスプラチンの治療後に白血病の発症率が高まることが、卵巣がんや精巣がんの患者を追跡した研究で報告されています。
白金製剤を含む抗がん剤治療を受けた卵巣がんの患者では、白血病の発症の相対リスクは4倍に上昇し、投与を受けた量が増えるほど発症リスクは上昇しています。治療期間が12ヶ月以上の場合は発症率が7倍になり、放射線治療を併用すると、その発症率はさらに上昇します。
DNAにダメージを与えて遺伝子変異を起こすトポイソメラーゼ阻害剤やアントラサイクリン系抗がん剤も白血病のリスクを高めることが指摘されています。
シクロフォスファミドの投与量が多いと膀胱がんの発生率が高まることが報告されています。
2次がんは治療後の経過期間に応じて発生率が高くなるので、小児や青年期に多い悪性腫瘍が問題になります。若い人に発症する精巣腫瘍は抗がん剤治療が効きやすく根治しやすい腫瘍ですが、精巣腫瘍の治療後の患者の死亡原因として2次がんの占める割合が高いことが報告されています。35歳で精巣腫瘍の治療を受けた患者では75歳までの他のがんの発症率は36%で、同じ期間の一般集団の発がん率が23%という結果が報告されています。(JNCI 97:1354-1365,2005)
このように、多くの抗がん剤は発がん剤と言っても過言ではありません。
【抗がん剤を続けていると抗がん剤抵抗性のがん細胞が増えてくる】
抗がん剤は細胞を死滅させることを目標にしています。そのための作用機序としては、DNAに結合してDNA合成を阻害したり、細胞分裂の際に重要な働きをする微小管の働きを阻害したり、細胞を増やすための細胞成分(核酸や細胞膜など)の合成を阻害したり、増殖のシグナル伝達系の分子を阻害したり、その他多くのメカニズムがあります。
このような作用をがん細胞に作用させれば、がん細胞は分裂できずに増殖を阻止し、死滅できるはずです。しかし、がん細胞はこのような抗がん剤に対して抵抗性を示すようになります。
抗がん剤で治療を行っていると、次第に抗がん剤の効き目が低下してきます。これを薬剤耐性と言い、抗がん剤治療が失敗するときの最大の理由です。
例えば肺腺がんで分子標的薬のチロシンキナーゼ阻害剤(イレッサ、タルセバなど)が効いても、多くは10から14ヶ月程度で効かなくなります。
通常の殺細胞作用を持った抗がん剤治療も、数ヶ月から1年もすれば効かなくなってきます。これは、がん細胞は抗がん剤治療を受けている間に薬剤抵抗性を獲得するからです。
がん細胞が抗がん剤でダメージを受けると、いろんなメカニズムを使って生き残る手段を獲得してきます。例えば、アポトーシスを誘導するたんぱく質の発現を抑えたり、アポトーシス抵抗性にするたんぱく質の発現を誘導することによって細胞死そのものに抵抗性になるメカニズムもあります。
細胞内に入ってきた抗がん剤を細胞外に排出するたんぱく質や抗がん剤を分解するたんぱく質の発現量を増やして、細胞内の抗がん剤の量を減らすメカニズムもあります(下図)。

図:がん細胞は様々なメカニズムで抗がん剤の効き目を弱めている。例えば、抗がん剤の分解や代謝を促進(①)、排出ポンプを増やして抗がん剤を細胞外への排出を促進(②)、抗がん剤のターゲット分子を増産(③)、アポトーシスに抵抗性になるBcl-2サブファミリーのタンパク質を増やしたり、アポトーシスを誘導するBaxサブファミリーの活性を抑制して細胞死に対して抵抗性を獲得(④)、ダメージを受けたDNAなど細胞成分の修復の促進(⑤)、など多くのメカニズムが知られている。
抗がん剤治療を繰り返し行っていると、抗がん剤に抵抗性のがん幹細胞が増えてくることが報告されています。
がん組織の中にはがん幹細胞 (cancer stem cells)と呼べるような細胞が存在して、成熟したがん細胞を供給しながらがん組織を構成しています。がん幹細胞はがん組織中に少数(数%程度)存在しています。
通常の抗がん剤治療や放射線治療に対して、成熟したがん細胞が死滅しやすいのですが、がん幹細胞は様々な機序で抵抗性を示します。がん幹細胞が生き残れば、がんはいずれ再燃・再発します。
抗がん剤治療を繰り返していると、抗がん剤で死にやすい成熟がん細胞は死滅しますが、がん幹細胞は生き残り、次第にがん幹細胞の数が増えて、益々抗がん剤が効きにくくなり、がん組織はさらに増大します。

図:がん幹細胞は自己複製してがん幹細胞を維持すると同時に、成熟がん細胞を供給してがん組織を構成している。抗がん剤治療に対して、成熟がん細胞が死滅しやすいが、がん幹細胞は様々な機序で抵抗性を示す。がん幹細胞が生き残れば、がんは増大する。抗がん剤治療を繰り返すと、抗がん剤に抵抗性のがん幹細胞が生き残り、がん幹細胞が増えることによって、さらに抗がん剤抵抗性が増強し、腫瘍は増大する。
【抗がん剤で遺伝子変異が促進される】
抗がん剤は細胞の遺伝子に変異を起こします。DNA修復に関わる遺伝子に変異が起こると、遺伝子変異の修復ができずに、遺伝子変異の発生が促進されることが報告されています。
以下のような報告があります。
A hypermutation phenotype and somatic MSH6 mutations in recurrent human malignant gliomas after alkylator chemotherapy.(アルキル化剤化学療法後の再発性ヒト悪性神経膠腫における高変異表現型および体細胞性MSH6変異)Cancer Res. 2006 Apr 15;66(8):3987-91.
【要旨】
悪性グリオーマ(神経膠腫)は予後が非常に悪い。神経膠腫の現在の標準治療は、外科的切除および放射線療法の後にアルキル化剤のテモゾロマイド(temozolomide)を用いた補助化学療法からなる。この治療法で、統計学的に有意な生存率の改善が報告されているが、ほぼすべての神経膠腫は再発し、このクラスの薬剤(アルキル化剤)による治療に対して感受性がなくなる。
9症例の神経膠腫細胞において、518個のプロテインキナーゼのキナーゼドメインに対応する500kbのゲノムDNAを配列決定した。
アルキル化剤処理後の2症例の神経膠腫で多数の体細胞突然変異が観察された。
これらの症例における突然変異のパターンは、実験系でのアルキル化剤によって誘発された突然変異パターンと非常に類似していた。
さらに検討したところ、いずれの場合も、ミスマッチ修復遺伝子MSH6を不活性化する体細胞突然変異が起こっていた。
ミスマッチ修復遺伝子のMSH6不活性化する体細胞突然変異は、生体内における神経膠腫のアルキル化剤に対する耐性獲得を引き起こす。さらに、DNAのミスマッチを修復できない状況においてアルキル化剤に継続して曝露する結果、耐性クローンにおける突然変異の誘発が加速される。
したがって、神経膠腫でMSH6が不活性化されると、アルキル化剤の効果は、がん細胞を死滅させる作用から、腫瘍の進行を促進するようになる。
これらの所見は、個々のがん細胞における遺伝子突然変異の意義を解明する上で、大規模な配列決定の有用性を示唆している。
脳腫瘍のグリオブラストーマの治療としてアルキル化剤のテモゾロマイドが使われます。このテモゾロマイドで治療を受けた膠芽腫ではミスマッチ修復遺伝子のMSH6遺伝子を不活性化する遺伝子変異が高率に見つかります。
ミスマッチ修復遺伝子の不活性化は遺伝子の突然変異を増やします。つまり、テモゾロマイド治療で、より悪性度の強いがん細胞が出現し易くなるという結果です。
このような遺伝子変異は、細胞死を起こりにくくすることによって、テモゾロマイドに対する抵抗性を高めます。
抗がん剤は発がん物質でもあり、抗がん剤投与によって、がん細胞の遺伝子変異が起こり、さらに悪化するという結果です。
がん細胞は遺伝子変異の蓄積によって発生します。さらに、遺伝子変異が加わると、より悪性度が進みます。多くの遺伝子変異が蓄積すると、増殖や細胞死の制御がさらに困難になって悪性度が進行します。

図: がんの発生と進行は遺伝子変異の蓄積の結果として起こり、これをがんの「多段階発がん」と言う。抗がん剤は遺伝子変異を引き起こして、より悪性度の強いがん細胞の発生を促進する。つまり、抗がん剤治療は悪性度の高いがん細胞を増やしていく作用がある。
細胞の核内のDNAは約30億塩基対から成る2本の鎖状になっています。細胞分裂のときにはDNAはDNAポリメラーゼによって複製が起こります。
DNAを複製するDNAポリメラーゼが間違った塩基を取り込む頻度は10-5のオーダーです。しかし、DNAポリメラーゼには自己校正機能があり、すぐさま99%は訂正されるので、DNAポリメラーゼによるエラーの頻度は10-7のオーダーです。(1,000万回に1回、107塩基対に1個は間違いを犯します)
残ったエラーの99.9%くらいは、DNA複製後にミスマッチ修復系で修復されるので、生体内のDNA複製で、最終的に間違った塩基が入る頻度は10-10のオーダーになります。
つまり、1回のDNA複製で、1個の特定の塩基が変異する確率は10-9〜10-10のレベルです。10億から100億回のDNA複製で、DNAのある特定の塩基が1回変異する確率です。
1つの細胞のDNAには30億対の塩基が含まれるので、1回の細胞分裂(DNA複製)で、1〜数箇所の塩基に変異が発生する計算になります。
DNAミスマッチ修復系が働かないと、遺伝子に突然変異が発生する確率が100倍〜1000倍くらいに増えることになります。
DNAは紫外線や放射線の照射といった外的要因や、複製エラーや活性酸素といった内的要因により、絶えず損傷を受けています。しかし、生物はこれらの損傷を元通りに修復するさまざまなDNA修復機構を備えており、この機構には多くのDNA修復タンパク質(酵素)が関わっています。ミスマッチ修復系はそのうちの1つです。
DNAが複製される際、2本鎖のらせんが解かれ、それぞれの1本鎖DNAには、新たな相補的塩基が結合して、2組の新しい2本鎖DNAが形成されます。しかしこの複製は完全ではなく、まれに相補的ではない塩基の組み合わせ(ミスマッチ)を含む2本鎖DNAが生じます。ミスマッチ修復系は、このミスマッチを見つけ出し、除去して修復します。
DNAミスマッチ修復酵素の変異が原因で起こる遺伝性疾患にリンチ症候群があります。大腸、子宮内膜、卵巣、胃など多臓器へのがんの発症リスクを高める遺伝性疾患で、特に大腸への発がんリスクを高め、全大腸がんのうち5~8%の原因になっていると推定されていいます。
つまり、DNAミスマッチ修復酵素の働きが無いと、遺伝子変異の率が増え、高率にがんを発生します。
前述の論文は、アルキル化剤のテモゾロマイドで治療すると、DNAミスマッチ修復系の異常(不活性化)が起こり、これが神経膠腫の再発と薬剤耐性に関連していることを報告しています。
DNAミスマッチ修復系が働かなくなると、遺伝子変異が起こり易くなり、薬剤耐性のがん細胞や悪性度の高いがん細胞の出現の確率を高めるということです。
遺伝子変異が起こり易い状態は、がん細胞の悪性進展が加速されることを意味します。
したがって、テモゾロマイドは初めはがん細胞を死滅させる作用が期待できるのですが、同時に、薬剤耐性やより悪性度の高いがん細胞が出現しやすくなるので、がんの進行を促進する方向で作用するようになるという結論です。(トップの図参照)
【進化論と生存競争と抗がん剤耐性】
がん細胞の治療抵抗性と再発という現象は、進化(Evolution)の観点から理解することが最近の趨勢になっています。
自然界においては、ダーウィンの進化論に従って、生物は自然選択され、進化していきます。つまり、環境の変化が起これば、その変化に対応できない個体は滅び、対応できる個体が生き残って、その遺伝形質がその集団内に広まります。その結果、生物は環境に適応するように進化します。
がん組織においても、その環境に適したものが生き残っていくという進化論と同様の考え方が適用されます。
例えば、抗がん剤治療を行えば、その抗がん剤に感受性のあるがん細胞は死滅し、抵抗性を持つがん細胞は生き残ります。抗がん剤に適応するのに適した遺伝子を持ったがん細胞が生き残りクローンを形成していきます。
がん組織内の個々のがん細胞は、遺伝子変異のパターンや増殖速度や薬剤耐性の程度などにおいて違いのあるクローンが混在しています。
このような不均一な細胞集団において、生存において有利な性質をもった細胞が生き残ってクローンを増やして行くというダーウィンの進化論と同様な自然選択(natural selection)が起こっています。
つまり、がん組織はすでに多様な変異を持った細胞集団から構成されるので、環境の変化に適応した遺伝子を持った細胞は出てき易いと言えます。そのため、抗がん剤治療は、抗がん剤に抵抗性を示す死滅しにくい細胞が選択的に生き残ることになります。
さらに、環境の変化に適応するように進化する「進化的適応(Evolutionary adaptation)」と同様なことが起こります。
がん細胞は遺伝子が不安定な状況で、変異を起こしやすい状態にあります。DNAミスマッチ修復系が働かないと遺伝子変異の確率が高くなるので、さらに進化的適応を起こし易くなります。
最大耐用量の抗がん剤治療を行う一つの根拠として、「耐性ができる前にできるだけ叩いておこう」という考えがあります。
しかし、抗がん剤治療を開始した段階で、すでに薬剤耐性のクローンが存在します。さらに、がん細胞は遺伝子変異を起こし易い状態にあり、抗がん剤治療似よって抗がん剤抵抗性の性質を獲得しやすいことが知られています。
したがって、固形がんに対する抗がん剤治療のほとんどは、最終的に抗がん剤が効かなくなって失敗することになります。
【薬剤耐性になるにはコストがかかる】
DNAに変異を起こして薬剤耐性になるというメカニズムでは、DNA変異を阻害する方法(例えば、フリーラジカル消去剤など)では、抗がん作用自体も減弱させるので、意味がありません。DNA変異を阻止すれば抗がん剤耐性細胞の出現は阻止できますが、がん細胞を死滅させる効果も阻害されるからです。
では、抗がん剤でがん細胞を死滅させる治療を行っているときに、薬剤耐性のがん細胞の出現や増殖を抑える手段に何があるかということが重要です。
この場合に「薬剤耐性になるにはコストがかかる」という現象がターゲットにできます。
例えば、多剤耐性 (multi-drug resistance; MDR) で重要な役割を演じているのがABCトランスポーターです。ABCトランスポーターはATP結合カセット輸送体 (ATP-binding cassette transporters) の略称です。
ATPのエネルギーを用いて物質の輸送を行う膜輸送体の一群で、構造的特徴を共有する非常に大きなタンパク質スーパーファミリーをなし、現生のすべての生物に存在します。
ABC輸送体の増加により細胞内からの薬剤の排出が増えることによって、現に投与されている薬剤のみならずその他の薬剤に対しても耐性が生じます。
薬剤耐性になるには、エネルギー(ATP)を消費します。
また、薬剤耐性になると酸化ストレスが亢進し、そのために増殖速度が遅くなります。抗酸化作用のあるグルタチオンを投与すると、薬剤耐性がん細胞の増殖が早くなることが報告されています。グルタチオンによって酸化ストレスが軽減し細胞の負担が少なくなるので、増殖を速くすることができるのです。
したがって、がん細胞のエネルギー産生をターゲットにした治療法や酸化ストレスを高める(さらにエネルギーを消費させる)治療法は、抗がん剤耐性の克服に有効と言えます。
つまり、ケトン食や、解糖系を阻害する2-デオキシ-D-グルコースや、ミトコンドリアを活性化するジクロロ酢酸ナトリウム、酸化ストレスを高めるメトホルミンやオーラノフィンやジスルフィラムやアルテスネイトや半枝蓮などは、薬剤耐性のがん細胞ほど効きます(下図)。
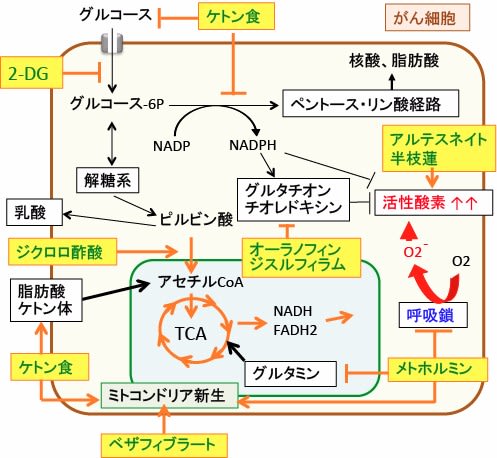
図:がん細胞の代謝の特徴であるワールブルグ効果(解糖系の亢進と酸化的リン酸化の抑制)を正常化し、がん細胞の酸化ストレスを高める方法として、がん細胞の解糖系やペントース・リン酸回路を阻害するケトン食と2-デオキシグルコース(2-DG)、ミトコンドリアでの代謝を促進するジクロロ酢酸、呼吸鎖を阻害して活性酸素の産生を高めるメトホルミン、細胞質でフリーラジカルを産生するアルテスネイトや半枝蓮、グルタチオンやチオレドキシンによる抗酸化システムを阻害するオーラノフィンやジスルフィラムがある。さらに、メトホルミンはグルタミンの利用を阻害し、PPARリガンドのベザフィブラートとケトン食とメトホルミンはミトコンドリア新生を促進して活性酸素の産生を増やす。これらを組み合わせると、がん細胞のエネルギー産生と物質合成を阻害し、さらに酸化ストレスを高めてがん細胞を死滅させることができる。
| « 552)抗がん剤... | 554)抗がん剤... » |



