がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
762)「がんは夜間に増殖する」は本当か?

図:メラトニンは多彩なメカニズムで抗腫瘍効果を発揮する。HanahanとWeinbergががんの特徴として挙げている10項目(持続的な増殖シグナル、増殖抑制シグナルへの不応答、アポトーシスの回避、無制限の複製能、継続的な血管新生、代謝リプログラミング、免疫系からの回避、ゲノム不安定性と変異、腫瘍促進性炎症、浸潤と転移)の全てにおいてメラトニンは抗腫瘍的に作用する。(参考:Melatonin and Cancer Hallmarks. Molecules. 2018 Mar; 23(3): 518.)
762)「がんは夜間に増殖する」は本当か?
【「がん細胞は夜間に増殖する」を利用したがんのクロノテラピー(時間治療)】
人間の体の中には体内時計が存在し、様々な臓器や組織の働きは体内時計に基づいて1日24時間の日内リズムを刻んでいます。
たとえば、体温や血圧は早朝に最も低下し、昼になるにつれて上昇し、夕方に最高になって、その後、低下し、再び朝方に最低になります。体が活動している時間帯は交感神経が優位になるので、体温や血圧が上昇し、夜間は体を休めるために副交感神経が優位になるので体温や血圧が低下すると考えられています。
正常細胞の分裂・増殖する日内リズムは、朝から昼に向かって活発化し、夕方から夜にかけて低下し、真夜中にもっとも沈静化します。一方、がん細胞の分裂・増殖リズムは、真夜中の寝ているときに盛んになり、昼間は低下することのほうが多いと考えられています。
このような生理機能の日内リズムは脳の松果体から分泌されるメラトニンによって調節されていると考えられています。松果体からのメラトニンの産生を制御している視交叉上核が体内時計の中枢と考えられています。
正常細胞とがん細胞における細胞増殖のピークの時間のずれを上手に利用すれば、正常細胞への毒性を極力抑え、抗がん剤の投与量を増やしてがん細胞により大きなダメージを与えることができると考えられます。
抗がん剤は増殖している細胞にダメージを与え、死滅させる治療です。細胞増殖に必要なDNA複製や微小管の働きを阻害して増殖を阻止します。したがって、正常細胞でも増殖活性の高い骨髄細胞やリンパ球や消化管粘膜上皮細胞や毛根細胞などがダメージを受けるので副作用がでます。増殖していない細胞は抗がん剤でダメージを受けません。
正常細胞の増殖活性が低く、がん細胞の増殖活性が高い夜間から夜中に抗がん剤を投与すると、有効性(奏功率)を高め、副作用を軽減できると考えられます。
このように、生体リズムに着目した薬の投与法を「時間治療(クロノテラピー)」と言います。
このクロノテラピー(chronotherapy)は50年くらい前に提唱され、20年くらい前かなり話題になっていたと思います。最近も行っている所はあると思いますが、最近はあまり聞かない印象もあります。通院(外来)での抗がん剤治療が普通になってきて、医療従事者の勤務時間の関係などから、深夜の抗がん剤投与の実施が困難なので、あまり積極的に行われていない感じです。
最近の総説論文で以下のような報告があります
Clocks, cancer, and chronochemotherapy.(時計、癌、および時間化学療法)Science. 2021 Jan 1;371(6524):eabb0738.
【要旨】
体内時計は、人間の生化学的、生理学的および行動的機能の1日のリズムを調整する。遺伝子発現、細胞分裂、およびDNA修復は体内時計によって調節されている。これにより、体内時計の機能不全が発がんの原因となる可能性が指摘されている。
多くの疫学および動物研究の結果は、腫瘍の発生と進行における体内時計の関与を指摘しているが、体内時計の制御異常が発がん性であると結論付けるにはエビデンスは不十分である。
同様に、多くの研究が化学療法の概日リズム依存性の有効性を示唆しているが、時間化学療法の臨床試験は従来のレジメンと比較して改善された結果を示していない。さらに概日リズム(体内時計)と発がんメカニズムの間の関連に焦点を当てた研究が必要である。
つまり、動物実験などの基礎研究では時間化学療法の有効性は示されています。さらに臨床試験でも副作用軽減や奏功率向上などの有効性を示した試験結果も多く報告されています。しかし、その有効性はまだ十分なエビデンスが無いようです。
最近は「がん細胞は夜間に増殖する」と言うことに反対の意見もあります。
【がん細胞は昼間に増殖活性が高い?】
メラトニンはがん細胞の増殖を抑える作用があります。メラトニンは深夜に分泌が最大になります。したがって、がん細胞の増殖活性は昼間に高く、夜間は低いという考えも提唱されています。最近の論文で以下のような報告があります。
Part-time cancers and role of melatonin in determining their metabolic phenotype(パートタイムのがんとその代謝表現型の決定におけるメラトニンの役割) Life Sci. 2021 May 8;278:119597. doi: 10.1016/j.lfs.2021.119597.
【要旨の抜粋】
このレビューでは、内因性メラトニンと固形腫瘍、特に乳がんの代謝との関連について説明する。さらに、体内で生成された、または外来性に投与されたメラトニンががん細胞の代謝に影響を与えるメカニズムに関する新しい知見を要約する。
がん細胞における代謝表現型が、日中のワールブルグ型代謝から、夜間にはより健康なミトコンドリアの酸化的リン酸化に変更される可能性があることが、多くの研究で示されている。
したがって、それらは日中のみがん細胞として機能し、夜はより健康な細胞として機能している。つまり、それらはパートタイムのがん細胞と言える。
夜間の酸化的リン酸化への切り替えにより、がん細胞は腫瘍表現型の低下を示し、急速に増殖したり、浸潤性または転移性になったりする性状が低下する。
また、一部の固形腫瘍は、代謝状態を決定するメラトニンの夜間の上昇により、日中は特に攻撃的であり、夜間はそれほど攻撃的ではない可能性についても説明する。
松果体から産生されるメラトニンは夜間に産生量が高くなります。メラトニンはがん細胞の代謝を、解糖系からミトコンドリアでの酸化的リン酸化に向け直す作用があります。メラトニンはがん細胞の代謝の特徴であるワールブルグ効果(好気的解糖)を是正する効果があります。
したがって、メラトニンの体内濃度が高い夜間はがん細胞の悪性度が低下しているという提案です。つまり、昼間だけがん細胞としての性状を示し、夜間はがん細胞の性状は低下するので、「パートタイムのがん(Part-time cancers)」と言う用語を使っています。
がんのクロノテラピーは「がん細胞は夜間に増殖する」と言うことを前提にしています。しかし、前述の論文では、夜間はメラトニンの濃度が高まり、がん細胞の酸化的リン酸化への切り替えにより、がん細胞は悪性度の低下を示し、急速に増殖したり、浸潤性または転移性になったりする可能性が低くなると言っています。つまり、夜間はがん細胞の増殖活性は低下するという意見です。
【メラトニンはワールブルグ効果を是正する】
メラトニンは様々なメカニズムで抗腫瘍効果を発揮します。メラトニンががん細胞の解糖系を抑制し、ミトコンドリアでの酸化的リン酸化を促進して、ワールブルグ効果を是正する効果が報告されています。
Melatonin inhibits Warburg-dependent cancer by redirecting glucose oxidation to the mitochondria: a mechanistic hypothesis.(メラトニンは、グルコース酸化をミトコンドリアに向け直すことにより、ワールブルグ依存性がんを阻害する:メカニズム的仮説)Cell Mol Life Sci 77(13), 2527–2542 (2020)
【要旨の抜粋】
いくつかの動物実験モデルで、メラトニンががん細胞の発生と進行と転移を阻止する作用を持つことが示されている。がん細胞に共通する代謝の特徴としてワールブルグ効果(好気的解糖)がある。ワールブルグ効果によってがん細胞の高い代謝要求に必要なATPを細胞質内での解糖で産生し、がん細胞の増殖を促進し、細胞死を回避し、転移を促進する。
グリコリティックス(glycolytics)と呼ばれる分子は、がん細胞における好気性解糖を阻害し、正常細胞と同様にミトコンドリアにおける酸化的リン酸化によってATPを産生するように代謝を変化させる。その結果、グリコリティックスはがん細胞の増殖を阻害する。
メラトニンはグリコリティックス(glycolytics)の作用を有し、ミトコンドリアでピルビン酸からアセチルCoAへの変換を妨げる酵素(ピルビン酸脱水素酵素キナーゼ)の発現を抑制するというメカニズムによって、がん細胞の回答を阻害する作用を持つ可能性がある 。
メラトニンはがん細胞の増殖活性と転移能を低下させ、容易にアポトーシスを起こすようにする。
メラトニンは正常細胞のミトコンドリアで合成されるが、アセチルCoAはメラトニン合成の律速酵素であるアリルアルキルアミン-N-アセチルトランスフェラーゼ(arylalkylamine-N-acetyltransferase)に必要であり、がん細胞ではアセチルCoAが低下しているため、がん細胞のミトコンドリアではメラトニンの合成能力は低下している。
メラトニンがグルコース酸化を細胞質からミトコンドリアに切り替える作用は、がん細胞の抗がん剤感受性をメラトニンが高めることの理由を説明している。
この論文の著者は米国テキサス州のサン・アントニオ(San Antonio)のテキサス大学ヘルスサイエンス・センター(University of Texas Health Science Center)の研究者らのグループです。
この論文で出てくる「グリコリティックス(glycolytics)」と言うのはこの研究者らが作った用語のようです。解糖(glycolysis)から派生した造語のようです。
このグリコリティックス(glycolytics)と言うのは、「がん細胞における好気性解糖(ワールブルグ効果)を阻害し、正常細胞と同様にミトコンドリアにおける酸化的リン酸化によってATPを産生するように代謝を変化させる物質」と定義されています。
つまり、がん細胞の好気性解糖(ワールブルグ効果)を是正して、がん細胞の増殖を抑え、死滅させるような物質です。
メラトニンがグリコリティックス(glycolytics)の作用を持つと言うのが、この論文の趣旨です。
メラトニンががん細胞のワールブルグ効果を阻害する作用は、低酸素誘導因子-1(HIF-1)の阻害作用が関与しています。メラトニンのこの作用を理解するには低酸素誘導因子-1(HIF-1)を理解する必要がありますので、まずHIF-1を解説します。
【低酸素になると低酸素誘導因子-1の発現が亢進する】
生物は外界の酸素濃度を認識する巧みな仕組みを保持しています。
酸素濃度が低下すると、生物は低酸素シグナルを活性化し低酸素状態に適応します。
この低酸素応答の中心的分子が低酸素誘導因子-1(Hypoxia inducible factor-1: HIF-1) およびプロリル・ヒドロキシラーゼ(prolyl hydroxylase )と呼ばれるタンパク質です。
HIF-1は、細胞が酸素不足に陥った際に誘導されてくる転写因子です。αとβの2つのサブユニットからなるヘテロ二量体であり、βサブユニットは定常的に発現して細胞核にいますが、 HIF-1αは細胞質で酸素濃度依存的な分解を受けます。
(HIFのαサブユニットにはHIF-1α, -2α and -3α、βサブユニットにはHIF-1β, -2β and -3βのそれぞれ3種類が知られていますが、低酸素誘導因子として中心になっているのはHIF-1αとHIF-1βであるため、HIF-1をHIFの同義語として使用しています。)
HIF-1αは、正常酸素濃度下では、HIF-1αタンパク質中の2カ所のプロリン残基がプロリル・ヒドロキシラーゼにより水酸化されることによりVHL(von Hippel-Lindau)タンパク質が結合します。VHLが結合するとHIF-1αのユビキチン化が促進されて26Sプロテアソームで分解されます。したがって、酸素が十分にある状況ではHIF-1は不活性の状態に維持されます。
プロリル・ヒドロキシラーゼは酸素濃度感受性のタンパク質で、酸素濃度が低下するとプロリル・ヒドロキシラーゼの酵素活性が著しく低下します。すると、HIF-1αのプロリン残基の水酸化が起きないので、HIF-1αは分解を受けずに安定化します。
安定化したHIF-1αは核内に移行し、HIF-1βと二量体を形成して低酸素応答配列(Hypoxia Responsive Element)に結合して、低酸素応答に必要な様々な遺伝子の発現を活性化します。
すなわち、HIF-1は各種解糖系酵素、グルコース輸送蛋白、血管内皮増殖因子(VEGF)、造血因子エリスロポイエチンなど多くの遺伝子の発現を転写レベルで制御し、細胞から組織・個体にいたる全てのレベルの低酸素適応反応を制御しています(下図)。
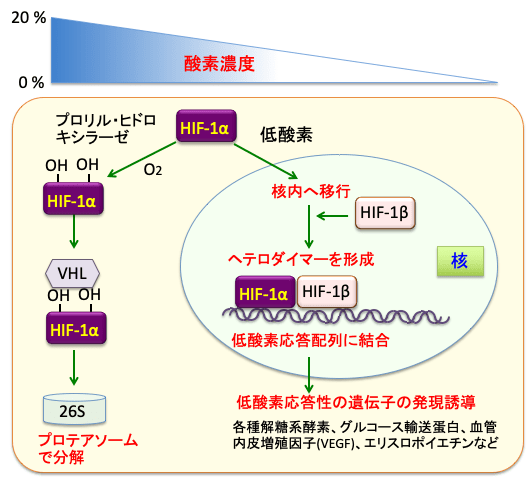
図:酸素濃度が高い状態では、HIF-1αは酸素濃度感受性タンパク質のプロリル・ヒドロキシラーゼによって水酸化され、VHL(von Hippel-Lindau)タンパク質が結合して26Sプロテアソームで分解される。低酸素状態ではプロリル・ヒドロキシラーゼの活性が低下してHIF-1αの分解が阻止されるので、蓄積したHIF-1αは核内に移行してHIF-1βとヘテロダイマー(ヘテロ二量体)を形成して遺伝子の低酸素応答配列に結合し、低酸素状態の適応に必要な様々な遺伝子の発現を誘導する。
HIF-1はグルコースを取り込むGLUT-1の発現を亢進し、解糖系酵素の発現を亢進します。一方、ピルビン酸脱水素酵素キナーゼの発現を亢進してピルビン酸脱水素酵素の活性を阻害し、ミトコンドリアの酸化的リン酸化を抑制します。つまり、HIF-1の活性亢進がワールブルグ効果を引き起こしていると言えます。

図:酸素分圧(pO2)が低下して低酸素になると(①)、低酸素誘導因子-1(HIF-1)の発現が亢進する(②)。HIF-1はグルコースを取り込むGLUT-1(③)と解糖系酵素(④)と乳酸を排出するMCT4(⑤)の発現を亢進する。HIF-1は血管内皮細胞増殖因子(VEGF)の産生を増やして血管新生を亢進する(⑥)。ペントース・リン酸経路を亢進し(⑦)、NADPHと核酸の合成を促進する(⑧)。HIF-1はピルビン酸脱水素酵素キナーゼの発現を亢進し(⑨)、ピルビン酸脱水素酵素の活性を阻害し、アセチルCoAの産生を低下させ、ミトコンドリアでの代謝を抑制する(⑩)。つまり、HIF-1は解糖系を亢進し、ミトコンドリアの酸化的リン酸化を抑制してワールブルグ効果を促進する。
【がん細胞では低酸素でなくてもHIF-1が恒常的に活性化している】
がん細胞の代謝の特徴は、酸素が十分に利用できる状況でも、酸素を使わない解糖系が亢進し、ミトコンドリアでの酸素を使ったエネルギー産生(酸化的リン酸化)が抑制されていることです。つまり、酸素があっても、あたかも低酸素のような代謝を行っているわけです。
このような代謝の特徴の根本的なメカニズムは、がん細胞では酸素濃度とは関係なく、恒常的にHIF-1が活性化しているためです。つまり、がん細胞では恒常的に低酸素シグナルがオンになっているということです。その理由は、がん細胞で活性化されているmTORC1やSTAT3がHIF-1の産生を促進するからです。
がん細胞の増殖シグナル伝達系であるPI-3キナーゼ/Akt/mTORC1シグナル伝達系においてmTORC1はHIF-1のタンパク質の産生(mRNAからタンパク質の翻訳)を促進します。また、増殖因子やサイトカインで活性化されるSTAT3という転写因子はHIF-1遺伝子の転写を亢進します。
mTORC1(哺乳類ラパマイシン標的タンパク質複合体1)はリボソームの生合成を促進するS6Kをリン酸化して活性化する作用によって蛋白質合成を促進し、HIF-1タンパク質の産生を増やします。
一方、STAT(signal transducer and activator of transcription;シグナル伝達兼転写活性化因子)は、様々な増殖因子やサイトカインを中心とする細胞外からの刺激によって活性化されたJAKなどのチロシンキナーゼによってリン酸化を受けると2量体を形成し、核内に移行してさまざまな遺伝子の発現を誘導します。STAT転写ファミリーには7種類が存在しますが、特にSTAT3はほとんどすべての固形がんで活性化されており、細胞のがん化に重要な働きをすることが分かっています。
STAT3はHIF-1の遺伝子発現(転写)を促進することが知られています。つまり、がん細胞で活性が亢進しているmTORC1とSTAT3はHIF-1タンパク質の産生量を相乗的に高めることが報告されています(下図)。
HIF-1αタンパク質の発現量が増えても、HIF-1αの分解に関与するプロリル・ヒドロキシラーゼやVHL(von Hippel-Lindau)タンパク質が正常に働けばHIF-1の活性亢進を抑制できますが、がん細胞ではプロリル・ヒドロキシラーゼやVHLの発現低下や遺伝子変異によってHIF-1αの分解過程に異常を起こしていることも多いことが報告されています。

図:増殖刺激や遺伝子変異などによってがん細胞で恒常的に活性が亢進しているSTAT3(シグナル伝達兼転写活性化因子)はHIF-1遺伝子の転写(mRNAの産生)を促進し、mTORC1はリボソームの生合成を促進するS6Kを活性化してHIF-1タンパク質の合成を促進する。
急速に増大するがん組織の中で、がん細胞は常に低酸素と低栄養による細胞死の危険にさらされています。そこで、低酸素や低栄養による細胞死を起こさないようにするメカニズムとしてがん細胞はHIF-1活性を高めています。これは、HIF-1活性が亢進しているほど、がん細胞は低酸素や低栄養で生存できる(死ににくい)ということを意味しています。
HIF-1はピルビンン酸脱水素酵素キナーゼ(下図のPDK:ピルビン酸脱水素酵素を阻害する)の発現を促進してピルビン酸脱水素酵素(ピルビン酸からアセチルCoAへの変換)の活性を低下させ、さらにピルビン酸から乳酸への嫌気性解糖系に働く乳酸脱水素酵素(LDH)の発現を促進する作用があります。
つまり、HIF-1はピルビン酸からアセチルCoAへの変換を阻害してTCA回路と酸化的リン酸化での代謝を抑制し、嫌気性解糖系(ピルビン酸から乳酸の変換)を亢進します。さらに、HIF-1は腫瘍特異的なピルビン酸キナーゼ-M2の発現を促進し、解糖系の途中におけるグルコース代謝産物から核酸や脂肪酸やアミノ酸の合成を促進する作用(ペントースリン酸経路の亢進)もあります。
また、HIF-1はがん幹細胞の幹細胞として能力を維持させる作用、上皮-間葉移行や細胞接着因子の遺伝子発現を誘導する作用、VEGFを介する血管新生によりがん細胞の遠隔転移を促進する作用なども知られています。
つまり、HIF-1活性が亢進するとグルコースの取込みと解糖系とペントースリン酸経路が亢進し、ミトコンドリアでの酸化的リン酸化の活性が抑制され、さらに、血管新生が促進され、乳酸の産生が増えると免疫細胞が抑制され、結合組織の分解も促進されて転移や浸潤が起こりやすくなるので、HIF-1活性が高いがんほど予後が悪いと言えます。(下図)

図:低酸素誘導因子(HIF-1)によって発現誘導や活性亢進される因子を図中の黄色地で赤字で示している。HIF-1はグルコース・トランスポーター(GLUT)の量を増やしてグルコースの取込みを増やす。ヘキソキナーゼ(HK)の量を増やして解糖系を亢進しグルコース-6-リン酸脱水素酵素(G6PD)を増やしてペントース・リン酸経路を活性化する。乳酸脱水素酵素(LDH)の量を増やしてピルビン酸から乳酸への変換を促進し、ピルビン酸脱水素酵素キナーゼ(PDK)を誘導してピルビン酸脱水素酵素を阻害して、ピルビン酸からアセチルCoAへの変換を阻害してミトコンドリアでの酸化的リン酸化を抑制する。乳酸を細胞外に排出するモノカルボン酸トランスポーター-4(MCT4)や血管新生を促進する血管内皮細胞増殖因子(VEGF)の発現を誘導する作用もある。これらの作用によって、がん細胞では解糖系が亢進し、ミトコンドリアでの酸化的リン酸化を抑制され、血管新生や免疫抑制や結合組織の分解などによって、増殖や浸潤や転移が促進される。
【メラトニンは低酸素誘導因子-1の活性化を阻止する】
HIF-1α誘導性のVEGF発現誘導をメラトニンが阻害することが多くの研究で示されていますが、その分子メカニズムに関しては幾つかの説があります。
他の多くの抗酸化剤と異なり、メラトニンには脳や様々な末梢組織の細胞の細胞膜に受容体が存在します。すなわち、メラトニンには、受容体に依存性の作用と非依存性の作用が知られています。
メラトニンには受容体とは非依存性の機序で、腎臓がん細胞において、HIF-1αの分解を促進してタンパク量を減らし、血管新生阻害作用を示すことが報告されています。
このHIF-1αとVEGFの発現を抑制するメラトニンの作用は、主に受容体非依存性の抗酸化作用が関連しています。抗酸化作用によって、メラトニンはHIF-1αたんぱく質の分解を促進します。
メラトニンはフリーラジカルを消去することによって、活性酸素によるPHD酵素の不活性化(PHD酵素の二価鉄イオンを酸化することによって)を阻止し、HIF-1αの分解を亢進してHIF-1αの量を減らします。すなわち、メラトニンはHIF-1αのmRNA量には影響せず、HIF-1αの核への移行を阻止し、HIF-1αとそのco-activatorであるCBPとp300の相互作用を阻害します。
VEGF遺伝子のプロモーター領域のHREにおいて、HIF-1αとコアクチベーターの結合を阻害する作用も知られています。
メラトニンには免疫増強作用やがん細胞の直接的な抑制作用がありますが、がん細胞のHIF-1αの分解を促進してワールブルグ効果と血管新生を阻害する効果もメラトニンの抗腫瘍効果のメカニズムとして重要です。
血管内皮細胞増殖因子(VEGF)の産生を抑制して血管新生を阻害する可能性も指摘されています。
以下のような総説論文があります。
Melatonin as an angiogenesis inhibitor to combat cancer: Mechanistic evidence.(がんと戦うための血管新生阻害剤としてのメラトニン:メカニズム的証拠)Toxicol Appl Pharmacol. 2017 Nov 15;335:56-63.
【要旨】
松果体から産生されるインドラミンであるメラトニンは、さまざまな身体機能に関与し、抗腫瘍作用などの多様な生物学的活性を有することが示されている。血管新生阻害は、メラトニンがその抗腫瘍効果を発揮するメカニズムの1つある。
血管新生の増加は腫瘍進行の主な特徴であり、したがって血管新生阻害はがん治療における重要なステップである。メラトニンは、がん細胞への栄養素と酸素供給を標的にするためにさまざまなメカニズムで作用している。転写レベルでは、低酸素誘導因子-1α(HIF-1α)およびその制御下にある遺伝子、例えば血管内皮増殖因子(VEGF)は、血管新生の阻害のためのメラトニンの主な標的である。
メラトニンは、HIF-1αの核内への移行を妨げ、それによってVEGFの発現を妨げ、また血管新生関連遺伝子の発現に関与するHIF-1α、リン酸化-STAT3およびCBP / p300複合体の形成も妨げる。
メラトニンの血管新生抑制作用はまた、VEGFR2の活性化および発現を阻害する作用も関与している。
さらに、メラトニンのその他の血管新生抑制メカニズムには、内皮細胞遊走と浸潤と脈管形成の阻害が含まれる。本研究では、メラトニンによって媒介される血管新生阻害の経路と、in vitroとin vivoの両方における様々な種類のがんにおける原因となる血管新生阻害のメカニズムを検討した。
この論文では、メラトニンが転写因子の低酸素誘導因子-1α(HIF-1α)の活性化を阻止し、血管内皮増殖因子(VEGF)の産生を阻害して血管新生阻害作用を発揮することを報告しています。
Douglas Hanahanと Robert Weinbergはがん細胞の特性(Hallmarks of Cancer)として以下の10項目を挙げています。
1. 持続的な増殖シグナル
2. 増殖抑制シグナルへの不応答
3. アポトーシスの回避
4. 無制限の複製能
5. 継続的な血管新生
6. 代謝リプログラミング
7. 免疫系からの回避
8. ゲノム不安定性と変異
9. 腫瘍促進性炎症
10. 浸潤と転移
メラトニンはこれら10項目に対して、抗腫瘍的に作用します。
つまり、メラトニンはがん細胞の増殖や転移を抑制し、細胞死(アポトーシス)を誘導し、血管新生を阻害し、抗腫瘍免疫を増強し、代謝を正常化する作用があります。
この様な多彩に機序で抗腫瘍作用を発揮することに対して、本当だろうかと疑問を持つ人も多いかもしれません。しかし、HIF-1の活性を抑制しワールブルグ効果を是正する作用は、無制限の複製や増殖や浸潤や転移の抑制や、血管新生の抑制を説明できます。さらにメラトニンは強い抗酸化作用や免疫増強作用があります。
つまり、HanahanとWeinbergが提唱する10項目の「がんの特性」を阻害する効果をメラトニンが有することは特に不思議とは言えないということです。
メラトニンが夜間に増えるので「がん細胞は夜間に増殖活性が低下する」というのは、実際はそうでない可能性があります。それはメラトニンの産生は年齢とともに低下し、多くのがんが発生する60歳以降は、松果体からのメラトニン産生がかなり低下しているためです。

図:年齢によるメラトニン分泌量の違いを示している。新生児はメラトニンの分泌はほとんどないが(①)、徐々に増加して小児期にピークになる(②)。思春期を超えるとメラトニン分泌は減少し始める(③)。中年期には加齢とともにメラトニン分泌量が減少し続ける(④)。60歳を超えるとメラトニンの分泌はごくわずかになる(⑤)。メラトニンの血中濃度は午前2時から4時くらいをピークに夜間に上昇するが、加齢とともに減少し、60歳以上になると、分泌量は極めて低下する(⑥)。
サプリメントでメラトニンを寝る前に20mgから40mgくらい多く摂取すると、実際にがん細胞の増殖を抑えることができるかもしれません。
がん治療におけるメラトニンの臨床試験は1日10mgから40mgで行われています。1カプセル20mgの製剤も販売されており、1日40mgでも副作用は起こりません。
実際に、私自身が1日に40mgから60mgを数年間服用していますが、副作用は経験しません。もともと体内で合成され、松果体だけでなくミトコンドリアで合成され、ミトコンドリアの活性を高め、抗老化作用やがん予防効果や寿命延長作用があります。
がん治療の目的で、1日60mgくらいの大量を服用すると、がん細胞の増殖を抑える効果が期待できるかもしれません。
ただし、リンパ球を刺激する作用があるため、自己免疫疾患(慢性関節リュウマチなど)や悪性リンパ腫や白血病など免疫細胞の腫瘍の場合は、メラトニンの服用は病気を悪化させる可能性があるため使用できません。血液凝固を抑える作用があるため、血液凝固に異常がある場合や、ワーファリンのような血液凝固を阻害する薬を服用中は注意が必要です。
血圧を低下させる作用があるため、降圧剤を服用中は注意して服用します。
これらの点に注意していれば、副作用はほとんど無く、がん治療にメラトニンの使用はメリットが高いと言えます。がん治療には1日1回、就寝前に10〜40mgを目安に服用します。
| « 761)抗がん剤... | 763)医薬品転... » |



