がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
761)抗がん剤は老化を促進し、寿命を短縮する
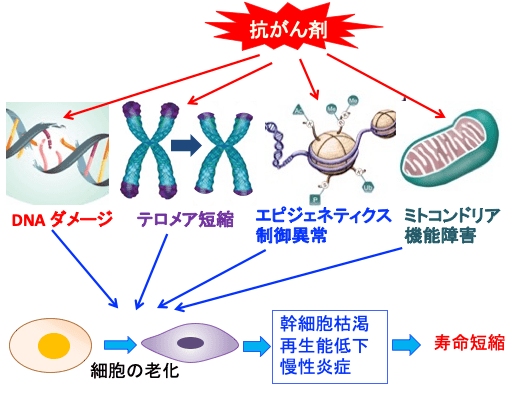
図:抗がん剤はDNAにダメージを与え、染色体のテロメアが短縮し、遺伝子発現を制御するエピジェネティクスの制御異常を引き起こし、ミトコンドリアの物質代謝やエネルギー産生などの機能を障害する。その結果、細胞の老化を促進し、組織の幹細胞が枯渇し、再生能力が低下し、慢性炎症が起こり、寿命を短縮する。
761)抗がん剤は老化を促進し、寿命を短縮する
【毒ガスからスタートした抗がん剤の開発】
最初の抗がん剤のナイトロジェンマスタードは、第一次世界大戦に化学兵器として使われたマスタードガスのイオウ原子を窒素に置き換えた化合物です。DNAやDNA結合タンパク質の特定の部位に結合して、DNAの複製を阻害して細胞分裂を止めます。
白血病や悪性リンパ腫の治療薬として効果を認められましたが、その作用機序から明らかなように細胞分裂を行っている正常細胞も死滅させるため、強い副作用が起こります。その後毒性を弱めたナイトロジェンマスタード誘導体が開発され、シクロフォスファミドやメルファランといった抗がん剤が現在も使用されています。

図:マスタードガス、ナイトロジェンマスタード、シクロホスファミドの構造式
ナイトロジェンマスタードが最初にがん患者に使用されたのは1946年です。1950年代以降のがん治療法の研究領域では、「がんはいかなるコストを払っても抹殺すべき」という考えが主流で、「がん細胞を死滅させる細胞毒を見つけて抗がん剤にする」ような研究が重視されました。したがって、細胞毒性の強い抗がん剤が多く開発され、現在も使用されています。
しかし、細胞分裂を阻害して増殖しているがん細胞を死滅させようとする抗がん剤の最大のデメリットは、正常細胞にもダメージを与えて強い副作用を引き起こすことです。骨髄細胞(白血球や赤血球や血小板)や免疫組織や消化管粘膜や毛根細胞など絶えず細胞分裂を行っている正常細胞もダメージを受けるため、白血球減少や免疫力低下や消化管機能障害や脱毛など様々な副作用を発症します。
【p16INK4aは細胞老化のマーカー】
生物は成長が終了した後(人間では20~30歳以降)、加齢(aging)とともに細胞や組織の機能が低下していきます。このような加齢に伴う生理機能の低下を老化と言います。体の組織は組織幹細胞が細胞分裂によって細胞を補うことによって正常に維持されますが、加齢とともに組織幹細胞も老化によって次第に再性能(細胞分裂能)を失い、やがて死滅し、数が減っていきます。その結果、組織の細胞量が減少し機能が低下していきます。
この老化の速度は個人差があり、遺伝的要因や生活要因や環境要因によっても影響をうけます。老化の程度や速度を評価するには「老化のマーカー」が必要です。これは、老化に伴って細胞内量が増えるか減るような(細胞の老化の程度と相関するような)細胞内物質が候補になります。
生化学的なマーカーとしては細胞老化関連ベータ・ガラクトシダーゼ(senescence-associated β-galactosidase)があります。老化した細胞はこの酵素の活性が高くなっており、X-galを使って老化細胞を染色することができます。senescence(細胞老化)というのは、増殖促進刺激に対して応答しなくなり、安定的に細胞周期が停止した状態の細胞です。細胞分裂できなくなった細胞です。
老化の分子マーカーとしてよく使われているのがp16INK4aというタンパク質です。P16INK4aは細胞の老化にともなって指数関数的に増加することが知られています。
細胞内のp16INK4aの量は16.7年で2倍になるという報告があり、この倍加時間で倍々になっていきます。つまり、細胞内のp16INK4aの発現量が多いほど、その細胞は老化していると評価されています。
p16INK4aタンパク質はサイクリン依存性期キナーゼ(cyclin dependent kinase: CDK)4と6(CDK4とCDK6)に結合する分子量が約16000ダルトン(16kDa)のタンパク質です。
p16INK4aはCDK4とCDK6に結合することによって、CDK4とCDK6がサイクリンD(cyclin D1, D2, D3)と結合することを阻害します。CDK4とCDK6は細胞が分裂をスタートするときに必須の働きを行うので、このサイクリン依存性期キナーゼが阻害されると細胞は分裂できません。
細胞が分裂して数を増やしていくとき、細胞周期は4 つの段階に分けられます。すなわち、DNA複製前のG1(Gap1) 期、DNA複製期(S期)、細胞分裂前のG2(Gap2)期、および最後の細胞分裂期(M) 期に分けられます。増殖を休止した状態の細胞はG0期にあると定義されます。
がん抑制遺伝子のRBタンパク質はE2Fに結合してE2Fの転写活性を阻害しています。細胞周期がG1期からS期に移行するとき、RBタンパク質がサイクリン依存性キナーゼ(CDK)でリン酸化されます。RBタンパク質がリン酸化されると転写因子のE2Fと結合できなくなり、フリーになったE2Fは増殖に関連する遺伝子の発現を促進して細胞周期を回します。
サイクリン依存性キナーゼ(CDK)はサイクリン依存性キナーゼ阻害因子というタンパク質によって機能が阻害されます。このサイクリン依存性キナーゼ阻害因子にはp16INK4a やp21Waf1/Cip1/Sdi1などのタンパク質が知られています。
(下図)
細胞の老化(senescence)というのは、細胞が不可逆的に分裂を停止する(細胞分裂能を喪失する)事です。細胞にダメージが蓄積して老化してくると、サイクリン依存性キナーゼ阻害因子のp16INK4aの発現量が増えてきて、細胞周期が回らないようにすると考えられます。したがって、老化した細胞ほどp16INK4aの発現量が増えており、細胞老化のマーカーとなるのです。

図:G1期にRBタンパクはE2Fという転写因子に結合して、E2Fの活性を抑えている。E2Fは転写因子で細胞の増殖にとって重要な多くの遺伝子類の発現を亢進する。したがって、RBが結合してE2Fの活性を抑えていると、細胞は増殖サイクルに入れない。しかし、サイクリン依存性キナーゼ(Cdk4あるいはCdk6)とサイクリンDの複合体によってRBがリン酸化されるとRBタンパクはE2Fから解離し、E2Fが活性な転写因子となって増殖関連遺伝子の発現を引き起こすので、細胞はDNA複製を開始して増殖サイクルを回し出す。
p16INK4aはサイクリン依存性キナーゼのCdk4とCdk6と結合することによって阻害する。Cdk4/6の活性が阻害されると、RBはリン酸化されないので、細胞周期はストップした状態に維持される。老化した細胞(分裂能を喪失した細胞)ではp16INK4aの発現量が増えており、p16INK4aは細胞の老化のマーカーとして知られている。
【副作用の強いがん治療は老化を促進し、寿命を短縮する】
一般的に、正常細胞に毒性の強い抗がん剤は、正常な細胞のDNAやタンパク質や細胞膜にダメージを与えるので、基本的には細胞や組織の老化を促進し、寿命を短くする可能性があります。二次的に別のがん(2次がん)を発症させるリスクや、免疫機能が傷害されると感染症を引き起こすリスクも高くなります。
最近は何年間も抗がん剤治療を受けている患者さんが増えています。昔は、進行がんで抗がん剤治療を受けても、短期間で効かなくなって終了することが多かったのですが、最近は使える抗がん剤の種類が増え、治療法も進歩し、再発や転移がんでも抗がん剤や放射線治療を受けながら長い期間がん治療を受けている患者さんが増えています。このような場合、抗がん剤の副作用による諸臓器の機能低下や組織の老化促進が問題になってきます。
がんがある程度進行している場合は、外科切除の後(場合によっては切除前)に抗がん剤治療が行われます。これを補助化学療法(Adjuvant chemotherapy)といいます。
補助化学療法は、正常細胞へのダメージによって、内分泌系の異常、認知力低下、心血管系疾患、神経や筋肉系の異常、別のがんの発生(2次がん)など、長期的なデメリットを有する可能性が指摘されていますが、短期的には生存率を高める効果があるため、メリットの方が高いという判断で、標準的に行われています。
補助化学療法の長期的な副作用や後遺症やデメリットについてはあまり重視されていませんが、実際は極めて重要であり、それを防ぐ方法を知ることはがんサバイバーには必要です。
例えば、ホジキンリンパ腫は30年前は治癒しない腫瘍でしたが、現在では強力な抗がん剤治療と放射線治療の組合せによって7~8割が治るようになっています。
しかし、このような治療を受けた患者の25年間の2次がん(乳がん、肺がん、消化器がん、甲状腺がん)の発症率は22%におよぶという報告があります。20歳以下でホジキン病の治療(抗がん剤+放射線治療)を受けた女性患者が10年間で乳がんを発症する率は40%という報告もあります。白血病や心筋傷害は数%の率で発症しています。
その他、多くのがんで強力な抗がん剤治療や放射線治療で治療成績は向上していますが、強力な治療ほど長期的な副作用(認知力の低下、心機能低下、2次がん、など)が問題になっています。体や細胞の老化を促進したり、寿命を短縮する可能性も指摘されています。
乳がんの補助化学療法を受けた患者さんは老化が10年~15年程度進む可能性を示唆する報告があります。以下のような論文があります。
Effect of Cytotoxic Chemotherapy on Markers of Molecular Age in Patients With Breast Cancer (乳がん患者における寿命のマーカーに対する細胞傷害性抗がん剤の作用)J Natl Cancer Inst. 2014 Apr; 106(4):dju057. doi: 10.1093/jnci/dju057. Epub 2014 Mar 28.
【要旨】
研究の背景:p16INK4aを発現している老化した細胞は生体の加齢とともに増え、老化関連疾患の発症に関与している。細胞傷害性の抗がん剤が生物学的な老化を促進するかどうかを明らかにする目的で、補助化学療法を受けた乳がん患者において、p16INK4aおよびその他の老化関連マーカーを測定した。
方法:ステージIからIIIの乳がん患者33名を対象に、①アントラサイクリンをベースにした抗がん剤治療の前、②抗がん剤治療の終了直後、③抗がん剤治療終了の3ヶ月後、④抗がん剤治療終了の12ヶ月後の4つの時点において、血液と臨床的情報を収集した。
CD3陽性T細胞を採取して、細胞老化のマーカーであるp16INK4αとARF遺伝子のmRNAの発現量、テロメアの長さ、老化関連のサイトカインの定量を行った。
176例の乳がん(治療後平均期間が3.4年、39%が抗がん剤投与を受けている)の別の集団を対象にした検討も実施した。
結果:前向きに解析した患者において、p16INK4αとARFのmRNAの発現量は抗がん剤治療直後から上昇し、治療後12ヶ月経過した時点でも高い値を維持していた。
P16INK4αの上昇率の中央値は75%であり、この値は、生物学的な加齢に換算すると14.7年分の加齢に相当する。ARFの発現量も同程度に増加した。
P16INK4αとARFの発現量の増加は、抗がん剤投与量と血液学的毒性の程度と相関していた。
2種類の老化関連のサイトカイン(VEGFAとMCP1)は補助化学療法によって持続的に上昇した。
テロメアの長さは抗がん剤治療で変化は認めなかった。
別の集団での検討では、抗がん剤治療を受けた患者ではp16INK4αの発現量が増加し、それは10.4年の加齢促進に相当する増加であった。
結論:乳がんに対する補助化学療法は、生体内における細胞の老化を促進し、造血組織の加齢を促進する作用がある。
この論文では、乳がん患者の2つの集団(コホート)で検討しています。一つは33人の乳がん患者を経時的に追跡する前向き研究で、もう一つは治療後平均3.4年が経過している乳がんサバイバーのコホートで、このコホートにおいて補助化学療法を受けた人と受けていない人で比較しています。
末梢血のT細胞のP16INK4aやARF遺伝子の発現量は加齢とともに増加することが知られており、この遺伝子発現量(mRNA量)を老化のマーカーとして検討すると、乳がんで術前あるいは術後の補助化学療法は、加齢を10~15年分促進する(つまり、寿命を10~15年間ほど短縮する)というデータが得られたということです。
ARFとはAlternative Reading Frameの意味で、p16INK4aとARF遺伝子は同じ遺伝子領域から転写されますが、p16INK4とは違ったコーディングフレーム(cording frame)を利用して作られるのがARFで、これも老化のマーカーです。
ヒトでは、p16は染色体9p21で、他の2つの腫瘍抑制遺伝子であるp15とARFに近接して見られます。p16遺伝子とARF遺伝子は同じ遺伝子座から選択的にスプライシングされますが、最初のエクソンが異なるため、結果として得られるタンパク質配列は異なります。最終的に老化につながるシグナルは、p16およびp15細胞周期遺伝子をアップレギュレーションします。
P16は、CDK4 / 6キナーゼに作用して網膜芽細胞腫(Rb)ファミリータンパク質のリン酸化を防ぎ、G1細胞周期の停止を促進して老化を引き起こすサイクリン依存性キナーゼ阻害剤です。ARFは、p53腫瘍抑制経路を介して老化を促進します。
P16の発現は、若い細胞では検出されず強力に細胞老化促進のストレス因子によって活性化されます。これにより、細胞増殖が永久に停止し、老化表現型の維持に必要なp16転写産物が維持されます。
P16の発現は、これまでに試験されたすべての哺乳動物種における年齢と共に指数関数的に増加します。

図:P16とARFのmRNAは同じ遺伝子座から発生するが、異なるペプチドをコードする。p16はエクソン1a、2、および3からコードされ、ARFはエクソン1b、2、および3からコードされる。p16は細胞周期依存性キナーゼCDK 4/6の阻害剤であり、その経路を介して細胞老化を誘導する。ARFはp53経路を介して老化を誘発する。
老化関連の遺伝子のp16INK4aとARFと2種類の老化関連のサイトカイン(VEGFAとMCP1)が抗がん剤治療によって増えているので、抗がん剤治療は老化を促進する、しかも、増えた量から換算すると、10年から15年に相当する年月の老化が促進していたというのがこの論文の結論です。
しかも、老化のマーカーは、前向き研究のコホートでは抗がん剤治療直後から上昇し、抗がん剤治療終了12ヶ月後も上昇しており、治療後平均3.4年が経過したコホートでも上昇が認められるので、抗がん剤治療による老化促進の影響は数年あるいは永久に持続する可能性が示唆されると言っています。
ただし、末梢血のTリンパ球だけの検討なので、体全体の寿命をそれだけ短縮するかどうかは不明です。造血組織は抗がん剤感受性が高くダメージを受けやすいので、このような顕著は差が出た可能性はあります。体全体では数年間かあるいはもっと短いかもしれません。
しかし、細胞傷害性の抗がん剤治療が細胞や体の老化を促進することは十分に納得できると思います。
乳がん治療にサイクリン依存性キナーゼ(CDK)4/6阻害剤パルボシクリブ(イブランス)が使用されています。 イブランスは、CDK4/6を阻害する経口分子標的薬です。イブランスはCDK4/6を選択的に阻害して、細胞周期の進行を停止させることにより、腫瘍の増殖を抑制すると考えられています。CDK4/6の阻害はP16INK4aの発現亢進と同じ効果なので、サイクリン依存性キナーゼ(CDK)4/6阻害剤パルボシクリブ(イブランス)は正常細胞に対して老化を促進して寿命を短縮する効果があると推測されます。
一般的に、抗がん剤はDNA損傷、テロメア短縮、エピジェネティックな変化、ミトコンドリア機能障害を引き起こし、老化細胞の誘導と蓄積につながります。次に、老化細胞は、幹細胞と組織の再生能力を制限し、炎症を増加させることにより、加齢に伴う衰退を引き起こします。(トップの図)
【がん患者は心臓血管疾患による死亡リスクが高い】
米国のがん登録データベースを解析した結果、がん患者の10人に一人が心血管死していることが報告されています。以下のような報告があります。
A population-based study of cardiovascular disease mortality risk in US cancer patients.(米国のがん患者における心臓血管疾患による死亡リスクに関する集団ベース研究)Eur Heart J. 2019 Dec 21;40(48):3889-3897.
この研究では、がん登録データベース(Surveillance, Epidemiology and End Results:SEER)から1973~2012年にがんと診断された患者323万4,256例を特定し、心臓血管疾患(心臓病、高血圧、脳血管疾患、動脈硬化、大動脈瘤)による死亡率を解析しました。その結果、がんによる死亡率は38%だった一方で、心臓血管疾患による死亡率は11%でした。心臓血管疾患死の76%は心疾患による死亡でした。
解析対象とした28種類のがんのうち、心臓血管疾患死亡率が最も高かったのは膀胱がん(19%)で、次いで喉頭がん(17%)、前立腺がん(17%)、子宮がん(16%)、大腸がん(14%)、乳がん(12%)の順でした。
心臓血管疾患死亡率よりがん死亡率が高かったがん種は、肺がん、肝がん、脳腫瘍、胃がん、胆嚢がん、膵がん、食道がん、卵巣がん、骨髄腫などの侵襲性が高く治療困難ながんでした。
また、がん診断時に35歳未満であった患者で心血管疾患による死亡リスクが最も高く、がん診断時に55歳未満であったがんサバイバーでは、将来の心血管疾患死亡リスクが一般人口の10倍超に達していました。
さらに、心血管疾患死亡リスクが最も高い時期はがん診断後1年間でした。
その要因として、がん診断時点での心臓血管疾患の合併や診断後の積極的治療(心毒性が高い治療)などが挙げています。
【多くの抗がん剤に心臓毒性が認められている】
抗がん剤の副作用としては、白血球や血小板が減少する骨髄抑制と、吐き気や下痢などの消化器毒性がよく知られていますが、その他に、心臓、肝臓、腎臓、肺、神経系などの主要臓器に障害をきたすこともあります。多くの抗がん剤は心臓に対する毒性を示します。
がん治療が心血管系に及ぼす影響は多岐にわたり、心機能障害・心不全、冠動脈疾患、心臓弁膜症、不整脈、高血圧症、血栓塞栓症、末梢動脈疾患、肺高血圧症など、ほぼ全ての循環器疾患の発症あるいは悪化要因となります。
がん治療における心毒性の重要性は、1970年代にドキソルビシン(アドリアマイシン)などのアントラサイクリン系抗がん剤による心筋症の報告によって認識されるようになりました。
ドキソルビシンによる心毒性は、1)投与後数時間以内に発現し、可逆性の不整脈などが主体の急性毒性、2)投与の数日後から数週間以内に発現する心筋炎や心外膜炎などの亜急性毒性、3)投与後数週間から数ヶ月以上して発現する慢性毒性の3種類に分類されます。
一般的には、ドキソルビシンの心臓毒性とは3の慢性毒性を指し、心筋障害による致死的なうっ血性心不全を来すことが知られています。
このように、投与後数ヶ月以上、あるいは1年以上も経過して出現する心毒性が報告されたことから、アントラサイクリン系抗がん剤の心毒性についての関心が大きくなりました。
この慢性毒性(心筋症)はドキソルビシンの総投与量が多くなるほど発症率が高まります。450mg/m2を超えると発現頻度が高くなり、1000mg/m2を超えると50%に達すると言われています。
うっ血性心不全を発現すると、利尿剤やジギタリス製剤などの治療に対する反応が悪く、死亡率が30~60%と極めて高いと言われています。
高齢者や心疾患を持っていたり、左乳房や縦隔への放射線照射との併用や、心臓毒性を持つ他の抗がん剤との併用の場合は、特に心臓毒性に対する注意が必要です。
アントラサイクリン系抗がん薬は蓄積性に心筋障害を起こすので、投与量を計画的に制限することでその発症を大幅に減少させることが可能になりました。つまり、経験的にドキソルビシンは500mg/m2が累積上限量とされています。
心臓毒性を示す抗がん剤としては、ドキソルビシン(アドリアマイシン)などのアントラサイクリン系抗がん剤の他に、シクロホスファミド、5-フルオロウラシル、パクリタキセル、ハーセプチンなども心臓毒性の発現が報告されています。
細胞毒性の強い通常の抗がん剤に比べて、分子標的薬や免疫チェックポイント阻害薬は心臓毒性が少ないと思われてました。しかし、このような新薬でも心臓への副作用が発症することが明らかになりました。
HER2受容体を特異的に阻害する抗体薬であるトラスツズマブ(ハーセプチン)の出現は、増殖性が強く難治性であったHER2陽性乳がんの予後を著明に改善しました。しかし、HER2受容体が心筋細胞にも存在しているため、投与前には予想されていなかった心不全が重大な副作用として明らかになりました。
一般に、HER2阻害薬(トラスツズマブ、ラパチニブ、ペルツズマブなど)による心毒性は累積投与量に依存しないと言われています。大部分が可逆性ですが、不可逆性に心機能低下を来す場合もあります。
オプジーボなどの免疫チェックポイント阻害薬は多くのがん種で標準治療となりつつありますが、副作用として免疫関連有害事象(immnune-related adverse events)がさまざまな臓器で報告され、頻度は低いものの劇症型心筋炎による死亡例の報告もあります。
新しい抗がん剤が出現すると、さらに新しい作用に合わせた予想できない心毒性が出現する可能性があり、多くの抗がん剤で心臓に対する副作用が問題になってます(下図)。

図:多くの抗がん剤治療や放射線療法は循環器系に様々な毒性を示し、心不全や高血圧や虚血性心疾患や不整脈や心膜疾患や弁膜症などを引き起こす。
【がんサバイバーは循環器疾患の罹患率が高い】
がんから回復した患者(がんサバイバー)に、がん治療からかなり時期を経て静脈血栓症が多発することや、冠動脈疾患の発生率が高くなることが指摘されています。以下のような報告があります。
Medium and long-term risks of specific cardiovascular diseases in survivors of 20 adult cancers: a population-based cohort study using multiple linked UK electronic health records databases(20種の成人がんの生存者における特定の心血管疾患の中長期リスク:複数のリンクされた英国の電子健康記録データベースを使用した集団ベースのコホート研究)Lancet. 2019 Sep 21; 394(10203): 1041–1054.
【要旨】
背景:過去数十年でがんの生存率は大幅に改善したが、がん生存者の長期的な心血管疾患のリスクについて懸念がある。 しかし、予防と管理に役立つ広範ながん生存者における特定の心血管疾患のリスクに関するデータはほとんど無い。 この問題に対処するために、英国の電子健康記録データを使用して検討した。
方法:この集団ベースのコホート研究では、英国におけるプライマリケアや入院やがん登録のデータベースと連携しているUK Clinical Practice Research Datalink(CPRD GOLD)を用い、一般的な20種類のがんについて診断後12ヵ月時点で生存している18歳以上のサバイバー(生存者)、ならびに年齢や性別などをマッチさせたがんの既往がない対照群のコホートを特定し、粗および調整されたCoxモデルを使用して、さまざまな心血管疾患の発症のリスクを比較し、パラメトリック生存モデルを使用して、長期にわたるリスクを推定した。
結果:1990年1月1日から2015年12月31日の期間で、1年以上の追跡調査を受けがん患者12万6,120例と、対照群の患者63万144例が特定され、除外基準に合致した症例を除き、がんサバイバー群10万8,215例と対照群52万3,541例が主要解析に組み込まれた。
静脈血栓塞栓症のリスクは、20種類の部位特異的がんのうち18種類のがんの生存者で対照と比較して上昇した。調整されたハザード比は、前立腺がん患者の1.72(95%信頼区間: 1.57〜1.89)から膵臓がん患者の9.72(95%信頼区間:5.50–17.18)までの範囲であった。 ハザード比は時間経過とともに減少したが、診断後5年以上も上昇を認めた。
20種類のがんのうち、10種のがんサバイバーで心不全や心筋症のリスクが増加することが確認された。それぞれの調整ハザード比(95%信頼区間)は、非ホジキンリンパ腫1.94(1.66~2.25)、白血病1.77(1.50~2.09)、多発性骨髄腫3.29(2.59~4.18)、食道がん1.96(1.46~2.64)、肺がん1.82(1.52~2.17)、腎がん1.73(1.38~2.17)、卵巣がん1.59(1.19~2.12)などであった。
不整脈、心膜炎、冠動脈疾患、脳卒中、および心臓弁膜症のリスクの上昇も、血液悪性腫瘍を含む複数のがんで観察された。
心不全または心筋症および静脈血栓塞栓症のハザード比は、心血管疾患の既往のない患者および若い患者で大きかった。しかし、絶対的超過リスクは一般的に年齢の増加とともに大きくなった。これらの結果のリスクの増加は、化学療法を受けた患者で最も顕著であると思われた。
考察:ほとんどの種類のがんの生存者は。一般集団と比較して、1つまたは複数の心血管疾患の中期から長期のリスクが増加し、がんの種類によってかなりのばらつきを認めた。
代表的ながん20種について英国のデータベース(UK Clinical Practice Research Datalink)を用い、がんサバイバー10万8,215例に対し、年齢・性別・診療医をマッチさせた52万3,541例の対照において心血管疾患の発生を25年にわたって追跡した大規模疫学研究です。それぞれのがんについて心血管疾患の発生倍率を算出しています。
その結果、がんサバイバーのほとんどで、がん部位別でかなり違いはあるものの、一般集団と比較して心血管疾患の中~長期リスクの増加が確認されたという結果です。
過去数十年で、がんの生存率は顕著に改善してきましたが、サバイバーの長期的な心血管リスクについては懸念が指摘されていますが、さまざまながんサバイバーにおける心血管疾患の予防や管理に関するエビデンスが不足していました。
この研究で、血液、食道、肺、腎、卵巣等のがんサバイバーで心不全や心筋症のリスクが増加することが明らかになっています。
静脈血栓塞栓症のリスクは、対照群と比較して、20種類のがんのうち18種のサバイバー群で増加していました。補正ハザード比の範囲は、前立腺がん患者の1.72(95%信頼区間:1.57~1.89)から、膵臓がん患者の9.72(95%信頼区間:5.50~17.18)にわたっていました。ハザード比は経時的に減少したものの、診断後5年以上増加が続いていました。
不整脈(がん20種中8種)、心膜炎(データ完備のがん15種中8種)、冠動脈疾患(20種中5種)、脳卒中(20種中5種)、心臓弁膜症(データ完備の18種中3種)のリスク増加も確認されました。心不全または心筋症、および静脈血栓塞栓症のハザード比は、心血管疾患の既往歴がない患者および若年患者において高い結果でした。しかし、絶対超過リスクは、年齢の上昇に伴い徐々に増加し、これらのリスク増加は化学療法を受けた患者において最も顕著でした。
以上のように、抗がん剤治療は心血管系にダメージを与えて、多くのがんのサバイバーにおいて、心不全や心筋症や血栓症を増やすので、寿命を短縮する原因になります。
抗がん剤治療は心臓や血管以外にも、免疫細胞の老化を促進し、さらに多くの組織や臓器の細胞の老化を促進し、組織の幹細胞が枯渇し、再生能力が低下し、慢性炎症が起こし、寿命を短縮することになります。(トップの図)
| « 760) 世界中で... | 762)「がんは... » |



