がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
844) 抗腫瘍免疫の活性化:プロパゲルマニウムと低用量シクロホスファミドとピドチモドとセレコキシブ
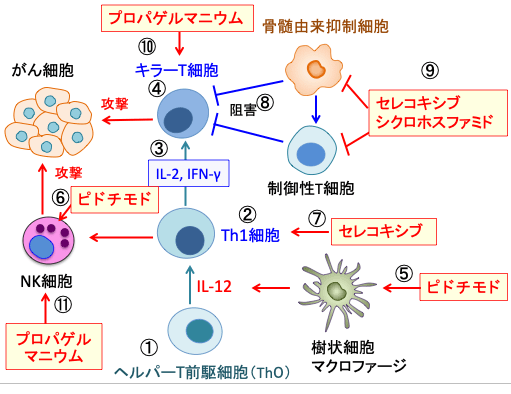
図:ヘルパーT前駆細胞(①)はサイトカインのIL-12によって1型ヘルパーT細胞(Th1)に分化誘導され(②)、Th1細胞はIL-2やIFN-γの産生を亢進し(③)、キラーT細胞の活性を高めてがん細胞に対する細胞性免疫を増強する(④)。ピドチモドは樹状細胞の成熟とIL-12産生を促進して(⑤)、ナチュラルキラー細胞(NK細胞)を活性化する(⑥)。セレコキシブはTh1細胞の活性を高める(⑦)。骨髄由来抑制細胞と制御性T細胞はキラーT細胞の働きを抑制する(⑧)。COX-2阻害剤のセレコキシブ(Celecoxib)と低用量のシクロホスファミドは骨髄由来抑制細胞と制御性T細胞の増殖や活性化を阻止する(⑨)。プロパゲルマニウムはキラーT細胞(⑩)やナチュラルキラー細胞(NK細胞⑪)の働きを高めて、がん細胞への攻撃を強化する。
844) 抗腫瘍免疫の活性化:プロパゲルマニウムと低用量シクロホスファミドとピドチモドとセレコキシブ
【自然免疫と獲得免疫】
免疫システムは病原体やがん細胞から生体を守る働きを担っています。この免疫システムは自然免疫と獲得免疫に分けられます。
自然免疫は先天的に備わった免疫で、微生物などに特有の分子パターンを認識して異物を攻撃します。マクロファージや好中球には細菌などの病原体に共通した情報を認識できる受容体を細胞表面に持っていて病原体を認識して貪食します。さらにマクロファージはナチュラルキラー細胞を活性化します。
一方、獲得免疫は,後天的に外来異物の刺激に応じて形成される免疫です。高度な抗原特異性と免疫記憶を特徴とします。(下図)

図:細菌やウイルスなどの病原菌に対して好中球やマクロファージやナチュラルキラー(NK)細胞が排除する。抗原による感作の必要のない第一次防衛機構が「自然免疫」となる(①)。病原菌の抗原が樹状細胞に取り込まれ(②)、抗原を貪食した樹状細胞はリンパ節に移動して抗原の情報をT細胞やB細胞に渡して活性化し(③)、病原菌に対する抗原特異的な免疫応答によって病原菌を排除する(④)。この抗原特異的な免疫応答が「獲得免疫」となる(⑤)。
病原微生物が侵入したり、何らかの原因で炎症が起こると、血管から顆粒球や単球などが遊走して来ます。このように炎症反応によって集まってきたり、あるいは組織に常在していた樹状細胞やマクロファージは、侵入した細菌やウイルス粒子、あるいは死滅した細胞の死骸や断片などを取り込み、リンパ液の流れに沿って所属リンパ節に移動します。
樹状細胞やマクロファージは取り込んだタンパク質を分解し、その結果産生されたペプチド(アミノ酸が数個から数十個つながったもの)をMHC(major histocompatibility complex:主要組織適合抗原複合体)分子の上に提示します。
活性化した樹状細胞はリンパ節で手当たりしだいにナイーブT細胞(まだ一度も活性化されたことのないT細胞)とくっつきあって、何かを確かめます。ナイーブT細胞はその表面にT細胞抗原認識受容体(TCR)を持っています。樹状細胞の表面に提示されたMHC+抗原ペプチドとピタッとくっつく受容体(TCR)をもったナイーブT細胞と出会うと、そのT細胞を活性化します。
抗原を提示して活性化している樹状細胞にはCD80/86という補助刺激因子が発現しており、T細胞のCD28と結合し、刺激を送ります。
さらに、活性化した樹状細胞はサイトカインを放出しており、ナイーブT細胞はそれを浴びることになります。
このようにT細胞抗原認識受容体(TCR)を介するシグナルとCD28を介する補助刺激とサイトカインによる刺激を同時に受けたTリンパ球は初めて活性化し、TCRの特異性を保ったままで分裂・増殖して自らのクローンを増やします。
CD4陽性T細胞(ヘルパーT細胞)は、Th1またはTh2のパターンを示すサイトカイン産生細胞へと分化します。
CD8陽性T細胞(キラーT細胞)は成熟し、細胞質内にパーフォリンやグランザイムなどを含んだ細胞傷害顆粒を持つエフェクター細胞になります。
エフェクター細胞はリンパ節を離れ、胸管を経て循環血液中へと流れ込み、血流に従って全身を巡ります。炎症の起こっている組織から産生されるサイトカインやケモカインなどの作用でエフェクターT細胞は炎症部位に集まり、病原菌やがん細胞の攻撃に参加します。
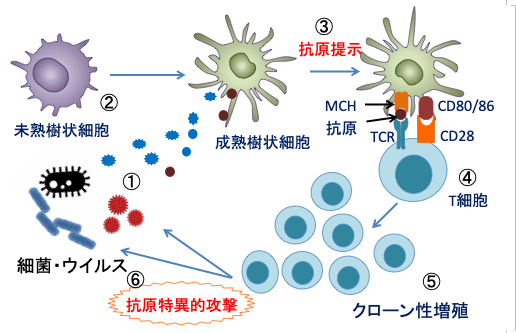
図:病原菌(細菌やウイルスなど)に由来する抗原(①)を未熟樹状細胞(②)が取り込んで成熟して抗原を提示するとき(③)、MCH(major histocompatibility complex:主要組織適合抗原複合体)分子にペプチド抗原を載せて細胞傷害性T細胞やヘルパーT細胞に提示する(④)。このとき、MCH+ペプチド抗原にぴったり結合するTCR(T細胞受容体)を持つT細胞は、補助刺激因子(CD28とCD80/86など)や樹状細胞から放出されるサイトカインの働きで活性化され、抗原を認識するT細胞がクローン性に増殖し(⑤)、病原菌を抗原特異的に攻撃する(⑥)。
この様に病原菌やがん細胞に対してリンパ球が抗原特異的に攻撃する場合、T細胞やB細胞などのリンパ球がクローン性に増殖する必要があります。「リンパ球のクローン性増殖」とは、ターゲットとなる病原菌やがん細胞に特異的に反応するリンパ球が細胞分裂を繰り返して同じ細胞を増やすことです。
【がん細胞は様々なメカニズムで免疫監視機構から逃れている】
私たちの体内では、毎日多数のがん細胞ができていますが、免疫監視の機能が正常であれば、がん細胞が増殖して成長することは無いと考えられています。しかし現実は、発生したがん細胞は増殖し、転移しています。それには大きく分けて2つの理由があります。
一つは「免疫監視機構」の機能が低下して、がん細胞を排除できないという理由です。これにはエフェクター細胞(キラーT細胞やNK細胞など)の機能低下や、免疫抑制性の要因(制御性T細胞や骨髄由来抑制細胞など)の存在などが含まれます。
もう一つは、がん細胞が抗原性を低下させているという理由です。がん細胞は不均一な集団で、がん抗原の発現の低いがん細胞が免疫監視機構による排除を回避して選択的に生き残る可能性があります。がん抗原の発現が低下すれば、免疫細胞は正常細胞と区別できないので、そのがん細胞を排除できません。
がん免疫監視機構が存在するにもかかわらず、がん細胞が発生し進行する理由を米国ワシントン大学医学部のR.D. Schreiberらは「がん免疫編集説(cancer immunoediting)」で説明しています。
この「がん免疫編集説」では、発がんにおける免疫系とがんの関わりは「排除相(Elimination)」「平衡相(equilibrium)」「逃避相(escape)」とよばれる3 相に分けられます。
最初に出現した変異細胞(がん細胞)は免疫原性が高いため、免疫監視機構によって異物と判断され、免疫担当細胞が攻撃することによって排除されます(排除相)。
しかし免疫原性の低い(免疫応答が容易に誘導されるがん抗原を有しない)がん細胞は免疫担当細胞からの攻撃にさらされないため、排除されることなく長期にわたって選択的に生存します(平衡相)。
さらに、がん組織内に免疫抑制性の細胞(骨髄由来抑制細胞や制御性T細胞など)や因子(プロスタグラジンE2や組織の酸性化など)が増え、積極的に抗腫瘍免疫応答を抑制する環境を作り上げ、免疫系からの攻撃を逃避することで無限に増殖し臨床的がんになります(逃避相)。
つまり、がん細胞は免疫系からの攻撃を受けにくい免疫原性の低いがん細胞を選択する(免疫選択)とともに、生体に備わっている様々な免疫抑制機構を用いて免疫系から逃避(免疫逃避)することで、 生体内で増殖し臨床的な「がん」となるということです。
したがって、がん免疫療法を成功させるには,がん細胞によって構築された免疫抑制ネットワークを解除すると共に,免疫原性の低いがん細胞に対して強力な免疫応答を誘導する必要があります。

図:がん細胞が発生すると、がん細胞に存在するがん抗原をターゲットにして樹状細胞やマクロファージやキラーT細胞などの免疫担当細胞(エフェキター細胞)ががん細胞を攻撃し(①)。がん細胞は免疫的に排除される(②)。がん抗原を多く発現している「免疫原性の高い変異細胞(がん細胞)」はこの排除相で排除されるが、がん抗原の発現の弱い「免疫原性の低い変異細胞(がん細胞)」は免疫担当細胞からの攻撃が弱いので、排除されることなく長期にわたって選択的に生存する(③)。この状態を平衡相と言う。がん細胞を攻撃するエフェクター細胞の働きを阻害する骨髄由来抑制細胞(MDSC)や制御性T細胞(Treg)やM2型腫瘍関連マクロファージ(TAM)や免疫阻害因子(プロスタグランジンE2やキヌレニンや乳酸など)によってエフェクター細胞の機能が低下すると、がん細胞は免疫監視から逃避して増殖し、臨床的がんになる(⑤)。これを逃避相と言う。がん細胞は抗腫瘍免疫応答を抑制する環境を積極的に構築している。
【がん細胞は多数のがん抗原を持っている】
がん細胞は、遺伝子の突然変異によって正常な増殖制御を失うことで発生します。さらに、がんが進行する過程で、ゲノムの不安定性に基づく遺伝子変異を蓄積します。
これらの遺伝子変異は正常とは異なる変異タンパク質を作ります。この変異タンパク質は免疫系に「非自己」として認識され、免疫応答の標的として免疫反応を強く誘導する抗原となります。このような抗原をネオアンチゲン(neoantigen)と言います。
ネオアンチゲンはがん細胞の遺伝子変異の結果,アミノ酸が置き換わって新規に生じた抗原で、もともとの宿主体内には存在しなかった抗原であるため、がん細胞を排除するキラーT細胞のターゲットになります。つまり、ネオアンチゲンはがんワクチンの候補となります。
免疫系は正常な「自己」の抗原には反応しませんが、ネオアンチゲンは正常な細胞には存在しないため「非自己」として認識されて強い免疫反応の標的になるのです。
先ほどの「がん免疫編集説」では、排除相(elimination)では生体内に生じた変異細胞(がん細胞)が種々の免疫細胞により排除されますが、排除相で排除しきれなかった免疫原性の低い(免疫応答が起こりにくい)変異細胞が生き残ります。つまり、免疫応答が起こりにくいがん細胞が生き残るように免疫系により編集(edition)を受けているのです。
これは抗がん剤治療と同じです。抗がん剤投与によってその抗がん剤に感受性のあるがん細胞は死滅しますが、その抗がん剤に耐性のがん細胞が選択的に生き残ります。
同様にネオアンチゲンを特定してがんワクチンを作っても、いずれはそのネオアンチゲンを持たないがん細胞が生き残って、免疫監視から逃避します。
そこで、がん細胞に存在する(あるいは治療に伴って新たに出現する)多様ながん抗原に生体内で免疫細胞が作用する環境を整える方が治療戦略としては合理的だといえます。
つまり、「抗腫瘍免疫応答を抑制するメカニズムや微小環境の改善」、「がん細胞を攻撃するエフェクター細胞の活性化」、「がん抗原の認識を高める」という3つを同時に行えば、多様ながん抗原をターゲットにしたがん免疫療法が実践できます。

図:がん細胞が死滅するとがん抗原が放出され、樹状細胞を活性化し、さらにキラーT細胞などがん細胞を攻撃する免疫担当細胞の活性を高める(①)。免疫担当細胞(キラーT細胞やNK細胞など)はがん細胞を死滅させ排除するように働く(②)。がん組織から炎症性サイトカインやケモカインなどが産生され(③)、制御性T細胞(Treg)や骨髄由来抑制細胞(MDSC)や腫瘍関連マクロファージ(TAM)などが動員され(③)、免疫担当細胞の働きを抑制する(④)。したがって、がん免疫療法を成功させるには,免疫担当細胞の活性を高め、がん細胞によって構築された免疫抑制ネットワークを解除すると共に、免疫原性の低いがん細胞に対して強力な免疫応答を誘導する必要がある。
例えば、ビタミンやミネラルやタンパク質の欠如は免疫担当細胞の働きを低下させます。したがって、栄養状態を良くすることはがん免疫治療において重要です。
がん細胞は抗腫瘍免疫応答を抑制する微小環境を積極的に作り上げています。この免疫抑制ネットワークの解除ができなければ、がん免疫療法は成功しません。
がん細胞の解糖系を抑制し、ミトコンドリアが活性化して、がん組織の酸性化を軽減するだけで、免疫担当細胞の活性が高まります。
がん細胞のがん抗原の発現を増やすことは困難ですが、がん抗原の認識と免疫応答を増強することは、がん細胞の排除に必要です。
【プロパゲルマニウムは抗腫瘍免疫を増強する】
プロパゲルマニウムはB型慢性肝炎の治療に使用されている経口薬です。商品名はセロシオンで、1994年に承認されてから使われている既存薬です。
プロパゲルマニウムは、IL-1、IL-2、IFN-γ産生増強などによって細胞傷害性T細胞(キラーT細胞)やNK細胞を賦活化します。
さらに、CCL2/CCR2経路を阻害しがん細胞の転移を抑制することが報告されています。
がん組織からCCL2というケモカインが分泌されています。ケモカインはサイトカインの一種で、白血球などの遊走を引き起こすタンパク質です。
CCL2は別名を単球走化性タンパク質-1と言い、創傷部位やがん組織にマクロファージや単球を動員する作用があります。がん組織に動員された腫瘍関連マクロファージはシクロオキシゲナーゼ-2(COX-2)から産生されるプロスタグランジンE2や、シグナル伝達兼転写活性化因子3(STAT3)の活性化によってM2型の腫瘍関連マクロファージになり、がん細胞の増殖や転移を促進します。(下図)

図:がん細胞からケモカインのCCL2が分泌され(①)、マクロファージのケモカイン受容体のCCR2に結合すると(②)、マクロファージはがん組織へと誘引され、腫瘍関連マクロファージとしてがん細胞の増殖を助ける(③)。腫瘍関連マクロファージはシクロオキシゲナーゼ-2(COX-2)から産生されるプロスタグランジンE2や、シグナル伝達兼転写活性化因子3(STAT3)の活性化によって(④)M2型の腫瘍関連マクロファージになり(⑤)、がん細胞の増殖や転移を促進する(⑥)。
がん組織内や周囲にいる線維芽細胞から、CCL2と呼ばれるタンパク質が過剰に分泌されて、がん細胞の周りに単球細胞(マクロファージ)を異常に呼び寄せています。プロパゲルマニウムはCCL2の働きを阻害します。
九州大学生体防御医学研究所の中山敬一教授らの研究グループは、プロパゲルマニウムをマウスに投与したところ、単球細胞の集積がみられなくなり、転移先でのがん細胞の増殖が抑えられることを報告しています。
プロパゲルマニウム治療で進行がんが消滅する例も報告されています。以下のような報告があります。
Propagermanium Induces NK Cell Maturation and Tends to Prolong Overall Survival of Patients With Refractory Cancer(プロパゲルマニウムはNK細胞の成熟を誘導し、難治性がん患者の全生存期間を延長する傾向がある)Anticancer Res . 2019 Sep;39(9):4687-4698.
この研究では、難治性の口腔がん(8例)と胃がん(15例)の患者がプロパゲルマニウム(30mg/日)を投与されました。プロパゲルマニウムの投与はナチュラルキラー細胞(NK細胞)の成熟を促進し、がん細胞のアポトーシスが増加しました。胃がん患者の全生存期間の中央値は172日で、2人の患者は肺または肝臓の転移が消滅しました。口腔がん患者の生存期間も延長する傾向が認められました。
以上から、プロパゲルマニウムは細胞傷害性T細胞(キラーT細胞)やNK細胞を活性化し、抗腫瘍免疫を増強してがん細胞を死滅する効果があると考察しています。
【低用量のシクロホスホスファミドは抗腫瘍免疫を活性化する】
シクロホスファミド(商品名:エンドキサン)は、ナイトロジェンマスタードの流れをくむアルキル化剤に分類される抗悪性腫瘍剤です。免疫抑制剤としてリュウマチ性疾患やネフローゼ症候群の治療にも使われています。
DNAをアルキル化してがん細胞(分裂している細胞)を死滅させます。 がん治療の場合は、1日100~200mgの服用で、自己免疫疾患の場合は1日50mg程度を服用します。
シクロホスファミドの低用量メトロノミック投与が、抗腫瘍免疫を活性化して、大きな腫瘍を消滅できるという実験結果が報告されています。メトロノミック(metronomic)とは、リズムを刻む「メトロノームの様な」という意味で、メトロノームのように規則的に低用量の薬(抗がん剤など)を頻回に投与していく治療法です。以下のような報告があります。
Metronomic cyclophosphamide eradicates large implanted GL261 gliomas by activating antitumor Cd8+ T-cell responses and immune memory.(シクロホスファミドのメトロノミック投与は、抗腫瘍性のCD8陽性T細胞応答と免疫記憶を活性化することによって、大きなGL261グリオーマ移植腫瘍を消滅させる)Oncoimmunology. 2015 Feb 18;4(4):e1005521.
免疫系が正常なマウスにGL261グリオーマ細胞を移植した実験系を用い、6日おきのシクロホスファミドのメトロノミック投与の効果を検討しました。 シクロホスファミドの6日おきのメトロノミック投与の2サイクルの治療で、腫瘍細胞特異的なCD8陽性細胞傷害性T細胞(CTL)とナチュラルキラー(NK)細胞、マクロファージ、その他の免疫細胞を増やし、活性化しました。 このようなCTLやNK細胞といったエフェクター細胞はシクロホスファミド投与の6日後にピークになりその後減少しました。制御性T細胞の数はCTLやNK細胞と逆の動きを示しました。
間歇的なシクロホスファミドを数回繰り返すことによって腫瘍は縮小し、消滅しました。 腫瘍の消滅にはCD8陽性キラーT細胞(CTL)が必要でした。GL261細胞の再移植に対して、末梢血中のCTLの増加と腫瘍組織でのCTLの浸潤が認められ、抗原特異的な免疫記憶が成立していました。
以上の結果から、抗がん剤のシクロホスファミドの単独の投与でも、その投与量と投与スケジュールを適切化すれば、大きな腫瘍を縮小させ、さらに消滅させ、免疫記憶を成立させることも可能であることが示されました。
シクロホスファミドを使ったメトロノミック化学療法は血管新生阻害作用によって抗腫瘍効果を示すと考えられています。しかし最近の研究では、自然免疫の活性化など免疫機能を介したメカニズムの関与が指摘されています。
この研究グループは、がん抗原特異的なキラーT細胞の活性化と移植腫瘍の縮小に、シクロホスファミドの間歇的な投薬スケジュールが有効だと報告しています。 シクロホスファミドで死滅すると免疫細胞が認識しやすい免疫原性細胞死を誘導します。
高用量だと、免疫原性細胞死を誘導しますが、免疫系も抑制されます。また、がん組織がダメージを受けると血管新生が促進され、がん組織の増大を招く場合もあります。
一方、低用量のメトロノミック投与の場合、免疫原性細胞死は起こりにくいのですが、血管新生が起こらず、骨髄由来抑制細胞(MDSC)と制御性T細胞(Treg)の活性は抑制され、細胞傷害性T細胞(CTL)やナチュラルキラー(NK)細胞は抑制されないので、抗原特異的な抗腫瘍免疫を活性化することができます。
つまり、低用量のメトロノミック投与は、最大耐用量を投与する通常の抗がん剤治療とは異なるメカニズムで腫瘍縮小効果を発揮します。 しかも、免疫記憶が成立するので、再発を予防できることになります。 
図:シクロホスファミドのメトロノミック(低用量頻回)な投与(①)は、キラーT細胞を抑制する制御性T細胞(Treg)や骨髄由来抑制細胞(MDSC)の活性を阻害する作用があり(②)、がん細胞を排除するキラーT細胞などによる抗腫瘍免疫を活性化する(③)。さらに、低用量の抗がん剤は血管新生を阻害する作用がある(④)。このように、シクロホスファミドの低用量頻回投与はと抗腫瘍免疫の活性化と血管新生の阻害によって、がんを消滅できる可能性がある(⑤)。
【ピドチモドは樹状細胞の成熟を促進する】
樹状細胞(Dendritic cell)は、細胞表面に突起構造を持っていることから名付けられ、高い運動性を有する免疫細胞の一種で、身体のあらゆる場所に存在しています。哺乳動物の免疫系では,最も強力な抗原提示細胞として機能しています。
末梢で病原体やがん細胞を食べて活性化した樹状細胞は最寄りのリンパ節に移動します。樹状細胞は取り込んだ細胞を細胞内で分解してペプチド(アミノ酸が数個つながったもの)にし、これらのペプチドはMHCという分子と結合して細胞表面に提示されます。
樹状細胞は活性化する前も「MHC+ペプチド」が提示されていますが、活性化されると、樹状の突起をめいっぱいに出して表面積を広げ、できるだけ多くの抗原を提示しようとします。 樹状細胞が提示する抗原と反応するヘルパーT細胞(CD4+)やキラーT細胞(CD8+)が活性化されて、リンパ球による抗原特異的な免疫応答が活性化されます。

図:腫瘍由来因子が未成熟な樹状細胞を骨髄から動員する(①)。末梢組織からも未熟樹状細胞が腫瘍組織に集まってくる(②)。死滅したがん細胞から放出されたがん抗原は未熟樹状細胞に取り込まれ、活性化されて成熟樹状細胞に分化誘導される(③)。成熟樹状細胞はリンパ節に移動し、MHCクラスI及びクラスIIに結合したがん抗原をTCR(T細胞受容体)を介して、CD4+T細胞(ヘルパーT細胞)とCD8+T細胞(キラーT細胞)に提示する(④)。抗原提示をうけて活性化したキラーT細胞はがん抗原特異的な免疫学的攻撃を行う(⑤)。
ピドチモド(Pidotimod)は、2つのアミノ酸が結合したようなジペプチド様構造の生体応答調節療剤(Biological Response Modifiers)の一種です。自然免疫と獲得免疫の両方を活性化する効果が知られており、感染症の予防や治療に有効であることが複数の臨床試験で明らかになっています。
例えば、上気道感染症や尿路感染症を頻回に繰り返す小児を対象にした臨床試験で、ピドチモドは感染症の発症頻度を減少させる効果が確認されています。 ピドチモドの免疫増強効果は老化やダウン症候群やがんのような免疫低下を起こしやすい状況でより高い効果が認められています。
ピドチモドの免疫刺激作用のメカニズムとして、樹状細胞の成熟を促進し(HLA-DRと補助刺激分子の発現亢進)、樹状細胞からの炎症性サイトカインの産生を刺激してT細胞の増殖とTh1フェノタイプへの分化誘導、ナチュラルキラー細胞(NK細胞)の機能亢進と貪食能の亢進などが報告されています。
ピドチモドはインターロイキン-12(IL-12)の産生を高める効果があります。IL-12は当初「NK細胞刺激因子」の名称で報告されたように、NK細胞に対する著明な活性化作用を特徴とするサイトカインです。IL-12はT細胞やNK細胞に対して細胞増殖の促進、細胞傷害活性誘導、IFN-γ産生誘導、LAK細胞誘導などの作用を示します。 このように、ピドチモドは自然免疫と獲得免疫の両方を活性化し増強します。
ピドチモドは1日400〜800mg程度を1日1〜2回に分けて空腹時に服用します。
経口摂取での生体利用率(bio-availability)は42〜44%で、血中の半減期は約4時間です。体内では代謝されずにそのままの形で尿中から排泄されます。
幾つかの国(イタリア、ギリシャ、中国、ベトナム、コスタリカ、ドミニカ共和国、エルサルバドル、グアテマラ、ホンジュラス、メキシコ、パナマ)で医薬品として販売されています。

図:ピドチモドは未熟樹状細胞を活性化して成熟樹状細胞に分化させる(①)。成熟樹状細胞はリンパ節に移動し、CD4+T細胞(ヘルパーT細胞)とCD8+T細胞(キラーT細胞)に抗原提示によって活性化する(②)。リンパ球のTh1フェノタイプを促進してIL-12, TNF-α,インターフェロン-γ(IFN-γ) の産生を亢進し、B細胞からIgGと分泌型IgAの産生を亢進する(③)。一方、Th2フェノタイプを抑制して抗アレルギー作用を示す(④)。ピドチモドはNK細胞、マクロファージ、好中球など自然免疫も活性化する(⑤)。これらの総合作用によって感染症やがんに対する免疫力を増強する(⑥)。
【COX-2阻害剤のセレコキシブは骨髄由来抑制細胞を抑制する】
免疫抑制性の細胞は、免疫反応を適切な時期に終息させたり、自己のタンパク質や食物に反応しないようにする働きがあります。もし異常に免疫系が活性化され続けたり、自己のタンパク質と反応すると、自己免疫疾患やアレルギー性疾患を引き起こします。 つまり、免疫応答を実行する細胞が暴走しないように抑制性の細胞やサイトカインや伝達物質が存在し、それによって免疫系が正常に働くことができるのです。
免疫抑制のメカニズムの一つに骨髄由来抑制細胞(Myeloid derived suppressor cell: MDSC)があります。この細胞は顆粒球のマーカーと単球/マクロファージのマーカーとを同時に発現している未熟な段階の骨髄由来細胞で、免疫反応を強力に抑制する働きを持っています。 骨髄由来抑制細胞はアルギナーゼや活性酸素、一酸化窒素、IL-10、TGF-βなどの産生を介して免疫担当細胞の活性を阻害したり、制御性T細胞(Treg)の誘導をきたすことによって免疫抑制作用を発揮します。
正常な場合には、免疫系が過剰に働いて自らの体を攻撃してしまう自己免疫疾患にならないように、骨髄由来抑制細胞や制御性T細胞がブレーキをかけています。つまりこれらの免疫抑制細胞は、健康な人にとっては、むしろ良い働きを担っています。
一方、担がん(体内にがんがある)状態では、骨髄由来抑制細胞ががん病巣部位のみならず循環血中やリンパ組織(リンパ節や脾臓など)においても増加することが報告されています。 末梢血中の骨髄由来抑制細胞の数が多いと予後が悪いという報告もあります。
がん細胞は免疫抑制性の骨髄由来抑制細胞をがん組織内に動員させることによって、キラーT細胞やNK細胞からの攻撃を抑えていることが明らかになっています。 つまり、がん細胞を攻撃・排除しようとするナチュラルキラー細胞(NK細胞)や細胞傷害性T細胞(キラーT細胞)の働きが、がん組織内では骨髄由来抑制細胞の増加によって抑制されているのです。

図:腫瘍組織からプロスタグランジンE2、IL-6、TGF-β、VEGF、GM−CSFなどの因子が産生される(①)。これらの腫瘍由来因子は血流によって骨髄に達し(②)、骨髄の前駆細胞から骨髄由来抑制細胞(MDSC)の増殖を促進する(③)。腫瘍組織から産生されるケモカイン(CXCL1/2やCXCL12など)がMDSCを腫瘍組織に誘導して集める(④)。腫瘍組織に集まったMDSCは細胞傷害性T細胞(CD8+T細胞)やナチュラルキラー細胞(NK細胞)の働きを阻害して抗腫瘍免疫を抑制する(⑤)。MDSCは成熟した樹状細胞やマクロファージに分化させることもできる(⑥)。
がん組織ではがん細胞やマクロファージが産生するシクロオキシゲナーゼ-2(COX-2)の活性亢進によってプロスタグランジンE2(PGE2)の産生が高まっています。 PGE2ががん組織に骨髄由来免疫抑制細胞を動員し、免疫担当細胞の働きを弱めることによって、免疫細胞の攻撃からがん細胞を守っていることが明らかになっています。 COX-2阻害剤のセレコキシブ(celecoxib)が骨髄由来抑制細胞の働きを阻害して、免疫療法の効き目を高めることが報告されています。

図:がん組織内ではがん細胞と炎症細胞からのシクロオキシゲナーゼ-2(COX-2)の発現と活性が亢進している(①)。COX-2はプロスタグランジンE2(PGE2)の産生を増やし(②)、PGE2は免疫担当細胞(樹状細胞、リンパ球、NK細胞など)の働きを抑制する(③)。一方、PGE2は骨髄由来抑制細胞を動員しがん組織内で増え、活性化する(④)。この骨髄由来抑制細胞は免疫担当細胞の働きを抑制する(⑤)。セレコキシブはCOX-2活性を阻害することによって、抗腫瘍免疫を活性化する(⑥)。
【メトロノミック化学療法が注目されている】
通常の化学療法(抗がん剤治療)は、副作用が耐えられる最大量(最大耐用量)を投与してがん細胞を短期間で死滅させる方法が基本になっています。50年以上にわたって、がん治療の基本になっています。この最大耐用量の化学療法はがん細胞を死滅させることが目的なので、できるだけ大量の抗がん剤を使うのが良いと考えます。白血病や悪性リンパ腫ではこの方法が有効です。
しかし、固形がんの場合は、この方法は必ずしも有効ではありません。 精巣腫瘍や小細胞性肺がんのように抗がん剤治療が著効を示す固形がんもありますが、多くの固形がん(肺がんや膵臓がんや胃がんなど)に対しては、抗がん剤の効き目は極めて限定的です。 固形がんの多くは抗がん剤治療に抵抗性を示し、抗がん剤治療だけでは全身に広がったがん細胞を根絶させることは、ほぼ不可能です。
抗がん剤の投与量を増やせば増やすほど、がん細胞を死滅させる効果は強くなります。しかし一方、抗がん剤の投与量が増えれば増えるほど正常細胞のダメージによる副作用が強くなり、投与量が限界を超えれば患者さん自身が死亡してしまいます。
患者さんが副作用に耐えられる投与量の範囲で最大限の投与量を設定するのが、最も効果が高いという意見が主流ですが、これはがん細胞だけをターゲットにしているからです。この最大耐用量の抗がん剤投与の方法には様々なデメリットと欠陥が指摘されています。
正常組織にダメージを与えて強い副作用を引き起こすだけでなく、免疫力を低下させたり、がん組織の血管新生を促進する可能性や、抗がん剤耐性のがん細胞の出現を促進する可能性などが指摘されています。
メトロノミック化学療法は、化学療法剤を長期の休薬期間なしに毒性のない用量で頻回に投与する治療法と定義され、当初は治療標的を腫瘍細胞から腫瘍内皮細胞(血管新生の阻害)に移すことで薬剤耐性を克服するように設計されました。
さらに、メトロノミック化学療法が、免疫系および腫瘍細胞に対しても抗腫瘍効果を発揮することが明らかになっています。メトロノミック化学療法に免疫療法に追加すると、相乗的に臨床転帰を改善できることが報告されています。
| « 843) 駆虫薬が... | 845)がん治療... » |



