がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
793) がん治療の効果を高める絶食と絶食模倣食
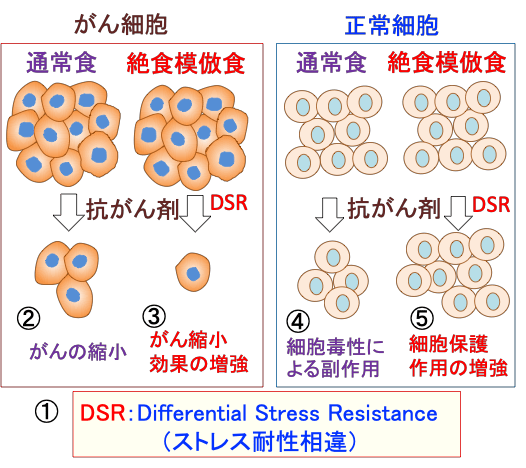
図:正常細胞とがん細胞は飢餓ストレスに対する耐性に相違があり、これを「ストレス耐性相違(Differential Stress Resistance, DSR)」という。抗がん剤治療を行うと、がん細胞が死滅してがんは縮小する(②)。この時、絶食や絶食模倣食を行うと、がん細胞の増殖や生存を促進する成長因子(インスリンやIGF-1など)の血中濃度が低下し、抗がん剤によるがん細胞死滅作用が増強し、がん縮小効果を高めることができる(③)。一方、正常細胞は、細胞毒性によって副作用が起こる(④)。絶食または絶食模倣食を行うと、DSR(ストレス耐性相違)によって細胞保護作用が増強して、副作用が軽減する(④)。
793) がん治療の効果を高める絶食と絶食模倣食
【抗がん剤治療や放射線治療の治療指数を高める方法が求められている】
副作用が抗がん剤治療の効果の限界の原因になっています。たとえば、ドキソルビシンの心筋傷害やシスプラチンの腎障害のように、抗がん剤による臓器障害の存在が、抗がん剤の投与量を制限し、そのためにがん細胞への十分な効果が得られない結果になっています。
「抗がん剤による正常細胞のダメージを軽減し、同時にがん細胞へのダメージは軽減しない(むしろ高める)」という都合の良い方法を見つけることが、抗がん剤治療や放射線治療の成績を高めることにつながります。
抗がん剤を全身に投与したとき、体に毒性を示す濃度と、効果が出る有効濃度との比率を治療指数(Therapeutic index)と言います。例えば、正常細胞の50%が死滅する量(半数致死量LD50)をがん細胞の50%が死滅する量(半数効果用量ED50)で割った(除した)値です。
通常の抗がん剤の治療指数は1.4~1.8と言われています。この治療指数が大きいほど、副作用が少なく抗腫瘍効果が大きくなります。
がん細胞が100%死滅する抗がん剤を投与すれば、がんは根治します。しかし、がん細胞が100%死滅する量を全身に投与すると、正常細胞のダメージが強く、多くの場合、宿主が死亡することになります。がん細胞が100%死滅する量の抗がん剤が使えないのが、抗がん剤だけでは多くの固形がんを根治できない理由です。
局所のがん組織をピンポイントで狙った放射線照射や、抗がん剤の局所投与の場合は、全身の正常細胞に対する毒作用が少ないので、がん細胞を全て死滅する量を投与できます。しかし、がんが全身に転移した場合は、この戦略は使えません。これが、全身に転移したステージ4のがんの根治が困難な理由です。
通常の抗がん剤治療は、薬効(がん細胞の一部を死滅させる)を発揮しつつ、毒性(副作用)は許容できる範囲の投与量になります。これだと、がん細胞を永久に根絶できないので、「固形がんは抗がん剤だけでは根治できない」ということになります。

図:多くの抗がん剤は、がん細胞を100%死滅させる用量を投与すると宿主も死亡する。がん細胞にある程度の抑制効果があり、正常細胞への傷害が許容できる(副作用が耐えられる)範囲が治療可能な投与量となるが、これだと腫瘍抑制率は100%でないので、根治は不可能。がん細胞の抗がん剤感受性を高め、正常細胞の抗がん剤抵抗性を高める方法によって、がん細胞を100%死滅できる量を投与しても副作用が許容できる範囲に収まれば、抗がん剤でがん細胞を全滅できる。
【絶食が抗がん剤や放射線治療の治療指数を高める】
抗がん剤や放射線治療の治療指数を高める方法として最近注目されているのが、絶食や絶食模倣食、カロリー制限、ケトン食です。
絶食やカロリー制限では、正常細胞は栄養飢餓に適応するため、一時的に細胞分裂を止め、酸化ストレスなどの様々なストレスに対する抵抗性を高め、毒物に対する解毒力も高まることが知られています。抗がん剤も放射線も細胞分裂している細胞が感受性が高いので、細胞分裂を止めることは抗がん剤や放射線治療によるダメージを軽減することになります。
一方、がん細胞は、がん遺伝子やがん抑制遺伝子の遺伝子変異などによって増殖シグナルが恒常的に亢進しているので、栄養飢餓になっても細胞分裂を止めることはありません。そのため、抗がん剤や放射線治療に対するがん細胞の感受性が絶食によって低下することはありません。
神経芽細胞腫を移植したマウスの実験モデルで、食事を自由摂取しているマウスでは50%が死亡する高用量の抗がん剤(エトポシド)を投与する実験で、エトポシド投与の48時間前から水だけを与える絶食を行うと、マウスは死亡せず、がん細胞に対する効果を弱めなかったという報告があります。
短期間の絶食が正常細胞を保護し、がん細胞は保護しないので、その結果、生存期間を有意に延長させるということです。
人間でも絶食による抗がん剤治療の副作用軽減作用が検討されています。以下のような報告があります。
Fasting and cancer treatment in humans: A case series report(人間における絶食とがん治療:症例報告)Aging (Albany NY). 1(12): 988–1007. 2009
【要旨】
高用量の抗がん剤治療の前に短期間(48時間)の絶食を行うと、正常細胞のダメージ(細胞傷害作用)は軽減されるが、がん細胞への細胞傷害性は軽減されないことが、マウスの実験で示されている。
これは、正常細胞とがん細胞の「ストレス耐性相違(Differential Stress Resistance, DSR)」と呼ばれているが、実際に抗がん剤治療を受けているがん患者において絶食を行うことの安全性や有効性についてはまだ十分に検討されていない。
この論文では、様々な種類のがんの患者で、抗がん剤治療前(48〜140時間)と抗がん剤点滴終了後(5〜56時間)に自発的に絶食を行った10例の結果を報告する。
この10例は様々なプロトコールの抗がん剤治療を平均4サイクル受け、同時に絶食療法を実践したが、空腹感と軽度のふらつき以外に絶食による副作用は認められなかった。
同じ患者で抗がん剤治療中に絶食を行った場合と通常の食事を行った場合で比較できた患者が6例いたが、倦怠感や体力低下や消化器症状の副作用はいずれの患者も絶食を行った時の方が軽かったという評価であった。
腫瘍の大きさや腫瘍マーカーで評価した抗がん剤治療の効果に対して、絶食が治療効果を妨げる作用は認めなかった。
この論文で提示した10例の症例の結果から、抗がん剤治療中の絶食の併用は、実施可能であり安全性は問題なく、抗がん剤による副作用を軽減する効果が示唆された。しかし、この研究は、抗がん剤治療中の患者における治療ガイドラインを確立する目的で計画された臨床試験ではないので、生活の質(QOL)や抗がん剤治療の治療指数(therapeutic index)を含めた臨床効果における絶食の有用性を評価するためには無作為対照試験の結果が必要である。
がん治療中の食事療法は、「栄養不足にならないように、通常よりも栄養摂取を増やす」というのが基本だと多くの人は信じています。
がん治療中に食事摂取量が減ることは、栄養素の不足や体重・筋肉の減少が起こり、治癒力や回復力が低下するので、ダメージを受けた組織や臓器の機能低下が起こって、副作用を起こしやすくなります。
したがって、「抗がん剤治療や放射線治療の最中に絶食を実践すると良い」という意見には多くの人は反対しています。多くのがん治療専門医はがん治療中の絶食やカロリー制限は危険だと考えています。
しかし、マウスを使った実験では、抗がん剤治療を行うときに絶食させておく方が、食事を自由に摂取しているマウスより副作用が少なく、死亡率も低下することが報告されています。
この論文では、以下のような結果が報告されています。
1)体重は絶食を行っているときに一時的に減少するが食事を開始すれば直ぐに回復する。
2)抗がん剤のダメージは蓄積していくので、副作用は回数を重ねるごとに強くなる傾向にあるが、絶食が抗がん剤治療のサイクルの中で後の方が行われたにもかかわらず、絶食の方が副作用が軽かった。
3)絶食を行った10人全員において、吐き気、嘔吐、下痢、腹痛、口腔粘膜炎の副作用は認めなかった。しかし、普通の食事も行った6人のうち5人では、普通の食事を行った場合はこれらの副作用の1つ以上がみられた。
4)抗がん剤治療中の全てに絶食を行った4例では、同じプロトコールの抗がん剤治療を受けている場合に通常認められるレベルの副作用の程度や発生率に比べて、極めて副作用が軽かった。
5)同じ患者で絶食した場合と絶食しなかった場合の2つの食事を実行した6例の検討では、絶食したときの方が副作用が軽かった。
つまり、抗がん剤治療の前2日間と抗がん剤投与当日の3日間ほど絶食すると、抗がん剤の副作用は軽減し、抗腫瘍効果は高まるということです。

図:絶食によって栄養飢餓の状態になると、正常細胞は栄養飢餓に適応するために細胞分裂を停止しストレス抵抗性を高めるように応答する(①)。細胞分裂停止とストレス抵抗性増強は、正常細胞を抗がん剤や放射線による細胞傷害から守る方向で作用する(②)。一方、遺伝子異常などによって増殖シグナルが活性化しているがん細胞では、絶食によって血中の増殖因子の濃度が低下して細胞増殖や細胞死抵抗性は抑制される(③)。その結果、抗がん剤や放射線治療によって死滅しやすくなる(④)。絶食は正常細胞の抵抗性を高めて副作用を軽減し(⑤)、がん細胞の抗がん剤や放射線治療の感受性を高める(⑥)。
このような研究はなかなか賛同が得られないので、この論文では、自由意志で絶食療法を試した様々ながんを持つ患者を対象にしています。そのため、対象が不均一であるため最終的な評価をできる臨床試験のレベルではなく、あくまでの臨床経験や症例報告のレベルです、したがって、厳密な無作為対照試験の結果がでるまでは絶食の有用性に関する結論はだせません。しかし、副作用を軽減し、治療効果を高める可能性は高いように思います。
この論文は2009年の報告ですが、この頃から、「抗がん剤治療と絶食の関係」を検討する研究が増えています。
例えば、PubMed(アメリカ国立医学図書館の国立生物工学情報センターが運営する医学・生物学分野の学術文献検索サービス)で「cancer chemotherapy fasting(がん 化学療法 絶食)」で検索すると350件の論文がヒットします(2022年1月末時点)。2010年以前は年間数編でしたが、2012年以降は10編以上になり、最近は年々増加しています(下図)。

図: PubMed(アメリカ国立医学図書館の国立生物工学情報センターが運営する医学・生物学分野の学術文献検索サービス)で「cancer chemotherapy fasting(がん 化学療法 絶食)」で検索すると350件の論文がヒットする(2022年1月末時点)。2010年頃からがん化学療法における絶食の影響を検討した論文が増えている。
【断食するとストレスに対する抵抗力が高まる】
断食というのは、一定期間すべての食物または特定の食物の摂取を断つことです。病気の治療目的でも古くから断食療法は行われています。古代ギリシャ時代の医師ヒポクラテスは、様々な病気の治療に断食が有効であることを記述しています。
ヒポクラテスは「断食すると体の治癒力が高まり、病気が治りやすくなる」と言っています、ヒポクラテスは約2500年前の人で西洋医学の礎を作ったとされ「医聖」や「医学の父」と呼ばれています。
薬が効かない難治性てんかんの治療に絶食が有効であることが知られています。がんやその他の様々な難病の食事療法としても断食や絶食が試されています。
絶食すると体脂肪が燃焼してケトン体(アセト酢酸とβヒドロキシ酪酸)という物質ができます。このケトン体には抗炎症作用や細胞保護作用があります。
また、絶食すると細胞のオートファジー(自食作用)が亢進して、細胞内に蓄積した異常タンパク質を分解して除去してくれます。つまり、細胞を若返らせ、治癒力を高める効果があります。
断食はファスティング(fasting)と呼ばれて、病気の治療目的で研究され実践されています。病気の治療の目的で長期間(2~4週間程度)絶食する方法や、健康増進の目的で1週間に1~2日間程度絶食する方法や、1日ないし数日置きに1日間絶食する間歇的な断食など、様々な方法で行われています。
絶食というのは生物にとっては生きるか死ぬかの強いストレスになるので、体は最大の防衛モードに入ります。日頃細胞分裂を行っている細胞も一時的に増殖を止めるか分裂速度を低下させ、様々なストレスや毒物に対する抵抗性を高めるタンパク質の合成を促進させます。
すなわち、絶食を行うと、物質を合成する同化作用や細胞分裂させる作用をもったホルモンや増殖因子(インスリンやインスリン様成長因子など)は減少し、ストレスに対する抵抗力を高める遺伝子の発現は増加します。 血中のインスリンや様々な増殖因子はがん細胞の増殖を促進し、細胞死を阻止します。したがって、絶食によってこれらの増殖因子が減少すると、がん細胞は増殖が抑制され、細胞死が起こりやすくなります。(下図)

図:インスリンやインスリン様成長因子-1(IGF-1)などの増殖因子(①)は、それらの受容体を介して、増殖や代謝のシグナル伝達系(PI-3K/Akt/mTORC1やRAS/Raf/MAPKなど)を亢進し(②)、物質合成や細胞増殖や細胞死抵抗性を亢進する(③)。その結果、抗がん剤治療に対して抵抗性を示す(④)。絶食やカロリー制限はインスリンやIGF-1の血中濃度を低下させるので(⑤)、抗がん剤抵抗性を阻止する(⑥)。
酵母の実験では活性酸素や抗がん剤に対する抵抗性は栄養飢餓(絶食)によって10倍以上に高まることが報告されています。
絶食はインスリンやインスリン様成長因子-1(IGF-1)の発現を低下させます。マウスの実験で、72時間の絶食で血中のIGF-1濃度が70%低下し、IGF-1の活性を阻害するIGF結合タンパク質-1(IGFBP-1)の濃度は11倍に増加しました。IGF-1の血中濃度が70から80%減少したマウスでは、抗がん剤などによる細胞毒性に対して抵抗性を示しました。
がん細胞に対してはインスリンやIGF-1は増殖を促進し、細胞死(アポトーシス)を抑制する作用があるので、絶食してインスリンとIGF-1の血中濃度が低下すると、がん細胞は抗がん剤で死にやすくなります。
寿命の研究では、成長ホルモン/IGF-1シグナル伝達系の阻害は、ストレス抵抗性を高め、寿命延長作用を示すことが多くの実験モデルで示されています。例えば、IGF-1シグナル伝達系が欠損している動物は寿命が長く、ストレスに対する抵抗性が高いことが報告されています。
つまり、絶食はインスリンやIGF-1シグナル伝達系の抑制によってストレス抵抗性が増し、寿命を延ばすメカニズムが作動すると考えられています。
断食すると抗がん剤や放射線治療の副作用を軽減し、抗腫瘍効果を高めることができます。以下の様な論文があります。
Starvation-dependent differential stress resistance protects normal but not cancer cells against high-dose chemotherapy.(飢餓に依存するストレス耐性相違は、高用量の抗がん剤治療において正常な細胞を保護するが、がん細胞は保護しない)Proc Natl Acad Sci U S A. 2008 Jun 17;105(24):8215-20.
【要旨】
がん治療の戦略は、主にがん細胞の死滅に焦点を合わせてきた。ここでは、化学療法からがん細胞ではなく、生体(正常細胞)を保護するストレス耐性相違(differential stress resistance)について考察する。
短期間の飢餓状態にした出芽酵母(Saccharomyces cerevisiae)またはがん遺伝子Ras2を欠損する細胞は、がん遺伝子Ras2を発言する細胞よりも、酸化ストレスまたは抗がん剤による毒性から、最大1000倍保護された。
過酸化水素または抗がん剤のシクロホスファミドによる毒性に対して、低グルコースまたは低血清の培地での培養は、初代グリア細胞を保護したが、6つの異なるがん細胞株(ラットおよびヒトの神経膠腫および神経芽細胞腫)は保護しなかった。
最後に、抗がん剤エトポシドの高用量の投与による細胞毒性に対して、短期間の飢餓は、マウスを完全な保護を示したが、移植された神経芽細胞腫細胞には保護作用は示さなかった。
これらの結果は、絶食に対する正常細胞とがん細胞のストレス耐性相違は、酸化ストレスとDNA損傷を促進する抗がん剤の抗腫瘍効果を高め、副作用を軽減するメカニズムを提供する。
インスリン様成長因子-1(IGF-1)の発現が低下するように遺伝子改変したマウスでは、抗がん剤に対する抵抗性が高くなることが報告されています。
絶食やカロリー制限やケトン食はIGF-1の活性を低下させる作用があります。IGF-1の活性を低下させる方法は抗がん剤や放射線治療の効果を高めることができます。以下のような報告があります。
Reduced IGF-I differentially protects normal and cancer cells and improves chemotherapeutic index in mice(マウスにおいてIGF-1活性の抑制は、正常細胞を保護しがん細胞は保護せず、抗がん剤治療の治療指数を高める)Cancer Res. 70(4): 1564–1572. 2010年
【要旨】
インスリン様成長因子-1受容体(IGF-1R)の作用を阻害すると、多くのがん細胞は抗がん剤感受性が高くなる(死滅しやすくなる)ことが多くの研究で示されている。しかし、抗がん剤治療中におけるIGF-1Rの活性阻害が正常細胞にどのような作用を及ぼすかは検討されていない。
我々は以前の報告で、高用量の抗がん剤治療中に絶食を行うと、正常細胞を抗がん剤の毒性から守り、がん細胞に対してはそのような保護作用は示さないことを示し、これを正常細胞とがん細胞の「ストレス耐性相違(Differential Stress Resistance, DSR)」と名付けた。
この研究では、絶食によるストレス耐性相違(正常細胞を保護し、がん細胞は保護しないこと)のメカニズムにIGF-1活性の抑制が関与している証拠を示した。
72時間の絶食は血中のIGF-1濃度を70%低下させ、IGF-1の活性を阻害するIGF結合タンパク質-1(IGFBP-1)の濃度は11倍に増加した。IGF-1の血中濃度が70から80%減少したマウスでは、投与した4種類の抗がん剤のうち3種類に対して抵抗性を示した。
絶食中にIGF-1の濃度を増やすと、その細胞保護作用は阻止された。
悪性黒色腫細胞を移植されたマウスは、絶食とドキソルビシンの治療群では60%が長期間生存したが、通常のエサでドキソルビシンの治療を受けた群では、転移やドキソルビシンの毒性で全てが死亡した。
IGF-1シグナル伝達系を抑制すると、抗がん剤のシクロフォスファミドに対してがん細胞(グリオーマ細胞)は死滅したが、正常なグリア細胞は保護された(ダメージは受けなかった)。また、IGF-1シグナル伝達系の抑制はマウス胎児線維芽細胞において、ドキソルビシンによって誘発されるDNA傷害から保護した。
同様に、IGF-1シグナル伝達系のタンパク質が欠損したパン酵母(S. cerevisiae)は抗がん剤によるDNA傷害に対して抵抗性であり、欠損を補うとその保護作用は消失した。
以上のことから、血中のIGF-1タンパク質の濃度を低下させると、抗がん剤によるDNA傷害に対して正常細胞やマウスは抵抗性になることが明らかになった。
短期間の絶食による正常細胞とがん細胞のストレス耐性の差は、IGF-1(インスリン様成長因子-1)の低下が重要なメカニズムとなっているということです。IGF-1の血中濃度を低下させる方法はがん細胞に対する抗がん剤の効き目を高め、正常細胞を抗がん剤による毒性から保護するので副作用が軽減するということです。IGF-1濃度を低下させる方法として絶食が有効ということです。
短期間の絶食というのは、通常は36時間から120時間の絶食です。
寿命の研究では、成長ホルモン/IGF-1シグナル伝達系の阻害は、ストレス抵抗性や寿命延長など共通の作用を示すことが多くの実験モデルで示されています。例えば、IGF-1シグナル伝達系が欠損している動物は寿命が長く、ストレスに対する抵抗性が高いことが報告されています。
つまり、正常細胞では絶食によるIGF-1シグナル伝達系の抑制によってストレス抵抗性が増し、また細胞増殖活性が低下するので、抗がん剤に対して抵抗性が高くなります。
一方、がん細胞は増殖シグナルが常にオンの状態で活性化されているので、短期間の絶食によるIGF-1シグナル伝達系は抑制できないため、抗がん剤感受性は低下しません。
また、絶食を数日実施するとケトン体が多く産生されます。このケトン体は正常細胞に対しては抗炎症作用や抗酸化作用などで保護的に作用しますが、がん細胞に対しては増殖阻害に作用し、抗がん剤や放射線治療の感受性を高めることが報告されています。
カロリー制限が放射線治療の効果を高めることが報告されています。以下のような報告があります。
Caloric restriction augments radiation efficacy in breast cancer(カロリー制限は乳がんの放射線治療の効果を増強する)Cell Cycle 12:12, 1955–1963; 2013;
【要旨】
カロリー制限のような食事内容の変更によってがんの発生や進展を抑制できることが報告されている。この研究では、予後が悪いトリプル・ネガティブ(Triple Negative Breast Cancer;以下TNBC)の乳がんの放射線治療において、カロリー制限が放射線治療の効果を高めるかどうかを検討した。
2種類のTNBCのマウスの実験モデルにおいて、放射線照射とカロリー制限はそれぞれ抗腫瘍効果を示し、顕著な腫瘍縮小効果を認めた。そして、放射線照射とカロリー制限を併用すると相乗的な腫瘍縮小効果を示した。
1日の摂取カロリーを30%減らす方法と、隔日の食事投与(1日おきの絶食;間欠的絶食)の方法を比較すると、前者(カロリー制限)の方が腫瘍縮小効果が高かかった。
腫瘍組織の組織学的検査では、カロリー制限と放射線照射の併用は、がん細胞の増殖活性を低下させアポトーシスを増加した。
この反応にはインスリン様成長因子-1(IGF-1)受容体シグナル伝達系が重要な関与をしており、IGF-1受容体シグナル伝達系で活性化されるIGF-1受容体、インスリン基質、PIK3ca、mTORの活性低下を認めた。
トリプル・ネガティブ乳がんの患者の治療において、カロリー制限食の併用は治療効果を高める方法として有用である。
常識的には、抗がん剤治療や放射線治療中は、栄養不足にならないように食事摂取は増やす方が副作用軽減に有効だと考えます。
しかし、正常細胞のストレス抵抗性を高め、細胞分裂を一時的の低下させて抗がん剤や放射線によるダメージを軽減するというのは、合理的な考えです。
抗がん剤治療の場合、例えば1週間に1回の投与の場合は、抗がん剤投与の48時間前から投与終了まで絶食(水分のみ摂取)すると抗腫瘍効果を高め、副作用を軽減できるといえます。
放射線治療の場合は連続して行われるので、治療中継続して絶食することは困難です。この場合はカロリー制限やケトン食が有効です。まだ、議論はあると思いますが、試してみる価値はあると思います。
【絶食模倣食ががん治療の効果を高める】
絶食やカロリー制限食やケトン食以外に、最近は絶食模倣食(Fasting-mimicking diet)という食事に関する報告が増えています。
絶食模倣食(Fasting-mimicking diet)は1週間のうち2日程度を1日300キロカロリー程度のカロリーと糖質とタンパク質摂取の少ない食事を摂る食事です。
抗老化(アンチエイジング)やがん治療の領域で報告が増えています。
PubMedで検索すると「Fasting-mimicking diet」がタイトルに入っている論文が82編見つかります。(2022年1月末)2012年が最初で、近年論文が増えています。

図: PubMed(アメリカ国立医学図書館の国立生物工学情報センターが運営する医学・生物学分野の学術文献検索サービス)で「fasting-mimicking diet(絶食模倣食)」で検索すると82件の論文がヒットする(2022年1月末時点)。2012年に最初の論文が報告され、この数年論文数が増えている。
以下のような論文があります。
Fasting-mimicking diet and hormone therapy induce breast cancer regression(絶食模倣食療法とホルモン療法は乳がんの縮小を誘導する)Nature. 2020 Jul;583(7817):620-624.
【要旨】
すべての乳がんの約75%が、エストロゲンおよび/またはプロゲステロン受容体を発現している。
これらのホルモン受容体陽性腫瘍に内分泌療法は有効であるが、原発性および獲得性の耐性出現によって、その長期的な利益が制限される。ここでは、ホルモン受容体陽性乳がんのマウスモデルにおいて、周期的絶食または絶食模倣食事が、循環IGF1、インスリン、レプチンを低下させ、EGR1とPTENの発現亢進を介してAKT-mTORシグナル伝達を阻害することにより、内分泌治療薬であるタモキシフェン(tamoxifen)とフルベストラント(fulvestrant)の活性を高めることを報告する。
フルベストラントをサイクリン依存性キナーゼ4/6阻害剤のパルボシクリブ(palbociclib)と組み合わせると、絶食模倣食を定期的に追加することで、腫瘍の縮小が長続きし、薬剤治療に対する耐性獲得が阻止した。さらに、絶食および絶食模倣食の両方が、タモキシフェン誘発性の子宮内膜増殖症を予防した。
エストロゲン療法を受けているホルモン受容体陽性乳がんの患者では、絶食模倣食事が、インスリン、レプチン、IGF1のレベルの低下など、マウスで観察されたものと同様の代謝変化を引き起こし、レプチンとIGF-1の低下は長期間続いた。
マウスでは、これらの長期的な効果は、長期的な抗がん作用に関連していた。
これらの結果は、ホルモン受容体陽性乳がんにおけるエストロゲン療法の補助治療としての絶食模倣食のさらなる臨床研究の必要性を裏付けている。
この報告はイタリアの多数の研究機関の研究グループからの報告です。この論文で注目すべきは、Natureという超一流の学術誌に2020年に掲載されていることです。
Natureは最も権威のある科学系学術誌の1つで、近代史における重要な科学的進歩の多くはNatureで最初に発表されてきています。ノーベル賞を受賞した研究の多くがNatureに掲載されてきました。
絶食ががんの治療効果を高めることはかなり前(30年以上前)から指摘されています。絶食模倣食という食事法は10年くらい前から研究されています。したがって、この論文の内容の新規性やインパクトはそれほど高くないので、なぜNatureに掲載されたか疑問はあります。
しかし、乳がんはがんの中で発症数が最も多いがんです。2020年に世界で乳がんと診断された女性の数が肺がん患者数を上回り、がんの全症例に占める割合で最多になったと報告されています。
この報告によると、2020年に新規に乳がんと診断された女性の症例は約230万例で、がんの全症例のうち11.7%を占めています。一方、新規に肺がんと診断された症例(男女計)は11.4%でした。
2020年に世界で報告された新規のがんの症例は推定1930万例、死亡は1000万例です。
日本でも、女性がんの罹患率は、乳がん、大腸がん、肺がん、胃がん、子宮がんの順で、乳がんが1番です。
男性のがん罹患率は、前立腺がん、胃がん、大腸がん、肺がん、肝臓がんの順です。
男女計のがん罹患率は、大腸がん、胃がん、肺がん、乳がん、前立腺がんの順です。
全世界では、がん罹患率(男女計)は、乳がん、肺がん、大腸がん、前立腺がん、胃がんの順です。
ホルモン依存性乳がんは乳がん全体の70%を占めるので、最近では1年間に約160万人がホルモン依存性乳がんを発症していることになります。
つまり、世界的に患者数の多いホルモン依存性乳がんの生存率を高める可能性のある研究結果なので、Natureに掲載される価値はあるとも言えます。
以下の論文は別の研究グループ(オランダ)からの報告です。
Fasting mimicking diet as an adjunct to neoadjuvant chemotherapy for breast cancer in the multicentre randomized phase 2 DIRECT trial(多施設無作為化第2相DIRECT試験における乳がんの術前化学療法の補助としての絶食模倣食)Nat Commun. 2020; 11: 3083.
【要旨】
担がんマウスの実験において、短期間の絶食は、抗がん剤治療の効果を高めながら、化学療法の毒性作用からマウスを保護する。
糖尿病がなく、BMIが18 kg/m2を超えるHER2陰性のステージII / III乳がんの患者131人をランダム化し、術前化学療法の前および最中の3日間に絶食模倣食または通常食のいずれかを投与した。
絶食模倣食グループではデキサメタゾンが省略されたにもかかわらず、両方のグループ間で毒性に差が認められなかった。
放射線検査による評価で、完全または部分的な腫瘍縮小は、絶食模倣食群の患者でより高頻度に発生した(OR 3.168、P = 0.039)。
さらに、プロトコルごとの分析により、90〜100%の腫瘍細胞喪失を示す Miller& Payneグレーディングシステムのグレード 4と5の病理学的反応が、絶食模倣食を実施している患者で頻度が高いことが明らかになった(OR 4.109、P = 0.016)。また、絶食模倣食は、Tリンパ球における化学療法誘発性のDNA損傷を大幅に抑制した。これらの肯定的な発見は、癌治療における絶食/絶食模倣食の利点のさらなる調査を奨励する。
Miller& Payneグレーディングシステムというのは、乳がんの化学療法に対する効果を病理学的に評価する方法です。
抗がん剤治療の後のがん組織の病理検査で、がん細胞の死滅の程度をグレード1からグレード5の5段階にグレーディングします。
グレード1はがん細胞の死滅はほとんど認めず、グレード2は最大30%の死滅、グレード3は腫瘍細胞の推定30%から90%の減少、グレード4は腫瘍細胞の90%以上の喪失、グレード5は腫瘍部位からの切片で識別可能ながん細胞が見られないという評価です。
グレード1と2は反応不良として分類され、グレード3〜5は反応良好として分類されます。グレード5は病理学的完全奏功(がん細胞が完全に死滅)に相当する状態です。
この論文では、90〜100%の腫瘍細胞喪失を示す Miller& Payneグレーディングシステムのグレード4と5病理学的反応が、絶食模倣食を実施している患者で頻度が高いことが認められました。つまり、術前化学療法の前および最中の3日間に絶食模倣食を実践すると、抗がん剤治療の効き目(奏功率)が高まるという結果です。
この研究ではXentigen™という市販の絶食模倣食が使用されています。通常の食事を行い、抗がん剤治療の各サイクルの前と当日計3日間は絶食模倣食の食事療法を受けました。絶食模倣食は植物ベースの低アミノ酸代替食であり、主にスープ、飲料、お茶で構成されており、1日の摂取カロリーは200キロカロリー以下です。
一般成人女性の基礎代謝量(生命維持に必要なカロリー)は1日に1000〜1200kcalです。体を動かすためにはさらに摂取カロリーが必要で、一般成人女性の1日消費カロリーは1800〜2000 kcal程度です。
絶食(摂取カロリーがゼロ)あるいは絶食模倣食(摂取カロリーが200kcal以下)では不足するカロリーを体脂肪の燃焼で補うことになります。
【絶食模倣食は抗老化にも有効】
絶食模倣食はがん治療明けでなく、アンチアイジング(抗老化)やメタボリック症候群や循環器疾患にも効果がある様です。以下の様な報告もあります。
Fasting-mimicking diet and markers/risk factors for aging, diabetes, cancer, and cardiovascular disease.(絶食模倣食と、加齢、糖尿病、がん、および心血管疾患のマーカー/危険因子) Sci Transl Med. 2017 Feb 15;9(377):eaai8700.
【要旨】
カロリー制限や食事内容の変更によって老化速度を遅くできる可能性があるが、ほとんどの被験者が極端な食事を長期間継続できないこと、およびこれらの食事の潜在的な悪影響により、その適用が制限されている。
米国の一般的に健康な100人の参加者を2つのグループにランダムに分け、加齢や老化性疾患に関連するマーカー及びリスク要因に対する絶食模倣食(カロリー、糖質、タンパク質が少なく、不飽和脂肪酸が多い食事)の影響を検討した。
制限の無い食事を3か月間続けた被験者と、絶食模倣食を1ヶ月に5日間連続して行う食事療法を3か月間実施した被験者を比較した。
3回の絶食模倣食のサイクルにより、体重、体幹脂肪および総体脂肪が減少し、血圧の低下とインスリン様成長因子1(IGF-1)の減少を認めた。重大な副作用は認めなかった。
3か月後に、コントロール食の被験者は絶食模倣食プログラムに変更され、合計71人の被験者が3回の絶食模倣食サイクルを完了した。
両方の絶食模倣食群の被験者の分析では、肥満度指数(body mass index)、血圧、空腹時血糖値、IGF-1、トリグリセリド、総および低密度リポタンパク質コレステロール、およびC反応性タンパク質が、病気発症リスクの無い被験者より、病気のリスクのある参加者でより有益に影響を受けたことが示された。
以上の結果から、1ヶ月に5日間の絶食模倣食のサイクルは安全で実行可能であり、加齢および加齢性疾患のマーカー/危険因子を減らすのに効果的である。病気の予防と治療に対する絶食模倣食の効果を確認するために、病気と診断された患者または病気発症の危険因子を持つ患者を対象とした大規模な研究が必要である。
絶食模倣食は、IGF-1、IGFBP-1、グルコース、およびケトン体の血清レベルに対して絶食時のような効果を達成すると同時に、絶食に起因する悪影響を最小限に抑えるために主要栄養素と微量栄養素の両方を提供するように設計された植物ベースの食事です。
この研究では、1日目は約4600kJ(タンパク質が11%、脂肪が46%、炭水化物43%)を供給しますが、2日目から5日目は1日あたり約3000 kJ(タンパク質9%、脂肪44%、炭水化物47%)の構成です。
ジュールもカロリーもエネルギー(熱量)の単位です。
1J(1ジュール)は、1ニュートンの力で物体を1メートル動かすときの仕事量です。
1cal(1カロリー)は1グラムの水の温度を1℃上げるのに必要なエネルギーです。100 キロカロリーは、100 リットルの水の温度を1℃上げるエネルギー量です。
1ジュール は 約0.24カロリーです。したがって、4600 kJは約1100 kcal、3000 kJは約720 kcalです。
絶食模倣食は、野菜ベースのスープ、エネルギーバー、エネルギードリンク、チップスナック、お茶、および高レベルのミネラル、ビタミン、必須脂肪酸を提供するサプリメントで構成されています。
このような絶食模倣食を1ヶ月のうち5日間行うだけで、加齢や老化性疾患に関連するマーカー及びリスク要因を減らすことができるという報告です。
長期間のカロリー制限や周期的(週に1から2日間)の絶食のような食事療法は、多少の苦痛を伴うので、アドヒランス(その治療法の実践を遵守すること)が低いという問題があります。その点、通常は制限のない食事を行い、1ヶ月に5日間程度、植物ベースのスープなどで摂取カロリーを20〜30%に減らす食事であれば、苦痛も少なく、この食事療法のアドヒランスも高くなります。
【転写因子FoxOはストレス耐性を高めて寿命を延長し、がんを抑制する】
寿命延長とストレス耐性が相互に密接に関連することは、1980年代にショウジョウバエの研究で初めて明らかになっています。
老化の遺伝学的研究の第一人者であるマイケル・R・ローズ博士(Michael R. Rose:現カリフォルニア大学アーヴァイン校/生態学・進化生物学部門教授)は、寿命を延ばしたショウジョウバエの集団を作成して、老化の遺伝的研究を行っていました。
ローズ博士は長寿化したショウジョウバエ群を初めて作成した研究者ですが、研究の初期のころ(1982年)、実験助手がエサをやるのを忘れてハエを死なせてしまうという出来事がありました。そのとき、普通のハエはほとんど死んでいたのに、長寿のハエはほとんどが生き残っていました。
そこで、ローズ博士は、「長寿バエはストレスに対する抵抗力を高くなっている」、「老化の先送り(寿命の延長)はストレス耐性の向上と関連している」と考えました。 実際に、長寿バエは普通のハエに比べて、飢餓や乾燥や酸化ストレスに対する耐性が高いことがその後の実験で明らかになっています。
この偶然の発見から、ショウジョウバエを使った長寿の遺伝子の研究は進歩します。つまり、それまでは、ハエの寿命が延びたかどうかは、ハエが死ぬまで(3ヶ月程度)待たなければなりませんが、若いハエを使ってストレスに対する能力を測定するのは数日で調べられるので、実験のスピードは5~10倍にまで加速することになったということです。
(上記の内容の参考図書:マイケル・R・ローズ「老化の進化論:小さなメトセラが寿命感を変える」熊井ひろ美訳、みすず書房2012年)
最近の研究で、このようなストレス耐性を高めているのがFoxO(Forkhead Box O)という転写因子であることが明らかになっています。
転写因子FoxO(Forkhead Box O)はDNA結合ドメインFox(Forkhead box)を持つForkheadファミリーのサブグループ“O”に属する転写因子です。哺乳類では4種類(FoxO1, FoxO3a, FoxO4, FoxO6)ありショウジョウバエでは1種類(dFOXO)あります。
ハエと哺乳類において、インスリン/インスリン様成長因子-1(IGF-1)シグナル伝達系は保存されており、FoxO転写因子はこのシグナル伝達系の下流する位置しています。
FoxO1とFoxO3は約650個のアミノ酸からなる蛋白質で、遺伝子のプロモーター領域のTTGTTTACという配列に結合します。アンドロゲン受容体やβカテニンとも相互作用します。
転写因子というのは特定の遺伝子の発現(DNAの情報を蛋白質に変換すること)を調節している蛋白質で、FoxOはストレス応答、代謝制御、細胞周期、アポトーシス、細胞分化、DNA修復、免疫機能、炎症などに関連する多くの遺伝子の発現を促します。

図:転写因子のFOXOは遺伝子のプロモーター領域のTTGTTTACという配列に結合し、標的遺伝子の発現を誘導し、ストレス応答、代謝制御、細胞周期、アポトーシス、細胞分化、DNA修復、免疫機能、炎症などの細胞機能を制御する。
FOXOは様々なストレスに対する抵抗力を高める作用を担っており、たとえば、カタラーゼやスーパーオキシドディスムターゼ(SOD)のような抗酸化酵素の発現を高めることによって酸化ストレスに対する抵抗力を高める作用があります。 がん抑制遺伝子としての性格も持っており、FoxOの活性化は抗がん作用を示します。
絶食すると脂肪が燃焼してケトン体が多く産生されます。ケトン体の一種のβヒドロキシ酪酸はヒストン脱アセチル化酵素を阻害し、FOXO遺伝子のプロモーター領域におけるヒストンの高アセチル化を引き起こし、FOXO遺伝子発現を亢進することによって酸化ストレス耐性を高めることが報告されています。
すなわち、飢餓や絶食による寿命延長効果のメカニズムとして、βヒドロキシ酪酸によって転写因子FOXOが活性化され、Mnスーパーオキシドジスムターゼ(Mn-SOD)やカタラーゼの発現を誘導し、酸化ストレスに対して耐性が増強することが関与している可能性が示唆されています。これは、血中のβヒドロキシ酪酸が高濃度になるケトン食や絶食(断食)が、寿命延長やがん抑制に有効である可能性を示唆しています。
【インスリンやインスリン様成長因子-1(IGF-1)はFOXO活性を抑制して寿命を短縮する】
線虫とハエと哺乳類において、インスリン/インスリン様成長因子-1(IGF-1)シグナル伝達系は保存されており、FOXO転写因子はこのシグナル伝達系の下流する位置しています。
FoxO3aのリン酸化にはリン酸化されるセリンあるいはスレオニンの部位によって、核外に移行して転写活性が阻害される場合と、逆に核内に保持されて転写活性が亢進される場合の2種類があります。
インスリン/インスリン様成長因子-1(IGF-1)はPI3K/Aktシグナル伝達系を亢進し、活性化されたAktは転写因子FOXOをリン酸化します。この場合、リン酸化されたFOXOは核外(細胞質)へ移行して分解されるので、FOXOの転写活性は抑制されます。(下図)

図:インスリン/インスリン様成長因子-1(IGF-1)はPI3キナーゼ/Aktシグナル伝達系を亢進し、活性化されたAktは転写因子FOXOをリン酸化する。リン酸化されたFOXOは14-3-3というたんぱく質と結合し核外(細胞質)へ移行して分解されるので、FOXOの転写活性は抑制される。FOXOの標的遺伝子はストレス応答、代謝制御、細胞周期、アポトーシス、細胞分化、DNA修復、免疫機能、炎症などの細胞機能を制御する。インスリン/IGF-1シグナル伝達系の活性化はFOXOの核外への移行(不活性化)を促進して、ストレス抵抗性を低下させ、寿命を短縮する。
前述の様に、FOXOはインスリン-PI3K-AKTシグナルによって負に制御されています。つまり、PI3K-AKTシグナルが活性化されるとAKTによって直接的にリン酸化され、FOXOの核外移行を促進することでその転写活性は抑制されます。
一方、栄養飢餓状態ではPI3K-AKTの不活性化に伴いFOXOの活性化が誘導されることになります。つまり、FOXOは飢餓や断食やカロリー制限などによる寿命延長や抗がん作用に関与する転写因子として重要な役割を担っています。
絶食はインスリンやインスリン様成長因子-1(IGF-1)の発現を低下させます。マウスの実験で、72時間の絶食で血中のIGF-1濃度が70%低下し、IGF-1の活性を阻害するIGF結合タンパク質-1 (IGFBP-1)の濃度は11倍に増加しました。IGF-1の血中濃度が70から80%減少したマウスでは、抗がん剤などによる細胞毒性に対して抵抗性を示しました。
成長ホルモン/IGF-1シグナル伝達系の阻害は、ストレス抵抗性を高め、寿命延長作用を示すことが多くの実験モデルで示されています。IGF-1シグナル伝達系が欠損している動物は寿命が長く、ストレスに対する抵抗性が高いことが報告されています。
つまり、絶食やカロリー制限はインスリンやIGF-1シグナル伝達系の抑制によってストレス抵抗性が増し、寿命を延ばすメカニズムが作動するのです。このメカニズムの中心が、栄養飢餓時に活性化されるFOXOという転写因子です。
【FOXOの遺伝子型が寿命に関連する】
ハワイで日系移民を対象にしたコホート研究のHonolulu Heart Program/Honolulu Asia Aging Studyは世界的に有名な疫学研究です。
1900年~1919年に生まれたハワイのホノルル在住の8006人の日系アメリカ人を対象に1965年から始まり、ほぼ50年間の追跡が行われています。
このうち約1200人が90歳以上生きており、まだ250人程度が生存しているということです。
このデータの解析では、身長が低い方が寿命が長いことが明らかになっています。
以下のような論文が最近報告されています。
Shorter Men Live Longer: Association of Height with Longevity and FOXO3 Genotype in American Men of Japanese Ancestry(低身長の男性は長く生きる:日系アメリカ人男性における身長と寿命とFOXO3遺伝子型の関連)PlosOne Published: May 07, 2014 DOI: 10.1371/journal.pone.0094385
ホノルル心臓プログラム(the Honolulu Heart Program)の研究のデータから得られた1915人の非喫煙者の健康な日系アメリカ人を対象に36年間追跡した解析では、エネルギー消費量が平均の15%低いグループでは死亡率が低いことが示されています。
この論文では以下のような図が載っています。この集団では、80歳くらいまでは身長による生存率に差は認められませんが、80歳以降は身長が低い方が長く生きることが示されています。

この論文では、成長の初期の段階で体格が小さいことが80歳以降の寿命の延長に関連しており、寿命に関連するFOXO3遺伝子の遺伝子型との関連を示唆しています。
FOXO3は転写因子で寿命を延ばす作用があります。このFOXO3遺伝子には一塩基多型(single nucleotide polymorphism:SNP)に基づく活性の違いがあります。このうち、寿命延長に関連したFOXO3遺伝子型を持っている人では、インスリン濃度が低値で、がんも少なく、身長が低い関係があると報告しています。
インスリン/インスリン様成長因子-1のシグナル伝達系の活性が低いと身長や体格は小さくなります。つまり、身長と寿命の逆相関はインスリン/インスリン様成長因子-1のシグナル伝達系、mTORC1活性、FOXO活性で説明できることになります。
身長の高い人や体格の良いひとはカロリー摂取が多いことががんのリスクを高めたり、早死にする原因になっているという指摘もあります。
女性が男性より寿命が長いことも身長との関連が指摘されています。女性において、インスリン/インスリン様成長因子-1(IGF-1)シグナル伝達系の活性の低下は寿命延長と短身長と相関しているという考えです。
大きい人は成長ホルモンやインスリン/インスリン様成長因子-1のシグナル伝達系(最終的にはmTORC1の活性化)が亢進しているから、成長が良いのだけど、これらのシグナル伝達系が亢進すると老化が促進されて寿命が短くなるというメカニズムです。
生物が「カロリー制限によって寿命が延びる」ようなメカニズムを進化の過程で獲得したであろうことは容易に理解できます。このメカニズムを獲得したものが淘汰に生き残ったとも言えます。この生物の生存や種の繁栄においてメリットがあるからです。
絶食やカロリー制限食では酸化ストレスや栄養飢餓など様々なストレスに対する抵抗性が増すことが知られています。
食糧が乏しい時には、栄養飢餓に対する抵抗性を高め、代謝を抑制して寿命を延ばし、食糧が十分に入手できるようになったときに生殖活動が行えるように、食糧が乏しい条件(カロリー摂取が不足するとき)では寿命を延ばすメカニズムやストレスに対する抵抗性を高めるメカニズムが進化したと言えます。
FOXOは酸化ストレスや飢餓ストレスに対する抵抗力を高める作用があります。栄養飢餓を乗り越えるために進化の過程で獲得したメカニズムです。
食糧が少なくなったとき単に寿命を延ばすだけでなく、食糧が得られるとき生殖活動を再開することが目的であるため、若々しく保つ(老化を抑制する)ことも重要です。
すなわち、カロリー制限は寿命を延ばすだけでなく、体を若々しくする効果もあることになります。
西洋人において理想の身長は188cmという報告があります。高身長は社会的にはかなりのメリットがあります。近い将来、遺伝子改変や薬を使って、自分の子供の身長を大きくすることを希望する親が出て来る可能性が高いことが指摘されています。現時点でも小児期に成長ホルモンを投与すれば、身長を伸ばすことは簡単にできます。
そのため、身長と寿命の関連に関する研究が必要という意見があります。その意見では、「体を大きくすることは寿命を犠牲にする」ことを知っておかなければならないと言っています。
高身長の人が寿命を延ばしたければ、成長した後にインスリン/インスリン様成長因子-1のシグナル伝達系を抑制するしかありません。そのためには、カロリー制限や糖質制限を行うと目的を実行できます。ケトン食も有効です。
運動も食事制限もやりたくなければ、薬やサプリメントを使ってAMP活性化プロテインキナーゼ(AMPK)とサーチュイン1を活性化してFOXOを活性化する方法もあります。その方法として、メトホルミン、レスベラトロール、プテロスチルベン、ビタミンD3、ニコチンアミド・モノヌクレオチド、ニコチンアミド・リボシドなどが有効です。(下図)

図:運動、絶食、カロリー制限、メトホルミン、プテロスチルベンは細胞内のAMP/ATP比を上昇し(①)、AMP依存性プロテインキナーゼ(AMPK)を活性化する(②)。AMPK活性化はNAD+/NADH比を高め(③)、サーチュイン1を活性化する(④)。サーチュイン1はFOXOファミリーの転写因子を脱アセチル化して活性化する(⑤)。活性化したFOXOは標的遺伝子の発現を促進し、抗酸化能やストレス耐性を亢進し、老化やがんを予防し寿命を延長する(⑥)。ビタミンD3はカルモジュリンキナーゼキナーゼβ (CaMKKβ)を活性化してAMPK活性を亢進する(⑦)。NAD前駆体のニコチンアミド・モノヌクレオチドとニコチンアミド・リボシドはNAD+/NADH比を高めてサーチュインを活性化する(⑧)。
| « 792)重曹がが... | 794)ノスカピ... » |



