がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
634)シンバスタチンとジスルフィラム:HSP90阻害とプロテアソーム阻害の相乗効果
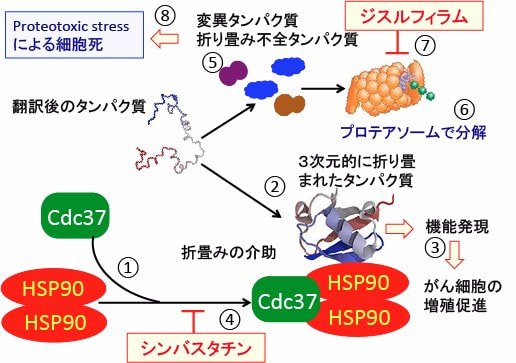
図:ヒートショック・プロテイン(熱ショックタンパク質)のHSP90はコシャペロン(共シャペロン)のCdc37などと複合体を形成することによってシャペロン機能を発揮する(①)。このHSP90/Cdc37複合体のシャペロン機能の介助によってタンパク質は3次元的に折り畳まれてタンパク質として成熟する(②)。正常に折り畳まれたタンパク質は機能を発揮するが、HSP90によって成熟するタンパク質には細胞の生存や増殖などがん関連のタンパク質が多いので、HSP90のシャペロン機能の活性化は結果的にがん細胞の増殖を促進する方向で作用する(③)。高脂血症治療薬のシンバスタチンはHSP90とCdc37の結合による複合体形成を阻害しシャペロン機能を阻害する(④)。HSP90のシャペロン機能が阻害されると、がん促進関連のタンパク質の成熟が阻止され、さらに折り畳み不全の異常タンパク質が蓄積する(⑤)。細胞はプロテアソームでの分解を促進してProteotoxic stressを軽減する(⑥)。ジスルフィラムはプロテアソームの働きを阻害する(⑦)。その結果、異常タンパク質の蓄積によるProteotoxic stressの亢進によって、がん細胞は死滅する。このような機序で、シンバスタチンとジスルフィラムはがん細胞の細胞死誘導において相乗効果を発揮する。
634)シンバスタチンとジスルフィラム:HSP90阻害とプロテアソーム阻害の相乗効果
【ヒートショック・プロテインは様々なストレスから細胞を守る】
ヒートショック・プロテイン(Heat Shock Protein:HSP)は熱ショック・タンパク質という意味です。細胞が熱などのストレスにさらされた際に発現が上昇して細胞を保護するタンパク質の一群で、分子シャペロンとして機能します。
分子シャペロン(Molecular chaperone) とは、他のタンパク質分子が正しい折り畳み(3次元構造)をして機能を獲得するのを助けるタンパク質の総称です。シャペロンとはフランス語で介添人のことで、社交界にデビューする若い婦人に付き添い、世話監督する人のことです。タンパク質が正常な3次構造と機能を獲得するのを助ける役割から、シャペロン(介添人)になぞらえた命名です。
タンパク質は多数のアミノ酸が重合して出来たものですが、特定の3次元構造に折り畳まれてはじめて酵素や受容体などとしての機能を発揮します。分子シャペロンは、他のタンパク質が3次元的に正しく折り畳まれるのを補助するタンパク質です。
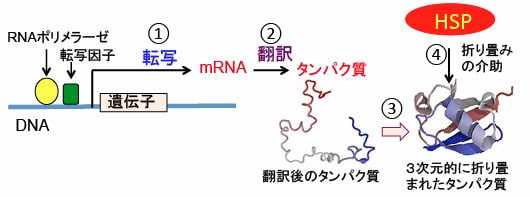
図:DNA上の遺伝子からRNAポリメラーゼや転写因子の働きによってmRNA(メッセンジャーRNA)が生成される過程を転写という(①)。mRNAの情報に基づき、アミノ酸が順番に結合してタンパク質が生成されることを翻訳という(②)。翻訳後のポリペプチド鎖は3次元的に折り畳まれて、機能を発揮する(③)。ヒートショック・プロテイン(HSP)はタンパク質の折り畳みを介助する(④)。
HSPはその分子量によりそれぞれの分子の名前がつけられており、例えばHsp60、70、90はそれぞれ分子量60、70、90kDaのタンパク質の事です。
ヒートショック・プロテイン(HSP)はストレスに対して細胞を守る働きがあるので、体内や細胞内のHSPの量を増やすことは、細胞のストレス抵抗性を高めることになり、体の健康状態を高めることができます。異常になったタンパク質を修復するので細胞の働きが正常化すると考えられています。
したがって、HSPを高める健康法が提唱されています。例えば、入浴による熱ストレスや運動によって適度なストレスを体に与えると、HSPが増えて全身の細胞が活性化するという考え方があります。
しかし、がん細胞の場合、がん細胞内のHSPの量が増え、分子シャペロンの機能が高まることは、がん細胞が死ににくくなることを意味し、抗がん剤に抵抗性を示すことになります。
したがって、がん治療の領域では、ヒートショック・プロテイン(HSP)の阻害がターゲットになっています。HSP阻害剤ががん細胞を死滅し、抗がん剤の効き目を高めることが多くの研究で明らかになっています。
体の抵抗力を高めてがんを治療する目的でHSPを増やすがん治療法を提唱している人もいますが、この考え方は間違いです。がん細胞を死滅するには、がん細胞のHSPの発現や働きを阻害することが重要というのががん研究者のコンセンサスです。
【ヒートショック・プロテイン90(HSP90)はがん細胞の生存と増殖を助ける】
タンパク質の3次元的な折り畳みを介助する分子シャペロンの多くはヒートショック・プロテイン(Heat shock protein: HSP)です。タンパク質は熱が加えられると変性し、折り畳み構造を失います。タンパク質は変性すると機能を失活します。HSPは分子シャペロンとして、熱で変性したタンパク質を正常な3次元構造に回復させる働きを担っています。
Heat shock protein 90(Hsp90)は,酵母からヒトにいたる生物種において保存されている分子シャペロンです。タンパク質発現の過程で正しい折り畳み(フォールディング)や細胞内局在等を助ける機能を担っています。
HSP90は細胞内の主要なシャペロンで、細胞がストレスを受けた時に発現量が増加します。HSP90は細胞のストレス状況下だけでなく、通常時も細胞質に多く存在しています。
HSP90は細胞増殖や分化に重要な役割を果たす多くのタンパク質に作用し、これらのタンパク質の機能の発現や維持に必須の働きを担っています。
HSPが作用するタンパク質をクライアント・タンパク質と言います。
クライアント(client)というのは、依頼人、顧客、取引先などの意味です。つまり、HSP90は細胞のがん化や増殖に関連する多くのタンパク質をクライアント(顧客)として持っているので、HSP90の働きががん細胞の生存や増殖を助ける役割を担っているということです。したがって、HSP90の阻害剤はがん治療薬となるのです。
通常の分子標的薬はターゲット分子が一つなので、がん細胞で活性化しているシグナル伝達経路の一つを阻害します。
一方、HSP90阻害薬は、がん細胞において多数のシグナル伝達経路を調節している1つのタンパク質(=HSP90)を阻害するので、がん細胞の生存や増殖を促進しているシグナル伝達系をマルチに阻害することによって、がん細胞を効率的、総合的に攻撃することができます。
つまり、HSP90の阻害薬はHSP90という一つのタンパク質を阻害することによって、細胞周期、細胞分裂、アポトーシス、ストレス耐性などに関わる複数のクライアント・タンパク質を同時に阻害し、がんの増殖を抑制します。
HSP90に介添されるタンパク質(クラアントタンパク質)として、これまでに200以上の分子が報告されており、がん細胞の発生や増殖や生存に関与しているタンパク質が多く含まれています。そのようながん促進関連のHSP90のクライアント・タンパク質の例を下表に示しています。
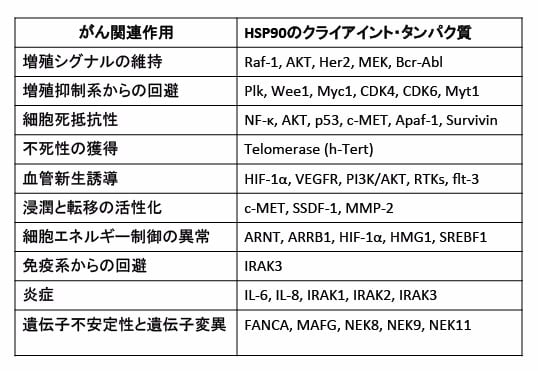
また、遺伝子増幅等で発現量が異常に増加しているタンパク質(Her2 など)、がんに特異的な変異(EGFR、p53など)、染色体転座によって生じる異常タンパク質などが、正常なタンパク質と比較してHsp90 依存度が高いという報告もあります。
したがって、HSP90阻害剤は、HSP90という単一のタンパク質を阻害するのですが、結果的にがん細胞のシグナル伝達系をマルチに抑制できるというユニークな特徴を持っています。
がん細胞の生存や増殖に重要なタンパク質の多くがHSP90のクライアントで、これらのタンパク質の細胞内での機能維持にHSP90が必要です。したがって、HSP90を阻害すると、間接的に多くのタンパク質の機能を阻害して、がん細胞の増殖や生存を阻止できるのです。
【がん治療では複数のターゲットを同時に攻撃する必要がある】
悪性度の高いがん細胞は、一つや二つの治療法(薬)ではほとんど効果が期待できません。増殖を促進するシグナル伝達系を一つ阻害しても、別の経路で生存と増殖を維持できます。道路の一箇所が通れなくなっても、迂回路はたくさんあるのです。
そこで、がん細胞の増殖や生存に重要なシグナル伝達系やタンパク質を複数の箇所で阻害する必要があります。この目的では分子シャペロンのHSP90はがん治療のターゲットとして多くのがん研究者が注目しています。
正常細胞には影響が少なく、がん細胞で影響が大きいターゲットを複数組み合わせれば、副作用の少ないがん治療が行えます。
例えば、がん細胞で亢進している解糖系や乳酸産生の阻害と、ミトコンドリアの活性化の組み合わせがあります。この組み合わせは、正常細胞には良い影響を与え、がん細胞には致命的な影響を与えます。
標準治療の最大耐用量の抗がん剤治療も、ただ抗がん剤を投与するだけでなく、がん細胞の抗がん剤感受性を高める方法を積極的に併用すれば、抗腫瘍効果を高めることができます。
最近、断酒薬(アルコール中毒の治療薬)のジスルフィラムと高脂血症治療薬のシンバスタチンの併用で顕著な抗腫瘍効果を得た乳がん患者さんの症例を経験しました。
進行した乳がん患者さんがアロマターゼ阻害剤が効かなくなったので、ジスルフィラムなどの代替療法を併用しましたが、ほとんど効果が得られませんでした。しかし、高脂血症治療薬のシンバスタチンを追加ですると、がん組織が明らかに縮小して行きました。
シンバスタチンには乳がんや膵臓がんなど多くのがんに対する増殖抑制効果が報告されており、その作用機序は多彩です。主な作用メカニズムは、スタチンがメバロン酸経路でのイソプレノイド生成を低下してGTP結合タンパク質の活性を阻害する作用です。(詳細は619話で解説しています)
【シンバスタチンは熱ショックタンパク質Hsp90のシャペロン機能を阻害する】
最近の報告で、シンバスタチンが分子シャペロンのHsp90を阻害する作用が報告されています。以下のような報告があります。
Simvastatin functions as a heat shock protein 90 inhibitor against triple-negative breast cancer.(シンバスタチンはトリプルネガティブ乳がんに対する熱ショック蛋白質90阻害剤として機能する)Cancer Sci. 2018 Oct;109(10):3272-3284.
【要旨】
発がん性タンパク質の構造的成熟と安定化に関与するヒートショック・プロテイン90(Hsp90)のシャペロン活性の調節において、Hsp90のアセチル化は重要な役割を果たす。しかしながら、抗がん剤の潜在的標的である機能的アセチル化の部位については明らかになっていない。我々は、Hsp90αのK292(292番目のリシン)でのアセチル化が乳がんの発症と治療に重要であることを見出した。
K292におけるアセチル化は、ATP、コシャペロン、およびクライアントタンパク質に対するHsp90の親和性を増強するだけでなく、in vitro(培養細胞を使った実験)でのがん細胞コロニー形成、移動、および浸潤、ならびにin vivo(動物実験)での腫瘍増殖を促進する。
重要なことに、K292−アセチル化Hsp90とコシャペロンのCdc37との間の複合体形成を阻害すると、クライアント・プロテインのキナーゼの成熟を抑制し、キナーゼ基質のプロテアソーム依存性の分解を誘導する。従って、K292−アセチル化Hsp90は抗がん剤のターゲットとなる。
さらに我々は、クライアントタンパク質の成熟を促進するHsp90のシャペロン機能を、シンバスタチンが阻害し、LBH589は促進した。そして、シンバスタチンとLBH589の組み合わせは、マウスの移植腫瘍の実験系において、がん細胞のアポトーシスの増加をもたらした。
これらの実験結果は、シンバスタチンが新規のHsp90阻害剤であり、トリプルネガティブ乳がん細胞におけるK292アセチル化Hsp90 / Cdc37複合体の形成を破壊することを示している。
シンバスタチンとLBH589との組み合わせは、トリプルネガティブ乳がんの新規治療戦略として使用することができる。
Hsp90がシャペロン機能を発揮するにはコシャペロン(cochaperone)のCdc37と結合して複合体を形成する必要があります。この時、Hsp90のK292(292番目のアミノ酸のリシン)がアセチル化される必要があります。
がん細胞の生存や増殖を支えている多くのがん遺伝子産物がタンパク質として成熟し、機能するためにはHsp90/Cdc37複合体のシャペロン機能が必要です。このシャペロン機能を阻害すると、Hsp90のクライアントタンパク質は成熟できず異常な構造のままになり、プロテアソームで分解されます。
Hsp90/Cdc37複合体を破壊する方法はがん細胞の増殖を止め、アポトーシスを誘導することになります。
がん細胞の中では、Hsp90の量が増え、K294の部位のアセチル化が亢進しています。このアセチル化がHsp90とATPとコシャペロンとクライアント・タンパク質との結合を促進し、Hsp90のシャペロン機能を促進します。
シンバスタチンはK294がアセチル化したHsp90とコシャペロン(cochaperone)のCdc37とクライアントプロテインの結合を阻害して、Hsp90のシャペロン機能を阻害し、がん細胞の増殖と生存のシグナル伝達系を阻止するということです。
LBH589 はパノビノスタット(Panobinostat)と呼ばれる非選択的ヒストン脱アセチル化酵素阻害剤で、商品名が「ファリーダック」で、ノバルティスファーマが製造販売し、多発性骨髄腫の治療に用いられています。
ヒストン脱アセチル化酵素阻害剤はタンパク質のアセチル化を促進します。したがって、この論文では、LBH589はHsp90のシャペロン機能を促進しました。
ヒストン脱アセチル化酵素阻害剤はヒストンだけでなく様々なタンパク質を過アセチル化して細胞周期を停止させる機序で多くのがん細胞の増殖を停止します。しかし、Hsp90のK292(292番目のアミノ酸のリシン)がアセチル化されるとHsp90のシャペロン機能が活性化さるので、がん治療にはマイナスになります。
そこで、K292がアセチル化したHsp90のシャペロン機能を阻害するシンバスタチンを併用するとLBH589 (パノビノスタット)の抗腫瘍効果を高めることができます。
Hsp90はK294がアセチル化したHsp90しかシャペロン機能を発揮しないので、ヒストン脱アセチル化酵素阻害剤と併用しなくても、Hsp90のシャペロン機能を阻害する作用メカニズムでがん細胞の増殖を抑制できます。しかし、ヒストン脱アセチル化酵素阻害剤を使ったがん治療は有用です。(475 話、476話参照)
ヒストン脱アセチル化酵素阻害作用のあるケトン食(β-ヒドロキシ酪酸)、オーラノフィン(リュウマチの治療薬)、アセチル-L-カルニチン、ジインドリルメタン、酪酸(水溶性食物繊維の腸内発酵によって産生)、抗てんかん薬のバルプロ酸ナトリウム(デパケン、セレニカなど)などを使用するときは、Hsp90のシャペロン機能を阻害する目的でシンバスタチンを服用するのが良いと言えます。
スタチンとヒストン脱アセチル化酵素阻害剤の相乗効果は他のメカニズムでも提唱されています(619話参照)
また、スタチンを服用しているときは、コエンザイムQ10の体内産生が阻害されるので、コエンザイムQ10をサプリメントか医薬品で補充することが推奨されます。
【HSP90阻害とプロテアソーム阻害の相乗効果】
HSP90の阻害はHSP90のクライアントタンパク質の不安定化を増進させます。細胞内で異常なタンパク質が蓄積すると、その毒性によるストレス(Proteotoxic stress)で細胞は死滅します。このような異常タンパク質はプロテアソームでの分解を亢進することによって細胞死を避けることができます。
したがって、プロテアソームの阻害剤は異常タンパク質の蓄積を亢進し、細胞死の誘導を促進します。実際にHSP90とプロテアソームの同時阻害が抗腫瘍効果を高めることが数多くの実験で確かめられています。以下のような報告があります。
Combined inhibition of Hsp90 and the proteasome affects NSCLC proteostasis and attenuates cell migration.(Hsp90とプロテアソームの併用阻害は非小細胞性肺がんのタンパク質恒常性に影響を及ぼし、細胞遊走を減弱させる。)Anticancer Drugs. 2014 Oct;25(9):998-1006.
【要旨の抜粋】
熱ショックタンパク質90(Hsp90)は、タンパク質翻訳後の折り畳みとタンパク質の安定性に関わる重要な分子シャペロンである。Hsp90はがん細胞の増殖シグナルを駆動する複数の発がん関連キナーゼ(リン酸化酵素)の機能的成熟に重要な役割を担っている。
しかしながら、折畳み不全のタンパク質が蓄積すると、小胞体(ER)ストレスが誘発され、そしてプロテアソーム機能の活性化など、幾つかの細胞応答経路が活性化される。ユビキチン- プロテアソームシステムは、多くの細胞タンパク質の代謝回転を調整している。
この研究では、ヒト非小細胞肺癌(NSCLC)細胞株を用いた実験で、Hsp90阻害の治療効果はプロテアソーム阻害剤を同時投与することによって増強される可能性があることを示す。
実際に、本研究において、Hsp90阻害剤17-デメトキシゲルダナマイシン(17-demethoxygeldanamycin :17-DMAG)とプロテアソーム阻害剤(ベルケイド)の同時投与が、小胞体ストレスを誘導することを示した。その結果、非小細胞性肺がん細胞において、生存率および細胞数の減少、アポトーシス細胞死の増加、細胞運動性の減少といった変化をもたらした。これらの結果は、小胞体の恒常性を標的にすることが、非小細胞性肺がんの治療に有益であることを示している。
次のような報告もあります。
Effect of inhibition of the ubiquitin-proteasome system and Hsp90 on growth and survival of rhabdomyosarcoma cells in vitro.(in vitroでの横紋筋肉腫細胞の増殖と生存に対するユビキチン- プロテアソーム系とHsp90の阻害の影響)BMC Cancer. 2012 Jun 12;12:233. doi: 10.1186/1471-2407-12-233.
【要旨】
研究の背景:ユビキチン- プロテアソームシステムおよび熱ショック応答は細胞恒常性の維持における2つの重要な調節因子であり、それらの阻害は正常細胞の増殖および生存、ならびにがん細胞のストレス応答および侵襲性に影響を及ぼす。横紋筋肉腫細胞におけるプロテアソーム阻害剤ボルテゾミブとHsp90阻害剤17-DMAGの作用を検討し、それぞれを単独で使用した場合と併用した場合の抗腫瘍効果を分析した。
方法:横紋筋肉腫細胞においてボルテゾミブおよび17-DMAGによって誘導された細胞毒性を評価するために、24、48および72時間後の生存率をMTTアッセイによって測定した。作用機序を解明するためにウエスタンブロッティングおよび免疫蛍光分析を行った。アポトーシスは、アネキシン-V-FITCおよびヨウ化プロピジウムを用いたフローサイトメトリーにより測定した。
結果:ボルテゾミブおよび17-DMAGをそれぞれ低濃度で組み合わせると、横紋筋肉腫細胞の増殖を阻害し、強力な細胞質空胞化および細胞質のLC3-1タンパク質をオートファゴソーム関連形態への変換を含むオートファジーの徴候を呈した。リソソーム阻害剤クロロキンによる処理はアポトーシスを促進するが、ラパマイシンによるオートファジーの刺激はLC3-I変換および細胞死を防止した。これは横紋筋肉腫細胞においてタンパク質毒性に対する耐性メカニズムにオートファジーの関与を示唆している。しかしながら、ユビキチン- プロテアソームシステムおよび熱ショックタンパク質システムの両方の同時阻害は細胞保護的な自食作用(オートファジー)を阻止し、折畳み不全の異常タンパク質の蓄積から生じるストレスを悪化させてアポトーシスを引き起こす。
結論:プロテアソーム阻害剤ボルテゾミブとHsp90阻害剤17-DMAGとの組み合わせは、単剤使用と比較して横紋筋肉腫細胞の治療において重要な治療上の利点を有するように思われる。治療の副作用として生じる代償的な生存メカニズムが阻止されるからである。
プロテアソーム(Proteasome)は生体のすべての細胞に存在する複数のサブユニットから成る酵素複合体で、細胞内で不要になったタンパク質を分解する重要な役割を担っています。
細胞内のタンパク質は秩序だった分解を受けますが、これに関与する分解系がユビキチン依存性プロテアソーム系です。
プロテアソームで分解されるためには,標的タンパク質に特定の目印が付かなければなりませんが、この目印の代表がユビキチンです。ユビキチンはアミノ酸76個から成るポリペプチドで,標的タンパク質のリジン残基にイソペプチド結合で結合します。ユビキチンは種を超えて極めて保存性の高いタンパク質です。
プロテアソームによるタンパク質分解は、細胞周期を遂行するうえで必須であるため、プロテオソームの働きを阻害するとがん細胞は細胞分裂が阻害されて死滅します。
増殖や代謝の盛んな細胞ほどプロテアソームによる蛋白質分解活性が高く、したがって、がん細胞ではプロテアソームの発現が亢進し、高いプロテアソーム活性を有することが知られています。
プロテアソーム阻害剤としてベルケード(一般名ボルテゾミブ)があります。ベルケードは化学療法に抵抗性になった難治性の多発性骨髄腫の治療薬として認可されています。ベルケードは強い副作用がありますが、それは正常細胞でもその機能維持にプロテアソームの働きが必要だからです。がん細胞におけるプロテアソームの活性のみを阻害できれば副作用の少ない抗がん剤となる可能性があります。
Hsp90とユビキチン-プロテアソーム系の同時阻害は、がん細胞に比較的選択的に細胞死を誘導できます。
Hsp90阻害剤としてシンバスタチンが使用でき、ユビキチン-プロテアソーム系の阻害剤としてアルコール中毒の治療薬のジスルフィラムが有効です。ジスルフィラムのプロテアソーム阻害作用については627話で解説しています。
シンバスタチンとジスルフィラムの併用は、コエンザイムQ10を補充し、飲酒しなければほとんど副作用を経験しません。乳がんや膵臓がんなどで、私自身が複数の有効性を経験しています。がんの代替医療として試してみる価値は高いと思います。その他、2-デオキシ-D-グルコース、メトホルミン、ジクロロ酢酸ナトリウム(DCA)、オーラノフィンなどを併用すると、がん細胞に特異的にProteotoxic stressを高めて死滅できます。これらを組み合わせた代替療法を多数の進行がんの患者さんに行っていますが、副作用はほとんど出現せず、有効性を確認しています。

図:がん細胞は遺伝子異常や栄養飢餓や低酸素や炎症などによって変異タンパク質や折り畳み不全などの異常なタンパク質が増えている。2-デオキシ-D-グルコース(2-DG)はグルコースの利用を妨げる作用と、糖タンパク質の糖鎖の異常を引き起こす作用によって変異タンパク質を増やし、メトホルミンやジクロロ酢酸ナトリウム(DCA)はミトコンドリアを活性化して活性酸素の産生を増やして酸化ストレスを高め、変異タンパク質を増やす(①)。異常タンパク質はユビキチンが結合して、プロテアソームで分解している。ジスルフィラムとオーラノフィンはプロテアソームに作用して、タンパク分解を阻害する(②)。ジスルフィラムとオーラノフィンは酸化ストレスを亢進して変異タンパク質を増やす作用もある。分子シャペロンのHSP90/Cdc37複合体は折り畳み不全の変異タンパク質の折り畳みを正常化している(③)。シンバスタチンはHSP90/Cdc37の働きを阻害する(④)。これらの薬剤の組合せは、がん細胞内で異常なタンパク質を蓄積し、その毒性によるストレス(Proteotoxic stress)で細胞は死滅する(⑤)。
| « 633)NADを枯渇... | 635)漢方治療... » |



