がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
830)スルフォラファンの抗がん作用

図:アブラナ科野菜(①)に含まれるグルコラファニン(②)に分解酵素のミロシナーゼ(③)が作用するとスルフォラファン(④)が生成する。スルフォラファンは転写因子のNrf2を活性化し(⑤)、第2相解毒酵素(抗酸化酵素、解毒酵素)の発現を誘導し(⑥)、がんを予防する(⑦)。抗酸化酵素や解毒酵素の発現誘導は、がん細胞の増殖を促進し、細胞死に抵抗性になって、がん治療を阻害する可能性がある(⑧)。しかし、スルフォラファンはヒストン脱アセチル化酵素(HDAC)の阻害、PI3K/Aktシグナル伝達系の阻害、ヘッジホッグ(Hh)シグナル伝達系の阻害、マイクロRNA(miRNA)の制御などの多彩なメカニズム(⑨)でがん細胞の増殖を抑制し、細胞死を誘導する効果を発揮し(⑩)、がん治療にも効果があると考えられている(⑪)。
830)スルフォラファンの抗がん作用
【アブラナ科野菜は解毒力や抗酸化力を高める】
キャベツ、ブロッコリー、ケール、カリフラワー、ダイコンなどのアブラナ科の野菜の辛味成分であるイソチオシアン酸塩成分には体内の解毒酵素の働きや抗酸化力を高める効果が知られています。
アブラナ(油菜)は菜の花とも呼ばれていて、3ー5月に黄色の十字架状の花が密集して咲く背丈が1ー2mの植物です。種には油が多く含まれていて植物油の原料として栽培されていましたが、近年、野菜としても売られるようになりました。
アブラナと同じ仲間(アブラナ科)で野菜として食用されているものに、キャベツ、ブロッコリー、ケール、カリフラワー、芽キャベツ、ダイコン、ハクサイ、カブ、コマツナ、チンゲンサイ、ワサビ、カラシなどがあります。
薬物や発がん物質などが体内に摂取されると、肝臓などの細胞内にある酵素の働きによって解毒されて体外に排泄されます。このような解毒酵素は大きくフェース1酵素群(phase 1 enzymes)とフェース2酵素群(phase 2 enzymes)に分類されています。
フェース1酵素(第1相解毒酵素)は物質を酸化したり加水分解して物質を変換し、フェース2酵素(第2相解毒酵素)は抱合反応などによって解毒する作用をもっています。このような薬物代謝酵素は多くの場合薬物の作用の消失を導くことから、解毒反応と呼ばれていますが、フェース1酵素群は場合によっては、発がん物質の前駆体を活性化し、発がん性を持たせるように働くこともあります。
一方、グルタチオン・S・トランスフェラーゼ(glutathione S-transferases)、 キノン還元酵素(quinone reductases)などのフェース2酵素は、DNAの変異を起こす発がん物質を不活化する作用を持っているので、フェース2酵素の量を増やす作用の食品や薬物のがん予防効果が注目されています。
アブラナ科の野菜にはがん予防効果が報告されていますが、その最も大きな理由は、アブラナ科の野菜に多く含まれているイソチオシアン酸塩成分にフェース2酵素の量を増やす作用があるからです。イソチオシアン酸塩はアブラナ科野菜に含まれる辛味成分です。
ジョンズ・ホプキンス大学のポール・タラレー博士らは、ブロッコリーに含まれるスルフォラファン(Sulforaphane)というイソチオシアン酸塩成分がフェース2酵素の合成を誘導する効果が強く、がん予防に効果があることを1994年に発見しました。その後も多くの研究でアブラナ科野菜に含まれるイソチオシアン酸塩成分のがん予防効果が確認され、そのメカニズムの研究が行われています。
【アブラナ科野菜は生で食べる方ががん予防効果が強い】
食事からのアブラナ科野菜の摂取量が多いほど、がんの発生率が低いことが、多くの疫学研究で明らかになっています。多くの報告をまとめると、アブラナ科野菜の摂取が少ない人に比べて摂取量の多い人のがん発症のリスクは50%から70%くらいに低下することが報告されています。
特に、生のアブラナ科野菜の摂取が多いほどがんの発生率が低下することが明らかになっています。それは、アブラナ科野菜は加熱調理すると抗がん成分が減少するからです。
アブラナ科の植物にはグルコシノレートという物質を含むのが特徴です。グルコシノレートは二次代謝産物の一種で、分子中にイオウ(硫黄)原子を含み、グルコースが結合しています。グルコシノレートにはグルコース以外の部分の構造が異なる多数の種類が知られています。
このグルコシノレートはミロシナーゼという酵素によって分解され、イソチオシアネートという非常に辛い物質に変化します。グルコシノレートは細胞内ではミロシナーゼと接触しないように安定して蓄えられていますが、昆虫などの捕食者にかじられると、細胞が壊れてグルコシノレートとミロシナーゼが接触して酵素反応が起こり、イソチオシアネートが生成するのです。
つまり、イソチオシアネートはアブラナ科植物が昆虫などの捕食者から身を守る防御物質なのです。ワサビや大根を擂り下ろすと辛みが出てくるのは、イソチオシアネートが生成するためです。

図:グルコシノレート(①)は分子中にイオウ(硫黄)原子を含み、グルコースが結合している。グルコシノレートは植物内でミロシナーゼ(②)と接触しないように安定して蓄えられているが、昆虫などの捕食者にかじられると、細胞が壊れてグルコシノレートとミロシナーゼが接触して酵素反応が起こり、イソチオシアネート(③)が生成する。
がん予防物質として有名なスルフォラファンは、グルコシノレートの一種のグルコラファニン(glucoraphanin)という物質がミロシナーゼによって分解されて生成します。つまり、スルフォラファンはイソチオシアネートの一種です。細胞が壊れてグルコシノレートとミロシナーゼが反応して生成するイソチオシアネートは昆虫などの捕食者を忌避させる効果を発揮します。
グルコラファニンはブロッコリーやカリフラワーやキャベツに多く含まれています。
スルフォラファンは抗酸化酵素やフェース2解毒酵素の活性を高めて、強いがん予防効果を発揮することが知られています。

図:グルコシノレートの一種のグルコラファニンがミロシナーゼで分解されるとスルフォラファンというイソチオシアネートが生成する。
別のグルコシノレートのグルコブラシシンも、同様にミロシナーゼによって加水分解してインドール-3-カルビノールになります。このインドール-3-カルビノールも植物の生体防御に働きますが、人間が摂取すると、胃の中の酸性の条件下では、インドール-3-カルビノールが2個重合したジインドリルメタンになります(図)。
ジインドリルメタンはがん細胞のシグナル伝達系に作用して、増殖や浸潤や転移を抑制し、細胞死(アポトーシス)を誘導し、抗がん剤感受性を高めるなどの抗がん作用を発揮します。

図:アブラナ科野菜に多く含まれるグルコシノレートの一種のグルコブラシシン(①)は、ミロシナーゼ(②)によって加水分解してインドール-3-カルビノール(③)になる。さらに胃の中の酸性の条件下では、インドール-3-カルビノールが2個重合し(④)、ジインドリルメタン(⑤)になる。
アブラナ科の植物に見られるグルコシノレートとミロシナーゼのシステムは、最もよく研究されている植物の化学的防御の1つです。
ミロシナーゼ(myrosinase)はβ-チオグルコシダーゼとも呼ばれ、グルコシノレートのグリコシド結合を加水分解して、硫酸基を離脱させることでイソチオシアネートを生成します。
グルコシノレートとその加水分解酵素であるミロシナーゼは、無傷の植物組織の別々の区画に保管されています。組織が破壊されると、グルコシノレートの生物活性化が開始されます。
つまり、ミロシナーゼはそのグルコシノレート基質にアクセスし、グルコシノレートの加水分解により、毒性のあるイソチオシアネートおよび他の生物学的に活性な生成物が形成されます。グルコシノレート-ミロシナーゼ系の防御機能は、さまざまな昆虫や草食動物を用いた多くの研究で実証されています。
このグルコシノレートとミロシナーゼによって生成されるスルフォラファンやインドール-3-カルビノールとその代謝産物が、アブラナ科野菜の抗がん作用のメカニズムになっています。(下図)

図:ブロッコリーやカリフラワーやキャベツなどのアブラナ科野菜にはグルコシノレートというイオウを含みグルコースが結合した物質が含まれている(①)。グルコシノレートには複数の種類があり、そのうちのグルコラファニン(②)は、野菜の細胞が壊れるとミロシナーゼという酵素と反応してスルフォラファンを生成する(③)。別のグルコシノレートのグルコブラシシン(④)も、同様にミロシナーゼによって加水分解してインドール-3-カルビノールになり(⑤)、さらに胃の中の酸性の条件下では、インドール-3-カルビノールが2個重合したジインドリルメタンになる(⑥)。これらの物質は、抗菌、抗酸化、解毒、発がん抑制、がん細胞の増殖・浸潤・転移の抑制などの作用を持っており、がんの発生予防や治療に役立つ効果を発揮する(⑦)。
【スルフォラファンは転写因子のNrf2を増やす】
フェース2解毒酵素の遺伝子の発現調節領域には、抗酸化反応エレメント(antioxidant response element)という領域があって、Nrf2という転写因子が結合するとフェース2解毒酵素の発現が誘導されます。
イソチオシアネートなどのフェノール性抗酸化剤はmitogen-activated protein kinases (MAPK)を活性化して、転写因子のNrf2が細胞核内に蓄積し、遺伝子の抗酸化反応エレメントへの結合を促進して、抗酸化に働く種々の遺伝子の発現を誘導して酸化ストレスを軽減させる作用があります。
転写因子のNrf2は、抗酸化機能や解毒機能を持つ様々な遺伝子の転写を誘導します。
活性酸素種の産生によりもたらされる酸化ストレスは,DNAやタンパク質や脂質などの生体高分子を酸化することで細胞や組織に傷害を与え、がんや糖尿病や腎臓疾患や神経変性疾患など様々な疾患を引き起こす原因になります。
このような酸化ストレスに対する防御機構において重要な機能を担っているのが、Keap1-Nrf2システムです.
正常細胞において酸化ストレスの無い状況では、Nrf2はKeap1(Kelch-like ECH-associated protein 1)というタンパク質に結合することによりユビキチン化を受け、分解しています。
しかし、酸化ストレスにさらされるとKeap1のシステイン残基が修飾を受けて構造が変化し、Keap1からNrf2が離れて核へ移行し、遺伝子上流に存在する抗酸化剤応答配列ARE(antioxidant response element)に結合することによって、このARE配列をもつ様々な遺伝子(抗酸化酵素やグルタチオンの合成に関与する酵素やフェースII解毒酵素など)の発現を誘導し、抗酸化や解毒に関するタンパク質や因子の合成を高めます。
このような作用によって、正常細胞や前がん細胞においては、Nrf2の活性を亢進するNrf2活性剤は発がん過程を抑制するので、がん予防物質として認識されています。このようなNrf2の活性化を介したがん予防物質としてスルフォラファンやクルクミンやレスベラトロールなどが報告されています。
図:Keap1-Nrf2システムは酸化ストレスや有害物質に対する防御機構において重要な役割を担っている。転写因子のNrf2は細胞質でKeap1によって分解が促進されることによって活性が抑制されている。酸化ストレスが加わると、Keap1の構造が変化してNrf2から離れ、フリーになったNrf2が核内に移行して、抗酸化酵素や解毒酵素の遺伝子の上流に存在する抗酸化剤応答配列ARE(antioxidant response element)に結合して、これらの遺伝子の発現を亢進する。
【Nrf2の活性化はがん細胞の増殖を促進する作用が懸念されている】
がん細胞においてはNrf2が恒常的に活性化しており、Nrf2活性を阻害するとがん細胞は死にやすくなることが報告されています。
ヒトの肺がんなど多くの固形腫瘍でNrf2機能の異常亢進が見つかっています。そして、Nrf2の活性が高いと治療に抵抗性で予後が不良であることが報告されています。
Nrf2は解毒酵素、抗酸化タンパク質、薬剤排出トランスポーターなどの遺伝子を統括的に活性化することにより、がん細胞の抗がん剤耐性と放射線耐性をもたらします。
さらに、Nfr2はグルコースやグルタミンの代謝を変化させて細胞増殖に有利な同化反応を促進します。
Nrf2はがん細胞のペントースリン酸経路を活性化して、核酸とNADPHの産生を増やすことで細胞増殖を亢進します。NADPHはグルタチオンの合成にも必要です。
多くのがん細胞では、酸化ストレスの有無とは関係なくNrf2の発現量と活性が亢進しています。その理由は、RASやMYCなどのがん遺伝子がNrf2を活性化しているからです。
Nrf2の活性を抑制するKeap1の遺伝子変異によってNrf2が活性化する場合も見つかっています。
恒常的に安定化したNrf2は酸化ストレスや抗がん剤/放射線治療に対する抵抗性を増強し、さらに積極的に細胞増殖を促進することになります。
抗がん剤治療や放射線治療によって活性酸素が増えると、がん細胞はさらにNrf2の量を増やして抵抗性を獲得してきます。
このようにNrf2の活性化はがん細胞が治療に対する抵抗性を獲得するメカニズムとして重要です。したがって、がん細胞のおけるNrf2の機能阻害は、抗がん剤治療の有効な戦略となります。

図:放射線照射や抗がん剤はがん細胞の活性酸素の産生を高め(①)、細胞増殖抑制や細胞死誘導を引き起こす(②)。がん細胞はNrf2の活性を亢進し(③)、活性酸素消去酵素や抗酸化物質の産生を増やすことによって活性酸素種を消去し、酸化ストレスを軽減している(④)。
がん細胞においては、K-Rasやc-Mycなどのがん遺伝子の活性化やKeap1の遺伝子変異などによってNrf2は恒常的に活性化しており、抗酸化酵素や解毒酵素の産生や活性が亢進しています。そのため、がん細胞は酸化ストレスや細胞傷害性物質に対する抵抗性が亢進しており、これが抗がん剤や放散線治療に対する抵抗性の原因になっています。
したがって、がん細胞においては、Nrf2の活性を阻害するもの(=Nrf2阻害剤)ががん治療に役立つことになります。このように、正常細胞(前がん細胞も含む)とがん細胞とではNrf2に対する対応は全く異なります。
糖尿病性腎症や慢性閉塞性肺疾患など多くの酸化ストレスと関連する疾患の予防や治療のためにNrf2の活性化剤が臨床応用に向けて開発されています。
一方、がんの治療になるとNrf2の阻害剤が有益になる可能性が高いと考えられています。
がん細胞のNrf2を阻害すると、
①がん細胞内での活性酸素種の蓄積によってアポトーシス(細胞死)が誘導できる。
②抗がん剤治療や放射線治療の効き目を高めることができる。
③がん細胞での物質合成(同化反応)を阻害することによって増殖を阻害できる。
などの効果が期待できます。
ただし、全身投与の場合は、がん組織以外の正常組織での酸化ストレス応答を減弱させる欠点もあります。つまり、がん細胞特異的にNrf2を阻害できる方法があれば、がん治療に役立ちます。
実際に、スルフォラファンががん細胞のNrf2の活性を亢進して、がん細胞の増殖を促進し、抗がん剤抵抗性を増強する実験結果も報告されています。
しかし、多くの研究はがん治療においてもスルフォラファンが治療効果を高める方向で作用することを示しています。そのがん治療における抗がん作用のメカニズムとして、ヒストン脱アセチル化酵素の阻害、PI3K/Aktシグナル伝達系の阻害、ヘッジホッグシグナル伝達系の阻害、マイクロRNA(miRNA)の制御などの多彩なメカニズムが報告されています。
【スルフォラファンはヒストン脱アセチル化酵素を阻害する】
スルフォラファンにはヒストン脱アセチル化酵素阻害作用が報告されています。例えば、以下のような報告があります。
A novel mechanism of chemoprotection by sulforaphane: inhibition of histone deacetylase.(スルフォラファンによる化学予防の新たなメカニズム:ヒストン脱アセチル化酵素の阻害)Cancer Res. 2004 Aug 15;64(16):5767-74.
スルフォラファンはヒストン脱アセチル化酵素を阻害する作用があるという報告です。
ヒストンはリシン(リジン)やアルギニンといった塩基性(プラスの電荷をもつ)のアミノ酸が多く、酸性(マイナスの電荷をもつ)のDNAと強い親和性を持っています。
ヒストンは、長いDNAをコンパクトに核内に収納するための役割と同時に、遺伝子発現の調節にも重要な役割を果たしています。ヒストンによる遺伝子発現の調節は複雑ですが、簡単にまとめると、「ヒストンとDNAの結合は転写に阻害的に働く」ということです。
遺伝子がmRNAに転写されるためには、転写因子やRNAポリメラーゼなどの他の蛋白質がDNAに結合する必要があり、ヒストンが結合していると転写に邪魔になります。したがって、転写の活発な遺伝子の部分ではヒストンとDNAの結合が緩くなっています。

図:細胞核内でDNAとタンパク質(ヒストンなど)の複合体をクロマチンという。クロマチンが凝集している部分はDNAが強く折り畳まれており遺伝子転写が抑制されている。一方、クロマチンが緩んでいる部分は、遺伝子の転写が活発になっている。
DNAとヒストンの結合を緩くする機序として、「ヒストンのアセチル化」という現象があります。アセチル化というのはアセチル(CH3CO)基が結合することです。
ヒストンのN末端領域のリシン残基のアミノ基(-NH2)がアセチル化という修飾を受けるとアミド(-NHCOCH3)に変換し、リシン残基の塩基性が低下して酸性のDNAとの親和性が無くなり、DNAからヒストンが離れ、DNAが露出することになります。
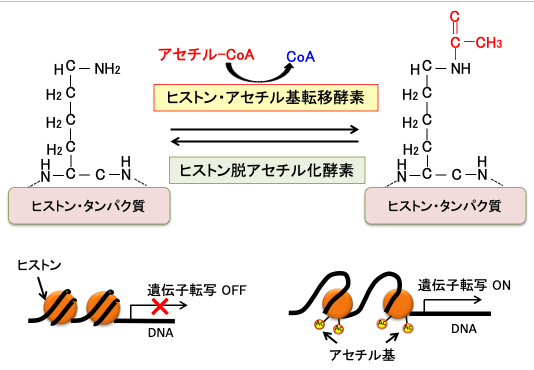
図:ヒストン・アセチル基転移酵素によってヒストン・タンパク質のリシン(リジンとも言う)のアミノ基(-NH2)にアセチル(CH3CO)基が結合するとアミド(-NHCOCH3)に変換し、リシン残基の塩基性が低下して酸性のDNAとの親和性が無くなり、DNAからヒストンが離れ、DNAが露出することになる。その結果、遺伝子の転写が起こりやすくなる。
一般的に、ヒストンが高度にアセチル化されている領域の遺伝子は転写が活発に行われていることを示しています。すなわち、ヒストンのアセチル化は遺伝子発現を促進(正に制御)し、 反対に、ヒストンが脱アセチル化(低アセチル化)されることにより遺伝子発現は抑制(負に制御)されると考えられています。
ヒストンのアセチル化と脱アセチル化の反応は「ヒストンアセチル基転移酵素(=ヒストンアセチルトランスフェラーゼ)」と「ヒストン脱アセチル化酵素(=ヒストンデアセチラーゼ)」によってダイナミックに制御されており、遺伝子発現のON/OFFのメインスイッチになっていると考えられています。アセチル基はグルコースや脂肪酸の分解によって産生されるアセチルCoAが使われます(下図)。

図:ヒストンアセチル基転移酵素はヒストンをアセチル化することによってクロマチン構造を緩めて遺伝子転写を活性化する。一方、ヒストン脱アセチル化酵素はヒストンのアセチル化を減らすことによってクロマチン(DNAとヒストンの複合体)を凝集して遺伝子転写を抑制する。アセチル基はグルコースや脂肪酸が分解して産生されるアセチルCoAから供給される。
細胞のがん化の過程で、ヒストンや非ヒストンタンパク質の脱アセチル化が進むことが明らかになっています。そして、がん細胞ではヒストン・アセチル基転移酵素の発現や活性が低下し、逆にヒストン脱アセチル化酵素の発現と活性が亢進していることが明らかになっています。

図:ヒストンや非ヒストンタンパク質のアセチル化の状況はヒストン・アセチル基転移酵素(HAT)とヒストン・脱アセチル化酵素(HDAC)のバランスで決まる。がん細胞ではヒストン・アセチル基転移酵素(HAT)の発現や活性が低下し、ヒストン・脱アセチル化酵素(HDAC)の発現や活性が亢進して、タンパク質の脱アセチル化が亢進している。
ヒストン脱アセチル化酵素の活性亢進は様々なヒストンアセチル化によって遺伝子発現に影響し、さらに非ヒストン・タンパク質の働きに影響し、これらの作用によって、がん細胞の脱分化、細胞増殖、浸潤・転移、細胞接着低下、アポトーシス抵抗性、血管新生を亢進し、がんの発生や悪性進展を促進する方向で作用しています。
したがって、ヒストン脱アセチル化酵素を阻害すること、あるいはヒストンのアセチル化の亢進はがん治療の有力な方法になります。

図:アブラナ科野菜の摂取で体内に吸収されるスルフォラファンは、ヒストン脱アセチル化酵素を阻害することによってヒストンのアセチル化を促進して、遺伝子発現状態に変化を及ぼす。その遺伝子発現の変化は抗がん作用と関連している。
アブラナ科野菜から生成される抗がん成分としては、スルフォラファンだけでなく、グルコブラシシン(Glucobrassicin)がミロシナーゼで加水分解してできるインドール-3-カルビノール(Indole-3-carbinol)もあります。インドール-3-カルビノールは胃の中の酸性の条件下では、インドール-3-カルビノールが2個重合したジインドリルメタン(3,3'-diindolylmethane, DIM)になります。ジインドリルメタンは消化管から容易に吸収され、体中の臓器や組織に移行することが知られています。
ジインドリルメタン(DIM)には乳がんや前立腺癌をはじめ、多くのがん細胞の増殖を抑え、細胞死(アポトーシス)を誘導する効果が報告されています。
ヘッジホッグ・シグナル伝達系やPI3K/Aktシグナル伝達系やWnt/βカテニン経路など多くの増殖促進のシグナル伝達系を抑制することが報告されています。
スルフォラファンとジインドリルメタンは転写因子のNF-κB活性を阻害することによって、がん細胞の抗がん剤感受性を高めることが乳がんや膵臓がんで示されています。
さらに、がん組織の血管新生を阻害する作用も報告されています。
卵巣がん患者の研究では、アブラナ科の野菜の摂取量が多いほど生存期間が長かったという報告があります。他のがんでも同様な結果が報告されています。
従って、アブラナ科野菜を多く摂取することはがんの予防と治療に有効です。この場合、スルフォラファンやインドール-3-カルビノールが多く生成する食べ方が重要になります。
【アブラナ科野菜を加熱調理すると抗がん作用が減少する】
以下のような報告があります。
Effect of cooking brassica vegetables on the subsequent hydrolysis and metabolic fate of glucosinolates.(アブラナ属野菜の調理がグルコシノレートのその後の加水分解と代謝に及ぼす影響)Proc Nutr Soc. 2007 Feb;66(1):69-81. の運命
【要旨の抜粋】
アブラナ科野菜のがん抑制作用は、グルコシノレート含有量に部分的に関連している可能性がある。グルコシノレートは、植物組織の損傷後にミロシナーゼによって加水分解される。イソチオシアネートは、グルコシノレートの代謝物の主要なグループの1つであり、がん予防効果に関係している。
アブラナ科野菜の調理中に、植物ミロシナーゼの不活性化、エピチオスペシファイア(epithiospecifier)タンパク質などの酵素補因子の損失、グルコシノレートとその代謝物の熱分解および/または浸出または代謝物の揮発の結果として、グルコシノレート-ミロシナーゼ系が影響される可能性がある。
調理したアブラナ科野菜を摂取したのち、活性ミロシナーゼを含む生のアブラナ科野菜を摂取すると、イソチオシアネートは上部消化管で生成する。
ミロシナーゼ活性を欠く調理済みのアブラナ科野菜を摂取した場合、グルコシノレートは結腸の常在微生物叢によって加水分解される。
アブラナ科野菜に含まれるグルコシノレートから抗がん作用を発揮するイソチオシアネートの産生の量は、野菜の細胞破裂の程度、胃腸通過時間、食事の組成、腸内細菌叢の違いなど多数の要因によって影響を受ける可能性があります。
加熱調理したアブラナ科野菜と一緒にミロシナーゼ活性を有する生のアブラナ科野菜(ブロッコリースプラウト、大根おろしなど)を一緒に食べるとイソチオシアネートが上部消化管内で生成するということです。
また、腸内細菌もミロシナーゼ活性をもつので、加熱調理したアブラナ科野菜でも大腸内で生成する可能性があります。
このような様々な要因の存在が、アブラナ科野菜の消費とがんの予防とを関連付ける弱い疫学的証拠を部分的に説明するかもしれないと言っています。
つまり、アブラナ科野菜の単純な摂取量ではなく、調理法によるイソチオシアネートの摂取量が重要と言うことです。アブラナ科野菜のがん予防効果や抗がん作用を考察する際には、アブラナ科野菜の調理および摂取中に生じる生化学的変化の理解が重要だと述べています。
アブラナ科野菜の摂取とがんの発生率との関連を検討した疫学研究は多数報告されています。その多く研究で、アブラナ科野菜の摂取量が多いほど様々ながんの発生率で低いことが明らかになっています。特に生のアブラナ科野菜の摂取量が多いほどがんの発生率が低い事が多くのがんで報告されています。
その理由は、アブラナ科野菜の抗がん物質のスルフォラファンやインドール-3-カルビノールやジインドリルメタンが本来は野菜の中に存在しないからです。
アブラナ科野菜に多く含まれるグルコシノレートという物質に、ミロシナーゼという酵素が作用してこれらの抗がん物質が生成します。
生の野菜を噛んだり、ミキサーなどで細切して野菜の細胞を壊さないとスルフォラファンやインドール-3-カルビノールは生成しないのです。
ミロシナーゼは酵素でタンパク質であるため、加熱調理するとタンパク質が変性して、酵素活性は消失します。
つまり、ブロッコリーやカリフラワーやキャベツを加熱調理するとそのがん予防効果や抗がん作用は低下することになります。したがって、アブラナ科野菜は生で食べたり、ジュースにして摂取するのがベストということになります。
ブロッコリーやカリフラワーやキャベツは生でも食べられますが、加熱調理しても、一つの工夫で抗がん作用を高めることができます。前述の論文で記載されていた、「ミロシナーゼ活性を含む生のアブラナ科野菜を摂取する」という方法です。
【アブラナ科野菜の加熱調理に生のアブラナ科野菜を一緒に食べる】
加熱調理したブロッコリーでも、ミロシナーゼを含む食品と一緒に食べれば、ブロッコリーの抗がん作用が保たれるということが報告されています。以下のような報告があります。
Enhancing sulforaphane absorption and excretion in healthy men through the combined consumption of fresh broccoli sprouts and a glucoraphanin-rich powder.(新鮮なブロッコリースプラウトとグルコラファニンが豊富なパウダーを組み合わせて摂取することで、健康な男性のスルフォラファンの吸収と排泄を促進する)
【要旨】
スルフォラファンは、ブロッコリーに存在するミロシナーゼ(myrosinase)によるグルコラファニン(glucoraphanin)加水分解に由来する、がん化学予防効果を有するイソチオシアネート(isothiocyanate)である。
ブロッコリー粉末がサプリメントとして販売されているが、ミロシナーゼが不活性化しているため、スルフォラファンの供給サプリメントとしての有効性が疑問視されている。
以前の研究では、グルコラファニンが豊富であるがミロシナーゼ活性を欠くブロッコリー粉末が、ミロシナーゼを含む空気乾燥ブロッコリースプラウト粉末と一緒に摂取すると、スルフォラファンの体内吸収が増えることを明らかにした。
この研究では、以前の研究で使用されたグルコラファニンを多く含むブロッコリーパウダーと、市販の新鮮なブロッコリースプラウトを一緒に摂取した場合のスルフォラファンの体内吸収について検討した。
生のブロッコリースプラウトは、空気乾燥ブロッコリースプラウトに比べて、入手しやすく、日常の食事でより利用しやすい食材である。
合計4人の参加者がそれぞれ、70μmolのスルフォラファン含有量に相当するブロッコリースプラウト、120μmolのスルフォラン含有量に相当するグルコラファニン粉末、乾燥シリアルとヨーグルトからなる4食(1週間ごとに分けて)を摂取した。
スルフォラファンの代謝物は血液と尿で分析された。 24時間尿中スルフォラファン-N-アセチルシステインの回収率は、グルコラファニン粉末の食事が24%、ブロッコリースプラウトの食事が60%、ブロッコリースプラウトとグルコラファニン粉末を同時に摂取した食事では65%であった。
グルコラファニン粉末摂取後のイソチオシアネイトの尿および血漿への出現は、ブロッコリースプラウトを摂取した場合およびブロッコリースプラウトとグルコラファニン粉末を同時に摂取した場合と比較して遅れた。
グルコラファニン粉末またはブロッコリースプラウト単独と比較して、ブロッコリースプラウトとグルコラファニン粉末を組み合わせることにより、スルフォラファンの血中への出現が促進され、このような食品の組み合わせががんを予防する健康作用を強化することが示された。
これは米国のイリノイ大学の食品化学・人間栄養学部門(Department of Food Science and Human Nutrition, University of Illinois)からの報告です。
グルコラファニンを多く含むブロッコリーパウダーを摂取しても、ミロシナーゼが不活性化していると、スルフォラファンは生成しないので、血中や尿中のスルフォラファンの量は上がりません。腸内細菌のミロシナーゼ活性によってスルフォランができる分しか体内に吸収しないということになります。
しかし、ミロシナーゼ活性を有する生のブロッコリースプラウトを一緒に摂取すれば、スルフォラファンが十分に生成されるという報告です。
ブロッコリーを煮て、その煮汁を捨てるとグルコラファニンをロスします。煮汁にグルコラファニンが多く浸出しています。ブロッコリーやカリフラワーを煮たときは、その煮汁を捨てないことです。
ミロシナーゼの活性の至適温度は 35〜40℃です。1分以上のゆで加熱調理によりミロシナーゼは失活します。
つまり、煮汁が40℃以下になってから、ミロシナーゼ活性をもつブロッコリースプラウトや大根おろしを混ぜれば、スープの中にスルフォランやインドール-3-カルビノールなどの抗がん成分が増えます。
アスコルビン酸(ビタミンC)はミロシナーゼの活性を高めることが知られています。
このようなスープは抗がん作用のあるイソチオシアネート(スルフォラファン、インドール-3-カルビノール)を豊富に含んでおり、さらに美味しいと思います。(下図)

図:ブロッコリーやカリフラワーを加熱してスープを作ると煮汁にグルコシノレート(グルコラファニン、グルコブラシシンなど)が多く含まれるが、加熱によってミロシナーゼは不活性化し、イソチオシアネート(スルフォラファン、インドール-3-カルビノールなど)は分解している(①)。このスープを40℃くらいに冷やした後に、大根おろし(②)や生のブロッコリースプラウト(③)や擦り下ろしたワサビ(④)を加えるとミロシナーゼの作用によってイソチオシアネート(スルフォラファン、インドール-3-カルビノールなど)が生成する。レモン(⑤)などビタミンCの多い食材を加えると、ミロシナーゼ活性を高めることができる。
| « 829)再利用薬... | 831)糖質の吸... » |



