がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
831)糖質の吸収を阻害するアカルボースはがんを予防し、寿命を延ばす
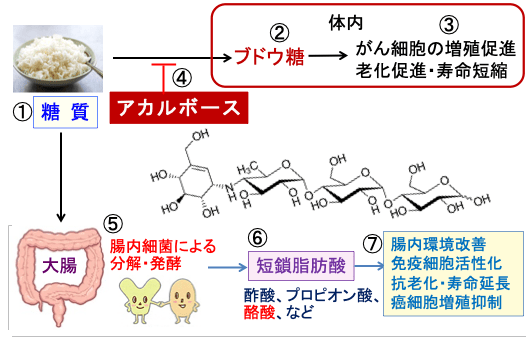
図:食事からのデンプンなどの糖質(①)はα-アミラーゼやα-グルコシダーゼによってブドウ糖(グルコース)に分解されて体内に吸収される(②)。ブドウ糖は血糖とインスリンを上昇させて、がん細胞の増殖を促進し、老化を促進し、寿命を短縮する(③)。アカルボースはα-アミラーゼとα-グルコシダーゼを阻害する作用があり、ブドウ糖の体内吸収と血糖・インスリンの上昇を抑制する(④)。分解されなかった糖質や二糖類は大腸の腸内細菌によって分解・発酵され(⑤)、酢酸やプロピオン酸や酪酸などの短鎖脂肪酸の産生を増やす(⑥)。短鎖脂肪酸は腸内環境改善、免疫細胞活性化、抗老化・寿命延長、がん細胞の増殖抑制などの効果を発揮する(⑦)。これらのメカニズムによって、アカルボースは抗がん作用と寿命延長効果が期待できる。
831)糖質の吸収を阻害するアカルボースはがんを予防し、寿命を延ばす
【フルクトースとグルコース】
それ以上に加水分解されない糖類を単糖(monosaccharide)と言います。複数の単糖が結合すると、結合した単糖の数に応じて、二糖やオリゴ糖や多糖という大きな糖になります。
生物にとってエネルギー源となる単糖の代表はグルコース(ブドウ糖)とフルクトース(果糖)です。ともに6つの炭素から構成され、化学式はC6H12O6で同じですが構造が異なります。これを異性体と言います。蔗糖(スクロース)はグルコースとフルクトースが一個づつ結合した二糖です(下図)。
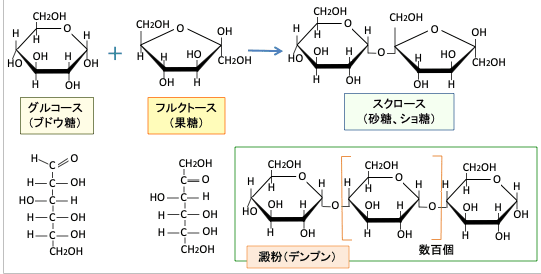
図:スクロース(蔗糖)はグルコース(ブドウ糖)とフルクトース(果糖)が結合した2糖で、澱粉はブドウ糖が多数結合している。これらの糖質は消化管の消化酵素でそれぞれの単糖に分解されて体内に吸収される。
食事から摂取する糖質の代表は、穀物やイモ類などに含まれる澱粉(デンプン)ですが、澱粉はグルコースが多数重合した多糖で、植物が光合成で作り出します。動物は食品中に含まれる澱粉を消化管内の消化酵素で最終的にグルコースまで分解して小腸から吸収し、細胞内に取込まれたグルコースは解糖系とTCA回路と電子伝達系によってエネルギー(ATP)を作って、生命活動に使用することになります。
一方フルクトース (fructose)は、果糖(fruit sugar)とも呼ばれるように果物に多く含まれます。全ての糖の中で最も水に溶けやすく、甘みは砂糖の1.5倍以上、グルコースの2倍以上あり、しかもコストが低いので、加工食品や飲料の甘味剤として多く使われています。
【グルコース(ブドウ糖)はアルデヒド基を持つ】
炭水化物(carbohydrate)は単糖を構成成分とする有機化合物の総称で、代謝されてエネルギー源となる「糖質(saccharides)」と人の消化酵素で消化されない(したがって、エネルギー源にならない)「食物繊維(dietary fiber)」に分けられます。つまり、炭水化物は糖質と食物繊維から成ります。
炭水化物の多くは分子式がCmH2nOnで表され、これを書き直すとCm(H2O)nとなり、炭素に水が結合した物質のように見えるため炭水化物と呼ばれます。炭水化物は単糖類、少糖類、多糖類に分けられます。
単糖は炭水化物の最小単位で、それ以上分解すると糖の性質を失います。
少糖は単糖が2個~10個程度が縮合したものでオリゴ糖とも言います。砂糖の主成分である蔗糖(スクロース)はグルコース(ブドウ糖)とフルクトース(果糖)が結合した二糖類です。
単糖が多数結合したものが多糖です。穀物に含まれる澱粉はグルコースが多数結合したものです。
人間を含め動物は食物中の糖質を分解してエネルギー、すなわちATP(アデノシン3リン酸)を作り出して生命活動に利用しています。
食物中の糖質は消化管でグルコースやフルクトースのような単糖まで分解されて吸収され、細胞に取り込まれて分解されてATP産生に利用されます。
さて、炭水化物は、水酸基(-OH)を多数持ち、さらに、アルデヒド基(-CHO)または、ケトン基(>C=O)のどちらかを持っています。
アルデヒド基を持つ単糖をアルドース(ポリヒドロキシアルデヒド)といい、ケトン基を持つ単糖をケトース(ポリヒドロキシケトン)といいます。酸素原子と二重結合でつながっている炭素を末端に持つものがアルドースで、内部に持つものがケトースということになります。グルコースはアルドース、フルクトースはケトースになります(下図)。

図:糖質は水酸基(-OH)を多数持ち、アルデヒド基(-CHO)かケトン基(>C=O)を持つ。アルデヒド基を持つ単糖をアルドース、ケトン基を持つ単糖をケトースと呼ぶ。グルコースはアルドースで、フルクトースはケトースになる。グルコースもフルクトースも還元性をもち、タンパク質やアミノ酸と結合する。
分子内に遊離性のアルデヒド基やケトン基を持っていると還元性を示すので、このような糖類を還元糖と言います。「還元」というのは、他の物質から酸素を奪い、自分は酸化される性質です。この還元糖の性質がタンパク質やアミノ酸と反応する理由です。つまり、グルコースだけでなく、フルクトースもタンパク質と結合します。
【アルデヒド基はタンパク質と結合する】
アルデヒド基はタンパク質の側鎖のアミノ基と反応して結合します。
病理検査で組織を固定する時にホルマリン(ホルムアルデヒドの水溶液)やグルタールアルデヒドを使用します。これは、ホルムアルデヒドやグルタールアルデヒドのアルデヒド基が組織のタンパク質のアミノ基と反応してタンパク質を架橋して凝固させる作用を持つからです。
アルデヒド基をもつグルコースも、細胞や組織の様々なタンパク質に結合して、働きを阻害します。つまり、グルコースはアルデヒド基を持つので、体に毒になる可能性を秘めているのです。
タンパク質のN未端あるいは分子内に含まれるリジン残基の遊離アミノ基はグルコースのアルデヒド基と非酵素的に結合します。この給合はいったん形成されると自然に解離することはありません。これをタンパク質の糖化といいます。
タンパク質の糖化は血糖値の高さに比例して起こるため、寿命の判明しているタンパク質の糖化度を測定すれば、過去のある一定期間の血糖の高さを推定することができます。この原理を利用したのが、糖尿病の検査に使われるヘモグロビンA1c(HbA1c)です。
赤血球の寿命は約120日なので、赤血球に含まれるヘモグロビンというタンパク質の糖化の度合いを測定すると、過去1~2ヶ月間の血糖値の指標になると考えられています。
食後に血糖が上がると、体は膵臓からインスリンを分泌して血糖を下げます。このインスリンによる血糖調節機構が破綻し、アルデヒド基をもつグルコースの毒性によって細胞や組織のダメージが進む状態が糖尿病という病気です。
【糖化したタンパク質が老化を促進する】
消化管粘膜上皮や血液細胞のように再生によって絶えず入れ替わっている細胞であれば、タンパク質の糖化が起こっても、新しい細胞に交代することで若い状態を維持できます。 一方、寿命の長い細胞やタンパク質は糖化が蓄積するので、タンパク質の糖化による影響を受けやすくなります。
例えば、神経細胞は増殖や再生をしないで一生使われるので、加齢とともにタンパク質の糖化が蓄積して機能が低下していきます。
皮膚のコラーゲンが糖化すると肌の張りや弾力性が低下します。血管のコラーゲンやエラスチンも寿命が長いので、糖化が蓄積すると体中の血管が徐々に破壊されて多くの臓器の働きが低下します。
「人は血管とともに老化する」と言われています。血管が老化して固くなると、臓器や組織を養う血液循環が悪くなり働きが低下するからです。健康を維持するためには血管を柔らかい状態に維持することが必須であり、そのためには血管のタンパク質の糖化を防ぐことが大切なのです。
白内障もタンパク質の糖化が原因です。眼のレンズに相当する水晶体を満たすクリスタリンというタンパク質は一度作られると補充や交換ができません。クリスタリンの糖化が進行すると固くなり透明度が低下して視力に障害がでるのが白内障です。
このように、神経や血管や皮膚や水晶体などのタンパク質に糖化が進むことによって、様々な老化現象が起こっています。
【糖化最終生成物(AGEs)が細胞機能を阻害する】
料理で食材を加熱すると、グルコースやフルクトースのような還元糖とアミノ化合物(タンパク質やペプチドやアミノ酸)が反応して様々な物質ができます。これらの物質は料理の味や香りや色とも関係しています。この反応はアミノカルボニル反応、あるいは発見者の名前をとってメイラード(Maillard)反応と呼ばれています。
このメイラード反応は非酵素的な反応で、加熱によって短時間で進行しますが、常温でも長い時間をかけて進行します。生体内でグルコースやフルクトースなどの還元糖がタンパク質に結合する糖化反応も生体内で起こるメイラード反応です。
体内で生成した糖化タンパク質はその後分解して様々な低分子物質が生成します。これらの物質を糖化最終生成物(advanced glycation endproducts;AGEs)と言います。AGEsというのは糖化反応による生成物の総称で、多数の種類が知られています。このAGEsという物質が、さらにタンパク質を変性させ、炎症や酸化ストレスを高めて老化を促進します。すなわち、AGEsはタンパク質を架橋して変性させ、正常な働きを阻害します。
マクロファージなどの炎症細胞や血管内皮細胞にはAGEsで修飾されたタンパク質が結合する複数の種類の受容体があり、これらの受容体にAGEs修飾タンパク質が結合すると細胞内のシグナル伝達系が活性化されて、増殖因子や炎症性サイトカインの産生が促進され、活性酸素の発生も増えてきます。
【糖質の摂取量が多いほど老化が促進される】
糖質を多く摂取すると血糖が上昇し、タンパク質の糖化やAGEsの産生が増えます。健常者でも、皮膚コラーゲン中のAGEs蓄積量は加齢とともに増加し、糖尿病患者で同年齢の健常者よりもAGEsの量が多いことが報告されています。
糖化によるAGEsの生成・蓄積は、糖尿病における様々な組織の機能低下だけでなく、動脈硬化や認知症や骨粗鬆症や皮膚の弾力低下など、加齢に伴う多くの老化現象の根本的な原因となっています。
つまり、糖質自体に老化を促進する作用があり、タンパク質の糖化やAGEsの産生を減らすこと、すなわち糖質摂取を減らすことで老化を遅らせることができると言えます。糖質はエネルギー源として有用ですが、生体にとって毒作用もあるという二面性を持っている物質なのです。

図:グルコースやフルクトースがタンパク質に結合して生成される糖化タンパク質や糖化最終生成物(AGE)は細胞や組織のタンパク質の架橋や変性を起こす。微小血管が高度に障害されると神経障害や腎臓障害や網膜症が発症し、大きな血管に障害が蓄積すると動脈硬化が進行し、心筋梗塞や脳卒中や末梢動脈の循環障害が起こる。
【ポリオール代謝経路の活性化は還元型グルタチオンの量を減らす】
前述のように、グルコースはアルデヒド基があるから体に害になります。体内で生成する毒性のあるアルデヒド類を代謝(解毒)するためにアルドース還元酵素(Aldose reductase)があります。
グルコースは末端にアルデヒド基(-CHO)があり、グルコースもアルドース還元酵素の基質になります。つまり、アルドース還元酵素は、アルドース(アルデヒド基をもつ単糖)を糖アルコールに変換する酵素です。この酵素反応にはNADPHが使われます。
細胞内でグルコースの濃度が高くなると、アルドース還元酵素によってソルビトールに変換され、さらにソルビトール脱水素酵素によってフルクトースに変換されます。この経路をポリオール経路(polyol pathway)と言います。
ポリオール経路が亢進するとNADPHを消耗します。このNADPHは酸化型グルタチオンを還元型に戻すのに必要です。
グルタチオンは細胞内に0.5~10mMという非常に高濃度で存在します。チオール基(SH基)を持ち、この水素が電子を供与することによって活性酸素やフリーラジカルを消去します。 還元型のグルタチオンはGSH(Glutathione-SH)と表記され、GSHが活性酸素などで酸化されると酸化型グルタチオンGSSG(Glutathione-S-S-Glutathione)になります。
つまり、酸化型は、二分子の還元型グルタチオンがジスルフィド結合(2個のイオウ原子が繋がった状態)によってつながった分子です。 細胞内で発生した活性酸素やフリーラジカルに電子を与えて酸化型になったグルタチオンを還元型に戻す酵素がグルタチオン還元酵素で、このときNADPH(ニコチンアミドアデニンジヌクレオチドリン酸、nicotinamide adenine dinucleotide phosphate)から水素をもらいます。
つまり、NADPHは酸化型グルタチオンを還元型に戻すのに必要で、NADPHが消費されて少なくなると還元型グルタチオンが減るので、細胞の抗酸化力が低下し、酸化ストレスを高める結果になります(下図)
ポリオール経路の亢進は糖尿病性の網膜症や腎症や神経障害といった糖尿病の合併症の発症に関る主要な機序の一つとして考えられており,高血糖状態では細胞内のポリオール経路の代謝亢進によるソルビトールの蓄積や補酵素のNADPHの減少が組織障害を引き起こすと考えられています。

図:細胞内でグルコースの濃度が高くなると、解糖系で分解される以外に、グルコースはアルドース還元酵素でソルビトールに変換され、さらにソルビトール脱水素酵素によってフルクトースに変換される。この経路をポリオール経路という。アルドース還元酵素ではNADPHが使われるので減少する。NADPHは酸化型グルタチオンを還元型グルタチオンに戻すのに必要であるため、ポリオール経路が亢進すると還元型グルタチオンが減少して抗酸化力が低下する。
【老化細胞の蓄積は組織機能を障害する】
老化細胞は、増殖を停止した細胞です。老化細胞が組織に蓄積すると、周りの正常細胞に様々な悪影響を及ぼすことが知られています。
老化細胞はサイトカイン、成長因子、ケモカイン、プロテアーゼなどの多くの成分を分泌しています。これらの因子は老化関連分泌表現型(senescence-associated secretory phenotype :SASP)と呼ばれ、老化細胞の周囲の組織に炎症や機能障害を引き起こす可能性があります。つまり、老化細胞が蓄積すると老化関連分泌表現型(SASP)の産生によって、その組織の機能が傷害されるのです。

図:加齢とともに、正常組織の中に増殖を停止した老化細胞が出現する。老化細胞は老化関連分泌表現型(senescence-associated secretory phenotype :SASP)と呼ばれる様々な因子(サイトカイン、成長因子、ケモカイン、プロテアーゼなど)を産生して、慢性炎症を誘発し、周りの正常細胞や組織の機能を障害する。
遺伝子が損傷した細胞の異常増殖を避けるために、様々な細胞障害に応答して永久的な細胞増殖停止を引き起こすメカニズムが細胞内に発達したと考えられています。これが細胞老化という現象です。細胞老化はがん細胞の発生を阻止するためのメカニズムと理解されています。
細胞老化が抗腫瘍メカニズムとして作用するにもかかわらず、老化細胞が腫瘍形成の素因となり、促進する可能性があるという説得力のある証拠があります。
老化細胞自体は増殖能力を失っているため、がん細胞に変化することはありませんが、それらに隣接する細胞が危険にさらされる可能性があります。これは、老化細胞が老化関連分泌表現型 (SASP) として知られる炎症誘発性の細胞間シグナル伝達に関与する多数の因子の合成および放出を増加するからです。これらの因子の中には、腫瘍形成を促進できるさまざまな炎症性分子と細胞外小胞があります。
老化した繊維芽細胞からの SASP は、がん細胞の発生や増殖や腫瘍形成を促進することが示されています。
このように、老化細胞を選択的に排除する薬物、あるいはSASPを標的とする薬剤の開発が注目されています。
老化細胞を選択的に排除する薬物をsenolytic drugと言います。「seno=老化」と 「lytic = 溶解」を組み合わせた用語です。「老化細胞除去薬」という意味です。
老化細胞除去作用のある天然物としてフィセチンとケルセチンが注目されています。
フィセチンは、イチゴ、キュウリ、リンゴ、ブドウ、玉ねぎなどの果物や野菜に含まれる生理活性フラボノール分子です。フィセチンが細胞の老化を抑制することやマウスの寿命を延ばすことが報告されています。
フィセチンは、PI3K / mTOR経路を含む複数のシグナル伝達キナーゼを阻害し、抗がん剤としても注目されています。
ケルセチン(quercetin)はフラボノイドの一種で、配当体(ルチン、クエルシトリンなど)または遊離した形で柑橘類、タマネギ、そばをはじめ多くの植物に含まれるフラボノイドの一種です。ケルセチンは複数のキナーゼを阻害します。
老化細胞のアポトーシスを抑制している遺伝子をターゲットにして、アポトーシスを誘導して老化細胞を除去しようという方法です。
老化関連分泌表現型 (SASP) の作用を抑制する薬をSenomorphic drug(老化細胞阻害薬)と言います。mTOR阻害薬のラパマイシン(Rapamycin)、AMPK賦活剤のメトホルミン(Metformin)、JAK阻害剤のルキソリチニブ(Ruxolitinib)などが有用視されています。

図:加齢とともに、正常組織の中に老化細胞が出現する。老化細胞は老化関連分泌表現型(senescence-associated secretory phenotype :SASP)と呼ばれる様々な因子(サイトカイン、成長因子、ケモカイン、プロテアーゼなど)を産生して、周りの正常細胞や組織 に慢性炎症を誘発し、がん細胞の発生や増殖を促進する。老化細胞を除去する老化細胞除去薬(Senolytic drug)や老化細胞阻害薬(Senomorphic drug)はSASPの産生を阻害してがん細胞の発生と増殖を抑制する。
【p16INK4aは細胞老化のマーカー】
体の組織は組織幹細胞が細胞分裂によって細胞を補うことによって正常に維持されますが、加齢とともに組織幹細胞も老化によって次第に再性能(細胞分裂能)を失い、やがて死滅し、数が減っていきます。その結果、組織の細胞量が減少し機能が低下していきます。
この老化の速度は個人差があり、遺伝的要因や生活要因や環境要因によっても影響をうけます。
老化の程度や速度を評価するには「老化のマーカー」が必要です。これは、老化に伴って細胞内量が増えるか減るような(細胞の老化の程度と相関するような)細胞内物質が候補になります。
生化学的なマーカーとしては細胞老化関連ベータ・ガラクトシダーゼ(senescence-associated β-galactosidase)があります。老化した細胞はこの酵素の活性が高くなっており、X-galを使って老化細胞を染色することができます。senescence(細胞老化)というのは、増殖促進刺激に対して応答しなくなり、安定的に細胞周期が停止した状態の細胞です。細胞分裂できなくなった細胞です。
老化の分子マーカーとしてよく使われているのがp16INK4aというタンパク質です。P16INK4aは細胞の老化にともなって指数関数的に増加することが知られています。
細胞内のp16INK4aの量は16.7年で2倍になるという報告があり、この倍加時間で倍々になっていきます。つまり、細胞内のp16INK4aの発現量が多いほど、その細胞は老化していると評価されています。
p16INK4aタンパク質はサイクリン依存性期キナーゼ(cyclin dependent kinase: CDK)4と6(CDK4とCDK6)に結合する分子量が約16000ダルトン(16kDa)のタンパク質です。
p16INK4aはCDK4とCDK6に結合することによって、CDK4とCDK6がサイクリンD(cyclin D1, D2, D3)と結合することを阻害します。
CDK4とCDK6は細胞が分裂をスタートするときに必須の働きを行うので、このサイクリン依存性期キナーゼ(CDK4/6)が阻害されると細胞は分裂できません。
細胞が分裂して数を増やしていくとき、細胞周期は4 つの段階に分けられます。すなわち、DNA複製前のG1(Gap1) 期、DNA複製期(S期)、細胞分裂前のG2(Gap2)期、および最後の細胞分裂期(M) 期に分けられます。増殖を休止した状態の細胞はG0期にあると定義されます。
がん抑制遺伝子のRBタンパク質はE2Fに結合してE2Fの転写活性を阻害しています。細胞周期がG1期からS期に移行するとき、RBタンパク質がサイクリン依存性キナーゼ(CDK)でリン酸化されます。RBタンパク質がリン酸化されると転写因子のE2Fと結合できなくなり、フリーになったE2Fは増殖に関連する遺伝子の発現を促進して細胞周期を回します。
サイクリン依存性キナーゼ(CDK)はサイクリン依存性キナーゼ阻害因子というタンパク質によって機能が阻害されます。このサイクリン依存性キナーゼ阻害因子にはp16INK4a やp21Waf1/Cip1/Sdi1などのタンパク質が知られています。
(下図)

図:G1期にRBタンパクはE2Fという転写因子に結合して、E2Fの活性を抑えている(①)。E2Fは転写因子で細胞の増殖にとって重要な多くの遺伝子の発現を亢進する(②)。したがって、RBが結合してE2Fの活性を抑えていると、細胞は増殖サイクルに入れない。しかし、サイクリン依存性キナーゼ(Cdk4あるいはCdk6)とサイクリンDの複合体によってRBがリン酸化されると(③)、RBタンパクはE2Fから解離し、E2Fが活性な転写因子となって増殖関連遺伝子の発現を引き起こす(④)。その結果、細胞はDNA複製を開始して増殖サイクルを回し出す(⑤)。p16INK4aはサイクリン依存性キナーゼのCdk4とCdk6と結合することによって阻害する(⑥)。Cdk4/6の活性が阻害されると、RBはリン酸化されないので、細胞周期はストップした状態に維持される(⑦)。老化した細胞(分裂能を喪失した細胞)ではp16INK4aの発現量が増えており、p16INK4aは細胞の老化のマーカーとして知られている。
細胞の老化(senescence)というのは、細胞が不可逆的に分裂を停止する(細胞分裂能を喪失する)事です。細胞にダメージが蓄積して老化してくると、サイクリン依存性キナーゼ阻害因子のp16INK4aの発現量が増えてきて、細胞周期が回らないようにすると考えられます。したがって、老化した細胞ほどp16INK4aの発現量が増えており、細胞老化のマーカーとなるのです。
p16INK4aを発現する細胞を任意のタイミングで選択的に除去できる遺伝子改変マウスを用いた実験で、老化細胞(p16INK4aを多く発現する細胞)の除去によって老化の進行を抑制できることが示されています(Nature. 2011 Nov 2;479(7372):232-6.)
【糖質制限は正常細胞のp16INK4αの発現を抑制して老化速度を遅くする】
p16INK4αが増えた細胞は老化した細胞で、このタンパク質の量があるレベルを超えると細胞分裂能を喪失すると考えられます。したがって、細胞内のp16INK4αの発現量は「細胞の老化の程度」と評価するマーカーになります。一方、p16INK4αの遺伝子発現の抑制は細胞の寿命を伸ばすことにつながります。以下のような論文があります。
p16(INK4a) suppression by glucose restriction contributes to human cellular lifespan extension through SIRT1-mediated epigenetic and genetic mechanisms.(グルコース制限によるp16INK4a遺伝子発現の抑制は、SIRT1-介在性のエピジェネティックあるいはジェネティックなメカニズムでヒト細胞の寿命延長に貢献する)PLoS One. 2011 Feb 24;6(2):e17421. doi: 10.1371/journal.pone.0017421.
【要旨】
カロリー制限が様々な動物において寿命を延長することが確認されているが、そのメカニズムについては十分に解明されていない。
培養液中のグルコースの濃度を減らすことによってカロリー制限と類似の状況を作り出す培養細胞の実験モデルを使って、細胞分子レベルでカロリー制限(グルコース制限)の作用メカニズムを検討した。
正常のヒト肺線維芽細胞(WI-38, IMR-90, MRC-5)においては、正常のグルコース濃度で培養した細胞と比べて、グルコースの量を減らした(グルコース制限)培養液で培養した細胞では、老化速度が抑制され、細胞の寿命が顕著に延長した。
さらに、検討した全ての細胞株において、グルコース制限は老化関連遺伝子として知られているp16INK4aの発現量を減少させた。
グルコース制限を行っている細胞(老化が抑制されている細胞)にp16遺伝子を過剰発現させると、細胞分裂が早期に停止し細胞老化が促進された。この結果は、グルコース制限による細胞寿命の延長にp16が重要な役割を担っていることを示している。
p16の発現抑制は、グルコース制限によってヒストン・アセチル化によるクロマチン再構成とp16遺伝子のプロモーター領域のメチル化が関与していた。
グルコース制限はNAD依存性のヒストン・脱アセチル化酵素であるSIRT1(サーチュイン1)の発現を増やした。SIRT1はカロリー制限による寿命延長と関連していることが知られている。
SIRT1の発現亢進はAkt/p70S6K1シグナル伝達系の活性を促進する。SIRT1遺伝子を欠損させた細胞では、グルコース制限によるp16発現の抑制とAkt/p70S6K1シグナル伝達系の活性化は起こらなかった。
これらの結果は、SIRT1はヒストンの脱アセチル化による直接作用とAkt/p70S6K1シグナル伝達系を介する間接的な作用によってp16遺伝子の発現を抑制することを示唆している。
複雑なメカニズムですが、簡単にまとめると「正常細胞に対してグルコース制限はp16INK4aの発現を抑制して、細胞の老化を遅らせる」ということです。そのメカニズムとしてSIRT1やヒストンアセチル化などが関与しているという話です。
【糖質制限はがん細胞のp16INK4αの発現を亢進して増殖を抑制する】
前述のように老化のマーカーであるp16INK4aを指標にした研究で糖質制限が正常細胞のp16INK4aの発現量を減少させて老化速度を遅くするという報告があります。
さらに、グルコース制限はがん細胞に対しては、正常細胞とは逆の応答をするという報告があります。以下のような論文があります。
Glucose restriction can extend normal cell lifespan and impair precancerous cell growth through epigenetic control of hTERT and p16 expression.(糖質制限はhTERT遺伝子とp16遺伝子の発現をエピジェネシスによる制御を介して正常細胞の寿命を延ばし、前がん細胞の増殖を抑制する)FASEB J. 24(5): 1442-1453, 2010年
【要旨】
がん細胞はグルコースの取込みと代謝が亢進しており、そのためグルコースの制限に対して正常細胞に比べて増殖や生存に対する影響が大きい。しかしながら、正常細胞とがん細胞のグルコース制限に対する影響の違いに関する分子メカニズムは十分に解明されていない。
正常な胎児肺線維芽細胞WI-38と、WI-38にがん遺伝子を導入して不死化したWI-38/S細胞を用いてグルコース制限に対する影響を検討した。その結果、不死化したWI-38/Sではグルコース制限によって増殖阻害とアポトーシスの誘導が認められたが、正常細胞のWI-38ではグルコース制限は寿命を延ばした。
さらに、WI-38/S細胞では、グルコース制限によってhTERT(human telomerase reverse transcriptase; ヒト・テロメラーゼ逆転写酵素)の発現が減少し、がん抑制遺伝子のp16INK4aの発現が増加した。
正常細胞のWI-38細胞では、hTERT遺伝子とp16遺伝子の発現に対するグルコース制限による影響は逆であった。(WI-38細胞では、グルコース制限でhTERT遺伝子の発現は増加し、p16INK4a遺伝子の発現や減少した)
このようなWI-38とWI-38/S細胞の遺伝子発現の違いは、hTERT遺伝子とp16遺伝子のプロモーター領域におけるDNAのメチル化やクロマチン再構成(chromatin remodeling)におけるグルコース制限による変化がWI-38とWI-38/Sとで異なることが関与していると思われた。
さらに、グルコース制限によるhTERT遺伝子とp16遺伝子の発現量の変化はWI-38の方がWI-38/S細胞より明らかであり、これはエネルギー低下によるストレスで誘導される遺伝子のエピジェネシスによる制御が正常細胞と前がん細胞で異なっていることを示唆している。
以上の結果から、食事による遺伝子のエピジェネシスによる制御が、がんの治療法と抗老化の手段となりうることを示している。
真核生物の染色体には端っこにテロメアと呼ばれる配列があり、細胞が分裂するたびにこのテロメアが減っていきます。このテロメアがある程度短くなると細胞は分裂できなくなります。つまり細胞分裂能の喪失(=老化)ということになります。
短くなったテロメアをもう一度伸ばしてくれる酵素が「テロメラーゼ」でこのタンパク質をコードしている遺伝子がhTERT遺伝子です。hTERT遺伝子の発現が増加するというのは、細胞の分裂する回数を増やすことができます。
普通の正常細胞ではテロメラーゼはほとんど発現していないため、細胞分裂の回数に限界があります。
一方、多くのがん細胞では、テロメラーゼが発現し、活性が亢進しています。その結果、無限に増殖できることになります。
図:染色体DNAの末端部分にはTTAGGGという配列が多数繰り返されたテロメアという構造が存在する(①)。正常細胞では細胞分裂のたびにテロメアが短縮し(②)、その短縮が限界に達するとDNAの複製ができなくなり、細胞はもはや分裂することが出来ず、細胞死を引き起こす(③)。多くのがん細胞ではテロメラーゼの発現と活性が亢進しておりテロメアを再生できる(④)。その結果、がん細胞は無限の細胞分裂能(不死化)を獲得している(⑤)。
この論文の結果では、がん細胞ではグルコース制限によってhTERTの発現が減少し、がん抑制遺伝子のp16INK4aの発現が増加し(=細胞が老化の方向に向かう変化)、正常細胞では逆に、グルコース制限でhTERT遺伝子の発現は増加し、p16INK4a遺伝子の発現が減少しました(=細胞が老化を抑える変化)。
培養細胞での検討ですが、糖質制限はがん細胞の老化を促進し、正常細胞の老化を抑制する可能性を示しています。
正常細胞の培養液にグルコースの量を増やすと老化が促進されることが報告されています。逆にがん細胞の場合は、グルコールの取込みと利用が亢進しているので、グルコースの量を増やすとがん細胞の増殖が促進されます。
つまり、正常細胞とがん細胞では、グルコース濃度に対する対応が全く異なります。
生体でも、高血糖はがん細胞の増殖を促進し、正常細胞の老化を促進します。したがって、糖質制限はがん細胞の増殖を抑制し、正常細胞の老化を抑制することになります。
がんの治療や再発予防やがんサバイバーにおける長期的な副作用(老化促進や2次がんなど)の予防に糖質制限が役立つことを示唆する研究結果だと思います。
【糖質は単糖に分解されて消化管から吸収される】
米やパンや麺類やイモなどに多く含まれる炭水化物(糖質)は、糖がいくつも連なった物質です。このような糖が連なった状態では小腸から吸収されないため、糖を細かく切っていく必要があります。この時に働く酵素がアミラーゼです。アミラーゼなどの酵素が働くことで、糖が2つ連なった二糖類へと変換されます。
二糖類もまだ小腸から吸収されません。小腸から吸収されるためには、単糖類として1つの糖にまで分解される必要があります。そして、「二糖類 → 単糖類」への分解に関与している酵素がα-グルコシダーゼです。
そこで、このα-グルコシダーゼを阻害できれば、糖の吸収を阻害することができます。
このような作用をする薬をα-グルコシダーゼ阻害薬と呼びます。α-グルコシダーゼ阻害薬としてアカルボースなどがあります。
アカルボースは小腸粘膜微絨毛膜に存在するα-グルコシダーゼ(グルコアミラーゼ、スクラーゼ、マルターゼ) を用量依存的に阻害するほか、膵液及び唾液のα-アミ ラーゼも阻害し、食後の著しい血糖上昇を抑制します。

図:食品中のデンプンなどの糖質はアミラーゼによって二糖類まで分解され、さらに小腸でα-グルコシダーゼによって単糖に分解されて小腸粘膜から体内に吸収される。α-グルコシダーゼ阻害薬は糖質の吸収を阻害することができる。
【α-グルコシダーゼ阻害薬のアカルボースは寿命を延ばす】
前述のように、「糖質の摂取量が多いほど老化が促進される」、 「糖質制限は正常細胞の老化速度を遅くする」、「糖質制限は老化細胞を除去して、がん細胞の発生を抑制する」、「糖質制限はがん細胞の増殖を抑制する」ことが明らかになっています。
正常細胞の培養液にグルコースの量を増やすと老化が促進されることが報告されています。逆にがん細胞の場合は、グルコールの取込みと利用が亢進しているので、グルコースの量を増やすとがん細胞の増殖が促進されます。
つまり、正常細胞とがん細胞では、グルコース濃度に対する対応が全く異なります。
生体でも、高血糖はがん細胞の増殖を促進し、正常細胞の老化を促進します。したがって、糖質制限はがん細胞の増殖を抑制し、正常細胞の老化を抑制することになります。
がんの治療や再発予防やがんサバイバーにおける長期的な副作用(老化促進や2次がんなど)の予防に糖質制限が役立つことが示唆されます。
食事からの糖質摂取を減らすことで上記の効果が得られるのであれば、食品中の糖質の吸収を阻害するα-グルコシダーゼ阻害薬は、糖質制限と同様に、老化抑制やがん予防の効果が期待できると予測できます。
実際に、α-グルコシダーゼ阻害薬のアカルボースが老化を抑制して寿命を延ばす効果、がんを予防する効果が報告されています。
例えば、以下のような報告があります。米国のシアトルのワシントン大学医学部からの報告です。
The antidiabetic drug acarbose suppresses age-related lesions in C57BL/6 mice in an organ dependent manner(糖尿病治療薬アカルボースは C57BL/6 マウスの加齢に伴う病変を臓器依存的に抑制する)Aging Pathobiol Ther. 2021 Jun 29;3(2):41-42.
【要旨】
アカルボースは、糖質の単糖への変換を阻害することによって血糖を下げるために使用される糖尿病治療薬である。マウスの寿命を延ばすことにより、老化防止薬としての有望性も示されているが、老化したマウスの短期治療の効果に関する研究は報告されていない。この問題に対処するために、生後20か月の C57BL/6 オスとメスのマウスに標準食、または 1000 ppmのアカルボースを添加した食事を3か月間与えた。この期間の後、老化の進行の遅延の有無を検討するために、加齢に伴う病変についてマウスを評価した。
結果は、アカルボースを投与されたマウスでは、心臓と腎臓の老化性病変が有意に減少したことが示された。これは、アカルボースが加齢に伴う心臓と腎臓の機能異常を抑制できることを示唆している。
C57BL/6マウスの平均寿命はオス826日、メス766日という報告があります。生後20ヶ月(600日)は人間の平均寿命を80歳とした場合の60歳前後に相当します。この年齢からでも糖質制限やアカルボースによる糖質吸収阻害は心臓や腎臓など臓器の老化性病変の進行を遅らせる効果が期待できるということです。
以下のような報告もあります。米国メイン州のジャクソン研究所、テキサス大学、ミシガン大学など多数の研究機関の共同研究です。
Acarbose improves health and lifespan in aging HET3 mice.(アカルボースは老化した HET3 マウスの健康と寿命を改善する)Aging Cell. 2019 Apr; 18(2): e12898.
【要旨の抜粋】
食後のグルコーススパイクを抑制する薬剤であるアカルボースがマウスの寿命を延ばすという以前の報告を追試するために、老化したHET3 マウスを使用して、400 ppm、1000 ppm、および2500 ppmの3つの用量でアカルボースの効果を検討した。
以前の報告と一致して、アカルボースの効果はオスの方がメスより大きく、オスの寿命の中央値を 1000 ppmで16% 、2500 ppmで 17% 増加させたが、メスでは1000 ppmで4%、2500ppmで 5%しか増加しなかった。
寿命に対する性別の影響は、体重や体脂肪量だけでは説明できない。オスよりもメスの方がアカルボースによって減少した。1,000 ppm のアカルボースは、オスの肺腫瘍を減少させた。
アカルボースの効果は、がんを含む老化性の病気に対する一過性の高血糖(グルコーススパイク)の影響へのさらなる注意を促し、ヒトにおけるアカルボースや他のグルコース制御薬の有用性を指摘している。
食事で糖が吸収されると血糖値が上昇します。血糖が上昇すると膵臓からインスリンが分泌されて血糖を低下させます。血糖値の急上昇や急降下は、血管の内壁に大きな負担をかけ、動脈硬化を引き起こす原因となります。
食後の血糖値が急上昇と急降下を起こす状態を「血糖値スパイク(グルコーススパイク)」といいます。スパイクは「とげ」を意味しますが、血糖値のグラフを見るとまさに「とげ」のような形になっています。
α-グルコシダーゼ阻害薬は糖の吸収をゆるやかにします。その結果、血糖値スパイクが抑制され、グルコースによる毒性が軽減されます。
グルコースの吸収を抑制するアカルボースは、ダイエットやカロリー制限のいくつかの側面を再現する薬です。食後のグルコースの急上昇が老化に寄与する可能性があることが示唆されていますが、この血糖値スパイクはアカルボースによって減少します。
アカルボースは、食後高血糖を予防するために臨床的に広く使用されています。アカルボースはα-グルコシダーゼとα-アミラーゼを阻害するため、食事中の血糖値スパイクが鈍くなり、多糖類の消化速度が低下し、糖の取り込みが減少します。
【アカルボースは腸内の短鎖脂肪酸を増やして寿命を延ばす】
さらに、分解されずに大腸に移行した糖質が腸内細菌の餌になり、腸内細菌叢を変化させる効果も報告されています。すなわち、アカルボースを投与されたマウスは腸内細菌による短鎖脂肪酸、特に酪酸が増えることが報告されています。酪酸などの短鎖脂肪酸が増えると寿命が延びることが報告されています。以下のような報告があります。
Acarbose enhances human colonic butyrate production(アカルボースはヒト大腸における酪酸産生を増やす)J Nutr. 1997 May;127(5):717-23.
二重盲検クロスオーバー試験で、1 日 3 回、50 ~ 200 mg のアカルボースまたはプラセボ (コーンスターチ) を被験者に与えました。
アカルボース投与群では、でんぷん発酵菌と酪酸菌が増え、糞便中の酪酸濃度が有意に増加しました。
以下のような論文もあります。
Extension of the Life Span by Acarbose: Is It Mediated by the Gut Microbiota?(アカルボースによる寿命の延長;腸内細菌叢によって媒介されるのか?)Aging Dis. 2022 Jul 11; 13(4): 1005–1014.
アカルボースは、食後の高血糖の発生率を減らし、血管内皮細胞の機能障害を改善することにより、心血管疾患の多くの危険因子を軽減することができます。アカルボースは、中程度の運動と組み合わせると、血糖値と心血管疾患に関連する危険因子を改善することもできます。
さらに、アカルボースを介した食後の血糖値の低下は、間接的にグルコース代謝を変化させ、それによってインスリン感受性を改善し、寿命に影響を与える可能性があります。
さらにアカルボースは、腸内微生物叢が関与するプロセスを通じてマウスの寿命を延ばすことが報告されています。 アカルボースは、結腸に入るデンプンの量を増やすことができ、それによって炭水化物分解細菌を増やし、腸内微生物叢とその発酵産物を変化させます。したがって、アカルボースによる治療は、潜在的な 短鎖脂肪酸 産生菌の存在量を増加させる可能性があります。
酪酸菌を増やすと寿命が延びることは810話と811話で解説しています。酪酸は様々なメカニズムで免疫力を高め、寿命を延ばす効果があります。
つまり、アカルボースは糖質摂取の減少や血糖スパイクの抑制に加えて、腸内細菌の酪酸産生を増やす効果など、総合的に健康寿命を延ばす効果が期待できます。
私は、基本的にケトン食(低糖質+高脂肪食)を実践していますが、時々、糖質+アカルボースで息抜きしています。ただ、これは酪酸を増やすメリットもあるので、ケトン食を実践している人はアカルボースも利用すると良いかもしれません。アカルボースは糖質を食べていない時は服用する必要はありません。糖質を食べた時だけです。アカルボースは非常に安価です。
酪酸菌の宮入菌(ミヤリサン、ミヤBM)と食物繊維とアカルボース(+糖質)の組み合わせは、腸内の酪酸を増やして、寿命延長に有効です。

図:食事中の糖質(①)は唾液や膵液のα-アミラーゼで二糖類(②)になり、小腸のα-グルコシダーゼによって単糖類(③)となって腸から吸収される。血糖とインスリンの上昇は老化を促進し、寿命を短縮し、がん細胞の発生と増殖を促進する(④)。アカルボースはα-アミラーゼとα-グルコシダーゼの両方を阻害する(⑤)。糖質と二糖類は腸から吸収できないので、腸内細菌によって分解され、酪酸などの短鎖脂肪酸が増える(⑥)。短鎖脂肪酸は老化を抑制し、寿命を延ばし、がん細胞の発生と増殖を抑制する(⑦)。
| « 830)スルフォ... | 832)抗腫瘍免... » |



