がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
807) 魚油はがん患者の悪液質を改善する
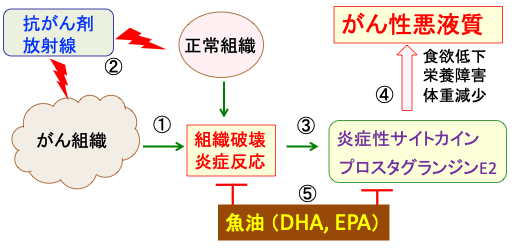
図:がん細胞は周囲の正常組織を破壊し、炎症反応を引き起こす(①)。抗がん剤や放射線治療はがん組織だけでなく正常組織にもダメージを与えて炎症反応を増悪する(②)。組織破壊とそれに伴う炎症反応はIL-1、 IL-6、 TNF-αなどの炎症性サイトカインやプロスタグランジンE2の産生を増やし(③)、食欲低下や栄養障害や体重減少を引き起こしてがん性悪液質を引き起こす(④)。ドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)の豊富な魚油は、抗炎症作用や抗がん作用によってがん性悪液質を抑制し、体重減少を抑え、がん患者の生活の質を改善し、延命する。
807) 魚油はがん患者の悪液質を改善する
【魚や海洋由来オメガ3系多価不飽和脂肪酸の摂取はがん患者の生存率を高める】
魚や海洋由来オメガ3系多価不飽和脂肪酸(DHAやEPA)の摂取が多いと、がん患者の生存率を高めることがメタ解析で明らかになっています。以下のような報告があります。
Dietary fish and omega-3 polyunsaturated fatty acids intake and cancer survival: A systematic review and meta-analysis.(食用魚とオメガ3多価不飽和脂肪酸の摂取量とがんの生存:系統的レビューとメタ分析)Crit Rev Food Sci Nutr. 2022 Jan 24;1-17.
【要旨】
魚とオメガ3多価不飽和脂肪酸は、がん患者の予後を改善する可能性が示唆されている。ただし、疫学研究の結果には必ずしも一致していない。この報告では、魚の摂取あるいはオメガ-3多価不飽和脂肪酸の摂取量とがん患者の予後との関連を検討した観察研究のメタ解析を実施した。
PubMedなどのデータベースを使用して、関連する論文の検索を行った。
このメタ解析には21件のコホート研究が含まれた。
ハザード比(HR)と95%信頼区間(CI)が抽出され、ランダム効果モデル(random-effect model)を使用してプールされた。
魚の摂取量が最も低い群と比較して、魚の摂取量が最も多い群では、卵巣がん患者(n = 1、HR = 0.74、95%CI:0.57-0.95)および全がん(n = 12、HR = 0.87、95%CI:0.81-0.94)において、死亡率の有意な低下を認めた。
オメガ3多価不飽和脂肪酸の総摂取量ではなく、海洋由来オメガ3 多価不飽和脂肪酸の摂取量は、全がん(n = 8、HR = 0.81、95%CI:0.71-0.94)、特に前立腺がん(n = 2, HR = 0.62, 95% CI: 0.46-0.82)の生存に有意な保護効果を示した。
用量反応メタ解析は、魚の摂取量および海洋由来オメガ3 多価不飽和脂肪酸の摂取量と全体的ながん患者の生存率の間に、それぞれ非線形および線形の関係があることが示された。
結論として、私たちのメタ解析の結果は、魚あるいは海洋由来オメガ-3系多価不飽和脂肪酸の消費は、がん患者の生存率を高めることを示している。
以下のような論文もあります。
Does omega-3 PUFA-enriched oral nutritional intervention benefit cancer patients receiving chemo (radio) therapy? A systematic review and meta-analysis of randomized controlled trials(オメガ3多価不飽和脂肪酸が豊富な経口栄養介入は、化学療法(放射線)療法を受けている癌患者に利益をもたらしますか?ランダム化比較試験の系統的レビューとメタアナリシス)Crit Rev Food Sci Nutr. 2021 Oct 4;1-16.
【要旨の抜粋】
オメガ3多価不飽和脂肪酸ががん治療において有益な栄養素であることが報告されているが、化学療法や放射線療法中のオメガ3多価不飽和脂肪酸の栄養介入の有効性に関する証拠はまだ限られている。
今回のメタ解析の主な目標は、化学療法あるいは放射線治療中のオメガ3多価不飽和脂肪酸を強化した経口栄養補助食品の投与の効果を検討したランダム化比較試験を要約し、患者の栄養状態と臨床転帰へのオメガ3多価不飽和脂肪酸の影響を評価することである。
PubMed、Embase、Web of Science、Cochraneデータベースを体系的に検索し、合計で1155人の参加者を含む22の研究が選択基準を満たした。
メタ解析の結果は、オメガ3多価不飽和脂肪酸の補充は、体重(+0.59 kg)、ボディマス指数(BMI)(+0.43 kg / m2)、血漿総ω-3脂肪酸の有意な増加を示した。C -反応性タンパク質(CRP)、腫瘍壊死因子-α(TNF-α)、インターロイキン6(IL-6)および有害事象の発生率は優位に減少した。しかし、血漿アルブミンレベルは有意な変化は認めなかった。
全体として、私たちのメタ解析は、オメガ3多価不飽和脂肪酸が豊富な経口栄養補助食品の摂取が、化学療法や放射線治療を受けている患者の栄養状態と臨床転帰に有益な効果を発揮するという証拠を提供している。
【がん患者は心臓血管疾患による死亡リスクが高い】
DHAやEPAの豊富や魚油ががん患者の生存率を高める理由として、抗がん剤や放射線治療の副作用を軽減する効果、抗腫瘍効果を高める効果、栄養状態を良くする効果など多数のメカニズムが指摘されています。
例えば、魚油が心血管疾患を予防する効果が知られています。抗がん剤治療はがん患者の心血管疾患を増やすので、魚油の心血管保護作用は重要な作用です。
米国のがん登録データベースを解析した結果、がん患者の10人に一人が心血管死していることが報告されています。以下のような報告があります。
A population-based study of cardiovascular disease mortality risk in US cancer patients.(米国のがん患者における心臓血管疾患による死亡リスクに関する集団ベース研究)Eur Heart J. 2019 Dec 21;40(48):3889-3897.
この研究では、がん登録データベース(Surveillance, Epidemiology and End Results:SEER)から1973~2012年にがんと診断された患者323万4,256例を特定し、心臓血管疾患(心臓病、高血圧、脳血管疾患、動脈硬化、大動脈瘤)による死亡率を解析しました。その結果、がんによる死亡率は38%だった一方で、心臓血管疾患による死亡率は11%でした。心臓血管疾患死の76%は心疾患による死亡でした。
解析対象とした28種類のがんのうち、心臓血管疾患死亡率が最も高かったのは膀胱がん(19%)で、次いで喉頭がん(17%)、前立腺がん(17%)、子宮がん(16%)、大腸がん(14%)、乳がん(12%)の順でした。
心臓血管疾患死亡率よりがん死亡率が高かったがん種は、肺がん、肝がん、脳腫瘍、胃がん、胆嚢がん、膵がん、食道がん、卵巣がん、骨髄腫などの侵襲性が高く治療困難ながんでした。
また、がん診断時に35歳未満であった患者で心血管疾患による死亡リスクが最も高く、がん診断時に55歳未満であったがんサバイバーでは、将来の心血管疾患死亡リスクが一般人口の10倍超に達していました。
さらに、心血管疾患死亡リスクが最も高い時期はがん診断後1年間でした。
その要因として、がん診断時点での心臓血管疾患の合併や診断後の積極的治療(心毒性が高い治療)などが挙げています。心臓血管疾患に対しては、がん治療を行う前から開始して一生継続する予防的な管理が重要で、腫瘍循環器学(Onco-Cardiology)の重要性が指摘されています。
【オメガ3系不飽和脂肪酸の心血管保護作用は用量依存的】
グリーンランドは北極海と北大西洋の間に位置する世界最大の島で、島の大部分が北極圏に属し氷床と万年雪で覆われています。このグリーンランドの先住民のイヌイットの人々は魚やアザラシを常食としているため、オメガ3系多価不飽和脂肪酸のエイコサペンタエン酸(EPA)とドコサヘキサエン酸(DHA)の消費量が極めて多いことが知られています。
このグリーンランドのイヌイットの人々は、デンマークの人口と比較して心血管疾患の発生率が著しく低いことが1976年に発見されました。EPAとDHAの消費量の大きな違いが、主要な要因であると考えられ、それ以降、心血管疾患とオメガ3系不飽和脂肪酸の関係に関する基礎研究および臨床研究が盛んに行われるようになりました。
例えば、40歳から84歳までの米国の男性医師約2万人を対象にしたハーバード大学の研究者らの調査では、魚摂取が月に1回未満の男性に比べて、週に少なくとも1回魚を食べている者は心臓発作などによる突然死が52%低下していることが判明しました。こうした結果を研究者らは魚のω-3系の高度不飽和脂肪酸が血流を促し、心臓での凝血を抑制しているものと見ています。
(Fish consumption and risk of sudden cardiac death. JAMA. 1998 Jan 7;279(1):23-8.)
魚やオメガ3系多価不飽和脂肪酸が心血管疾患を予防する効果を支持しない研究結果も報告されていますが、最近のメタ解析の結果では、DHA/EPAのサプリメントは、心筋梗塞や狭心症のような冠状動脈性心臓病の発症率と死亡率を減らし、その効果は用量依存的であることが明らかになっています。
このメタ解析は、2019年8月より前に公開されたEPA / DHA介入と心血管転帰を伴うすべてのランダム化比較試験(合計135,267人の参加者による合計40件の研究)が含まれました。
1日1 gのDHA/EPAサプリメントで冠状動脈性心臓病と心筋梗塞のリスクがそれぞれ9%と13%減少し、その効果は用量依存的であることが示されています。
(Effect of Omega-3 Dosage on Cardiovascular Outcomes: An Updated Meta-Analysis and Meta-Regression of Interventional Trials. Mayo Clin Proc. 2021 Feb;96(2):304-313.)
欧米の研究では、魚摂取の多いグループで週に1回または2回の魚の摂取です。このような魚摂取の少ない国での研究では、魚摂取を増やすとさらに予防効果が高くなるのか、あるいは予防効果が得られる摂取量の上限があるのかはっきりしません。
そこで、日本人のように魚をよく食べる集団の中での研究が注目されます。日本の疫学研究の結果は、魚やオメガ3系多価不飽和脂肪酸の摂取量が多いほど、虚血性心疾患に予防的な効果があるということが示されました。
Intake of fish and n3 fatty acids and risk of coronary heart disease among Japanese: the Japan Public Health Center-Based (JPHC) Study Cohort . Circulation. 2006 Jan 17;113(2):195-202.
このコホート研究(JPHC研究)では男女約4万人を約11年追跡しました。魚およびオメガ3脂肪酸の摂取量は、2回の食事調査をもとに、摂取する魚の種類と1週間の摂取頻度、1回あたりの摂取量から算出しました。
追跡期間中に男性207人、女性51人、合計258人に虚血性心疾患が確認されました。虚血性心疾患とは、心臓に血液を送る動脈の硬化や血栓などによって、心臓の血流が悪くなることで生じる疾患で、代表的なものに心筋梗塞症があります。
摂取量が最も少ない1日約20gのグループに比べ、その他のグループではいずれもリスクが下がり、最も多いグループでは40%低くなりました。また、全虚血性心疾患のうち、診断の確実な心筋梗塞(心電図、血液検査などから確定)に限った場合には、リスクの低下傾向がよりはっきり示されました。
魚の摂取量が最も多いグループ(中央値180g、週に8回ペース)でも、虚血性心疾患のリスクが低下しました。このことから、魚による虚血性心疾患予防効果は、週1~2回程度でも期待できるけれども、それ以上に食べるとさらに高くなることがわかりました。
魚に豊富に含まれるEPAやDHAといった二重結合をたくさん持った脂肪酸(オメガ3系多価不脂肪酸)には、血小板凝集能の阻害、血液の粘稠度を下げるなどの働きがあります。これが、魚によって虚血性心疾患が予防できる理由の一つと考えられています。
DHAとEPAは血栓形成を抑制し、血管内皮機能を改善します。さらにDHAとEPAは、細胞膜リン脂質に組み込まれた後、心臓のイオンチャネル機能や細胞シグナル伝達経路への有益な効果や細胞膜の流動性の増加などの電気生理学的効果を生み出すことができます。これらの効果は心室性不整脈や心臓突然死のリスクの低下と関連しています。
【がん組織では炎症が起こっている】
がん組織ではがん細胞の周囲にマクロファージや好中球やリンパ球などの炎症や免疫に関与する細胞が多数集まっています。
これはがん細胞が周囲の正常組織を破壊して、炎症を引き起こすからです。また、免疫細胞ががん細胞を敵と認知して攻撃している場合もあります。
つまり、この炎症反応はがん細胞による組織破壊を修復したり、組織を破壊するがん細胞を排除するための正常組織の防御機構による応答です。しかし、この炎症反応ががん細胞を刺激して、増殖や転移を亢進しているという結果になっています。
さらにがん組織における炎症反応は、がん性悪液質を引き起こし、がん患者の食欲低下や体重減少の原因になっています。

図:がん細胞による組織破壊は(①)、マクロファージやリンパ球や好中球などの免疫細胞や炎症細胞を活性化し(②)、組織破壊に対する修復やがん細胞の排除の目的で集まっているが(③)、炎症性サイトカインや増殖因子の産生と分泌が亢進しており、これらががん細胞に対する増殖シグナルとなって、がん細胞の増殖や浸潤を亢進している(④)。このような機序でがん組織は慢性炎症状態になっており、がん性悪液質を引き起こし(⑤)、食欲低下、栄養障害、体重減少、体力低下、倦怠感、睡眠障害、抑うつ、貧血、発熱などの症状を引き起こしている。
【血中のCRPが高いと予後不良】
炎症性サイトカイン(IL-6, IL-1, TNF-α)や炎症マーカーのCRP(C-反応性タンパク)が高い状態は、体内に慢性炎症があることを示唆します。
炎症とがんとの関係は、古代ギリシャ時代の医師のガレノス(Galenus)がすでに指摘しています。
細胞病理学のパイオニアのウィルヒョウ(Rudolph Virchow)は1863年に、がん組織の中に炎症細胞の存在を認め、腫瘍が慢性炎症の部位に発生することを指摘しています。
近年では、分子生物学的研究によって、がんの細胞生物学が明らかになり、がんの微小環境における炎症細胞やサイトカインの重要性が明らかにされています。
体内のがん組織における慢性炎症状態を総合的に評価する指標の一つがCRP(C-reactive protein:C-反応性タンパク)です。
体内に炎症が起きたり、組織の一部が壊れたりした場合、血液中に蛋白質の一種であるC-反応性タンパク(C-reactive protein=CRP)が現われます。
このCRPは、もともと肺炎球菌という肺炎を起こす菌によって炎症がおこったり組織が破壊されたりすると、この菌のC‐多糖体に反応するタンパク質が血液中に出現することからC‐反応性タンパク(CRP)と呼ばれていました。
しかし、肺炎以外の炎症や組織の破壊でも血液中に増加することがわかり、現在では炎症や組織障害の存在と程度の指標として測定されます。
CRPは炎症に対する生体反応として肝臓から産生されます。炎症性サイトカインのIL-6によって合成が亢進されます。CRPは急性期反応タンパク質の一つです。
サイトカインはリンパ球やマクロファージなど炎症や免疫に関わる細胞から分泌されるタンパク質で、細胞の増殖や分化や細胞死などの情報を伝達し、免疫や炎症や創傷治癒など様々な生理機能の調節に重要な役割を担っています。
サイトカインは細胞表面の膜上にある受容体に結合することによって、受容体に特有の細胞内シグナル伝達の引き金となり、極めて低濃度で生理活性を示します。
白血球が分泌し免疫系の調節を行なうインターロイキン、ウイルス増殖阻止や細胞増殖抑制の働きをもつインターフェロン、様々な種類の細胞増殖因子など数百種類のサイトカインが知られています。炎症反応に関与するものを炎症性サイトカインと呼んでいます。
マクロファージは刺激を受けるとインターロイキン-1(IL-1)やインターロイキン-6(IL-6)や腫瘍壊死因子アルファ(TNF-α)といったサイトカインを分泌します。これらは炎症性サイトカインと呼ばれ、炎症の部位に他の免疫細胞や炎症細胞を集め、炎症反応や免疫応答を開始する役割をもっています。
このような反応を急性期反応(acute phase response)と言います。急性期反応は、感染、悪性新生物、外傷、外科的侵襲などのストレスに対する生体の生理的な防御機構で、免疫担当細胞や炎症細胞が産生するサイトカインがメディエーターとなって惹起されます。
急性期反応では、炎症の起こっている局所だけでなく、体全体に様々な症状が発現します。
IL-6は肝臓に作用してC-反応性蛋白(CRP)などの急性期反応タンパク質の合成を亢進し、アルブミンの合成は抑制されます。
細菌感染症や自己免疫疾患(膠原病)、心筋梗塞、肝硬変、悪性腫瘍などにおいて、炎症や組織破壊の程度が大きいほど高値になり、炎症や破壊がおさまってくるとすみやかに減少します。
そのため病気の活動度や重症度、あるいは病気の予後を知る指標として使われています。がん患者においてCRP高値は、生命予後の不良を示唆します。
全身状態の悪化した進行がんの患者さんの治療を行うとき、CRPとアルブミンの値は特に注意します。
手術後のがん患者や手術不能のがん患者などを対象に、CRPの血中濃度と予後との関連を検討した報告は多数あり、CRPの血中濃度とがんの進行度やがん患者の予後不良とは正の相関があることが示されています。
すなわち、CRPが高いほど生命予後が悪い(生存期間が短い)ことが多くの研究であきらかになっています。CRP値が高いのは、がんの重量が大きく、がん細胞によって組織の破壊が進行していることを示しているからです。
例えば、肺がんにおいて、手術前の血液検査で、CRPの数値が高いほど、腫瘍が大きく、血管やリンパ管への浸潤が強いことが示されています。つまり、この研究では、手術前にすでにCRPが高いと手術後の予後が悪いことを示しています。(Lung cancer 63:106-110, 2009)
CRPとがん患者の予後に関する系統的レビューが報告されています。以下のような報告があります。
C-Reactive Protein Is an Important Biomarker for Prognosis Tumor Recurrence and Treatment Response in Adult Solid Tumors: A Systematic Review(C反応性蛋白は、成人固形腫瘍における予後と腫瘍再発と治療応答のための重要なバイオマーカーである:系統的レビュー)PLoS One. 2015; 10(12): e0143080.
【要旨】
目的:固形腫瘍患者のCRP上昇と予後との関係を決定するために、体系的な文献レビューが行われた。 C反応性蛋白(CRP)は、血清中の急性期反応物質であり、確立された炎症マーカーである。 我々はまた、治療反応性および腫瘍再発を予測するCRPの役割を調べた。
方法:MeSH(Medical Subject Heading)用語を用いて複数の電子データベース(PubMed、EMBASE、Web of Science、SCOPUS、EBM-Cochrane)を検索した。 2人の独立した査読者が研究論文を選択した。 品質アセスメント(quality Assessment)スコアも含め、品質アセスメントスコアが50%未満のレポートは除外された。 メタ解析と系統的レビューの方法論で解析した。
結果:271件の論文が最終審査のために特定された。 前向き研究は45%、後ろ向きは52%であった。 264は中程度の品質アセスメントスコア(50%以上80%未満)であった。 7件の論文は十分に適切な品質アセスメントスコアであった(80%〜100%)。
90%の試験(245/271)においてCRPの高値は予後不良を示した。 論文の多く(52%)は胃腸の悪性腫瘍または腎臓悪性腫瘍に関するものであり、これらの腫瘍に関する報告の90%(141のうち127)においてCRP高値は予後不良を示した。 CRPはまた、他の種類の固形腫瘍のほとんどの報告において予後予測因子であった。
結論:固形がんの患者を対象にした研究の90%において、CRP高値は高い死亡率と関連していた。 これは特に消化器系がんおよび腎臓がんにおいて顕著であった。 他の固形腫瘍(肺、膵臓、肝細胞癌および膀胱)でも、CRPの高値は予後不良と関連していた。 さらに、治療応答を決定し、腫瘍の再発を予測するのにCRPの測定が役立つことを示すエビデンスが認められた。 CRP値と予後との関連をより包括的に検討するために、より良く設計された大規模な研究が実施されるべきである。
手術後のがん患者や手術不能のがん患者などを対象に、CRPの血中濃度と予後との関連を検討した報告は多数あり、CRPの血中濃度とがんの進行度やがん患者の予後不良とは正の相関があることが示されています。すなわち、CRPが高いほど、予後が悪い(生存期間が短い)ことが多くの研究で明らかになっています。

図:がん組織が増大し周囲に浸潤したり他の臓器に転移を起こして、組織の破壊や炎症反応が起こると、生体反応として肝臓からC-反応性蛋白(CRP)が産生される。血中のCRP値が高いほど、組織破壊や炎症が高いことを示唆している。したがって、血清中のCRP値が高いほど、がん患者の予後が悪いことが報告されている。
【魚油は炎症反応(CRP)を低下させる】
炎症性サイトカインの産生を抑える治療として、副腎皮質ホルモン、プロスタグランジンの産生を抑えるシクロオキシゲナーゼ阻害剤などがあります。サプリメントとして魚の油のドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)も有効です。DHAやEPAは抗炎症作用によって悪液質を改善すると同時に、がん細胞の増殖を抑える作用もあります。
例えば、結腸直腸がん患者11例を対象に、9週間の抗がん剤治療中に、魚油を1日2g(DHA+EPAは600mg/日)投与した群(6例)と、魚油非投与のコントロール群(5例)で、炎症反応の指標であるC反応性タンパク(CRP)や炎症性サイトカインやアルブミン値や血清脂質を、抗がん剤治療開始前と終了時で測定して比較しています。
魚油のサプリメントを投与された群の患者の血清脂質の値は、コントロール群に比べてEPAは1.8倍、DHAは1.4倍に増加し、アラキドン酸は0.6倍に減少しました。
CRP値は魚油を投与した群で有意に低下していました。
抗がん剤終了後(9週間後)の体重は、魚油投与群が平均1.2kgの増加に対して、コントロール群では平均0.5gの減少を認めました。
以上のことから、抗がん剤治療中に魚油を1日2g(DHA+EPAで600mg)摂取すると、炎症反応のCRPが低下し、体重減少を防ぐ効果があることが示されています。
Fish oil decreases C-reactive protein/albumin ratio improving nutritional prognosis and plasma Fatty Acid profile in colorectal cancer patients.(魚油は結腸直腸がん患者において、C反応性蛋白とアルブミンの比を低下させ、栄養状態と血清脂質組成を改善する)Lipids. 48(9):879-88. 2013年
DHAやEPAは抗炎症作用によって、CRPを低下させる作用があるので、抗がん剤治療中や進行がんの状態にDHAやEPAを多く摂取することはメリットがあります。低アルブミンや貧血の改善には、CRPが高い場合は炎症を抑えることが必要となります。その方法として魚油を多めに摂取することが有効だと言えます。
抗がん剤治療だけでなく、放射線治療中でもオメガ3多価不飽和脂肪酸の豊富な食事はがん患者に栄養状態と臨床転帰において様々な利益をもたらすことが報告されています。そのメカニズムとしてC -反応性タンパク(CRP)、腫瘍壊死因子-α(TNF-α)、インターロイキン6(IL-6)の減少が認められており、オメガ3多価不飽和脂肪酸の抗炎症作用が重要であることが指摘されています。
【魚油は膵臓がん患者の悪液質を改善する】
膵臓がんの患者の多くは、診断後4ヶ月以内に体重が25%減少し、6ヶ月以内に死亡しています。
このような膵臓がん患者にEPAやDHAの豊富な魚油をサプリメントとして与えると、体重減少が抑えられ、延命することが報告されています。
膵臓がんで体重が減るのは、悪液質という状態にあるからです。がん性悪液質というのは、がん組織から産生される腫瘍壊死因子α(TNF-α)やプロスタグランジンなどの作用によって筋肉の分解が促進されたり食欲が低下することによって、体力が消耗していく病態です。
膵臓がんの場合は、痛みや、消化液の産生低下などによっても食欲が低下し、栄養の摂取にも支障がでてきます。消化管の運動や通過が障害されると、吐き気や嘔吐を恐れて食事の摂取が低下してしまいます。このような悪循環に陥ると、栄養摂取が障害され、体力や抵抗力の低下が加速され、死を速めることになります。
膵臓がん患者の85~90%は診断時にすでに悪液質の状態になっていると言われており、多くは6ヶ月以内に亡くなっています。
栄養状態を良くし、悪液質を改善して、体重の減少を防ぐことは、延命につながることが明らかになっています。その目的において、魚の油であるEPAやDHAの補充が有効であることが、臨床試験で明らかになっています。
進行した膵臓がんで緩和治療を受けている場合でも、魚油の補充によって悪液質を改善すれば、QOLを高め延命に有効です。
EPAやDHAはプロスタグランジンの産生を抑え、炎症反応を抑制し、その他様々なメカニズムでがん性悪液質を改善し、体重の減少や体力低下を防ぎ、延命に寄与することが期待できます。
このような効果は膵臓がんだけでなく、多くの進行がんでも期待できます。
【培養した微細藻類由来DHAが注目されている】
がんや認知症や循環器疾患の予防や治療にDHAやEPAが有効であることは確立しています。従って、DHAやEPAの多い脂の乗った魚を多く食べることが推奨されています。しかし、魚のメチル水銀やマイクロプラスチックなど海洋汚染に由来する有害物質の魚への蓄積の問題が、魚食を安易に推奨できない事態になっています。
メチル水銀は毒性が強く、血液により脳に運ばれ、やがて人体に著しい障害を与えます。母親が妊娠中にメチル水銀を体内に取り込んだことにより、胎児の脳に障害を与えることもあります。
魚は自然界に存在する水銀を食物連鎖の過程で体内に蓄積するため、日本人の水銀摂取の80%以上が魚介類由来となっています。魚摂取が増えるとメチル水銀の体内摂取が増え、胎児の脳の発育に悪影響を及ぼすことが明らかになり、厚生労働省は平成15年(2003年)に妊婦の魚摂取に関する注意事項を公表しています。つまり、妊婦や小児は魚を多く食べてはいけないと言っています。
海洋でDHAとEPAを作っている微細藻類を培養して、培養した微細藻類からDHAとEPAを取り出せば、汚染物質がフリーのDHA/EPAを製造できます。閉鎖環境での培養のため、汚染の心配がありません。植物由来なので菜食主義者も抵抗なく摂取できます。(下図)

図:オメガ3系多価不飽和脂肪酸のエイコサペンタエン酸(EPA)やドコサヘキサエン酸(DHA)は微細藻類が合成している(①)。プランクトン(②)が微細藻類を食べ、小型魚(③)がプランクトンを食べ、大型魚(④)が小型魚を食べるという食物連鎖によって、魚油にEPAやDHAが蓄積している。人間は魚油からDHAとEPAを摂取している(⑤)。環境中の水銀(⑥)が魚に取り込まれてメチル水銀になって魚に蓄積する(⑦)。DHAとEPAを産生している微細藻類をタンク培養して油を抽出すると(⑧)、汚染物質がフリーで、植物由来のDHA/EPAが製造できる(⑨)。
がん治療には1日3から5グラムのDHAの摂取が有効であることが多くの研究で示されています。通常の魚油の場合、DHA含有量は10%から20%程度です。1日5グラムのDHAを摂取するには25gから50gの魚油の摂取が必要になります。
そこで、微細藻類の中でもDHA含有量が極めて多いシゾキトリウム(Schizochytrium sp.)をタンク培養して製造したDHA(フランス製)を原料にした「微細藻類由来オイル(DHA含有量51%)」を製造してがん治療に使用しています。
詳細は以下のサイトで紹介しています。
http://www.f-gtc.or.jp/DHA/DHA-51.html
画像をクリックするとYouTubeの動画に移行します。
| « 806)再利用薬... | 808) 七叶一枝... » |





