がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
832)抗腫瘍免疫増強法(その1):イミキモド+ピドチモド+セレコキシブの相乗効果

図:ナイーブヘルパーT(Th)細胞が抗原提示細胞(樹状細胞やマクロファージ)から抗原の提示を受ける際、IL-12はTh1細胞への分化を促進する(①)。一方、プロスタグランジンE2(PGE2)はTh2細胞への分化を誘導する(②)。Th1細胞はインターフェロン-γ(IFN-γ)、IL-2、TNF-αなどのサイトカインを産生し、細胞性免疫を促進する(③)。IFN-γはナイーブTh細胞のTh1細胞への分化を促進する(④)。Th2細胞はIL-4、IL-5、IL-10などのサイトカインを産生して液性免疫(抗体産生)を促進する(⑤)。IL-4はナイーブTh細胞のTh2細胞への分化を促進する(⑥)。ピドチモドは樹状細胞からのIL-12の産生を亢進し(⑦)、COX-2阻害剤のcelecoxibはPGE2の産生を阻害するので(⑧)、両者を併用するとTh1細胞への分化を促進して抗腫瘍免疫を亢進できる。さらに、イミキモドはトル様受容体7(TLR7)を刺激して樹状細胞の成熟を促進する(⑨)。したがって、ピドチモド、セレコックス、イミキモドの3種を併用するとがん細胞に対する免疫的排除を促進できる。
832)抗腫瘍免疫増強法(その1):イミキモド+ピドチモド+セレコキシブの相乗効果
【理想のがん治療とは】
強い副作用を伴う抗がん剤治療が「理想のがん治療」でないことは明らかです。細胞毒性によってがん細胞の増殖を抑制するような治療法は、医学が進歩すれば、いずれは淘汰される治療法です。現行の抗がん剤治療は、正常細胞を傷つけ、老化や発がんを促進し、寿命を短縮する治療法であり、病気の治療法として理想とは言えません。
しかし、このような治療法が50年以上も続いているという現実があります。抗がん剤治療はほとんど進歩が無いということを意味しているかもしれません。
例えば、シクロホスファミド(商品名:エンドキサン)は1958年に合成され、1959年に臨床試験が開始され、1962年に注射用製剤と錠剤が販売され、それ以来、各種の悪性腫瘍の治療に主要な抗がん剤として使用されています。
つまり、50年以上前に販売された薬がいまだにメインの抗がん剤として使用されていることが、抗がん剤を使った治療法の開発に革新的な進歩がないことを示唆しています。
体の免疫力や治癒力を利用した治療法は理想的ながん治療法になると多くの研究者は考えています。私たちの体には細菌やウイルスやがん細胞を排除する免疫監視機構というシステムが存在します。そのシステムを活性化してがん細胞を排除することができれば、理想のがん治療になります。
実際に、免疫チェックポイント阻害薬と言われる抗PD -1抗体のニボルマブ(商品名オプジーボ)や抗CTLA-4抗体のイピリブマブ(商品名ヤーボイ)は、がん種によっては通常の抗がん剤より有効であることが報告されています。
免疫細胞の働きを抑制するPD-1を発見した京都大学の本庶佑教授とCTLA-4を発見した米国テキサス大学のジェームズ・アリソン教授が2018年のノーベル生理学・医学賞を受賞したことは、免疫細胞を利用したがん治療が有望であることが認められたためです。
しかし、免疫チェックポイント阻害薬も免疫細胞が正常細胞も攻撃して自己免疫疾患などの重篤な副作用を引き起こすこともあります。副作用が起きずに奏功率が高い免疫療法が確立すれば、それは理想に近いがん治療になるかもしれません。
【がん組織が自然に消滅することもある】
特に治療をしないのにがんが自然に消滅する場合があります。「がんの芽」のようなでき始めのがん(子宮頸がんの上皮内がんなど)や非常に小さながんが食事療法や免疫を高めることによって消える例は、それほど珍しくありません。
手術ができないような進行がんが自然に消えることは非常に稀ですが、そのような症例を経験したり聞いたりすることはあります。
文献的にも、進行がんの自然退縮の症例が多数報告されています。手術不能の進行がんの自然退縮例は数万例に1例程度と考えられています。このような自然退縮を引き起こすメカニズムを研究することが、がんの治療に役立つと考えられています。
今まで肉ばかり食べていた人が野菜を中心にした食事に代えたらがんが自然に消えたという例が報告されています。また、動物性脂肪を減らし魚油に多く含まれるオメガ3不飽和脂肪酸の量を増やすと、がんが消えたという症例報告もあります。このような経験から、がんの食事療法は、野菜やオメガ3系多価不飽和脂肪酸の摂取が基本になっています。
民間薬や漢方薬などががんの自然退縮を引き起こしたと推測される症例も数多く報告されています。
感染症などで高熱を起こした後にがんが消滅した症例も報告されています。このような経験から、温熱療法や、細菌成分を注射して発熱と免疫力を高める治療法が行われるようになりました。
がん細胞を攻撃するナチュラルキラー細胞やキラーT細胞の活性化ががんの自然退縮に関与している可能性が高いので、これらの免疫細胞を活性化するリンパ球療法や、がん特異抗原を免疫細胞に認識させるがんワクチンや樹状細胞療法などが研究され、がん治療に試されています。
免疫チェックポイント阻害剤で進行がんが消滅する場合があります。これは免疫細胞の働きを十分に高めると、進行がんも消滅できることを意味しています。
以上のように、いろんな原因やメカニズムで、進行がんが自然退縮する例があることは確かです。このような体に備わった治癒力を活性化する方法を多数実践すると、がんとの共存やがんの自然退縮を達成できる可能性が高くなります。
進行がんの治療に対して、抗がん剤治療に代わって、いずれ免疫療法が主体になると思われます。免疫療法の方が理想に近いからです。
がん組織の微小環境には、免疫細胞の働きを阻害する多数のメカニズムが存在します。このような免疫細胞の働きを抑制しているメカニズムを阻止して、免疫細胞によるがん細胞への攻撃を高める方法ががんの補完・代替療法でも重要になります。
【がん細胞に特異的な獲得免疫が始動するには自然免疫の活性化が必要】
免疫システムは病原体やがん細胞から生体を守る働きを担っています。この免疫システムは自然免疫と獲得免疫に分けられます。
自然免疫は先天的に備わった免疫で、微生物などに特有の分子パターンを認識して異物を攻撃します。マクロファージや好中球には細菌などの病原体に共通した情報を認識できる受容体を細胞表面に持っていて、病原体を認識して貪食します。 さらにマクロファージはナチュラルキラー細胞を活性化します。 ナチュラルキラー(natural killer)細胞(略してNK細胞)は、ターゲットの細胞を殺すのにT細胞と異なり事前に感作させておく必要が無いことから、生まれつき(natural)の細胞傷害性細胞(killer cell)という意味で名付けられました。
「感作」というのは、前もって抗原に対する認識能を高めておくことで、感作させておく必要がないというのは、初めて出あった細胞でも、直ちにその異常細胞を認識して攻撃できるということです。
ナチュラルキラー細胞(NK細胞)は、MHCクラスI分子が喪失した細胞(自己性を喪失した異常な細胞)を認識して攻撃します。 NK細胞の細胞質にはパーフォリンやグランザイムといった細胞傷害性のタンパク質をもち、これらを放出してターゲットの細胞を死滅させます。 がん細胞を見つけると直ちに攻撃するため、がんに対する第一次防衛機構として、特に発がん過程の初期段階でのがん細胞の排除において重要な役割を果たしています。
一方、獲得免疫は,後天的に外来異物の刺激に応じて形成される免疫です。高度な抗原特異性と免疫記憶を特徴とします。 マクロファージや樹状細胞が、がん細胞からがん抗原ペプチドと呼ばれる小さなタンパク質を捕足し、その情報がヘルパーT細胞に伝えられ、その情報に従って特定のがん抗原に対する免疫応答が引き起こされるのが獲得免疫です。
キラーT細胞は、がん抗原で活性化されて初めて細胞傷害活性を持つようになります。すなわち、細胞傷害活性を持たないナイーブキラーT細胞(抗原刺激を一度も受けたことがないキラーT細胞)が抗原提示細胞から抗原ペプチド(がん抗原)を提示され、その抗原とぴったり結合するキラーT細胞が活性化されて増殖し、がん細胞に対して特異的な細胞傷害活性を持つ細胞傷害性T細胞(キラーT細胞)となり、がん細胞を攻撃するようになります。
細胞傷害性T細胞(CTL)は細胞傷害物質であるパーフォリン、 グランザイム, TNF(tumor necrosis factor)などを放出したり、ターゲット細胞のFasを刺激してアポトーシスに陥らせることでがん細胞やウイルス感染細胞を死滅させます。
細胞傷害性T細胞の一部はメモリーT細胞となって、異物に対する細胞傷害活性を持ったまま宿主内に記憶され、次に同じ異物(抗原)に暴露された場合に対応できるよう備えます。
「自然免疫」は、マクロファージや好中球などの食細胞が侵入した病原体やがん細胞を食べてしまうというシステムが基本になっています。 病原体を食べた食細胞は、TLR(トル様受容体)などのパターン認識受容体で、病原体や危険シグナルに共通するパターンを認識して活性化します。
一方、「獲得免疫」は「抗原」というターゲットに対して対応する免疫応答です。この獲得免疫は、自然免疫による病原体認識という段階を経なければ始動しないことが判っています。 その理由は、抗原特異的なT細胞が活性化するには、樹状細胞から抗原提示を受けなければならないのですが、樹状細胞は他の食細胞と同様にパターン認識受容体で病原体やがん細胞を認識して活性化する必要があるからです。

図:活性化したマクロファージはナチュラルキラー細胞(NK細胞)を活性化する(②)。活性化されたマクロファージやNK細胞などががん細胞を攻撃してがん細胞の破壊が起こると(②)、がん抗原が樹状細胞に取込まれる(③)。抗原による感作の必要のないがん細胞に対する第一次防衛機構が「自然免疫」となる(④)。がん抗原を貪食した樹状細胞(⑤)は、がん抗原の情報をT細胞やB細胞に渡して活性化する(⑥)。がん抗原特異的な免疫応答によるがん細胞の攻撃が起こり(⑦)、これが「獲得免疫」となる(⑧)。
【獲得免疫の始動には樹状細胞の活性化が必要】
樹状細胞(Dendritic cell)は,細胞表面に突起構造を持っていることから名付けられ,高い運動性を有する免疫細胞の一種で,身体のあらゆる場所に存在しています。哺乳動物の免疫系では,最も強力な抗原提示細胞として機能しています。
末梢で病原体やがん細胞を食べて活性化した樹状細胞は最寄りのリンパ節に移動します。樹状細胞は取り込んだ細胞を細胞内で分解してペプチド(アミノ酸が数個つながったもの)にし、これらのペプチドはMHCという分子と結合して細胞表面に提示されます。
樹状細胞は活性化する前も「MHC+ペプチド」が提示されていますが、活性化されると、樹状の突起をめいっぱいに出して表面積を広げ、できるだけ多くの抗原を提示しようとします。 樹状細胞が提示する抗原と反応するヘルパーT細胞(CD4+)やキラーT細胞(CD8+)が活性化されて、リンパ球による抗原特異的な免疫応答が活性化されます。

図:腫瘍由来因子が未成熟な樹状細胞を骨髄から動員する(①)。末梢組織からも未熟樹状細胞が腫瘍組織に集まってくる(②)。死滅したがん細胞から放出されたがん抗原は未熟樹状細胞に取り込まれ、活性化されて成熟樹状細胞に分化誘導される(③)。成熟樹状細胞はリンパ節に移動し、MHCクラスI及びクラスIIに結合したがん抗原をTCR(T細胞受容体)を介して、CD4+T細胞(ヘルパーT細胞)とCD8+T細胞(キラーT細胞)に提示する(④)。抗原提示を受けて活性化したキラーT細胞はがん抗原特異的な免疫学的攻撃を行う(⑤)。
【トル様受容体が自然免疫を発動させる】
生体は「自己にない分子パターンを認識する」というメカニズムで細菌やウイルスや真菌などの病原体を認識して、自然免疫を発動させます。 また、細胞傷害に伴って放出される細胞内分子を「危険シグナル(danger signals)」として認識し、自然免疫や炎症を発動させます。
このような自然免疫の発動で重要な役割を果たしているのがトル様受容体(Toll-like Receptor: TLR)です。 トル様受容体(TLR)は動物の細胞表面やエンドソームにある受容体タンパク質です。
TLRは、細菌やウイルスや原虫や真菌などに共通して保存されている病原体関連分子パターン(pathogen-associated molecular patterns)を認識します。
細胞がダメージを受けたとき、通常であれば細胞内に隠れている細胞内成分が放出され、炎症細胞や免疫細胞を活性化します。このような炎症を引き起こす細胞内成分をダメージ関連分子パターン(damage-associated molecular patterns;DAMPs)と総称しています。 DAMPsは細胞傷害に伴って細胞から放出され、周囲の組織や細胞に危険を知らせるアラームのような役割を担う因子のことです。
DAMPsが細胞外や細胞膜上に露出するような細胞死が起こると、炎症反応が引き起こされ、ダメージを受けた組織の修復が起こります。DAMPsもトル様受容体を介して自然免疫を始動させます。
トル様受容体が認識する成分として、細菌表面のリポ多糖(LPS)、リポタンパク質、鞭毛のフラジェリン、ウイルスの一本鎖RNAと二本鎖RNA、細菌やウイルスのDNAに含まれる非メチル化CpGアイランドなどがあります。ある特定の分子を認識するのではなく、一群の分子を認識するパターン認識受容体です。
これらの受容体にリガンドが結合すると、そのシグナルによって自然免疫の応答が発動されます。

図:細菌やウイルス由来のリポ多糖、脂質、タンパク質を認識するトル様受容体(TLR)1,2,4,5,6はいずれも 細胞表面に存在し、細胞表面で微生物の表層成分を認識しシグナルを伝達する。一方、核酸を認識する TLR3,7,8,9はいずれもエンドソーム(エンドサイトーシスによって細胞内へと取り込まれた様々な物質の選別・分解・再利用などを制御する細胞内小器官)などの細胞内オルガネラ膜に局在し、エンドソームでリガンドを認識しシグナルを伝達する。(参考:Immunotherapy. 2009;1(6):949-964.のFig1)
【抗原提示とT細胞の活性化】
病原微生物の侵入など何らかの原因で炎症が起こると、血管から顆粒球や単球などが遊走して来ます。このように炎症反応によって集まってきたり、あるいは組織に常在していた樹状細胞やマクロファージは、侵入した細菌やウイルス粒子、あるいは死滅した細胞の死骸や断片などを取り込み、リンパ液の流れに沿って所属リンパ節に移動します。
樹状細胞やマクロファージは取り込んだタンパク質を分解し、その結果産生されたペプチド(アミノ酸が数個から数十個つながったもの)をMHC(major histocompatibility complex:主要組織適合抗原複合体)分子の上に提示します。
活性化した樹状細胞はリンパ節で手当たりしだいにナイーブT細胞(まだ一度も活性化されたことのないT細胞)とくっつきあって、何かを確かめます。ナイーブT細胞はその表面にT細胞抗原認識受容体(TCR)を持っています。樹状細胞の表面に提示されたMHC+抗原ペプチドとピタッとくっつく受容体(TCR)をもったナイーブT細胞と出会うと、そのT細胞を活性化します。
抗原を提示して活性化している樹状細胞にはCD80/86という補助刺激因子が発現しており、T細胞のCD28と結合し、刺激を送ります。 さらに、活性化した樹状細胞はサイトカインを放出しており、ナイーブT細胞はそれを浴びることになります。
このように①TCRを介するシグナルと②CD28を介する補助刺激と③サイトカインによる刺激を同時に受けたTリンパ球は初めて活性化し、TCRの特異性を保ったままで分裂・増殖して自らのクローンを増やします。 CD4陽性T細胞(ヘルパーT細胞)は、Th1またはTh2のパターンを示すサイトカイン産生細胞へと分化します。
CD8陽性T細胞(キラーT細胞)は成熟し、細胞質内にパーフォリンやグランザイムなどを含んだ細胞傷害顆粒を持つエフェクター細胞になります。
エフェクター細胞はリンパ節を離れ、胸管を経て循環血液中へと流れ込み、血流に従って全身を巡ります。炎症の起こっている組織から産生されるサイトカインやケモカインなどの作用でエフェクターT細胞は炎症部位に集まり、病原菌やがん細胞の攻撃に参加します。
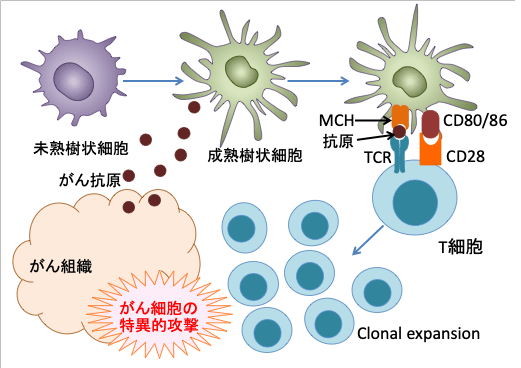
図:がん細胞から放出されたがん抗原を未熟樹状細胞が取り込んで成熟して抗原を提示するとき、MCH(major histocompatibility complex:主要組織適合抗原複合体)分子にペプチド抗原を載せて細胞傷害性T細胞やヘルパーT細胞に提示する。このとき、MCH+ペプチド抗原にぴったり結合するTCR(T細胞受容体)を持つT細胞は、補助刺激因子(CD28とCD80/86など)や樹状細胞から放出されるサイトカインの働きで活性化され、がん抗原を認識するT細胞が増殖し、がん細胞を攻撃する。
【イミキモド(imiquimod)はTLR7のリガンド】
トル様受容体(TLR)シグナル系は自然免疫と獲得免疫の両方を活性化します。TLRの活性化はI型インターフェロンと炎症性サイトカインの遺伝子発現を促進します。 I型インターフェロンとはインターフェロンファミリーのうち、インターフェロンα(IFN-α)とインターフェロンβ(IFN-β)などを含めた総称で、ウイルス感染で誘導される抗ウイルス作用をもつサイトカインです。免疫系細胞から分泌されてマクロファージを活性化するインターフェロンγ(IFN-γ)はII型インターフェロンと言います。
I型インターフェロンは抗原提示、T細胞増殖、樹状細胞の成熟、ナチュラルキラー細胞の活性化を促進します。
トル様受容体(TLR)を介する樹状細胞の活性化は、貪食作用、成熟、流域リンパ節への移動、Th1サイトカインの分泌、リンパ球への抗原提示能を亢進します。
TLRのアゴニストはがんの免疫療法において有望な治療薬となりうると考えられており、多くの物質が臨床使用に向けて開発中です。 腫瘍局所にTLRアゴニストを投与すると、自然免疫と獲得免疫を誘導し、さらに腫瘍の微小環境に様々な作用を及ぼして、腫瘍を効率的に排除することができます。
TLRアゴニストは樹状細胞を活性化し、T細胞応答を増強し、制御性T細胞の免疫抑制作用を減弱させるので、がんワクチン療法の効果を増強します。 抗がん剤治療や放射線治療や抗体療法や分子標的薬とTLRアゴニストとの併用療法に関する研究が進行中です。 すでに臨床で使用されているものもあります。BCGやピシバニールはTLRを活性化します。さらにTLR7のリガンドのイミキモド(imiquimod)という塗り薬が、尖圭コンジロームや皮膚がんの治療に使用されています。
イミキモド(Imiquimod)は合成イミダゾキノリン(imidazoquinoline)で、樹状細胞やマクロファージなどに発現しているTLR7(Toll-like receptor 7)にリガンドとして直接結合し、シグナルを伝えることによって、I型インターフェロンを誘導し自然免疫を活性化します。
TLRはパターン認識受容体で、病原体の侵入を感知して自然免疫を活性化し、ついで獲得免疫を作動させます。TLR7は樹状細胞やマクロファージなどの抗原提示細胞のエンドソームの膜に存在し、ウイルスの一本鎖RNAがリガンドになります。 TLR7の活性化はIFN-α、IL-12、TNF-αなどの炎症性サイトカインの産生を増やし、樹状細胞の成熟と抗原提示能を促進します。
塗布薬(5% imiquimodクリーム)として販売され、基底細胞がんや尖圭コンジローマに対して使用され、さらに日光角化症、ボーエン病など表在性の皮膚悪性腫瘍でも有効性が認められています。
欧米で実施された基底細胞がん(BCC)を対象にした臨床試験では、表在型BCCに対し6週間毎日または5回/週の外用で、80%前後の腫瘍の病理学的消失率が認められています。 有害事象としては紅斑、びらん、潰瘍、局所刺激感などの局所反応が主体であり、おおむね安全に使用できます。
このような皮膚がんに対する効果は、イミキモドがTLR7のアゴニストで、自然免疫を活性化して、皮膚がんに対する特異免疫を誘導して、免疫機序で腫瘍を縮小・消滅させると考えられています。
したがって、皮膚がん以外の転移性皮膚腫瘍に対しても効果が期待でき、さらには、皮膚投与でイミキモドが腫瘍近くのリンパ節に取り込ませることも可能なので、皮膚転移以外の全身のがん転移にも効果があります。
実際に乳がんの皮膚転移にイミキモドクリームが有効であった症例の報告があります。さらに、イミキモドクリームの皮膚投与は頭蓋内腫瘍を縮小させたり、肺組織の免疫を高めるなどの動物実験の結果が報告されています。

図:トル様受容体7(TLR7)のリガンドであるイミキモド(①)を皮膚に塗布すると皮下に吸収され、皮下の未熟樹状細胞を成熟させる(②)。がん組織から放出されるがん抗原を成熟樹状細胞が取り込むと活性化され、T細胞に抗原提示を行う(③)。樹状細胞はMCH分子の上にがん抗原を乗せ、この抗原にぴったり合うT細胞受容体(TCR)を見つけると、補助刺激因子(CD28とCD80/86など)の結合やサイトカインの放出などによって、がん抗原を認識するT細胞が活性化される(④)。その結果、がん抗原を認識するTCRをもつT細胞がクローナルに増殖する(⑤)。⑥抗原特異的に活性化されて増殖したT細胞(キラーT細胞)はがん細胞を攻撃する(⑥)。
【イミキモドは乳がん皮膚転移の治療に有効】
乳がんは外胚葉性付属器である乳管に由来するため、皮膚転移を引き起こすことが多くあります。多くの場合、皮膚転移は乳がんの手術後に発生し、潰瘍、びまん性浸潤性病変、腫瘍、胸壁または残存乳房組織上の皮膚の近くの結節として現れます。予後が悪く、生活の質が著しく低下し、感染や出血のリスクが高まります。
外科的切除や切除後の放射線療法などの通常の治療を行っても、腫瘍の再発が多く、新しい治療戦略が求められています。このような皮膚転移を伴うステージ IV 乳がん患者に、イミキモドによる治療が奏功した症例が複数報告されています。
以下のような報告があります。
Imiquimod in the treatment of breast cancer skin metastasis(乳がん皮膚転移の治療におけるイミキモド)J Clin Oncol. 2014 Mar 10;32(8):e22-5.
治療歴の長い26歳女性で、抗がん剤や放射線治療が繰り返し行われ、最終的に皮膚転移を発症しました。
皮膚病変は、患者の左上背部、左鎖骨上領域、および首の前部を周方向に占めていました (下図の①)。病変は強い痛みを伴いました。その後、患者はイミキモド 5% を週 3 回投与されました。イミキモドクリームを使用してから1週間以内に、病変の強度と厚さが減少し、表面積は安定しました(下図の②)。翌週には、表面積が減少し、強度と厚さがさらに減少しました(下図の③)
副作用は報告されていません。イミキモドの開始から 3 週間後、患者は痛みの強さが 10 点中 8 点から 10 点中 6 点に軽減したと報告しました。彼女はオキシコドン長時間作用型 5 mg を中止することができました。
その後、患者は約 2 ~ 3 週間イミキモドの塗布を中止し、病変は急速に進行し始めました。イミキモドを再開すると、症状が改善し、4 か月間、局所イミキモドの使用により、皮膚病変と痛みは改善し続けました(下図の④)

以下のような報告もあります。
A case report of imiquimod topical therapy as treatment for cutaneous metastasis of breast cancer.(乳がんの皮膚転移に対するイミキモド外用療法の症例報告)Rare Tumors. 2021 Jun 24;13:2036361320975748
左前胸部と左鎖骨上領域に皮膚転移を伴うステージ IVの50歳の乳がん患者が局所イミキモドによる治療で奏功したという症例報告です。患者は、治療を開始してから数か月以内に外見と症状の改善を経験し、その結果、皮膚転移はほぼ解消しました。

図:乳がんの皮膚転移(①)が、治療開始から2か月後、病変の厚さが減少(②)、治療開始から4か月後、肥厚性病変は解消し、黄斑瘢痕のみが残った(③)。
臨床試験も実施されています。以下のような報告があります。
Topical TLR7 agonist imiquimod can induce immune-mediated rejection of skin metastases in patients with breast cancer.(Toll様受容体TLR7のアゴニストのimiquimodの局所投与は乳がん患者の皮膚転移の免疫的排除を誘導する)Clin Cancer Res. 8(24): 6748–6757.2012年
【要旨】
研究の目的:乳がんの皮膚転移は治療が困難である。Toll様受容体の一種のTLR7のアゴニストのイミキモド(Imiquimod)は免疫応答修飾物質であり、原発性の皮膚がんに対して局所投与によって免疫的機序で縮小する効果が認められている。本研究では、イミキモドの局所投与が抗腫瘍免疫を活性化し、乳がんの皮膚転移を縮小できるかどうかを検討した。
方法:乳がんの皮膚転移部位にイミキモド・クリームを8週間(週5回)の塗布による治療を行い、前向き試験でその臨床効果(奏功率)を検討した。安全性と免疫学的変化についても検討した。
結果:10例の乳がん患者を対象に臨床試験を行った。免疫調整作用によるグレード1~2の一過性の皮膚症状および全身症状による副作用を認めたのみで大きな副作用は認めず、安全に8週間の治療が終了した。 2例において部分奏功を認めた。皮膚転移が縮小した症例では、組織学的に腫瘍組織内へのリンパ球浸潤やサイトカインの産生に変化を認めた。
結論:乳がんの皮膚転移や胸壁浸潤に対してイミキモドの局所投与は安全で有効な治療手段となりうる。イミキモドは乳がん組織内において免疫的排除が起こりやすい環境に誘導する。 我々の研究グループで行った前臨床研究では、放射線治療とイミキモドを併用すると相乗的な抗腫瘍効果を認めている。この組合せが抗腫瘍免疫の増強や臨床効果を高めるかどうかの臨床試験が進行中である。
この研究では、寝る前に皮膚100cm2当たり250mgのクリームを薄く延ばして塗布し、起床時に洗っています。 イミキモドクリームの投与の前後でがん組織の生検を行い、病理検査でがん組織内の免疫細胞の状況を検討し、腫瘍組織にリンパ球の浸潤が増えると、がんが縮小することが示されています。
【乳がん皮膚転移の放射線治療とイミキモドの相乗効果】
乳がんの放射線治療にイミキモドクリームの塗布を併用すると抗腫瘍免疫を高めることができます。以下のような報告があります。
The TLR7 agonist imiquimod as an adjuvant for radiotherapy-elicited in situ vaccination against breast cancer.(乳がんに対する放射線治療誘発性の局所ワクチン療法の補助療法としてのトル様受容体7のアゴニストのイミキモド)Oncoimmunology. 2013 Oct 1;2(10):e25997. Epub 2013 Sep 24.
米国のニューヨーク医科大学の病理学と放射線腫瘍学とがん研究所の研究グループからの報告です。短い総説論文なので、本文の内容を抜粋して紹介します。
【本文の抜粋】
乳がんの皮膚転移自体は乳がん患者の死亡原因になることはないが、生活の質を著しく悪化させるので、有効な治療法が求められている。
皮膚転移は目で見えるため、局所に適用した治療薬の効果を簡単に評価できる。
乳がんの皮膚転移に対する局所療法として放射線治療が行われる。放射線照射はがん細胞のDNAに傷害を与えることによって分裂中の細胞を死滅させる。
しかしながら、放射線照射は直接的な細胞死誘導作用だけでなく、免疫学的な抗腫瘍効果を示すことが多くの研究で明らかになっている。そのため、放射線治療の主要な目標をがん細胞を局所のがんワクチンに変換するというアイデアが成り立つ。
免疫原性細胞死を誘導することによって、放射線照射は樹状細胞を活性化し、がん抗原特異的なCD8+キラーTリンパ球を活性化することによって獲得免疫を誘導する。 がん抗原に応答するキラーT細胞はサイトカインの働きで照射部位に集積し、生き残ったがん細胞を認識して排除する。
しかしながら、通常の多くのがんワクチンと同様に、放射線照射によるがんワクチンの抗腫瘍効果は、全身の腫瘍制御を達成できるほど十分な効果が得られることは少ない。
ワクチンによって誘導された免疫応答を増強する最も有効な方法は、効果の高い免疫増強剤(アジュバント)を見つけることである。
トル様受容体(Toll-like receptors)は、危険を察知するセンサーのようなものであり、様々な病原体由来のリガンドあるいは内因性リガンドによる刺激に応答して、自然免疫を活性化し、さらに獲得免疫を誘導する。
したがって、トル様受容体の合成アゴニストが免疫増強剤(アジュバント)として盛んに研究されている。 トル様受容体7のアゴニストであるイミキモドは、多くの皮膚腫瘍の治療に塗布薬として使われている。 乳がんの皮膚転移や胸壁に浸潤した再発乳がんの治療にも使用されている。
我々は以前の研究にて、イミキモドの局所投与を併用することによって、腫瘍関連抗原を投与する免疫療法の免疫応答を増強することを確認している。
さらに最近の研究では、イミキモドの単独の投与が、がん組織の微小環境における免疫学的な性状を変化させることによって抗腫瘍効果を示し、乳がんの皮膚転移の患者の20%において部分奏功を示したことを報告している。
皮膚に乳がん細胞を移植するマウスの動物実験のモデルで、局所の放射線照射とイミキモドの併用によって抗腫瘍免疫が増強することを示した。 マウスの乳がんを用いた実験で、イミキモドの局所投与は抗腫瘍効果を示し、プラセボ群に比べて腫瘍の増殖を抑制した。
イミキモドを投与した乳がん患者では、この免疫療法で腫瘍増殖の抑制を認めたがん組織ではTリンパ球と樹状細胞の増加を認めた。
同様に、マウスの実験でも、イミキモドの投与によって腫瘍組織内に集積したT細胞と樹状細胞の数が増えた。
マウスの実験では、局所の放射線照射を受けたがん組織の部分にイミキモドを局所投与すると、多くのマウスにおいて完全な腫瘍の消失を認めた。一方、放射線照射のみの場合は、腫瘍増大の遅延は認めたが、腫瘍の完全な消滅は認めなかった。 放射線照射とイミキモドの局所投与の併用治療を受けたマウスでは、腫瘍組織の周囲のリンパ節において、抗原刺激に応答してインターフェロンγを産生する腫瘍抗原特異的なエフェクターCD8+T細胞が検出された。
このように、イミキモドと放射線治療は相乗的な抗腫瘍効果を発揮し、局所再発の腫瘍の制御に有効性が認められた。
多発する皮膚転移の一カ所(この部位がワクチン部位になる)に放射線照射とイミキモド投与を行うと放射線照射をしていない転移巣にも抗腫瘍効果を示すという遠隔効果(abscopal effect)が得られるかどうかを検討するために、マウスを使った実験を行った。
すなわち、マウスの皮下の2カ所に乳がん細胞を移植し、腫瘍が触知できる大きさに成った時点で、一つの腫瘍にのみイミキモド投与と放射線照射を行った。
予想通りに遠隔効果を認め、放射線照射を行わなかった腫瘍も顕著な縮小を認めた。
イミキモドは腫瘍細胞のMHCクラスI抗原とICAM1の発現を亢進し、抗腫瘍免疫を増強し、照射していない腫瘍組織を排除した。
この免疫治療が全身の抗腫瘍免疫を誘導し、局所の腫瘍の制御だけでなく、患者の生存期間の延長にもつながるかもしれない。
がんの放射線治療を行うと放射線を照射していないがん組織も縮小することがあります。 これをアブスコパル効果(abscopal effect)と言います。遠隔効果や遠達作用などと日本語訳されています。
従来、放射線照射の抗腫瘍効果は、細胞分裂中のがん細胞のDNAにダメージを与えてがん細胞を死滅させる局所的な作用のみと考えられていました。
しかし、最近の研究で、放射線治療が全身の抗腫瘍免疫の活性化の引き金になりうることが明らかになっています。 局所のがん組織を放射線で照射して、がん細胞が死滅すると、がん抗原が放出されてがん抗原特異的な抗腫瘍免疫が誘導され、照射した部位以外の腫瘍が縮小することが示されています。

図: 放射線照射によってがん組織からがん抗原(腫瘍関連抗原)が放出され、そのがん抗原は樹状細胞に捕捉される(①)。イミキモドは樹状細胞を成熟させ、がん組織内に誘導し集積させる作用がある(②)。腫瘍関連抗原を取込んで活性化した樹状細胞は、がん組織の周囲のリンパ節に移動し、そこでまだ抗原刺激を受けていないナイーブがん抗原特異T細胞を活性化する(③)。活性化した腫瘍抗原特異T細胞は増殖し、放射線照射されたがん組織の他に、照射を受けていない腫瘍組織にも移動し、がん抗原特異的にがん細胞を攻撃する(④)。イミキモドおよび放射線照射はがん細胞の表面のMHCクラスI分子とintercellular adhesion molecule 1 (ICAM1)の発現を亢進し、細胞傷害性T細胞の細胞傷害活性は、MHCクラスI分子とICAM1の発現が亢進しているがん細胞に対して、細胞傷害活性を強く示す。このように、放射線照射とトル様受容体7のアゴニストのイミキモドは相乗的に作用して、がん細胞を局所のがんワクチンに変える作用がある。
【ピドチモド(Pidotimod)は樹状細胞の成熟を促進する】
ピドチモド(Pidotimod)は、2つのアミノ酸が結合したようなジペプチド様構造の生体応答調節療剤(Biological Response Modifiers)の一種です。自然免疫と獲得免疫の両方を活性化する効果が知られており、感染症の予防や治療に有効であることが複数の臨床試験で明らかになっています。
例えば、上気道感染症や尿路感染症を頻回に繰り返す小児を対象にした臨床試験で、ピドチモドは感染症の発症頻度を減少させる効果が確認されています。ピドチモドの免疫増強効果は老化やダウン症候群やがんのような免疫低下を起こしやすい状況でより高い効果が認められています。
ピドチモドの免疫刺激作用のメカニズムとして、樹状細胞の成熟を促進し(HLA-DRと補助刺激分子の発現亢進)、樹状細胞からの炎症性サイトカインの産生を刺激してT細胞の増殖とTh1フェノタイプへの分化誘導、ナチュラルキラー細胞(NK細胞)の機能亢進と貪食能の亢進などが報告されています。
ピドチモドはインターロイキン-12(IL-12)の産生を高める効果があります。IL-12は当初「NK細胞刺激因子」の名称で報告されたように、NK細胞に対する著明な活性化作用を特徴とするサイトカインです。IL-12はT細胞やNK細胞に対して細胞増殖の促進、細胞傷害活性誘導、IFN-γ産生誘導、LAK細胞誘導などの作用を示します。 このように、ピドチモドは自然免疫と獲得免疫の両方を活性化し増強します。
ピドチモドは1日400〜800mg程度を1日1〜2回に分けて服用します。空腹時に服用します。経口摂取での生体利用率(bio-availability)は42〜44%で、血中の半減期は約4時間です。体内では代謝されずにそのままの形で尿中から排泄されます。 幾つかの国(イタリア、ギリシャ、中国、ベトナム、コスタリカ、ドミニカ共和国、エルサルバドル、グアテマラ、ホンジュラス、メキシコ、パナマ)で医薬品として販売されています。

図:ピドチモドは未熟樹状細胞を活性化して成熟樹状細胞に分化させる(①)。成熟樹状細胞はリンパ節に移動し、CD4+T細胞(ヘルパーT細胞)とCD8+T細胞(キラーT細胞)に抗原提示によって活性化する(②)。リンパ球のTh1フェノタイプを促進してIL-12, TNF-α,インターフェロン-γ(IFN-γ) の産生を亢進し、B細胞からIgGと分泌型IgAの産生を亢進する(③)。一方、Th2フェノタイプを抑制して抗アレルギー作用を示す(④)。ピドチモドはNK細胞、マクロファージ、好中球など自然免疫も活性化する(⑤)。これらの総合作用によって感染症やがんに対する免疫力を増強する(⑥)。
【IL-12産生を刺激しPGE2の産生を抑制するとTh1細胞活性が増強する】
T細胞(Tリンパ球)には、細胞表面にCD4という分子を出しているヘルパーT細胞(CD4陽性T細胞)と、CD8という分子を出しているキラーT細胞(CD8陽性T細胞)があります。まだ抗原に出会ったことのないT細胞をナイーブT細胞と言います。 樹状細胞やマクロファージなどの抗原提示細胞が抗原提示を行う相手はナイーブT細胞です。 抗原提示細胞が提示する抗原にぴったり結合する受容体をもったT細胞が活性化されます。これを抗原特異的な活性化と言います。抗原提示を受けて活性化したT細胞は増殖し、抗原特異的な免疫応答を開始します。
ヘルパーT細胞にはTh1細胞(細胞性免疫)とTh2細胞(液性免疫)があります。抗原提示細胞がIL-12を産生するか、それともプロスタグランジンE2(PGE2)を産生するかがTh1とTh2のどちらが優位になるかを決定しています。 すなわち、ナイーブヘルパーT細胞(Th0)は抗原提示細胞が産生するサイトカインによって細胞性免疫に関与するTh1細胞か、液性免疫に関与するTh2細胞へと分化します。
抗原提示細胞が抗原をナイーブT細胞に提示する際にIL-12を分泌するとTh1細胞(T helper 1 cell)に分化します。Th1細胞はIFN-γ、IL-2、TNF-αなどのサントカインを産生し、細胞性免疫を促進します。Th1細胞が産生するIFN-γはTh0細胞(ナイーブヘルパーT細胞)のTh1細胞への分化を促進します。
一方、抗原提示細胞が抗原をナイーブT細胞に提示する際にプロスタグランジンE2(PGE2)を分泌するとTh2細胞(T helper 2 cell)に分化します。Th2細胞はIL-4、IL-5、IL-10などのサイトカインを産生し、液性免疫(抗体産生)を促進します。Th2細胞が産生するIL-4はTh0細胞(ナイーブヘルパーT細胞)のTh2細胞への分化を促進します。
がん細胞を攻撃する抗腫瘍免疫を高めるためにはTh1細胞を増やして細胞性免疫を高める必要があります。そのためには、抗原提示細胞からのIL-12産生を促進し、PGE2の産生を抑制することがポイントになります。
ピドチモドは樹状細胞の成熟とIL-12の産生を促進し、Th1細胞を増やします。PGE2産生はシクロオキシゲナーゼ-2(COX-2)の阻害剤のcelecoxib(セレコキシブ)で阻止できます。
実際の多くの実験系で、がんワクチンや樹状細胞療法にCOX-2阻害剤のcelecoxibを併用すると抗腫瘍免疫が増強することが示されています。 つまり、ピドチモドとセレコキシブの併用はTh1細胞を増やして細胞性免疫を高める方法となります。(下図)

図:ナイーブヘルパーT(Th)細胞が抗原提示細胞(樹状細胞やマクロファージ)から抗原の提示を受ける際、IL-12はTh1細胞への分化を促進する(①)。一方、プロスタグランジンE2(PGE2)はTh2細胞への分化を誘導する(②)。Th1細胞はインターフェロン-γ(IFN-γ)、IL-2、TNF-αなどのサイトカインを産生し、細胞性免疫を促進する(③)。IFN-γはナイーブTh細胞のTh1細胞への分化を促進する(④)。Th2細胞はIL-4、IL-5、IL-10などのサイトカインを産生して液性免疫(抗体産生)を促進する(⑤)。IL-4はナイーブTh細胞のTh2細胞への分化を促進する(⑥)。ピドチモドは樹状細胞からのIL-12の産生を亢進し(⑦)、COX-2阻害剤のcelecoxibはPGE2の産生を阻害するので(⑧)、両者を併用するとTh1細胞への分化を促進して抗腫瘍免疫を亢進できる。さらに、イミキモドはトル様受容体7(TLR7)を刺激して樹状細胞の成熟を促進する(⑨)。したがって、ピドチモド、セレコックス、イミキモドの3種を併用するとがん細胞に対する免疫的排除を促進できる。
【イミキモドは皮膚からの投与の方が効果が高い】
以下のような論文があります。
Topical rather than intradermal application of the TLR7 ligand imiquimod leads to human dermal dendritic cell maturation and CD8+ T-cell cross-priming.(TLR7リガンドのイミキモドは皮内投与より局所投与の方が、ヒト皮膚樹状細胞の成熟とCD8陽性T細胞の活性化を誘導する)Eur J Immunol. 44(8):2415-24.2014年
【要旨】
Toll様受容体(TLR)のリガンドは樹状細胞の活性化を介して免疫応答を刺激する作用を持つので、がんワクチン療法の補助療法として注目されている。
ヒトの皮膚には樹状細胞の密なネットワークが存在するので、がんワクチンを皮内に投与すると樹状細胞に容易に取り込ませることができる。したがって、皮膚はがんワクチンの投与部位として活発に研究されている。
本研究では、ヒトの皮膚外移植モデル(human skin explant model)を用いて、複雑な微小環境における樹状細胞活性化に対するアジュバント(補強剤)としてのTLRリガンドの可能性を検討した。
実験の結果、TLR7/8リガンドのR848やイミキモドの溶解液を皮内に注射で投与するよりも、TLR7リガンドのイミキモドを5%の割合で含有するクリームを外用(塗布)で投与する方が、樹状細胞の移動を顕著に亢進した。さらに、イミキモドで活性化された樹状細胞はT細胞の活性化に必要な分子(CD86, CD83, CD40, and CD70)の発現レベルが最も高かった。皮膚の生検でイミキモドの局所塗布投与は皮膚の炎症性サイトカインの産生が最も高かった。
ペプチド抗原の皮内投与によるワクチン療法と併用すると、Aldaraで活性化された樹状細胞はメラノーマ抗原のMART-1の抗原提示を促進し、MART-1特異的なCD8陽性T細胞の活性化を亢進した。
以上の結果から、がんワクチンとAldaraの局所塗布投与の併用は有用であることが示された。
イミキモドクリームを皮膚に外用塗布すると、肺組織の免疫活性が増強することが報告されています。
皮膚転移だけでなく、他の部位に転移がある場合でも、抗がん剤治療や放射線治療を行うときにイミキモドクリーム、ピドチモド、セレコックスを併用すると抗腫瘍効果を高めることができます。この治療法は乳がん以外のがんにも有効です。
イミキモドを使った抗腫瘍免疫の増強法については以下のサイトで紹介しています。
◉ イミキモド(Imiquimod)の免疫増強作用
◉ トル様受容体7のリガンド(イミキモド)を使用した抗腫瘍免疫増強法
| « 831)糖質の吸... | 833)抗腫瘍免... » |



