がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
816)ドコサヘキサンエン酸(DHA)はプレバイオティクスか?:DHAは酪酸菌を増やす
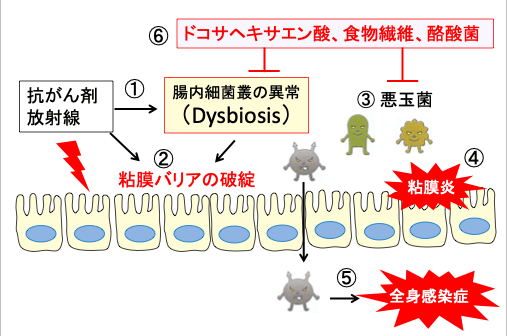
図:抗がん剤や放射線治療は腸内細菌叢の異常(Dysbiosis)を引き起こし(①)、粘膜バリアが破綻し(②)、悪玉菌が優位になって(③)、粘膜の炎症を引き起こす(④)。腸内細菌が体内に侵入して全身感染症を引き起こす(⑤)。ドコサヘキサエン酸と食物繊維と酪酸菌は腸内の酪酸を増やし、腸内細菌叢の異常を改善し、悪玉菌の有害作用を阻止する(⑥)。
816)ドコサヘキサンエン酸(DHA)はプレバイオティクスか?:DHAは酪酸菌を増やす
【腸管上皮細胞は粘液を産生して細菌の侵入を防ぐバリアを作っている】
大腸内には多くの微生物(腸内細菌)が棲みついています。一般に、500種類から1000種類、約100兆個の微生物が存在すると言われています。
これらの腸内微生物は、腸内に常在しているだけでなく、食物繊維の分解によって産生される短鎖脂肪酸や、葉酸、ビタミンK、ビタミンB類などのビタミンを宿主に提供し、健康維持に大きく貢献しています。
しかし、こういった有益な腸内細菌も、体内に侵入すれば免疫システムによって外敵とみなされ排除されます。そのため腸内微生物と宿主の両者を空間的に分け隔てるメカニズムが必要であり、それを可能にするのが腸管上皮細胞によって構築される「粘膜バリア」です。
粘膜バリアは物理的バリアと化学的バリアの二つに大別されます。
物理的バリアは物理的な壁となって微生物の侵入を防止するバリアであり、上皮層を被覆する粘液層、上皮細胞表面に存在する糖鎖の集合体である糖衣、細胞間接着装置である密着結合などがあります。
粘液層は腸管上皮細胞の一つである杯細胞から産生される糖タンパク質のムチンによって構成され、腸管上皮を覆うことで物理的に腸管組織への細菌侵入を防止しています。
化学的バリアは、抗菌活性を発揮することで細菌侵入を抑制する分子群です。ディフェンシンファミリー分子やReg3ファミリー分子などが含まれ,それらの分子は主として腸管上皮細胞の一つであるパネート(Paneth)細胞から産生されます。(下図)

図:腸管腔には多数の腸内細菌が棲みついている(①)。杯細胞(②)から粘液が産生され、粘液層が形成される(③)。パネート細胞(④)からは様々な抗菌物質(⑤)が産生されている。粘膜上皮細胞の間には細胞間接着装置(⑥)があって、上皮間からの細菌の侵入を防いでいる。これらが腸内微生物の体内への侵入を防ぐ粘膜バリアを構築している。
【抗がん剤治療は小腸粘膜の機能障害を起こす】
抗がん剤はがん細胞を死滅させる効果ががん治療に利用されますが、同時に正常な細胞をも傷つけてしまう欠点を持っています。
特に細胞分裂を日常的に行っている骨髄細胞・腸粘膜上皮・リンパ球の障害が顕著であるため、体の自然治癒力に最も重要な栄養吸収と免疫能・生体防御能の低下をきたす事が問題です。
消化された栄養素は小腸の粘膜から吸収されます。吸収する粘膜の面積を増やすため、粘膜の上皮細胞はじゅうたんのようにヒダ状になっておりこれを絨毛(じゅうもう)といいます。
消化管の内腔側に粘膜が突出した絨毛を形成することによって表面積を10 倍以上に広げることができます。その結果、ヒト小腸では200 m2 もの表面積となっています。
胃や大腸を含めた消化管全体では、その表面積は400m2にもおよび、これはテニスコート1面半にも相当します。皮膚で覆われている体表の面積は成人で約1.5~1.8 m2ですので、消化管がどれくらい広いかがよくわかります。
小腸絨毛の粘膜上皮では、幹細胞の分裂・分化により新生した上皮細胞は上方へ向かい、絨毛先端部に達するとアポトーシスを起こして脱落し糞便の一部となります。
その結果、小腸上皮の殆どは 1 週間以内に新たな細胞に入れ替わっています。したがって、抗がん剤で粘膜上皮細胞の分裂・分化が阻害されると、絨毛が平坦化あるいは消失し、粘膜の吸収面積が狭くなるので、消化不良や下痢をおこしやくなります。
(下図)

図:小腸粘膜上皮は幹細胞の分裂によって1週間以内に新たな細胞に置き換わっている(①)。小腸粘膜は吸収する粘膜の面積を増やすため、粘膜の上皮細胞はじゅうたんのようにヒダ状になっておりこれを絨毛(じゅうもう)と言う(②)。抗がん剤によって小腸粘膜の上皮の幹細胞の増殖が阻害されると、細胞回転が速い小腸粘膜は絨毛の消失により粘膜の平坦化が起こる(③)。その結果、食物の消化管での消化吸収が低下する。
抗がん剤は免疫細胞の増殖を阻害するので、粘膜のリンパ組織が減少し、腸管免疫の機能も低下します。腸管粘膜の上皮がダメージを受け、さらに、腸管粘膜で生体防御に働いている免疫細胞も減少するので、病原性を持った細菌やウイルスや毒物が体内に入りやすくなります。
また、筋層内には脊髄に匹敵するほどのニューロン(神経細胞)を有する腸管神経系を持ち交感・副交感神経を介して中枢神経と連携するとともに、粘膜に存在する多種類の神経内分泌細胞とその消化管ホルモンにより、微妙な制御がなされています。神経や消化管ホルモンの分泌がダメージを受けると、胃腸の動きも低下します。
つまり、抗がん剤治療は腸管の消化吸収機能と腸管粘膜バリアーの機能を障害する結果、体力と免疫力を低下し、感染症を発症しやすくするのです(下図)。

図:小腸の主たる機能は栄養素の吸収であり、内腔側には粘膜が突出した絨毛を形成して表面積を広げている(①)。小腸粘膜上皮は幹細胞の分裂によって1週間以内に新たな細胞に置き換わっている。したがって、抗がん剤によって小腸粘膜の上皮の幹細胞の増殖が阻害されると、細胞回転が速い小腸粘膜は絨毛の消失により粘膜の平坦化が起こる(②)。消化管は皮膚・呼吸器と同様に外界と直接接し、生体のバリアーとしての機能も重要な役割を担っている。体内の形質細胞(抗体を産生する細胞)の70〜80% が腸管粘膜固有層に位置しているといわれ、二量体 IgA 抗体を多量に分泌し、腸管表面で分泌型 IgA(sIgA)として生体防御を担っている(③)。sIgA産生の他に、杯細胞は粘液のムチンを産生し、パネート細胞はαデフェンシンやリゾチームを産生して、病原菌の侵入を防ぐ腸管粘膜バリアーを形成している(④)。抗がん剤治療は腸管粘膜バリアーを破壊する。小腸の食物の消化吸収能と生体のバリアーとしての機能が障害されると(⑤)、生体は栄養状態が悪化し、病原菌が侵入しやすくなる(⑥)。その結果、抗がん剤治療は体力と免疫力を低下し、感染症を発症しやすくする(⑦)。
【腸内微生物叢の異常をディスバイオシス(dysbiosis)と言う】
抗生物質の投与や偏った食事や病原体感染などの理由によって、腸内細菌叢(微生物叢)を構成する細菌の種類や数が減少することにより,細菌叢(微生物叢)の多様性が低下した状態をディスバイオシス(dysbiosis)と言います。
ヒトの腸内には、およそ1000種類、約100兆個に及ぶ細菌が生息しており、宿主に栄養源を供給したり、病原菌の繁殖を抑制したりすることで、ヒトの健康維持に重要な役割を果たしています。
しかし、何らかの原因により、腸内細菌の総菌数が著しく減少したり、その構成比が変化してしまうこと、また、通常は菌数レベルの低い菌種が異常に増加することなど、正常な細菌構成が異常になることがあります。これらの異常を総称して、ディスバイオシスと呼んでいます。
最近になって、ディスバイオシスが炎症性腸疾患、肥満、糖尿病などのさまざまな病気と密接な関わりをもつことが明らかとなってきています。
抗がん剤や放射線治療もディスバイオシス(dysbiosis)を引き起こし、腸粘膜の炎症や酸化ストレスを悪化させ、腸粘膜のバリア機能を低下させ、感染症や敗血症の原因になります。
【抗がん剤や放射線照射は腸内細菌叢の変化を誘導して粘膜炎や敗血症を引き起こす】
化学療法や放射線療法は大腸にも異常をきたします。大腸の場合は、腸内微生物叢の異常による腸粘膜バリアのダメージと炎症が重要です。
消化管粘膜上皮層は、粘膜バリアの重要な構成要素であることが知られています。健康な人では、上皮細胞間の密着結合(タイト・ジャンクション:tight junctions)が腸上皮の透過性を維持する上で極めて重要な役割を果たしています。
この上皮細胞間のタイト・ジャンクションが、消化管内に有害物質を隔離しながら栄養素の吸収を可能にしています。
さらに、腸上皮を覆う粘液層も粘膜バリア機能に寄与しています。この層は、糖タンパク質、ムチン、免疫グロブリン、および酪酸で構成されています。
たとえば、ムチン三量体は上皮細胞を内腔毒素から保護するバイオフィルムを構築し、分泌型IgAは粘液層の毒素や病原体を中和できる非常に重要な抗体です。
健康な腸内では、ラクトバチルスや連鎖球菌などのいくつかの有益な細菌が分泌型IgAの生合成を促進することが報告されています。
食物繊維の発酵によって産生される酪酸は、ムチン2(MUC2)遺伝子の発現を誘導することによってムチン合成を促進します。さらに、酪酸は腸上皮細胞から放出される抗菌ペプチドであるカテリシジン(cathelicidin)の分泌を促進することができます。
したがって、酪酸産生細菌は、健康な腸内の粘液の生理的組成を維持する上で重要な役割を果たしており、これらのプロセスにより、腸のバリアが十分に維持され、消化管内の病原体に対する宿主の防御が向上します。
しかし、化学療法または放射線療法によって腸内微生物叢に異常が生じると、悪玉菌が増え、粘液層が破壊され、腸上皮の透過性が高まります。さらに、粘膜炎が発生し、バリア機能の低下によって病原菌が体内に侵入して敗血症を引きおこします。(下図)

図:大腸粘膜上皮細胞(①)は密着結合(タイト・ジャンクション)によって隙間が無い状態で、粘液層(②)が厚く、善玉菌(③)が多く、分泌型IgAや酪酸の量が多い(④)。抗がん剤や放射線照射(⑤)は腸内細菌叢の変化を起こして悪玉菌が増える(⑥)。上皮細胞の間の密着結合が破綻して隙間ができ(⑦)、腸管内の病原菌が体内に侵入し(⑧)、粘膜炎や敗血症や全身感染症を引き起こす(⑨)。
抗がん剤や放射線治療は腸内細菌叢のディスバイオシス(dysbiosis)を引き起こします。以下のような報告があります。
Chemotherapy-driven dysbiosis in the intestinal microbiome(腸内細菌叢における化学療法誘発性のディスバイオシス)Aliment Pharmacol Ther. 2015 Sep;42(5):515-28.
【要旨の抜粋】
背景:化学療法はいくつかの副作用を引き起こし、胃腸の粘膜炎は最も頻繁に見られる副作用の一つである。消化管粘膜炎の病態生理学の検討において、腸内微生物叢の役割については検討されていない。
目的:消化管粘膜炎の病態生理における腸内微生物叢の役割を解明するために、化学療法後の微生物叢の変化を検討するために、ハイスループットDNAシーケンス分析を行なった。
方法:骨髄移植前の骨髄破壊的抗がん剤治療を受け、抗生物質などの他の併用療法を受けていない非ホジキンリンパ腫の28人の患者において、化学療法の前後の糞便サンプルから16SrRNA遺伝子を増幅および配列決定した。
結果:化学療法前に収集されたサンプルと比較して、化学療法後に収集された糞便サンプルは、ファーミキューテス(P = 0.0002)および放線菌(P = 0.002)の量の有意な減少とプロテオバクテリア(P = 0.0002)の量の有意な増加を示した。
結論:この研究は、化学療法によって誘発される消化管粘膜炎の発症に、腸内微生物叢の組成的および機能的不均衡の関与を明らかにしている。腸内微生物叢を標的とした治療法の開発の潜在的な有効性を示唆している。
抗がん剤治療による腸管粘膜炎の発症に腸内細菌叢のディスバイオシスが関与しているという報告です。
放射線治療における倦怠感や下痢の発症にも腸内細菌叢のディスバイオシスの関与が報告されています。以下のような報告があります。
Gut Microbial Dysbiosis May Predict Diarrhea and Fatigue in Patients Undergoing Pelvic Cancer Radiotherapy: A Pilot Study.(腸内微生物性叢のディスバイオシスは、骨盤がん放射線療法を受けている患者の下痢と倦怠感を予測する可能性がある:パイロット研究)PLoS One. 2015; 10(5): e0126312.
【要旨の抜粋】
倦怠感と下痢は骨盤放射線療法の最も頻繁な副作用であるが、その発症メカニズムはほとんどわかっていない。
この研究は、骨盤放射線療法によって誘発される腸内細菌叢の変化(ディスバイオシス)と倦怠感および下痢との間の相関関係を調査した。
11人のがん患者における骨盤放射線療法の5週間の治療中に、一般的な倦怠感スコアは有意に増加し、下痢の患者でより顕著であった。
倦怠感スコアは、血清シトルリン(機能的腸粘膜上皮細胞量の指標)の減少および全身性炎症性タンパク質(ハプトグロビン、オロソムイド、α1-アンチトリプシン、TNF-α)の増加と密接に相関していた。
リポ多糖(LPS)の血清レベルも上昇し、特に粘膜上皮バリアの破綻と内毒素血症を示す下痢の患者で上昇した。
16S rRNA遺伝子の分析により、後に下痢を発症した患者では、放射線治療前に、微生物の多様性、細胞数、およびファーミキューテス門(Firmicutes)/バクテロイデス門(Bacteroidetes)の比率の比率が大幅に変化した。骨盤放射線療法は、糞便中の微生物生態学にさらなる変化を引き起こし、そのいくつかは下痢の有無にかかわらず患者に特有のものであった。
この研究の結果は、放射線療法前の腸内微生物のディスバイオシスが下痢の発症を予測し、予防的治療の選択肢を導くために利用される可能性があることを示している。放射線誘発性腸内細菌叢のディスバイオシスは、消化管粘膜炎、下痢、全身性炎症反応、倦怠感などの骨盤放射線照射に関連する副作用の一因となる可能性がある。
化学療法または放射線療法によって誘発される腸内微生物叢の異常(ディスバイオシス)は、腸粘膜バリアの機能障害を引き起こします。 第一に、腸内バリアはLPS産生細菌によって損なわれ、腸粘膜上皮の透過性の増加につながる可能性があります。 第二に、酪酸産生菌の割合が減少することで、粘液層を以前よりも薄くすることができます。 第三に、分泌型IgAの腸内濃度は化学療法または放射線療法後に減少します。

図:抗がん剤や放射線治療は腸内細菌叢の異常(Dysbiosis)を引き起こし(①)、粘膜バリアが破綻し(②)、悪玉菌が優位になって(③)、粘膜の炎症を引き起こす(④)。腸内細菌が体内に侵入して全身感染症を引き起こす(⑤)。
【オメガ3多価不飽和脂肪酸は抗がん剤や放射線治療によるディスバイオシスを改善する】
抗がん剤や放射線治療によるディスバイオシス(腸内微生物叢の異常)をオメガ3多価不飽和脂肪酸のドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)が改善することが報告されています。以下のような報告があります。
Potential of Omega-3 Polyunsaturated Fatty Acids in Managing Chemotherapy- or Radiotherapy-Related Intestinal Microbial Dysbiosis(化学療法または放射線療法に関連する腸内微生物叢の異常の管理におけるオメガ3多価不飽和脂肪酸の可能性)Adv Nutr. 2019 Jan 1;10(1):133-147.
【要旨】
化学療法または放射線療法によって誘発される腸内微生物叢の異常(ディスバイオシス)は、腸粘膜炎の主な原因の1つである。腸内細菌の末梢血への侵入とその後の敗血症の発症は、腸のバリアの機能不全の結果として発生する。
化学療法や放射線療法は、腸内の有益な細菌と有害な細菌のバランスを崩し、腸内微生物叢の異常を引き起こす。有益なバクテリアの減少は、有害なバクテリアに対する腸の抵抗力を弱めることにつながり、炎症性シグナル伝達経路の強力な活性化をもたらす。
たとえば、リポ多糖(LPS)産生細菌は、ストレスを受けた粘膜上皮細胞上のトール様受容体4との結合を介して、核転写因子-κB(NF-κB)シグナル伝達経路を活性化する。
多くの研究により、ドコサヘキサエン酸やエイコサペンタエン酸などのオメガ-3(n-3)多価不飽和脂肪酸は、ラクトバチルス(Lactobacillus)、ビフィズス菌(Bifidobacterium)、酪酸産生細菌(RoseburiaやCoprococcusなど)などの有益な細菌種を増やすことで、腸内微生物叢の異常を改善することが示されている。
さらに、オメガ3(n-3)多価不飽和脂肪酸は、腸内のLPS産生菌と粘液溶解菌の割合を減らし、炎症と酸化ストレスを減らすことができる。
重要なことに、オメガ3(n-3)多価不飽和脂肪酸は結腸直腸がんに対して抗がん効果を発揮する。
このレビューでは、化学療法または放射線療法に関連する腸内微生物叢異常の特徴を要約し、腸内毒素症による腸粘膜炎の発症メカニズムを考察する。次に、オメガ3(n-3)多価不飽和脂肪酸が化学療法または放射線療法に関連する腸内微生物叢異常をどのように軽減できるかについて説明する。このレビューは、化学療法または放射線療法に関連する腸内微生物叢異常の管理のためのオメガ3(n-3)多価不飽和脂肪酸の臨床使用について考察する。
化学療法や放射線療法によって発症する腸内微生物叢異常の予防と治療にオメガ3(n-3)多価不飽和脂肪酸が有効ということを指摘しています。
【オメガ3不飽和脂肪酸は酪酸を増やすプレバイオティクスか?】
最近、いくつかの疾患の病因における腸内細菌叢の重要性が臨床的関心を集めています。腸内細菌叢に影響を与える外因性の要因の中で、食事療法が最大の効果を持っているように見えます。
脂肪酸、特にオメガ3多価不飽和脂肪酸は、心臓代謝、炎症、癌など、さまざまな病気を改善します。脂肪酸に関連する有益な効果は、腸内細菌叢の組成の変化を通じて、重要な程度まで媒介される可能性が指摘されています。オメガ3が豊富な食事に応じた腸内細菌叢の変化に関する研究が増えています。
あるケーススタディでは、オメガ3が豊富な食事による腸内細菌叢の変化が調査されました。糞便サンプルは、14日間毎日600mgのオメガ-3を摂取した45歳の男性から収集されました。介入後、種の多様性は減少しましたが、いくつかの酪酸産生細菌は増加しました。 FaecalibacteriumprausnitziiとAkkermansiasppに重要な減少がありました。腸内細菌叢の変化は、14日間のウォッシュアウト後に元に戻りました。
オメガ3 多価不飽和脂肪酸は、腸内細菌叢において有益なバクテリアの割合を増やすことができます。たとえば、オメガ3 多価不飽和脂肪酸を含む食餌を与えられたマウスは、オメガ6多価不飽和脂肪酸を含む食餌を与えられたマウスよりも、糞便中に多くの乳酸菌とビフィズス菌を示し、腸の炎症が少ないことを示しました。
つまり、オメガ3の健康関連の利点のいくつかは、部分的には、酪酸産生細菌の増加に起因する可能性があります。
オメガ3 多価不飽和脂肪酸は、化学療法または放射線療法によって誘発される腸内微生物叢の異常を軽減します。 オメガ3 多価不飽和脂肪酸は、化学療法または放射線療法によって誘発される腸内微生物叢の異常を元に戻し、腸のバリアを正常に維持します。 オメガ3 多価不飽和脂肪酸の摂取は、有益なバクテリアの割合を増やし、有害なバクテリアの割合を減らすことによって、有益な微生物叢を回復させます。 その結果、粘液層が正常に維持され、腸透過性が低下し、分泌型IgAの濃度が回復します。
【培養した微細藻類由来DHAが注目されている】
がんや認知症や循環器疾患の予防や治療にDHAやEPAが有効であることは確立しています。従って、DHAやEPAの多い脂の乗った魚を多く食べることが推奨されています。しかし、魚のメチル水銀やマイクロプラスチックなど海洋汚染に由来する有害物質の魚への蓄積の問題が、魚食を安易に推奨できない事態になっています。
メチル水銀は毒性が強く、血液により脳に運ばれ、やがて人体に著しい障害を与えます。母親が妊娠中にメチル水銀を体内に取り込んだことにより、胎児の脳に障害を与えることもあります。
魚は自然界に存在する水銀を食物連鎖の過程で体内に蓄積するため、日本人の水銀摂取の80%以上が魚介類由来となっています。魚摂取が増えるとメチル水銀の体内摂取が増え、胎児の脳の発育に悪影響を及ぼすことが明らかになり、厚生労働省は平成15年(2003年)に妊婦の魚摂取に関する注意事項を公表しています。つまり、妊婦や小児は魚を多く食べてはいけないと言っています。
海洋でDHAとEPAを作っている微細藻類を培養して、培養した微細藻類からDHAとEPAを取り出せば、汚染物質がフリーのDHA/EPAを製造できます。閉鎖環境での培養のため、汚染の心配がありません。植物由来なので菜食主義者も抵抗なく摂取できます。(下図)

図:オメガ3系多価不飽和脂肪酸のエイコサペンタエン酸(EPA)やドコサヘキサエン酸(DHA)は微細藻類が合成している(①)。プランクトン(②)が微細藻類を食べ、小型魚(③)がプランクトンを食べ、大型魚(④)が小型魚を食べるという食物連鎖によって、魚油にEPAやDHAが蓄積している。人間は魚油からDHAとEPAを摂取している(⑤)。環境中の水銀(⑥)が魚に取り込まれてメチル水銀になって魚に蓄積する(⑦)。DHAとEPAを産生している微細藻類をタンク培養して油を抽出すると(⑧)、汚染物質がフリーで、植物由来のDHA/EPAが製造できる(⑨)。
がん治療には1日3から5グラムのDHAの摂取が有効であることが多くの研究で示されています。通常の魚油の場合、DHA含有量は10%から20%程度です。1日5グラムのDHAを摂取するには25gから50gの魚油の摂取が必要になります。
そこで、微細藻類の中でもDHA含有量が極めて多いシゾキトリウム(Schizochytrium sp.)をタンク培養して製造したDHA(フランス製)を原料にした「微細藻類由来オイル(DHA含有量51%)」を製造してがん治療に使用しています。
詳細は以下のサイトで紹介しています。
http://www.f-gtc.or.jp/DHA/DHA-51.html
画像をクリックするとYouTubeの動画に移行します。
| « 815)高齢者の... | 817)亜麻仁油... » |





