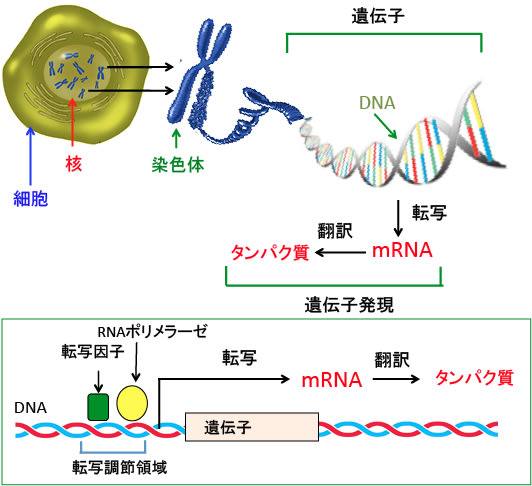
図:(上)遺伝情報は細胞の核の中にある染色体のDNA(デオキシリボ核酸)に書き込まれている。DNAは2本のロープがより合わさったような二重らせん構造になっており、そこには4種類の塩基という物質(アデニン、グアニン、シトシン、チミン)が、文字列のように延々と一列に並んでおり、その配列を読み取って体に必要な蛋白質を作り出している。DNAの情報がメッセンジャーRNA(mRNA)に転写され、タンパク質に翻訳される過程を遺伝子発現と言う。
(下)それぞれの遺伝子の上流には遺伝子の転写を調節する領域があり、この領域にRNAポリメラーゼや転写因子が結合して遺伝子発現のスイッチがオンになる。転写因子には多くの種類があり、それらの働きによって細胞の種類や刺激の種類に応じた遺伝子発現が調節されている。
塩基性ヘリックス・ループ・ヘリックス(basic helix-loop-helix; bHLH)というのはDNA結合ドメインである塩基性領域と、タンパク質相互作用に働くHLHモチーフからなる転写因子です。
「モチーフ」というのは「特徴的なアミノ酸配列からなる構造」のことです。
すなわち、HLH(Helix-Loop-Helix)モチーフというのは、2つのαへリックス(バネに似た右巻ラセン構造のアミノ酸配列)がループ状のアミノ酸配列によって連結された構造です。
塩基性領域をもったbHLHがHLHの部分で結合して2量体を形成し、2つの塩基性領域が特定の遺伝子のプロモーター領域の特徴的なDNA配列を認識して結合することによって、遺伝子転写を制御(促進または抑制)します。
Id (inhibitor of DNA binding)は、Id-1からId-4という4つの分子から構成されるファミリーで、helix-loop-helix (HLH)ドメインを持ち、ほかのbasic HLH蛋白と結合しますが、DNA結合部分(塩基性領域)を持たないため、bHLHのDNA結合を阻害し、bHLHの転写制御を阻害します。(その機能は細胞種やIdの分子種によっても異なります)。
bHLH(basic helix-loop-helix)は多くの哺乳動物および非哺乳動物において、細胞や組織に特異的な遺伝子発現の制御や、細胞分化や増殖に関わる遺伝子の転写の制御において中心的な働きを行っています。
Id-1はES細胞や神経幹細胞などで発現が上昇している転写因子であり、幹細胞の自己複製能を制御しています。
分化した細胞にはId-1は発現していません。Id-1タンパク質の恒常的な発現は、様々な組織において、細胞の分化(differentiation)を阻害する作用を持ちます。
つまり、bHLHの転写制御によって細胞分化が維持されていた細胞は、Id-1タンパク質が多く産生されるとbHLHの働きが阻害されて、細胞は脱分化し、がん化してしまいます。
Id-1はがん幹細胞の自己複製能の維持に関与しています。幹細胞は、自分と同じ細胞を作り出す自己複製能と、色々な細胞に分化する多分化能という性質を有しており、組織の再生や成長において非常に重要な細胞です。
がん組織においても、正常の幹細胞と同じような性質を有した細胞集団(いわゆるがん幹細胞)が存在し、がんの増大に関与しています。がん組織の中に存在するがん幹細胞が、がん細胞を供給することでがん組織を構成しています。がん幹細胞は通常のがん細胞よりも抗がん剤や放射線に対する抵抗性が強く、がんの転移や再発に重要な役割を果たしています。つまり、Id-1の発現が多いがん細胞は抗がん剤や放射線治療が効きにくい細胞です。
さらに、Id-1の発現ががん細胞の増殖や浸潤や転移を促進することが多くのがん細胞で示されています。Id-1の発現量が多いがん細胞ほど悪性度が高く、浸潤や転移を起こしやすく、予後が悪いことが多くのがんで明らかになっています。
そして、Id-1の発現を阻害するとがん細胞の浸潤や転移を抑制できることが報告されています。
また、Id-1は血管新生にも関与しています。
したがって、がん細胞のId-1の発現を抑制することは、がん細胞の浸潤や転移を抑制し、予後を良くする効果が期待できるため、Id-1抑制はがん治療のターゲットとして注目されています。
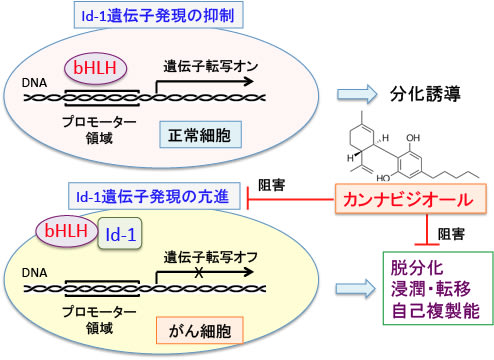
図:(左)bHLH(basic Helix-Loop-Helix:塩基性ヘリックス・ループ・ヘリックス)タンパク質は2量体を形成してDNAの転写調節領域に結合して遺伝子の転写を制御する。bHLHは細胞の分化や増殖に関わる遺伝子の転写制御において中心的な働きを行っている。
(右)Id-1はHLHドメインは持つがDNA結合ドメイン(塩基性領域)を欠いている。Id-1タンパク質と結合したbHLHはDNAに結合できなくなる。つまり、Id-1タンパク質はbHLHの機能を阻害的に制御する因子として働く。分化した正常細胞はId-1タンパク質が発現していないが、Id-1タンパク質が多く発現すると細胞は脱分化を起こす。細胞分化を阻止するId-1タンパク質が、ヒトのがんの発生や進展に重要な関与をしていることが明らかになっている。
【カンナビジオールはId-1遺伝子の発現を阻害する】
前述のように、Id-1は正常細胞の発生や分化の過程で発現する遺伝子で、細胞が分化して成熟したあとはId-1遺伝子は休眠状態になっています。
それが細胞のがん化とともに発現が活性化され、特にがん細胞が浸潤や転移の性質を獲得するときに重要な働きをしています。
つまり、Id-1遺伝子が発現し活性化すると、がん細胞はより悪性度を増し、浸潤や転移する性質を獲得するのです。したがって、Id-1遺伝子の発現や活性を阻害すると、がん細胞の浸潤や転移を抑えることができます。精神変容作用のないカンナビノイドのカンナビジオールが、Id-1遺伝子の発現を抑制することが乳がんやグリオブラストーマなどで報告されています。以下のような論文があります。
Cannabidiol as a novel inhibitor of Id-1 gene expression in aggressive breast cancer cells.(浸潤性乳がん細胞におけるId-1遺伝子発現の新規の阻害剤としてのカンナビジオール)Mol Cancer Ther 6(11): 2921-7, 2007年
【要旨】
増殖の早い乳がん細胞の浸潤および転移は、がんの進行における最終段階であり、死が近いことを意味している。しかし、そのメカニズムは十分に解明されていない。がん細胞の浸潤や転移に対する有効で副作用の少ない治療法の開発は急がなければならない。
bHLH(basic helix-loop-helix)転写因子の阻害剤の一つであるId-1タンパク質は、乳がんやその他多くのがん細胞の転移能の制御において重要な役割を担っていることが明らかになっている。
マウスを用いた実験系において、アンチセンスId-1によってId-1遺伝子の発現を抑制すると、転移性の乳がん細胞の転移能が顕著に抑制されることを、以前の論文において報告している。
しかしながら、臨床的に転移性乳がんの患者に、アンチセンス技術を用いてId-1遺伝子発現を抑制することは現時点では技術的に不可能である。この論文では、低毒性のカンナビノイド(大麻草に含まれる成分の総称)であるカンナビジオール(cannabidiol)が浸潤性のヒト乳がん細胞においてId-1発現を抑制する作用を明らかにした。
カンナビジオールによる乳がん細胞の増殖能や浸潤能の抑制効果は、Id-1発現抑制と相関していた。カンナビジオールはmRNAとタンパクのレベルでのId-1の発現を用量依存的に抑制した。
これらの作用は、Id-1遺伝子のプロモーターレベルの阻害の結果によることが示唆された。カンナビジオールは異所性(ectopically)にId-1を発現させた細胞の浸潤能は阻害しなかった。
この研究の結論として、カンナビジオールは転移性の乳がん細胞のId-1遺伝子の発現を有効に阻害してがん細胞の浸潤や転移を抑制できる毒性の低い物質として発見された最初の物質と言える。
この論文では、内因性のId-1遺伝子プロモーターで制御されないベクター(pLXSN vector)を使ってId-1遺伝子を導入してId-1を異所性(ectopically)に過剰に発現させると、カンナビジオールの抑制効果は無くなりました。つまり、カンナビジオールはId-1遺伝子をプロモーターレベルで作用して転写を抑制するという機序が示唆されています。
次の論文も同じ研究グループからの報告です。
Pathways mediating the effects of cannabidiol on the reduction of breast cancer cell proliferation, invasion, and metastasis. (乳がん細胞の増殖、浸潤、転移の抑制におけるカンナビジオールの作用機序)
Breast Cancer Res Treat. Aug 2011; 129(1): 37–47.
【要旨】
進行性の乳がんにおいて浸潤や転移はがん進展の最終で死に至る段階を意味している。このような転移性の乳がんに対する有効な治療法はまだ無い。したがって、副作用が少ない有効性の高い治療法が望まれている。
Id-1は塩基性ヘリックス・ループ・ヘリックス(basic helix-loop-helix)タイプの転写因子を制御するタンパク質で、乳がん細胞をはじめ様々な種類のがん細胞において転移を制御する重要な因子であることが近年の研究で明らかになっている。
大麻草に含まれるカンナビノイドのうち低毒性の特徴をもつカンナビジオールが、培養した浸潤性の高いヒト乳がん細胞において、Id-1の遺伝子発現を抑制することを、我々は以前の論文で報告している。
細胞増殖と浸潤のアッセイ系、細胞周期の状態を解析するフローサイトメトリー、活性酸素の産生量、タンパク質発現量の解析(ウェスタンブロット解析)を用いて、カンナビジオールによるId-1遺伝子発現の抑制と、その結果として起こる乳がん細胞の増殖や浸潤の抑制のメカニズムを検討した。
さらに、マウスの4T1乳がん細胞株を用いた肺転移の実験モデルにおいて、生体内(in vivo)でカンナビジオールの投与が転移を抑制できるかどうかを検討した。
カンナビジオールは細胞外シグナル制御キナーゼ(extracellular signal-regulated kinase;ERK)のシグナル伝達系と活性酸素が関連するシグナル伝達系の2つの経路を介してId-1遺伝子の発現を抑制し、乳がん細胞の増殖と浸潤を阻害することを示した。
さらに、細胞分化を誘導するId-2遺伝子の発現を亢進することを明らかにした。
免疫状態が正常のマウスに腫瘍を移植する2つの実験系において、カンナビジオールを投与すると乳がんの原発部位の腫瘍組織の増大を顕著に抑制し、肺転移の数や大きさも抑制した。
これらのデータは乳がんの前臨床試験におけるカンナビジオールの有効性を示している。この結果は、乳がんの転移の治療における新規の毒性のない治療薬の開発につながる可能性をもっており、がんの進行とId-1やカンアビノイドの関連性の重要性を示している。
Idタンパク質ファミリーは種類によって働きが異なります。この実験系ではId-1の発現は細胞を脱分化させ、Id-2は細胞分化を亢進すると言っています。そして、カンナビジオールはId-1の発現を阻害し、Id-2の発現を亢進して、乳がん細胞の分化を誘導するという結果です。
【カンナビジオールはグリオブラストーマの増殖を抑制する】
グリオブラストーマ(神経膠芽腫)は極めて悪性度の高い脳腫瘍で、治療が困難で予後が不良の腫瘍です。生存率を高めるためには通常の手術や抗がん剤や放射線治療の他に、可能性のある治療を併用することが重要です。
このブログでは
ケトン食や
フェノフィブラートや
メベンダゾールなどの有効性を紹介しています。(
326話、
339話、
401話参照)
カンナビジオールの有効性も報告されています。(これも前述の研究グループからの報告です)
Id-1 is a key transcriptional regulator of glioblastoma aggressiveness and a novel therapeutic target.(Id-1はグリオブラストーマの悪性度に関連する遺伝子転写を制御するカギとなる因子であり、新規の治療ターゲットである)Cancer Res 73(5): 1559069, 2013年
【要旨】
グリオブラストーマ(神経膠芽腫)は成人の原発性脳腫瘍で最も頻度の高い腫瘍である。グリオブラストーマ細胞の多くは強い浸潤性を示し、再発率が高く、根治が困難な腫瘍である。
したがって、グリオブラストーマ細胞の浸潤性を制御している中心的調節機構を明らかにし、それをターゲットにした治療法の開発が必要である。
我々はこの研究において、転写制御因子のId-1が、グリオブラストーマの培養細胞株と原発性のグリオブラストーマ細胞において、浸潤性を制御する中心的な役割を担っていることを明らかにした。
グリオブラストーマの培養細胞株および患者から生検で採取したグリオブラストーマ細胞の組織学的悪性度のグレードとId-1発現のレベルの間には正の相関を認めた。
Id-1遺伝子の発現阻止(ノックダウン)はグリオブラストーマの浸潤性性質を顕著に低下させ、間葉系(mesenchymal)マーカーの発現レベルを低下させて形態学的にも著明な変化を認めた。さらに、グリオーマの幹細胞のマーカーの発現を低下させ、幹細胞の自己複製能(self-renewal potential)を阻害した。
ヒトのグリオブラストーマ細胞を移植する動物実験モデルでの検討において、がん細胞のId-1遺伝子を欠損させると(genetic knockdown)、腫瘍を移植した動物の生存率が顕著に高くなった。
さらに、非毒性(nontoxic)物質であるカンナビジオール(cannabidiol)は、グリオブラストーマのId-1遺伝子の発現を顕著に低下させ、グリオブラストーマ細胞の浸潤性と幹細胞の自己複製能を低下させた。
さらに、マウスを使った生体内(in vivo)の実験系においても、カンナビジオールはグリオブラストーマ細胞の浸潤性を進行を顕著に阻止した。
これらの結果は、Id-1遺伝子はグリオブラストーマ細胞における数多くの腫瘍促進経路(multiple tumor-promoting pathways)を制御しており、Id-1をターゲットにした医薬品は、グリオブラストーマの患者の治療効果と生存率を高める可能性の高い新規の治療法となることを示している。
この論文の研究グループは以前の研究において、乳がん細胞の浸潤性と転移能がId-1タンパク質の発現レベルと強い正の相関を示すことを報告しています。さらに、Id-1タンパク質の発現レベルが、リンパ節転移を認めなかった乳がん患者の予後を示すマーカーになることを報告しています。
乳がんの浸潤能や転移能とId-1の発現レベルが相関し、Id-1遺伝子の働きを阻害すると、がん細胞の浸潤や転移が顕著に低下することを報告しています。
乳がんやグリオブラストーマだけでなく、Id-1の発現量と悪性度が正の相関を示すことは卵巣がんや胃がんなど多くのがん種で報告されています。つまり、一般的に、Id-1遺伝子の発現量が多いほど悪性度が高く、浸潤や転移を起こしやすいと言えます。
また、Id-1タンパク質はがん幹細胞に発現し、自己複製能の維持に関与していることが報告されています。
医療大麻がグリオブラストーマの治療に有効であることが報告されています。この場合、カンアビノイド受容体のCB1とCB2を介した抗腫瘍作用が指摘されていますが、CB1とCB2 のアゴニスト作用は精神作用の存在のため使用が困難です。
この論文では、医療大麻によるグリオブラストーマへの抗腫瘍効果の作用機序の一つとして、カンナビジオールによるId-1遺伝子発現阻害作用が関与している可能性を示唆しています。Id-1発現亢進はグリオブラストーマ細胞の浸潤性や悪制度亢進を関連しているからです。
つまり、カンナビジオールはId-1の発現を抑制してグリオブラストーマの分化を誘導するという作用機序です。
分化誘導作用のあるレチノイドやビタミンD3との併用の可能性も示唆されます。
Id-1阻害は浸潤能や転移能や幹細胞の自己複製能を阻害するが増殖能に対する抑制効果は弱いことがこの論文で指摘されています。したがって、細胞増殖を抑制する微小管形成抑制のメベンダゾールとの併用が抗腫瘍効果を高める可能性があります。
Id-1の阻害は、腫瘍細胞の悪性度亢進と関連する様々なタンパク質の活性を低下させることが報告されています。これらの作用は抗がん剤感受性を高めることになります。
また、Id-1の阻害はSox-2タンパク質の発現を低下させ、腫瘍の再発を抑制する作用が報告されています。
幹細胞の自己複製能を低下させることは再発予防につながります。
つまり、カンナビジオールは進行がんの悪性度を低下させる作用や、抗がん剤感受性を高める作用があるといえます。
カンナビジオールはがん細胞のミトコンドリアでの活性酸素の産生を高めて抗腫瘍効果を発揮するという報告があります。
がん細胞に活性酸素の産生を高める方法としてピルビン酸脱水素酵素の活性を高めるジクロロ酢酸ナトリウムやR体アルファリポ酸があります。さらに、ミトコンドリアの呼吸酵素複合体1を阻害してミトコンドリアでのATP産生を阻害すると同時に活性酸素の産生を増やす作用があるメトホルミンがあります。
したがって、カンアビジオールで治療を行うときは抗酸化作用のある成分はカンナビジオールの抗腫瘍効果を弱める可能性があります。(R体アルファリポ酸は抗酸化作用がありますが、ピルビン酸脱水素酵素の活性化による抗がん作用の方が強いようです)
これらを併用する方法も試してみる価値はあります。
ただし、グリオブラストーマの放射線治療中はカンナビジオールは併用しない方が良いようです。放射線治療は細胞分裂を行っているがん細胞ほど感受性が高い(死にやすい)ことが知られています。Id-1の発現が高いグリオブラストーマ細胞ほど放射線治療後の予後が良いという論文があります。つまり、放射線治療中はがん細胞の細胞分裂を抑制すると放射線治療の効果が減じるということです。
カンナビジオールを他のがん代替医療や標準治療に併用する際、その作用機序を考察することが大切です。
マウスの実験ではCBDの投与量は最大で5mg/kgで行われています。体重1kg当たり1~5mg程度で効果があるようです。マウスの代謝速度はヒトの7倍程度ですので、人間の投与量は体重1kg当たり0.2から1mg程度で良いように思われます。体重50kgで1日10~50mg程度です。(動物実験の量からの人間の服用量の換算については
293話に解説)
がん治療にCBDオイルを使う場合の一つの目安になります。
【もはや医療大麻を認可しないのは憲法違反である】
麻薬はその使用が厳しく規制され、嗜好目的の使用は犯罪です。しかし、治療効果が証明されれば、医療目的での使用は許可されるはずです。
モルヒネは大麻に比べれば格段に毒性も身体依存性も高いにも拘らず、その治療効果(鎮痛作用)が証明されているために、がん治療の臨床現場では自由に使用されています。むしろ、がんの緩和医療においては、疼痛を緩和するために積極的にモルヒネ(オピオイド)を使用することがガイドラインに記載されています。
日本では、大麻は医療目的でも使用できません。その大前提は「大麻の医療効果は証明されていない」と考えられているからです。
しかし、近年の多くの研究において、様々な病気の治療に大麻が極めて有効であることが証明されています。ネット上には、進行がんが医療大麻で劇的に良くなった例を見つけることができます。絶望的な状態の脳腫瘍の子供が医療大麻で完治した例が米国のテレビで放送されています(YouTubeでみられるので、そのうち訳して紹介予定)
つまり、「大麻に医療効果は証明されていない」という主張は科学的および医学的に間違いだと断定できます。それが、近年、各国において医療大麻が許可されるようになった理由です。
(本来、大麻取締法は日本を米国の石油繊維の市場にする目的があったため、大麻草そのものの栽培を禁止し、そのために、医療用使用まで禁止する条項をわざわざ加えたと言われています)
米国では、1996 年にカリフォルニア州で医療大麻を合法化する住民投票が可決され、全米で始めて医療大麻が解禁されました。その後、23州とワシントンDCで大麻の医療用の使用(医療大麻)が法令で認められています。さらに、2013年には2州で嗜好大麻が合法化されています。
2000年代には、カナダ、ベルギー、ドイツ、イスラエル、スペイン、イギリスなどで続々と医療大麻が解禁になっているそうです。
日本の進行がんの患者さんが外国で医療大麻による治療を受けて劇的に良くなっている例もあるようです。
日本もはやく医療大麻の解禁に向けて法整備をしないと世界の医療から取り残される可能性が高いと思います。