がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
561)トリプルネガティブ乳がんとメトホルミンと2-デオキシ-D-グルコースとジクロフェナク
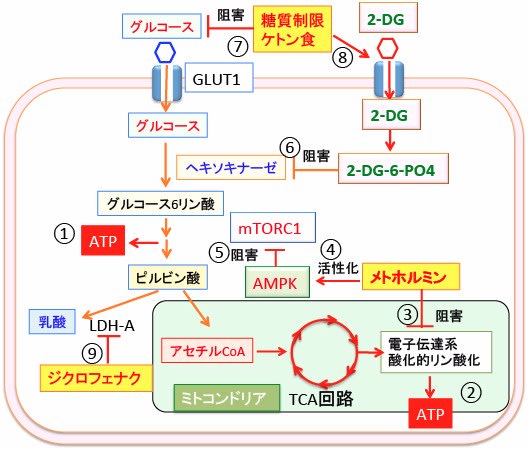
図:細胞は細胞質(解糖系①)とミトコンドリア(酸化的リン酸化②)でATPを産生する。メトホルミンは電子伝達系の呼吸酵素を阻害してATP産生を阻害し(③)、AMP活性化プロテインキナーゼ(AMPK)を活性化する(④)。活性化したAMPKは哺乳類ラパマイシン標的蛋白質複合体-1(mTORC1)を阻害して細胞の増殖を抑制する(⑤)。2-デオキシ-D-グルコース(2-DG)はヘキソキナーゼを阻害してグルコースの解糖系での代謝を阻害する(⑥)。糖質制限やケトン食は、がん細胞におけるグルコース利用を低下させ(⑦)、2-DGの細胞内取込みを高める(⑧)。ジクロフェナクは乳酸脱水素酵素A(LDH-A)活性を阻害して解糖系を抑制する(⑨)。ケトン食と2-DGとメトホルミンとジクロフェナクの併用は、がん細胞のエネルギー産生を阻害し、増殖を相乗的に抑制する。
561)トリプルネガティブ乳がんとメトホルミンと2-デオキシ-D-グルコースとジクロフェナク
【トリプル・ネガティブ乳がんはメトホルミンが効きやすい生物学的特徴を持っている】
トリプル・ネガティブ(Triple Negative)乳がんというのは、ホルモン受容体(エストロゲン受容体とプロゲステロン受容体)とHER2(ヒト上皮細胞増殖因子受容体タイプ2)蛋白を発現していない乳がんです。細胞増殖能が高く、遠隔臓器への転移を起こし易く、早期に再発し易い生物学的特徴を持っています。原発性乳がんの約15%を占め、乳がんの中でも生物学的悪性度の高いサブタイプです。
トリプルネガティブ乳がんの補完・代替療法については555話でまとめています。ここでは、糖尿病治療薬のメトホルミンと2-デオキシ-D-グルコースの併用の有効性を中心に解説します。
メトホルミンがトリプル・ネガティブ乳がんに効くという報告があります。以下のような論文があります。
Metformin induces unique biological and molecular responses in triple negative breast cancer cells.(メトホルミンはトリプルネガティブ乳がん細胞において特徴的な分子生物学的応答を引き起こす)Cell Cycle. 2009 Jul 1;8(13):2031-40.
【要旨】
トリプルネガティブ乳がんは、肥満または2型糖尿病を有する女性や若年の有色人種の女性でより多い頻度で見られる。
トリプルネガティブ乳がんは、エストロゲンやプロゲステロやII型受容体チロシンキナーゼのHer-2に対する受容体を発現しないが、サイトケラチンと上皮成長因子受容体(EGFR)の発現が亢進している。
このような性状は、グルコースおよび脂肪酸代謝の異常、EGFRおよび遺伝因子を介したシグナル伝達がトリプルネガティブ乳がんの発症を促進する可能性を示唆している。
2型糖尿病治療薬のメトホルミンは乳がんの発生率を低下させることが知られているが、メトホルミンによって発症が抑制される乳がんの特定のサブタイプについては報告されていない。
我々のデータは、メトホルミンが培養細胞(in vitro)および動物実験(in vivo)の両方の実験系において、トリプルネガティブ乳がんに対してユニークな抗腫瘍効果を有することを示している。
メトホルミンは、トリプルネガティブ乳がん細胞に特徴的な内在性および外因性シグナル伝達経路の活性化を介して、細胞増殖(部分的なS期停止を伴う)やコロニー形成を阻害し、アポトーシスを誘導する。
分子レベルでは、メトホルミンは用量および時間依存的に、リン酸化したAMP依存性プロテインキナーゼ(P-AMPK)を増加させ、リン酸化した上皮成長因子受容体(P-EGFR)、上皮成長因子受容体(EGFR)、リン酸化したMAPキナーゼ(P-MAPK)、リン酸化したSrc(P-Src)、サイクリンD1およびサイクリンEを減少させ(サイクリンAまたはB、p27またはp21ではなく)、PARP切断を誘導する。
これらのデータは、ルミナルAおよびB、Her-2陽性乳がん細胞に対して知られているメトホルミンの生物学的および分子的効果とは明らかに対照的である。
トリプルネガティブ乳がん細胞(MDA-MB-231)をヌードマウスに移植した実験系で、メトホルミン投与は、対照群(メトホルミン非投与群)と比較して、腫瘍増殖(p = 0.0066)および細胞増殖(p = 0.0021)において有意な減少を示す。
MDA-MB-231細胞をヌードマウスに移植する前にメトホルミンを投与すると、腫瘍の増殖と発生数の有意な減少をもたらす。
メトホルミンは培養細胞および動物実験でトリプルネガティブ乳がん細胞に対して特徴的な抗腫瘍活性を示すので、トリプルネガティブ乳がんの治療法としてメトホルミンは検討されるべきである。
「P-AMPKを増加させ、P-EGFRとEGFRとP-MAPKとP-SrcとサイクリンD1とサイクリンEを減少させ、PARP切断を誘導する」という効果は、がん細胞の増殖を抑制しアポトーシス(細胞死)を誘導します。
この論文では、メトホルミンはトリプルネガティブ乳がんの治療に有用という見解です。
【メトホルミンはミトコンドリアの呼吸酵素複合体Iを阻害する】
メトホルミン(metformin)は、世界中で1億人以上の2型糖尿病患者に使われているビグアナイド系経口血糖降下剤です。
ビグアナイド剤は、中東原産のマメ科のガレガ(Galega officinalis)から1920年代に見つかったグアニジン誘導体から開発された薬です。ガレガは古くから、糖尿病と思われる病気(口渇や多尿)の治療に経験的に使われ有効性が認められており、その関係でこのガレガから血糖降下作用のあるビグアナイドが発見されました。
メトホルミンは、ミトコンドリアの呼吸鎖の最初のステップである呼吸酵素複合体I を阻害することが明らかになっています。
その結果、ミトコンドリアでのATP産生が減少し、AMP:ATPの比が上昇し、AMP活性化プロテインキナーゼ(AMPK)が活性化されます。活性化したAMPKは、肝臓の糖新生を抑制し、解糖を亢進し、骨格筋でのグルコース利用を促進して血糖を低下させます。
すなわち、メトホルミンの血糖降下作用はミトコンドリアにおけるATP産生の阻害によって体内のATP量が減少するためです。体はATPを増やすために、グルコースの分解(異化)を促進し、糖新生(同化)を抑制するので、血糖が低下します。
最近の研究では、メトホルミンはミトコンドリアのグリセロールリン酸脱水素酵素(mitochondrial glycerol-phosphate dehydrogenase: mGDP)を阻害することも報告されています。(下図)

図:メトホルミンは有機カチオン輸送体1(organic cation transporter 1 :OCT1)によって細胞内に入り、ミトコンドリアに集積する。ミトコンドリアでは呼吸酵素複合体IとmGDP(ミトコンドリア・グリセロールリン酸脱水素酵素)を阻害してNADH酸化を阻害し、ミトコンドリアでのATP産生が低下する。その結果、AMP活性化プロテインキナーゼ(AMP)シグナル伝達系を亢進し、cAMP/PKAシグナル伝達系を抑制し、糖新生を抑制し、解糖を亢進する。(参考:BMC Biol. 2014; 12: 82.)
【AMPKは細胞内のエネルギーセンサー】
メトホルミンの薬効のメカニズムは多彩ですが、最も重要なメカニズムはAMP活性化プロテインキナーゼ(AMP-activated protein kinase:AMPK)の活性化です。
AMPKは人から酵母まで真核細胞に高度に保存されているセリン/スレオニンキナーゼ(セリン/スレオニンリン酸化酵素)の一種です。
AMPKは細胞内のエネルギーのセンサーとして重要な役割を担っています。
AMPKは低グルコースや低酸素や虚血など細胞のATP供給が枯渇する状況に応答して活性化されます。活性化の機序は下図に示します。

図:AMP活性化プロテインキナーゼ(AMPK)は低グルコースや低酸素や虚血など細胞のATP供給が枯渇させるようなストレスに応答して活性化される(①)。AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在する(②)。γサブユニットにはATPが結合しているが、ATPが枯渇してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置き換わる(③)。その結果、アロステリック効果(酵素の立体構造が変化すること)によってこの複合体は中等度(2~10倍程度)に活性化され、上流に位置する主要なAMPKキナーゼであるLKB1に対して親和性が高くなり、LKB1によってαサブユニットのスレオニン-172(Thr-172)がリン酸化されると、酵素活性は最大に活性化される(④)。mTORC1(哺乳類ラパマイシン標的タンパク質複合体1)は細胞の分裂や生存を促進する(⑤)。 活性化されたAMPKはmTORC1活性を抑制する(⑥)。メトホルミンはミトコンドリアの呼吸酵素複合体Iを阻害してATP産生を低下させ、AMP/ATP比を高める作用とLKB1を活性化する作用によってAMPKを活性化して抗がん作用を発揮する(⑦)。
細胞内ATPの減少を感知して活性化したAMPKは、異化の亢進(ATP産生の促進)と同化の抑制(ATP消費の抑制)を誘導し、ATPのレベルを回復させる作用があります。すなわち、AMPKが活性化すると糖や脂肪や蛋白質の合成は抑制され、一方、糖や脂肪や蛋白質の分解(異化)が亢進してATPが産生されます(下図)。物質合成が抑制されることは細胞の増殖が抑制されることになります。

図: AMPKはATPの減少を感知して活性化され、物質合成(同化)とATP消費を抑制し、ATP産生を亢進して、細胞内ATP量を増やす作用がある。物質合成が抑制されるので、がん細胞の増殖も抑制される。
【メトホルミンは乳がん細胞の増殖活性を低下させる】
メトホルミンは単独で乳がんに対して抗がん作用を示します。以下のような報告があります。
Metformin in early breast cancer: a prospective window of opportunity neoadjuvant study. (早期乳がんにおけるメトホルミン:好機術前補助療法の前向き試験) Breast Cancer Res Treat. 135(3):821-30. 2012
【要旨の抜粋】
メトホルミンはインスリン介在性の直接作用あるいはインスリンとは関連しない間接作用によって抗がん作用を示す。我々は、手術可能な乳がん患者を対象に、手術前の限られた期間にメトホルミンを投与する術前化学療法の効果について検討した。
新たに診断された治療をまだ受けていない、糖尿病でない乳がん患者に、確定診断のための針生検の後から手術の直前までメトホルミンを1日1500mg(500mg x 3回/日)投与した。
39名の乳がん患者がこの研究に参加した。平均年齢は51歳で、メトホルミンを服用した期間は13日~40日で中央値は18日であった。手術前日の夜間まで服用した。
中等度の自制できる吐き気(50%)、下痢(50%)、食欲不振(41%)、腹部膨満(32%)の副作用をそれぞれ括弧内の率で認めたが、生活の質(QOL)を評価するEORTC30-QLQ function scalesでは有意な低下は認めなかった。
がん組織におけるKi67染色スコア(細胞増殖の割合)は 36.5 から 33.5 %(p = 0.016) に有意に減少し、 TUNEL 染色(アポトーシスを起こしている細胞)は0.56 から1.05( p = 0.004)に有意に増加した。手術前の短期間のメトホルミン投与は忍容性が高く、抗がん作用と一致する臨床所見とがん組織の変化を示した。生存期間のような臨床的エンドポイントを用いて適切な臨床試験を実施し、メトホルミンの抗がん作用に関する臨床的妥当性の評価が必要である。
この論文では、乳がんの診断が確定してから実際に手術が行われるまでの限られた機会を利用して、メトホルミンの術前化学療法としての効果を評価する前向き試験を行っています。
メトホルミンを1日1500mg(1回500mgを3回)投与しています。投与期間は中央値が18日(13~40日)と比較的短期間の投与ですが、臨床症状や血液検査で、抗がん作用を示唆する結果が得られています。
メトホルミンは2型糖尿病の治療薬ですが、インスリンの分泌を促進するのではなく、細胞のインスリン感受性を高める(インスリン抵抗性を改善する)作用なので、糖尿病でなくても血糖を下げ過ぎることは無いので、糖尿病が無い人に対して1日1500mgの投与でも問題ないようです。
【メトホルミンはがん幹細胞をターゲットにする】
メトホルミンは抗がん剤治療の効き目を高めることが複数の研究で示されています。特にがん幹細胞の抗がん剤感受性を高めることが報告されています。以下のような報告があります。
Metformin selectively targets cancer stem cells, and acts together with chemotherapy to block tumor growth and prolong remission(メトホルミンはがん幹細胞を選択的にターゲットにして、抗がん剤治療と併用することによって腫瘍の増殖を阻止し、寛解期間を延長する)Cancer Res. 2009 Oct 1; 69(19): 7507–7511.
【要旨】
腫瘍組織中の多くのがん細胞と異なり、がん幹細胞は抗がん剤治療に抵抗性を示し、再発の原因となっている。したがって、がん幹細胞を選択的に死滅させる治療法は、特に抗がん剤治療との併用において有効な手段となる。
この研究報告において我々は、糖尿病治療薬のメトホルミンの低用量の投与が、がん幹細胞を選択的に死滅させることを、4種類の異なる乳がん細胞株で明らかにした。
培養細胞を使った実験で、メトホルミンと抗がん剤のドキソルビシンの併用は、がん幹細胞と通常のがん細胞(非幹細胞)の両者を死滅した。
さらにマウスに乳がん細胞を移植する実験モデルで、それぞれを単独で投与した場合と比べて、この併用療法は腫瘍の増大と再発を顕著に抑制した。
メトホルミンとドキソルビシンの併用投与を中止したあと、2ヶ月以上の間、腫瘍の再発を認めなかった。
これらの実験結果は、抗がん剤治療とメトホルミンの併用療法が、乳がん(そして多分、他のがん)の患者の治療効果を高める効果を示唆している。
がん幹細胞は腫瘍始原細胞とも呼ばれ、がん細胞を生み出すもとになる細胞であり、がん組織中に少数(数%程度)存在しています。そして、がん幹細胞は正常な組織幹細胞と同様、特別な微小環境(ニッチ)中に存在し、ニッチより分泌される液性因子などによって、多分化能の維持や分裂増殖が制御されていると考えられています。
通常の抗がん剤治療や放射線治療に対して、成熟したがん細胞は死滅しやすいのですが、がん幹細胞は様々な機序で抵抗性を示します。その結果、再発や再燃を起こします。
一方、抗がん剤や放射線治療にメトホルミンを併用すると、がん幹細胞が死滅し易くなるので、がんが消滅する可能性が高くなります。(下図)
がん幹細胞の抗がん剤感受性を高める方法としてメトホルミンの他にアルコール中毒治療薬のジスルフィラムが有効です。ジスルフィラムはがん幹細胞に過剰に発現しているアルデヒド脱水素酵素を阻害して抗がん剤感受性を高めます(543話参照)
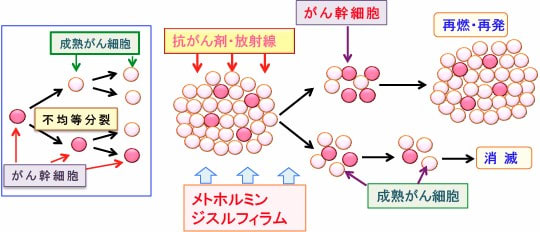
図:がん組織にはがん幹細胞が存在して、成熟がん細胞を供給しながらがん組織を構成している。がん幹細胞は自己複製を行う一方、不均等分裂により一部が自己複製のサイクルから逸脱して分化し通常のがん細胞となっている。成熟がん細胞は抗がん剤や放射線で死滅しやすいが、がん幹細胞は死滅しにくいので抗がん剤治療や放射線治療で生き残る。生き残ったがん幹細胞が増殖して再発や再燃が起こる。メトホルミンやジスルフィラムはがん幹細胞がアポトーシス抵抗性になっているメカニズムを阻害して、抗がん剤や放射線治療の効果を高めることができる。
【メトホルミンは脂肪酸合成を阻害する】
がん細胞では新規(de novo)の脂肪酸合成が亢進しています。脂肪酸には2つの大きな役割があります。細胞の周囲や内側を構成する膜の主成分となっているリン脂質をつくることと、エネルギーを圧縮して貯蔵することです。
脂肪酸は食事からも摂取されますが、細胞内でも新規に合成されています。正常細胞は食事から摂取した脂肪酸をうまく利用しますが、がん細胞は自分で新たに脂肪酸を合成する代謝が亢進しています。
がん細胞は、ミトコンドリアの活性を抑えているため、脂肪酸を分解する(β酸化でATPを産生する)活性は低下していますが、自分で新規に脂肪酸を作る代謝は亢進しています。
AMPKの活性化は、脂質合成に関与するアセチル-CoAカルボキシラーゼ(ACC)と脂肪酸合成酵素(FAS)の活性を阻害します。したがって、AMPK を活性化するメトホルミンは脂質合成を阻害できます。
アセチルCoAカルボキシラーゼ(Acetyl CoA carboxylase)はアセチルCoAと二酸化炭素の縮合反応によりマロニルCoAを生成する酵素で、脂肪酸合成の律速酵素 です。アセチルCoAカルボキシラーゼの活性阻害によって乳がん細胞や前立腺がん細胞のアポトーシスが誘導されることが報告されています。
脂肪酸合成酵素(fatty acid synthase)はアセチルCoA、マロニルCoA、NADPHの縮合反応により炭素数16個の飽和脂肪酸であるパルミチン酸を合成する酵素です。正常細胞では肝臓、脂肪組織、分泌乳腺で高い発現が見られますが、それ以外の組織ではほとんど発現していません。
肝臓と脂肪組織では、余ったエネルギーを脂肪として貯蔵する役割があり、分泌乳腺では乳汁中の脂肪を作るために発現しています。
正常細胞では発現が低いのですが、多くの種類のがん細胞で脂肪酸合成酵素の発現が亢進しています。
乳がんや前立腺がんではがん化の初期段階から過剰発現がみられ、がん遺伝子として機能しています。
以上のような新規(de novo)の脂肪酸合成に関与する酵素の活性を阻害したり抑制すると、がん細胞の増殖を抑えたり、死滅させることもできます。メトホルミンはAMPKを活性化する機序で脂肪酸合成を抑制し、がん細胞の増殖を低下させます。

図: ミトコンドリアのTCA回路で生成されたクエン酸は、細胞質でATPクエン酸リアーゼによってアセチルCoAに変換され(①)、アセチルCoAカルボキシラーゼによってマロニルCoAに変換され(②)、脂肪酸合成酵素によって脂肪酸が合成される(③)。メトホルミンはミトコンドリアの呼吸酵素を阻害する機序でATP産生を阻害してAMP/ATP比を上昇させ(④)、AMP活性化プロテインキナーゼ(AMPK)を活性化する(⑤)。活性化したAMPKはアセチルCoAカルボキシラーゼ(⑥)と脂肪酸合成酵素を阻害する(⑦)。その結果、がん細胞の増殖を抑制する。
メトホルミンによる脂肪酸合成酵素の阻害にマイクロRNAのmiRNA-193bが関与するという報告もあります。
Metformin-Induced Killing of Triple Negative Breast Cancer Cells is Mediated by Reduction in Fatty Acid Synthase via miRNA-193b(トリプルネガティブ乳がん細胞におけるメトホルミン誘導性の細胞死はmiRNA-193bを介する脂肪酸合成酵素の発現低下によって引き起こされる)Horm Cancer. 2014 Dec; 5(6): 374–389.
【要旨】
糖尿病治療薬のメトホルミンは幾つかの種類のがんの発生率と死亡率を減少させる。メトホルミンはがん幹細胞を選択的に死滅させ、トリプルネガティブ乳がん細胞株はメトホルミンの抗腫瘍活性に感受性が高いことが明らかになっている。しかしながら、メトホルミンに対するトリプルネガティブ乳がん細胞の感受性亢進のメカニズムに関しては明らかになっていない。
メトホルミンを投与されたトリプルネガティブ乳がん細胞の遺伝子発現パターンの解析で、メトホルミン投与24時間後に最も発現が減少する遺伝子の一つに脂肪酸合成酵素が同定された。
脂肪酸合成酵素は新規の脂肪酸合成に重要は役割を担っており、トリプルネガティブ乳がん細胞の生存にも重要であるので、我々は、脂肪酸合成酵素の発現抑制がメトホルミン誘導性アポトーシスを促進していると推測した。
メトホルミン誘導性のマイクロRNAのmiR-193ファミリーメンバーの増加と、miR-193bが脂肪酸合成酵素遺伝子(FASN)の3’非翻訳領域に結合することが明らかになった。
トリプルネガティブ乳がん細胞にmiR-193bを外来性に添加すると、脂肪酸合成酵素の発現が減少し、アポトーシスが亢進した。しかし、非腫瘍細胞は影響を受けなかった。
一方、miR-193の活性を阻害すると、メトホルミンは脂肪酸合成酵素の発現を減少させることもアポトーシスを誘導することもできなかった。
さらに、メトホルミンによるmiR-193の増量は、トリプルネガティブ乳がん細胞株の腫瘍塊形成を減少させた。
これらの実験結果は、メトホルミンによるトリプルネガティブ乳がん細胞の細胞死誘導のメカニズムの解明に役立つ。
マイクロRNAs(miRNAs)は,ゲノム上にコードされた約22塩基の非常に小さいノンコーディングRNA で, mRNA の翻訳(タンパク質の合成)を転写後レベルで抑制して、mRNAの転写後翻訳レベルでの遺伝子発現制御を担っています。
この論文では、miR-193bが脂肪酸合成酵素遺伝子(FASN)の3’非翻訳領域に結合して脂肪酸合成酵素の発現を抑制することを報告しています。
そして、miR-193bの活性を阻害すると、メトホルミンは脂肪酸合成酵素の発現を減少させることもアポトーシスを誘導することもできなかったことから、メトホルミンはmiR-193bの発現量を増やすことによって脂肪酸合成酵素の発現を抑制するという結論です。
がん細胞は新規の脂肪酸合成が阻害されると細胞を増やすことはできません。脂肪酸合成酵素の阻害剤はがん治療のターゲットとして注目されています。
メトホルミンの抗がん作用のメカニズムとして脂肪酸合成を阻害する作用が重要なようです。
メトホルミンはがん幹細胞に有効で、トリプルネガティブ乳がん細胞はがん幹細胞の性質を持ったがん細胞が多いと言われています。したがって、トリプルネガティブ乳がんにメトホルミンを利用する価値はあるように思います。
【メトホルミンの抗腫瘍活性はグルコース摂取を減らすと増強できる】
メトホルミンの抗腫瘍作用の最も重要なメカニズムはミトコンドリアの酸素呼吸を阻害してATP産生を低下させることです。
しかし、ミトコンドリアでのATP産生を抑制しても、グルコースの取込みが十分にあれば、がん細胞は解糖系だけでATPを賄うことができます。がん細胞は解糖系で細胞が必要とするATPを産生できます。

図:がん細胞ではグルコースの取り込みと解糖系が亢進し、ミトコンドリアでの酸素呼吸(酸化的リン酸化)は抑制されている。そのレベルはがん細胞によって異なるが、一つの平均的な数値として、正常細胞のグルコースの取込み量を1とした相対値を記載している。正常細胞では取り込まれたグルコースの8割くらいがミトコンドリアでの代謝に使われている(上図)。がん細胞でもミトコンドリアでの代謝は同程度に起こっているが、グルコースの取込みは10倍程度に亢進し、その多くは解糖系で代謝され、乳酸の産生が顕著に増えている(下図)。(参考:Free Radic Biol Med 2015 Feb; 0: 253-263)
つまり、がん細胞にメトホルミンを投与しても、グルコースが十分に供給されていれば、抗腫瘍効果は期待できません。メトホルミンの抗腫瘍効果はグルコースの利用を阻止すると増強することが明らかになっています。以下のような論文があります。
Mechanisms by which low glucose enhances the cytotoxicity of metformin to cancer cells both in vitro and in vivo.(培養細胞および生体内におけるがん細胞に対するメトホルミンの細胞毒性が低グルコースによって増強されるメカニズム)PLoS One. 2014 Sep 25;9(9):e108444. doi: 10.1371/journal.pone.0108444. eCollection 2014.
【要旨の抜粋】
がん細胞に対するメトホルミンの毒性は細胞の種類によって感受性が異なる。その一つの理由は、細胞を培養するときの培養液に高濃度のグルコースが添加されているためであり、グルコースの濃度が低い条件では、多くのがん細胞に対してメトホルミンの細胞毒性は増強されることが最近の研究で明らかになっている。
0から5mMの低グルコース濃度の条件では、メトホルミンは乳がん細胞株のMCF7とMDAMB231とSKBR3、卵巣がん細胞株のOVCAR3とPA-1に対して細胞毒性を示した。
高濃度のグルコースを含有する通常の培養液での検討では、MDAMB231とSKBR3細胞はメトホルミンの細胞毒性に抵抗性を示す。培養液のグルコース濃度を10mM以上にすると、全ての培養細胞株はメトホルミンの細胞毒性に対して抵抗性になった。
培養液の糖の濃度が低グルコース(2.5mM)の条件では、メトホルミンの添加によってATP産生は顕著に減少した。しかし高グルコース(25mM)の培養液ではATP産生の減少は認めなかった。
4T1乳がん細胞をマウスに移植するin vivoの動物実験系を使った研究で、低糖質のケトン食を与えて血中グルコースのレベルを低下させると、メトホルミンによる腫瘍増殖の抑制効果は増強された。
以上の結果は、グルコースの利用を抑制する条件下ではメトホルミンのATP産生抑制と生存シグナル伝達系の阻害効果画が増強することを示している。
25mMというのは450mg/dLです。正常な血糖のレベルは4~6mM(72–108 mg/dL)です。
高血糖という条件だけで、がん細胞の増殖経路は活性化されます。
メトホルミンでミトコンドリアでのATP産生を阻害すると、がん細胞の解糖系が亢進して、解糖系でのATP産生が増えて代償しようとします。したがって、グルコースの取込みや解糖系を阻害する方法を併用するとメトホルミンの抗腫瘍活性を増強できます。
がん細胞のグルコース取り込みや利用を阻止する方法として、ケトン食や2-デオキシ-D-グルコースが有効です。
【2-デオキシ-D-グルコースとメトホルミンの相乗効果】
2-デオキシ-D-グルコース(2-Deoxy-D-glucose:2-DG)は、グルコース(ブドウ糖)の2-ヒドロキシル基が水素原子に置換された物質(グルコース誘導体)です。

図:2-デオキシ-D-グルコース(2-DG)はグルコース・トランスポーター(GLUT1)によって細胞内に取り込まれる。がん細胞はGLUT1の発現量が増え、グルコースと同時に2-DGも多く取り込む。2-DGはヘキソキナーゼで2-DG-6-リン酸(2-DG-6-PO4)に変換されるが、それ以上代謝されない。がん細胞はフォスファターゼの活性が低いので、2-DG-6-リン酸ががん細胞内に蓄積する。2-DG-6-リン酸はヘキソキナーゼをフィードバック阻害(アロステリック阻害)するので、 2-DG-6-リン酸を取り込んだがん細胞はグルコースの解糖系での代謝が阻害される。その結果、がん細胞のエネルギー産生と物質合成は阻害されることになる
2-DGはグルコース(ブドウ糖)と同じグルコース輸送担体(グルコース・トランスポーター)のGLUT1を利用して細胞内に取り込まれ、解糖系の最初のステップのヘキソキナーゼによって2-DG-6リン酸に変換されます。
リン酸化されて2-DG-6リン酸になるとGLUT1を通過できなくなり、2-DG-6リン酸はその次の解糖系酵素では代謝できないため細胞内でどんどん蓄積します。
2-DG-6リン酸はヘキソキナーゼを阻害するので、正常のグルコースの代謝も阻害されます。
2-DGを取り込んでエネルギー産生が低下するとそのストレス応答によってグルコーストランスポーター(GLUT1)の発現がさらに増え、2-DGの取り込みをさらに増やすことになります。したがって、がん細胞には正常細胞に比べてより多くの2-DGが取込まれ、エネルギー産生と物質合成の阻害による影響はがん細胞で大きくなります。
つまり、糖質制限やケトン食のときに2-DGを併用すると、2-DGが優先的にがん細胞に取り込まれ、「トロイの木馬」のようにがん細胞の中に入って、解糖系やペントース・リン酸経路を阻害して、がん細胞を内部から崩壊させることができるのです。
2-DGががん細胞の増殖を抑制する効果が最初に指摘されたのは1950年代です。「細胞のエネルギー源であるグルコースの誘導体を取り込ませれば、がん細胞の増殖を抑制できる」というアイデアは、もう60年も前に研究されており、グルコースの誘導体の抗腫瘍活性が検討され、2-DGに強い抗腫瘍効果があることが証明されています。
2-デオキシ-D-グルコースは解糖系を阻害することによってATP産生を阻害します。経口糖尿病薬のメトホルミンはミトコンドリアの呼吸酵素を阻害してATPの産生を阻害します。
がん細胞のエネルギー産生経路を2-デオキシ-D-グルコースとメトホルミンで二重阻害すると抗腫瘍効果が増強することがマウスを使った移植腫瘍の実験で示されています。以下のような報告があります。
Dual inhibition of Tumor Energy Pathway by 2-deoxy glucose and metformin Is Effective Against a Broad Spectrum of Preclinical Cancer Models(2-デオキシグルコースとメトホルミンによる腫瘍細胞のエネルギー産生経路の2重の阻害は、多くの前臨床の動物実験モデルにおいて効果がある) Mol Cancer Ther. 10(12): 2350-2362, 2011年
この論文では、様々な種類のがん細胞をマウスに移植した実験モデルを用いて、2-デオキシグルコース(2-DG)とメトホルミンを同時に投与すると、抗腫瘍効果が相乗的に高まることを報告しています。
2-DGとメトホルミンはそれぞれ単独では抗腫瘍効果は強くはありませんが、併用すると強い抗腫瘍効果が得られるという結果です。
培養がん細胞を用いた実験では、2-DGで解糖系を阻害しても、がん細胞を死滅させるだけの効果はありませんが、メトホルミンを同時に投与すると、がん細胞は死滅しました。
マウスの移植腫瘍の実験系でも、2-DGとメトホルミンを同時に投与すると、がん組織が著明に縮小しました。
メトホルミンはミトコンドリアの呼吸鎖(電子伝達系)を阻害してATP産生を阻害する作用がありますが、さらにAMP活性化プロテインキナーゼ(AMPK)を活性化してmTORC1(哺乳類ラパマイシン標的蛋白質複合体-1)の活性を阻害することによってがん細胞の増殖を阻害します。
一方、2-DGはグルコースの解糖系とペントース・リン酸経路での代謝を阻害することによって、エネルギー産生と物質合成を抑制し、その結果、がん細胞の増殖が抑えられます。
すなわち、2-DGとメトホルミンの同時投与は、がん細胞のエネルギー産生と物質合成と増殖シグナル伝達を効率的に阻害することによって、がん細胞の増殖を阻害することができるのです。最近、以下のような報告があります。
Co-treatment of breast cancer cells with pharmacologic doses of 2-deoxy-D-glucose and metformin: Starving tumors.(薬理学的用量の2-デオキシ-D-グルコースとメトホルミンによる乳がん細胞の併用治療:がん細胞の飢餓)Oncol Rep. 2017 Apr;37(4):2418-2424.
【要旨】
がん細胞のエネルギー産生の特徴は、好気性解糖である。従って、解糖の阻害は、がん細胞に選択的な治療法となる。
解糖系を阻害する2-デオキシ-D-グルコース(2DG)は、多くのがん細胞においてアポトーシス(細胞死)を誘導することが示されている。さらに、糖尿病治療薬のメトホルミンの抗腫瘍活性が実証されている。
本研究では、2DGとメトホルミンの薬理学的用量の組み合わせが抗腫瘍効果を高めるかどうかを確認することを目的とした。
トリプルネガティブ乳がん(TNBC)細胞のMDA-MB-231およびHCC1806細胞を用いて、2DGとメトホルミンのそれぞれ単独の投与と併用投与の場合の細胞生存率を測定した。
アポトーシスの誘導は、ミトコンドリア膜電位の低下およびPARP(ポリADPリボースポリメラーゼ)の切断の測定によって定量した。
2DGまたはメトホルミンによる乳がん細胞の治療は、細胞生存率の有意な低下およびアポトーシスの増加をもたらした。
2DGとメトホルミンを同時に投与すると、それぞれ単一で投与した場合と比較して、生存率が有意に低下した。この生存率の低下は、アポトーシスの誘導によるものであった。
さらに、アポトーシス誘導に関しては、単剤で投与した場合と比較して、併用投与はより強い誘導効果を示した。
ヒト乳がん細胞の解糖系亢進は、治療のターゲットになりうる。解糖系阻害剤の2DGおよび糖尿病治療薬のメトホルミンの併用投与は副作用が少なく、乳がんに対する適切な治療法になるかもしれない。
トリプルネガティブ乳がんに対してメトホルミンと2-デオキシ-D-グルコースの併用が抗腫瘍効果を高めることは他にも多数の論文があり、最近増えています。がん細胞では解糖系が亢進しているので、メトホルミンだけでは抗腫瘍効果が十分に得られないことが分ってきたからです。
メトホルミンをがん治療に使うときには、がん細胞の解糖系を阻害する方法を併用することが重要と言えます。
【トリプル・ネガティブ乳がん細胞は解糖系の亢進が強い】
トリプルネガティブ乳がん細胞では、特に解糖系が亢進していることが報告されています。以下のような報告があります。
Mitochondrial dysfunction in some triple-negative breast cancer cell lines: role of mTOR pathway and therapeutic potential(幾つかのトリプル・ネガティブ乳がん細胞株におけるミトコンドリア機能異常:mTOR経路の役割と治療への応用)Breast Cancer Res. 2014; 16: 434.
【要旨】
イントロダクション:トリプル・ネガティブ乳がんは悪性度が高い乳がんのサプタイプで予後は不良である。トリプル・ネガティブ乳がんにはホルモン療法は無効であり、通常の抗がん剤治療にも抵抗性を示す。したがって、トリプル・ネガティブ乳がん細胞の生物学的特徴をさらに解明し、有効な治療法を開発することが緊急の課題になっている。
方法:まず最初に、トリプル・ネガティブ乳がん細胞の代謝の特徴を、他のサブタイプの乳がん細胞と比較した。代謝における違いをターゲットにした特殊な阻害剤およびsiRNA(低分子干渉RNA)を用いることによって、他のサブタイプの乳がん細胞よりトリプル・ネガティブ乳がん細胞をより死滅できることを示した。
結果:エストロゲン受容体陽性細胞と比べて、トリプル・ネガティブ乳がん細胞では、グルコースの取込みと乳酸産生がより亢進し、ミトコンドリアでの酸化的リン酸化が低下していた。トリプル・ネガティブ乳がん細胞における酸化的リン酸化の低下は解糖系への依存を強め、したがって、解糖系の阻害はトリプル・ネガティブ乳がん細胞の治療において有効性が高いことが示唆された。
結論:我々の研究結果は、他のサブタイプの乳がん細胞に比べて、トリプル・ネガティブ乳がん細胞ではミトコンドリアにおける酸素呼吸がより低下し、解糖系がより亢進するというと代謝の特徴を示すことを明らかにした。トリプル・ネガティブ乳がん細胞ではミトコンドリア機能が低下しているので、解糖系の阻害に感受性が高く、解糖系を阻害する治療法が有効である可能性を示している。
エストロゲン受容体陽性乳がん細胞に比べて、トリプル・ネガティブ乳がん細胞はグルコース取り込みと解糖系亢進が強いという結果です。したがって、トリプル・ネガティブ乳がん細胞のグルコース取り込みと解糖系を阻害する治療法は有効性が高いことが示唆されます。
グルコース取り込みと解糖系を阻害する治療法としては、前述のようにケトン食と2-デオキシ-D-グルコースがあります。
解糖系が亢進すると乳酸の産生が増えます。乳酸脱水素酵素(LDH)の発現が多いほど、解糖系の亢進を意味します。以下のような報告があります
Tumor LDH-A expression and serum LDH status are two metabolic predictors for triple negative breast cancer brain metastasis.(腫瘍の乳酸脱水素酵素Aの発現と血清中の乳酸脱水素酵素の値はトリプルネガティブ乳がん細胞の脳転移を予測する代謝指標である)Sci Rep. 2017 Jul 20;7(1):6069.
【要旨】
トリプル・ネガティブ乳がんに対する治療法は限られており、進行して脳転移も多く、末期状態に移行しやすい。原発巣も脳転移巣もともに解糖系の亢進が強いので、解糖系の最後のステップである乳酸脱水素酵素(lactate dehydrogenase:LDH)の発現量は脳転移を予測する因子であり、治療のターゲットにもなるという仮説のもとに実験を行った。
119例のトリプル・ネガティブ乳がんの組織サンプルのLDH-Aの発現量を測定し、さらに血清中のLDH濃度を測定した。
トリプル・ネガティブ乳がんの組織中のLDH-Aの発現量は正常乳腺組織に比べて顕著に亢進していた。
腫瘍組織内のLDH-A発現レベルと血清中のLDH値は、トリプル・ネガティブ乳がん患者の脳転移の発生と関連を認めた。
この研究は、腫瘍組織のLDHの発現量と血清中のLDHの値はトリプルネガティブ乳がんの脳転移を予測する因子となることが示された。
がん細胞では乳酸脱水素酵素A(LDH-A)の発現と活性が亢進しています。
細胞内に取り込まれたグルコースは、解糖系で代謝されてピルビン酸まで分解されます。その後、正常細胞では、酸素が使える状況ではピルビン酸はミトコンドリアに入り、ピルビン酸脱水素酵素によってアセチルCoAに変換されてTCA回路でさらに代謝されます。低酸素の状況では、ピルビン酸は細胞質で乳酸脱水素酵素(LDH)によって乳酸に変換されます。
一方がん細胞では、酸素が十分に使える状況でも、ミトコンドリアでの酸素呼吸(酸化的リン酸化)が抑制されており、ピルビン酸はミトコンドリアに入らずに、細胞質内の乳酸脱水素酵素によって乳酸に変換されます。
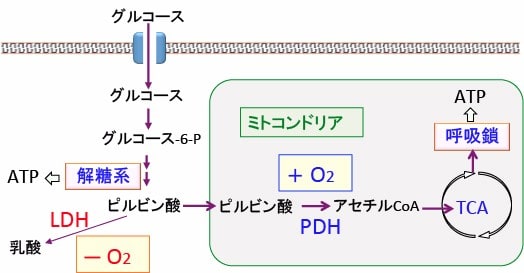
図:グルコースが解糖系でピルビン酸まで分解されたあと、酸素があればミトコンドリアでピルビン酸脱水素酵素(Pyruvate Dehydrogenase; PDH)によってアセチルCoAに変換されてTCA回路でさらに代謝され、電子伝達系(呼吸鎖)でATPが産生される。酸素が無い条件では、ピルビン酸は乳酸脱水素酵素(Lactate Dehydrogenase; LDH)によって乳酸に変換される。がん細胞では、LDHの活性が亢進し、PDHの活性は抑制されており、酸素が十分に使える状況でも、ミトコンドリアでの酸素呼吸(酸化的リン酸化)は抑制され、乳酸産生が亢進している。
LDHにはLDH-AとLDH-Bの2つのサブタイプがあります。
LDH-Aは骨格筋タイプあるいはLDH-Mとも言い、ピルビン酸から乳酸の変換に適しています。骨格筋では通常は有酸素でミトコンドリアでの代謝が中心ですが、短距離ダッシュのような無酸素での運動では骨格筋で嫌気性解糖によるエネルギー産生が起こるのでLDH-Aが必要になります。
一方、LDH-Bは心臓タイプあるいはLDH-Hとも言い、乳酸からピルビン酸の変換に適しています。心臓では、血中の乳酸もエネルギー源に利用するので、乳酸からピルビン酸に変換するLDH-Bが必要になります。

図:乳酸脱水素酵素(LDH)はピルビン酸から乳酸への変換を促進するLDH-Aと、乳酸からピルビン酸への変換を促進するLDH-Bの2つのタイプがある。がん細胞ではLDH-Aの発現と活性が亢進している。
LDH-Aはがん治療のターゲットになります。それは好気性解糖(ワールブルグ効果)が亢進しているがん細胞ではLDH-Aの発現が亢進しているのに対して、正常細胞では骨格筋にしか発現していないためです。
LDH-Aは骨格筋で嫌気性解糖を行うときしか必要ないので、短距離ダッシュのように無酸素の運動をしなければ、LDH-Aは正常細胞では無くても構わないと言えます。実際にLDH-Aの遺伝子が欠損していても、大した異常は起こらないことが報告されています。
多くのがん細胞でLDH-Aの発現亢進が認められています。LDH-Aは低酸素誘導因子-1(HIF-1)によって発現が誘導されます。がん細胞ではHIF-1の発現が亢進しており、LDH-Aの発現が亢進しています。
LDH-A(乳酸脱水素酵素A)は正常細胞の働きには必要性は低いので、LDH-Aの発現や活性を阻害することはがん治療のターゲットとして有望と考えられています。
ジクロフェナクは商品名がボルタレンというポピュラーな消炎鎮痛剤ですが、LDH-Aをターゲットにして解糖系を阻害する作用が報告されています。(541話参照)
さらにLDHは低酸素誘導因子-1(HIF-1)によって発現が誘導されるので、低酸素誘導因子-1(HIF-1)の発現や活性を抑制するラパマイシン、ジインドリルメタン、ヘキソキナーゼ活性を阻害する2-デオキシグルコースなどを併用してがん細胞の解糖系を阻害する方法を組み合せると抗腫瘍活性を高めることができます。
低酸素誘導性因子-1(HIF-1)の活性を抑制する方法に関しては364話でまとめています。
以上のように、トリプルネガティブ乳がんでは、解糖系とミトコンドリアの酸素呼吸を同時に阻害することが重要です。
この目的で、メトホルミンと2-デオキシ-D-グルコースとジクロフェナクとケトン食の併用は有効です。
さらに、高濃度ビタミンC点滴と抗生物質のドキシサイクリンの併用も有効です。(559話参照)
つまり、メトホルミン+2-デオキシ-D-グルコース+ジクロフェナク(ボルタレン)+ドキシサイクリン+高濃度ビタミンC点滴+ケトン食はがん細胞に選択的にATPを枯渇させる方法になります。
同時に、がん細胞の酸化ストレスを高めるジクロロ酢酸、オーラノフィン、ジスルフィラム、アルテスネイト、半枝蓮の併用は抗腫瘍効果を増強します。
正常細胞も解糖系とミトコンドリアの酸素呼吸が同時に阻害されると生きていけません。しかし、グルコーストランスポーターの発現が増えてグルコースの取込みと解糖系が亢進しているがん細胞のエネルギー産生の特徴を利用すると、がん細胞に選択的にエネルギー枯渇を起こせます。
抗がん剤耐性が強いトリプル・ネガティブ乳がんを高用量の抗がん剤投与だけで治療しても勝てるわけがありません。最大耐用量の抗がん剤治療は抗がん剤耐性のがん細胞を増やす作用があるからです(553話参照)。
トリプル・ネガティブ乳がんは解糖系依存が強いことが知られているので、代謝とがん幹細胞をターゲットにした治療の併用が重要だと思います。
トリプル・ネガティブ乳がんの補完・代替医療については以下のサイトでまとめています。
http://www.f-gtc.or.jp/TNBC/Triple_Negative_Breast_Cancer.html
画像をクリックするとサイトに移行します。
| « 560)mTORC1活... | 562)トリプル... » |





