がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
562)トリプル・ネガティブ乳がんに対するカンナビジオール(CBD)の抗がん作用
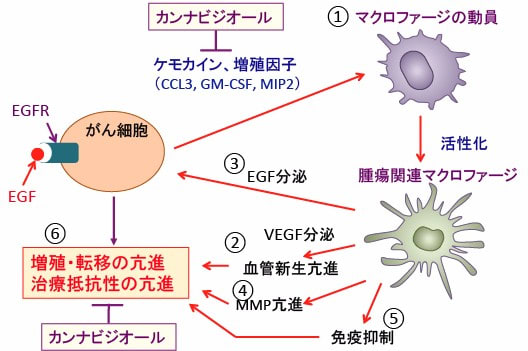
図:がん細胞から分泌されるケモカインや増殖因子はマクロファージをがん組織に動員する(①)。活性化した腫瘍関連マクロファージは血管内皮増殖因子(VEGF)などを産生して血管新生を亢進する(②)。さらに、上皮成長因子(EGF)などの増殖因子を産生してがん細胞の増殖を亢進する(③)。さらに、MMP(matrix metalloproteinase)やEGFの産生を促進してがん細胞の浸潤性を高める(④)。活性化したマクロファージから産生されるプロスタグランジンE2や炎症性サイトカインはががん細胞に対する抗腫瘍免疫を抑制する(⑤)。このようにして、腫瘍関連マクロファージはがん細胞の増殖・転移・治療抵抗性を促進する(⑥)。カンナビジオールはこれらの経路を抑制する。
562)トリプル・ネガティブ乳がんに対するカンナビジオール(CBD)の抗がん作用
【カンナビジオールはトリプル・ネガティブ乳がんの増殖を阻止する】
大麻(Cannabis sativa)の成分として、現在までに500を超える化合物が分離・同定されています。これらの大麻成分の中に「カンナビノイド」と総称される化合物があります。カンナビノイドは大麻草固有の成分で、他の植物には見つかっていません。
カンナビノイドには、Δ9-テトラヒドロカンナビノール(THC)、カンナビジオール(CBD)、テトラヒドロカンナビヴァリン、カンナビゲロール、カンナビクロメンなど100種類以上が見つかっています。
カンナビジオール(CBD)はΔ9-テトラヒドロカンナビノール(THC)と並んで大麻の主要なカンナビノイドです。
CBDはカンナビノイド受容体のCB1とCB2には作用しないためTHCのような精神作用はありません。その他の受容体(セロトニン受容体の5-HT1Aなど)やイオンチャネル(TRPV1など)に作用して多彩な作用を発揮します(下図)。

図:カンナビジオールは様々な受容体に作用して、その働きに影響する。図内の(+)はその受容体にアゴニスト(作動薬)として作用して受容体を刺激する。(−)は拮抗的あるいは阻害的に作用してその受容体の働きを抑制する。内因性カンナビノイドの受容体であるCB1/CB2のアゴニスト(作動薬)に対してカンナビジオールは拮抗作用を示す。さらに、カンナビジオールはCB1とCB2に対して逆アゴニストとして働き、CB1/CB2受容体の働きを阻害する。カンナビジオールはセロトニン受容体の5-HT1A受容体とTRPV1-2バニロイド受容体を活性化する。その他にも様々な受容体やタンパク質と作用して活性化や阻害の作用を示し、これらの総合的な作用によって多彩なメカニズムで抗がん作用を発揮する。(図はBr J Clin Pharmacol 75(2):303-312, 2012年のFigure 2より改変)
カンナビジオールは乳がん細胞の増殖を抑制することが報告されています。特にトリプル・ネガティブ乳がんに効くという報告があります。以下のような報告があります。
Modulation of the tumor microenvironment and inhibition of EGF/EGFR pathway: Novel anti‐tumor mechanisms of Cannabidiol in breast cancer(腫瘍の微小環境の制御とEGF/EGF受容体経路の阻害:乳がんに対するカンナビジオールの新規の抗腫瘍効果のメカニズム)Mol Oncol. 2015 Apr;9(4):906-19.
【要旨】
精神作用のないカンナビノイドの一種であるカンナビジオールの抗腫瘍効果とそのメカニズムに関しては十分に解明されておらず、特にトリプル・ネガティブ乳がんに対する作用についてはほとんど検討されていない。
この研究では、トリプル・ネガティブ乳がん細胞を含めて高度に増殖活性と悪性度の高い乳がん細胞株を用いて、カンナビジオールの抗腫瘍活性を検討した。
我々はこの研究で初めて、乳がん細胞における上皮成長因子(EGF)誘導性の増殖と移動をカンナビジオールが有意に阻害することを明らかにした。
カンナビジオールは、EGFRとERKとAKTとNF-κBシグナル伝達系のEGF誘導性の活性化を阻害し、MMP2とMMP9のEGF誘導性の分泌を阻害した。
さらに、マウスを使った複数の実験系で、カンナビジオールは腫瘍の増大と転移を阻害した。
分子メカニズムの解析によって、原発巣の腫瘍間質や肺転移巣における腫瘍関連マクロファージの動員をカンナビジオールが顕著に阻害することを示した。
培養細胞を使った実験では、カンナビジオールを投与した乳がん細胞の培養液は、マクロファージ細胞(RAW 264.7)の移動を低下させた。 カンナビジオールで処理した乳がん細胞を培養した後の培養液では、マクロファージの動員と活性化に重要な役割を果たすGM-CSFとCCL3サイトカインの濃度の低下を認めた。
以上をまとめると、CBDはEGF/EGR受容体シグナル伝達系と腫瘍組織の微小環境を制御するという新規のメカニズムによって乳がん細胞の増殖と転移を阻害することを初めて示した。
これらの結果は、治療法が限られ、予後が不良なトリプル・ネガティブ乳がんを含めて、悪性度の高い乳がんサブタイプの増殖と転移を阻止する新規の治療法としてカンナビジオールが使用できる可能性を示している。
血中を循環する単球は、皮膚などの末梢組織に入るとマクロファージとよばれる細胞に分化します。
がん組織に浸潤したマクロファージを腫瘍関連マクロファージ(tumor-associated macrophage;TAM)と言い、血管新生、増殖因子産生、免疫抑制、転移促進などのさまざまな機能により発がん・悪性化を促進する働きをしています。
以前は、マクロファージが活性化するとがん細胞を攻撃してくれると考えられていたのですが、むしろ逆で、腫瘍内にマクロファージの数が多いほど予後が悪いことが報告されています。
活性化したマクロファージから産生されるプロスタグランジンE2や炎症性サイトカインはがん細胞を悪化させ、抗腫瘍免疫を抑制してがん細胞の増殖を促進し、転移や再発を促進することが明らかになっています。

図:シクロオキシゲナーゼ-2(COX-2)とシグナル伝達兼転写活性化因子3(Signal transducer and activator of transcription 3 :STAT3)はマクロファージを活性化する(①)。活性化した腫瘍関連マクロファージはVEGF, FGF-2, IL-1, IL-8を産生して血管新生を亢進する(②)。さらに、EGF, FGF-2, IL-6, TGF-β, PDGFを産生してがん細胞の増殖を亢進する(③)。さらに、がん細胞と融合したり、EGF, IL-6, IL-8を産生して、がん幹細胞の性状をがん細胞に獲得させる(④)。さらにMMPs(matrix metalloproteinase)やEGFの産生を促進してがん細胞の浸潤性を高める(⑤)。このようにして、腫瘍関連マクロファージはがん細胞の増殖、転移、治療抵抗性、再発を促進する。(参考:J Zhejiang Univ Sci B. 15(1): 1–15. 2014年, Fig.1)
この論文では、乳がん細胞がGM-CSF(顆粒球・マクロファージコロニー刺激因子)やケモカインのCCL3を産生して腫瘍関連マクロファージをがん組織内に動員するのをカンナビジオールが抑制する作用を指摘しています。
カンナビジオールはこのようながん細胞の増殖を促進するような微小環境を変えて、がん細胞の増殖や悪性進展を阻止する作用が期待できるということです。
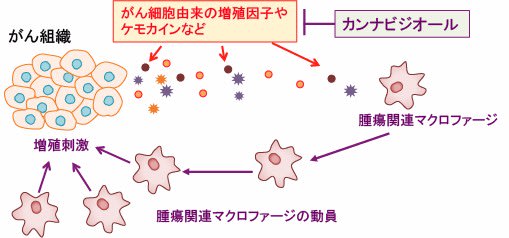
図:がん細胞から分泌される増殖因子やケモカインは腫瘍関連マクロファージをがん組織に動員する。腫瘍関連マクロファージはプロスタグランジンE2や炎症性サイトカインを産生し、がん細胞の増殖や転移を促進する。カンナビジオールはがん細胞からの増殖因子やケモカインの産生を阻止することによって、がん細胞の増殖や転移を抑制する。
【カンナビジオールは増殖シグナル伝達系を阻害する】
前述の論文では、カンナビジオールが上皮成長因子(EGF)誘導性のがん細胞の増殖と移動を阻害することが報告されています。増殖シグナルと細胞内シグナル伝達系を簡単に解説しておきます。
細胞の増殖は、増殖因子受容体が細胞外ドメインで増殖シグナルを受け取ることから始まります。
細胞内で機能している多数のシグナル伝達経路の中で、がん細胞の増殖と生存で最も重要なのが、PI3K-Akt経路(生存シグナル経路)とERK-MAPK経路(増殖シグナル経路)です。
細胞膜の増殖因子受容体にリガンド(増殖因子)が結合し2量体化すると、PI3Kのリン酸化活性からAktのリン酸化を通して、アポトーシス(細胞死)の誘導を阻害します。(PI3K-Akt経路)
増殖因子による刺激は、低分子量G蛋白質Rasを経由して、Raf→MEK→ERKとリン酸化反応するMAPK経路(MAPKカスケード)によりシグナルが伝達されます。活性化したERKは最終的に核へ移行し、転写因子が活性化され、細胞増殖関連の遺伝子が発現します。(ERK-MAPK 経路)

図:チロシンリン酸化型受容体の上皮成長因子受容体(EGFR)にリガンド(EGFやTGF-α)が結合し2量体化すると(①)、受容体が自己リン酸化されて活性化する(②)。受容体が活性化されるとPI3Kのリン酸化活性からAktがリン酸化されて活性化する(PI3K/Akt経路 ③)。一方、受容体の活性化は、低分子量G蛋白質Rasを経由して、Raf→MEK→ERKとリン酸化反応するMAPK経路によりシグナルが伝達される④。PI3K/Akt経路とMAPK経路の活性化は、最終的に核の転写因子の活性化を介して、がん細胞の増殖や転移を亢進し、アポトーシスに抵抗性(死ににくくなる)の性質を持つようになる(⑤)。
上皮成長因子受容体(Epidermal Growth Factor Receptor; EGFR)は、細胞膜を貫通して存在する分子量170キロダルトンの糖蛋白質で、チロシンキナーゼ型受容体の一種です。細胞外(血液や体液中)にある上皮成長因子(EGFやTGF-αなど)のシグナルを細胞内に伝える働きをします。
EGFRは621個のアミノ酸から構成される細胞外領域(リガンド結合ドメイン)、23アミノ酸の膜貫通領域、542アミノ酸の細胞内領域(チロシンキナーゼ・ドメイン)を持ちます。
細胞外領域に上皮成長因子(EGF)やTGF-αなどのリガンドが結合すると、受容体は細胞膜上を移動して、EGFR同士、あるいは他のErbBファミリー受容体と二量体を形成します。二量体を形成すると、細胞内領域にあるチロシンキナーゼ部位はATP(アデノシン三リン酸)を利用して受容体の細胞内領域にあるチロシン残基を自己リン酸化します。
チロシンのリン酸化が起こると、さらに細胞内のシグナル伝達系の蛋白質が次々に活性化され、増殖シグナルが核まで伝わり、増殖に関連する遺伝子の発現が起こります。その結果、細胞増殖、アポトーシス抑制、血管新生、浸潤・転移などが起こります。
EGFRは正常組織において細胞の分化や増殖の調節に重要な役割を演じていますが、このEGFRに遺伝子異常(増幅や変異や構造変化)や過剰発現が起きると、細胞のがん化や、増殖、浸潤、転移などに関与するようになります。実際に多くのがんでEGFRの遺伝子異常や過剰発現が認められています。
【IκBキナーゼはNF-κBを活性化する】
炎症性疾患やがんの治療のターゲットの一つにNF-κB(エヌエフ・カッパー・ビー、Nuclear Factor-kappa B、核内因子-κB)いう遺伝子の転写を調節するタンパク質複合体があります。
遺伝子の発現(DNAをmRNAに転写すること)を調節するタンパク質を転写因子と言い、この転写因子はDNA上のプロモーターやエンハンサーといった転写を制御する部分に特異的に結合し、DNAの遺伝情報をmRNAに転写する過程を促進、あるいは逆に抑制する働きを持っています。
NF-κBは転写因子の一つですが、炎症反応や免疫応答や細胞増殖に関連する多くの遺伝子の発現を調節しており、NF-κBの活性化は様々な炎症性疾患やがんを増悪させることが明らかになっています。
NF-κBは免疫グロブリンのκ鎖遺伝子のエンハンサー領域に結合するタンパク質として発見され、当初はリンパ球のB細胞に特異的に発現していると考えられていましたが、後にほとんどの細胞に存在することが明らかになりました。
がん細胞ではNF-κBが活性化すると死ににくくなるので抗がん剤に抵抗性になり、増殖や転移が促進されます。さらに、がん細胞や炎症細胞のNF-κB活性が高まると、血管内皮細胞増殖因子(VEGF)や単球走化因子-1(monocyte chemoattractant factor-1)やインターロイキン-8(IL-8)やシクロオキシゲナーゼ-2(COX-2)など、腫瘍血管の新生に関与する蛋白質の産生が増加します。
炎症細胞やがん細胞に、炎症性サイトカン(IL-1, TNF-αなど)や酸化ストレス(放射線や活性酸素など)が作用すると、細胞内でNF-κBが活性化されます。このNF-κBを活性化するタンパク質がIκBキナーゼ(IKK)です。
NF-κBは細胞質に存在し、IκB(Inhibitor of κB)と呼ばれる制御蛋白質と複合体を形成し、不活性型で細胞質に局在しています。
炎症性刺激や酸化ストレスやプロテインキナーゼCなどによりIκBのセリン基をリン酸化するIκBキナーゼ(IKK)が活性化されてIκBをリン酸化し、さらに蛋白分解の目印となるユビキチンが結合し、プロテアソームで分解されます。
IκB が外れるとIκBでマスクされていた核内移行シグナルが露出して、NF-κBは核に移行できるようになります。NF-κBはDNA上のκBモチーフ (GGGACTTTCC) と呼ばれる配列に結合し、目的遺伝子の転写活性化を行います。(図)
NF-κBの活性化を阻止することは、炎症性疾患やがんの治療に有効と考えられています。
IκBキナーゼ(IKK)の阻害剤としてオーラノフィンやサリドマイドが知られています(431話、544話参照)

図:NF-κB(Nuclear FactorκB)は細胞質に存在し、IκB(Inhibitor of κB)と呼ばれる制御蛋白質と複合体を形成している(①)。炎症性サイトカイン(IL-1やTNF-αなど)や細菌由来のリポ多糖や酸化ストレス(放射線や活性酸素など)はIκBキナーゼを活性化してIκBをリン酸化する(②)。さらにユビキチンが結合してプロテアソームで分解される(③)。IκBが外れるとNF-κB分子内の核内移行シグナルが露出してNF-κBは核に移行し、目的遺伝子の転写を行う(④)。NF-κBで活性化される遺伝子は炎症やがんの進展と関連するものが多い(⑤)。その結果、がん細胞の増殖は亢進し、アポトーシスが起こりにくくなって抗がん剤耐性となり、腫瘍血管の新生が促進される(⑥)。
【トリプル・ネガティブ乳がんではEGFRの発現が亢進している】
トリプル・ネガティブ乳がんではEGFRの発現が亢進しており、EGFRの発現が高いほど予後が悪いことが知られています。
前述の論文ではカンナビジオールはEGFで誘導される増殖や移動や浸潤の亢進を抑制し、EGFで活性化されるERKとAKTシグナル伝達系を阻害することを報告しています。EGFRのリン酸化を阻止し、AKTとERKのリン酸化も阻害します。
EGF/EGFRシグナル系の活性化はNF-kB経路を活性化します。NF-kBの活性化も乳がん細胞の増殖や転移を促進し、抗がん剤耐性を誘導します。EGF誘導性のNF-κBの活性化をカンナビジオールが阻害すると報告しています。
つまり、カンナビジオールはEGF/EGFRシグナル系(MAPK経路とPI3K/Akt経路)とNF-κB経路を阻害して、がん細胞の増殖や生存を阻止するという結論です(下図)。

図:チロシンリン酸化型受容体にリガンド(増殖因子や成長因子)が結合し2量体化すると、受容体がリン酸化されて活性化する(①)。受容体が活性化されるとPI3Kのリン酸化活性からAktがリン酸化されてPI3K/Akt経路が活性化する(②)。一方、受容体の活性化は、低分子量G蛋白質Rasを経由して、Raf→MEK→ERKとリン酸化反応するMAPK経路によりシグナルが伝達される(③)。NF-κBは細胞質に存在し、IκBと呼ばれる制御蛋白質と複合体を形成している(④)。炎症性サイトカイン(IL-1やTNF-αなど)や細菌由来のリポ多糖や酸化ストレス(放射線や活性酸素など)はIκBキナーゼを活性化してIκBをリン酸化する(⑤)。リン酸化されたIκBはユビキチンが結合してプロテアソームで分解される(⑥)。IκBが外れるとNF-κB分子内の核内移行シグナルが露出してNF-κBは核に移行し、目的遺伝子の転写を行う(⑦)。PI3K/Akt経路とMAPK経路とNF-κB経路の活性化は、最終的に核の転写因子の活性化を介して、がん細胞の増殖や転移や腫瘍血管の新生を亢進し、アポトーシスに抵抗性の性質を持つようになる(⑧)。カンナビジオールはこれらの経路を抑制することによって抗腫瘍活性を示す。
この論文の動物実験では、腫瘍組織の周囲に2日に1回の割で10mg/kgのCBDを投与しています。マウスの10mg/kgは人間では1〜2 mg/kgに相当します。しかし、注射は100%吸収されますが、舌下や経口では一部しか体内に吸収されないので、カンナビジオールを舌下投与するとき、がん細胞に対する増殖抑制効果を期待するには、人間では数百mg(可能であれば1gくらい)が必要かもしれません。
【カンナビジオールはパクリタキセルの神経障害性疼痛を軽減する】
Cannabidiol inhibits paclitaxel-induced neuropathic pain through 5-HT(1A) receptors without diminishing nervous system function or chemotherapy efficacy. (カンナビジオールは、神経系の機能や抗がん剤の効果を減弱することなく、5HT1A受容体を介してパクリタキセル誘発性の神経障害性疼痛を阻止する)Br J Pharmacol. 171(3):636-45.2014年
【要旨】
研究の背景と目的:パクリタキセルは末梢神経にダメージを与えて痛みを引き起こす副作用があり、これによって抗がん剤治療を中断せざるを得ない場合もある。我々は以前の研究において、精神変容作用を持たないカンナビノイド(大麻に含まれるある種の成分の総称)の一つであるカンナビジオールが、パクリタキセルによる機械的および温熱による疼痛感受性の亢進を阻止する作用を有することをマウスを使った実験で明らかにした。抗がん剤による末梢神経障害を阻害するカンナビジオールの作用のメカニズムを明らかにし、カンナビジオールの作用が神経機能や抗がん剤の抗腫瘍効果を減弱させる作用がないかどうかを検討した。
主な結果:マウス(C57Bl/6 mice)を使った実験で、パクリタキセルで誘発される機械的刺激に対する疼痛感受性の亢進はカンナビジオール(2.5~10mg/体重1kg, 腹腔内投与)の投与によって阻止された。この効果は5−HT(1A)受容体のアンタゴニスト(拮抗薬、阻害薬)であるWAY100635の同時投与によって減弱したが、カンナビノイド受容体のCB1のアンタゴニスト(SR141716)やCB2のアンタゴニスト(SR144528)では減弱しなかった。カンナビジオールの投与によってマウスの学習機能や認知機能などに低下は認めなかった。
培養乳がん細胞を用いた実験では、パクリタキセルとカンナビジオールの併用は、相加あるいは相乗的な抗腫瘍効果の増強を示した。
結論:今回の実験結果より、カンナビジオールはパクリタキセルによって引き起こされる神経障害を予防する効果を示し、その作用機序として5-HT1A受容体を介する機序が示唆された。さらに、学習効果や認知機能などの神経系の働きに悪影響は及ぼさず、乳がん細胞に対するパクリタキセルの抗腫瘍効果を減弱させることはなかった。以上のことから、パクリタキセルによる抗がん剤治療にカンナビジオールを併用することは、神経障害の発生予防や軽減において有効で安全な治療法と言える。
パクリタキセルなどの抗がん剤治療における末梢神経障害(しびれ、感覚異常、味覚障害、疼痛など)によって苦しむ患者さんは極めて多くいます。しかも、有効な治療法がありません。
ビタミン剤(ビタミンB6,B12など)や漢方薬(牛車腎気丸や芍薬甘草湯など)やリリカやサプリメント(アセチル-L-カルニチン、メラトニン、αリポ酸、DHA/EPAなど)など多くの方法が多少の効果が報告されていますが、現実的には強い神経障害に対してはあまり効いていません。
カンナビジオールはカンナビノイド受容体のCB1とCB2には作用しませんが、Ca透過性イオンチャネルのTRPV(transient receptor potential vanilloid type)やセロトニン受容体の5-HT1Aなど幾つかの受容体に作用することが報告されています。
この論文では、5-HT1A受容体の拮抗薬によってカンナビジオールの神経障害抑制効果が減弱(阻止)されたので、カンナビジオールの神経障害抑制作用は5-HT1A受容体の関与を示唆しています。
5-HT1A受容体はセロトニン受容体の一種で、5-HT1A作動薬は抗不安や抗うつ作用などの作用があります。7回膜貫通型のG蛋白共役型受容体で、アデニル酸シクラーゼ活性の抑制や、内向き整流性カリウムチャネルを活性化して神経活動を抑制(過分極)することが知られています。
5-HT1A受容体は不安障害やうつ病の治療標的分子として長く研究されてきましたが、最近の研究によって統合失調症やパーキンソン病の新たな治療ターゲットとしても注目されるようになってきました。実際にカンナビジオールが統合失調症など精神疾患に有効であることが報告されています。このような作用から、抗がん剤による末梢神経障害による痛みや感覚異常やしびれに対する効果が得られるのかもしれません。
この実験ではカンナビジオールを2.5~10mg/体重1kgを腹腔内投与しています。マウスの2.5~10mg/体重1kgは人間では0.5〜2 mg/kgに相当しますが、腹腔内投与は100%吸収され、舌下投与ではその一部しか体内に吸収されないので、10mg/kg程度は必要と思われます。(小児の難治性てんかんでは1日体重1kg当たり数mgから20mg程度で効いています。)
【カンナビジオールはシスプラチンの副作用を軽減する】
Cannabidiol Attenuates Cisplatin-Induced Nephrotoxicity by Decreasing Oxidative/Nitrosative Stress, Inflammation, and Cell Death.(カンナビジオールは活性酸素や一酸化窒素によるストレス、炎症および細胞死を減少させることによってシスプラチンによる腎障害を軽減する)J Pharmacol Exp Ther.328(3): 708–714.2009年
シスプラチンは腎毒性の発現頻度が高い抗がん剤です。シスプラチンは静脈内投与後に血漿蛋白と結合しますが、蛋白と結合しなかったフリーのシスプラチンは腎臓の糸球体からろ過され、近位尿細管に蓄積されます。シスプラチンの腎毒性は、このフリーのシスプラチンが近位尿細管細胞に酸化ストレスを与え、細胞死を誘導することが主な原因です。腎毒性を減少させるには、尿中のシスプラチン濃度を低下させ、近位尿細管の細胞との接触時間を減らすことが重要で、そのため水分負荷と強制利尿が行われています。
シスプラチンによる細胞傷害には、活性酸素や一酸化窒素の産生が高まって細胞に酸化ストレスを与え、炎症反応や細胞死が引き起こされることによって生じます。
この論文では、マウスにシスプラチンを投与して腎障害を引き起こす実験モデルを用いて、カンナビジオールが活性酸素や一酸化窒素などのフリーラジカルの産生を抑制し、タンパク質やDNAのダメージや炎症を抑制することによって腎臓における細胞傷害を軽減する効果を報告しています。
【カンナビジオールはドキソルビシンの心臓毒性を軽減する】
Cannabidiol Protects against Doxorubicin-Induced Cardiomyopathy by Modulating Mitochondrial Function and Biogenesis(カンナビジオールはミトコンドリアの機能と新生を制御することによってドキソルビシン誘発性心筋障害を防ぐ)Mol Med. 2015; 21(1): 38–45.
【要旨】
ドキソルビシンは広く使用されている抗腫瘍活性の高い抗がん剤であるが、その用量依存的な心臓毒性によって臨床使用に限界がある。
ドキソルビシンの心臓毒性には活性酸素や一酸化窒素による酸化ストレスの亢進や、心筋細胞や血管内皮細胞のミトコンドリア機能の障害や細胞死が関与している。
カンナビジオールは大麻に含まれる精神活性を持たない成分であり、有害作用は少なく、抗酸化作用や抗炎症作用を有し、さらに最近は抗腫瘍活性も報告されている。
ドキソルビシン誘発性の心筋障害のマウスの実験モデルを用いて、カンナビジオールの効果を検討した。
ドキソルビシン誘発性心筋障害は心筋細胞のダメージのレベル(血清中のクレアチニンキナーゼと乳酸脱水素酵素の値)、活性酸素や一酸化窒素による細胞傷害のレベル(細胞内のグルタチオン量、グルタチオンペルオキシダーゼ1活性、脂質過酸化、3-ニトロチロシン形成、誘導性一酸化窒素合成酵素mRNAレベル)、心筋細胞死(アポトーシス、ポリADPリボースポリメラーゼ1依存性)、心筋機能(心拍出機能と左室内径短縮率)で評価した。
ドキソルビシンはミトコンドリア新生を抑制し、ミトコンドリア機能を低下させ(呼吸酵素複合体IとIIの活性低下)、心筋細胞における脱共役たんぱく2と3(uncoupling protein 2 and 3)とmedium-chain acyl-CoA dehydrogenase mRNAの発現を低下させた。
カンナビジオールの投与は、これらのドキソルビシン誘発性の心筋機能の障害を改善し、活性酸素や一酸化窒素による細胞ストレスと細胞死を軽減した。
カンナビジオールは障害されたミトコンドリア機能とミトコンドリア新生を改善した。
これらの実験結果は、ドキソルビシンによる心筋障害に対する新たな治療法をしてカンナビジオールの有用性を示唆しており、ミトコンドリアの機能や新生に対するカンナビジオールの作用は、他の多くの組織障害の実験モデルでのカンナビジオールの作用機序を説明できるかもしれない。
【カンナビジオールは吐き気を軽減する】
医学用語では吐き気を「悪心(おしん)」、吐くことを「嘔吐(おうと)」と言います。
抗がん剤治療を受けた患者さんで、予期性悪心や予期性嘔吐を呈する人がいます。
これは、抗がん剤治療時の副作用として吐き気を経験した人の中で、実際に抗がん剤の投与を受けていない時でも、抗がん剤治療を想像しただけで、吐き気を感じてしまったり、実際に嘔吐してしまうような症状を予期性悪心や予期性嘔吐と言います。他人の点滴をみたり、病院の建物を見ただけで、吐き気や嘔吐することもあります。
予期性悪心・嘔吐には普通の吐き気止め(制吐薬)はあまり効果がないとされ、抗不安薬が用いられています。カンアビジオールには抗不安作用があるので、予期性悪心や予期性嘔吐に効く可能性があります。実際に動物実験でカンナビジオールが抗がん剤治療に伴う予期性悪心や予期性嘔吐を予防する効果が報告されています。
The effect of cannabidiol and URB597 on conditioned gaping (a model of nausea) elicited by a lithium-paired context in the rat.(ラットにおけるリチウム誘発性の条件づけギャッピングモデル[吐き気のモデル]に対するカンナビジオールとURB597の効果)Psychopharmacology 196(3): 389-395, 2008年
Gaping(ギャッピング)というのは「大口を開けること」で吐き気を意味する行動のようです。塩化リチウムを注射すると吐き気(悪心)が起こり、このときのラットの変化が「gaping:大口を開けること」です。この塩化リチウムを注射すると同時に匂いのついた場所に移すという条件付けを繰り返すと、塩化リチウムを投与しなくても匂いのついた場所に移すだけで悪心(吐き気)を起こすようになります。これが予期性悪心や予期性嘔吐の実験モデルとなります。この論文の要旨は以下です。
【要旨】
研究の背景:抗がん剤治療中の患者にしばしば経験される予期性悪心(Anticipatory nausea)は通常の吐き気止めを使った治療に抵抗性である。この研究では、予期性悪心に治療における内因性カンナビノイド系の制御の役割についてラットの悪心モデル(conditioned gaping)を用いて検討した。
目的:カンナビジオール(CBD)と脂肪酸アミド加水分解酵素(fatty acid amide hydrolase;FAAH)の阻害剤であるURB597(URB) がラットにおける条件付けギャッピングを減らすことができるかどうかを検討した。(脂肪酸アミド加水分解酵素は内因性カンナビノイドのアナンダミドを分解する酵素)
方法:匂いのついた場所にラットを起き、その直前に塩化リチウムの注射によって悪心を誘発しで条件付けを行った。1,5,10mg/kgのCBDはラットを匂いのついた場所に移す30分前に投与した。URBは0.1 か 0.3 mg/kgの用量を2時間前に投与した。
また、カンナビノイド受容体CB1のアンタゴニスト/逆アゴニスト(inverse agonist)であるSR141716Aの作用を検討した。
結果:予期性悪心を誘発する前に、CBD (1 and 5, but not 10 mg/kg) あるいは URB (0.3, but not 0.1 mg/kg)を投与すると条件付けギャッピングを抑制した。URBによる抑制効果はCB1のアンタゴニスト/逆アゴニストであるSR141716Aで前投与すると消失した。条件付けを行うとき、URBはその条件付けの成立を阻害した。
結論:内因性カンナビノイド系を制御することは予期性悪心の治療に効果が期待できる。
この論文では、内因性カンナビノイドのアナンダミドを分解する脂肪酸アミド加水分解酵素の阻害剤(URB597)が予期性悪心を予防するということは、カンナビノイド受容体CB1の活性化が予期性悪心を予防する効果があることを意味しています。
URBによる抑制効果はCB1のアンタゴニスト/逆アゴニストを前投与すると消失したこともCB1の活性化が予期性悪心の予防の作用機序であることを意味しています。
前述のようにカンナビジオールはCB1のアンタゴニスト/逆アゴニストとして作用するので、カンナビジオールの予期性悪心の予防の作用機序はCB1を介するものとは異なると考えられます。
カンナビジオールにはセロトニン受容体5-HT1A受容体を活性化する作用があり、この作用は抗不安作用や吐き気止め作用があります。したがって、カンナビジオールは5-HT1A受容体を介する機序で吐き気を止める可能性が高いかもしれません。
ただし、カンナビジオールの作用機序は不明な点も多くあります。論文の中にはカンナビジオールがCB1受容体のアゴニストに分類しているものもあります。また、アナンダミドの分解に関与するfatty amide hydrolase (FAAH)の活性を刺激する場合と阻害する場合があります。
したがって、作用機序に関してはまだ不明な点が多いのですが、カンナビジオールには予期性悪心や予期性嘔吐の予防効果はあるということです。(カンナビジオールの抗不安作用や抗うつ作用や抗精神病作用は多くの論文で示されています。)
【カンナビジオールは抗がん剤治療の補完療法として価値がある】
以上のように、カンナビジオールには、直接的な抗腫瘍効果と、抗がん剤の副作用を軽減する効果が数多くの実験で示されています。
抗がん剤治療が長期になると、心臓や腎臓や神経系へのダメージが問題になってきます。
乳がんなどで長期間の抗がん剤治療を受けている患者さんに認知機能が低下することが問題になっています。これをケモブレインと言います。
ケモブレイン(chemobrain)とは、chemotherapy(化学療法)の「chemo」と、brain(脳)を組み合わせて作られた用語です。「 化学療法後の脳機能障害」という意味で、抗がん剤治療中や治療後に起こる記憶や認知力の低下のことを指しています。
抗がん剤治療中あるいは治療後に、物忘れが強くなったという患者さんがいます。抗がん剤治療の進歩のおかげで再発率が低下し、生存期間が延長してくると、抗がん剤治療の後遺症の一つとして、記憶力や認知力の低下が問題になってきました。
命に関わることでは無いのですが、生活の質(QOL)を低下させる点で患者にとっては深刻な問題になっています。
とくにこの問題は乳がん患者の間で1980年代の後半から問題になってきました。乳がんの治療では、神経細胞の障害を起こしやすい抗がん剤が複数使用されることが多いことと、長期間延命する患者さん(乳がんのサバイバー)が多いためです。(76話参照)
カンナビジオールがアルツハイマー病などの神経変性疾患に有効であることが報告されています。
アメリカ合衆国は「Cannabinoids as antioxidants and neuroprotectants(抗酸化剤および神経保護剤としてのカンナビノイド)」という特許を登録しています。この対象となっているカンナビノイドはカンナビジオールです(501話参照)。
また、がんサバイバーは循環器疾患の罹患率が多いことも報告されています。抗がん剤治療などによる心臓毒性の影響かもしれません。
したがって、抗がん剤治療にカンナビジオールを併用することは十分なエビデンスがあると言えます。
動物実験の結果や、小児のてんかんでの治療効果などから、抗がん剤の副作用予防の目的では、成人で1日体重1kg当たり数mgから10mg程度が目安になるようです。1日に100〜数百mgを舌下投与で摂取することになります。
がん細胞に対する抗腫瘍効果を期待するには、カンナビジオール単独では強い効果は期待できません。
腫瘍関連マクロファージの活性化抑制ではシクロオキシゲナーゼ-2(COX-2)阻害剤のcelecoxib(セレコックス)とシグナル伝達兼転写活性化因子3(Signal transducer and activator of transcription 3 :STAT3)を阻害するオーラノフィンの併用が有効です。
NF-κBの活性を阻害する方法としてはIκBキナーゼを阻害するオーラノフィンやサリドマイドが有効です。
ビタミンD3が乳がん細胞のEGFR(上皮成長因子受容体)の遺伝子発現を抑制することが報告されています。(429話参照)
これらを組み合わせると、がん細胞の増殖を抑制する効果が高まります。(下図)

図:がん細胞から分泌されるケモカインや増殖因子はマクロファージをがん組織に動員する(①)。マクロファージはCOX-2やSTAT3によって活性化されて腫瘍関連マクロファージになる(②)。腫瘍関連マクロファージは炎症性サイトカインや増殖因子やMMP(matrix metalloproteinase)を産生してがん細胞の増殖・浸潤・転移を亢進する(③)。がん細胞と腫瘍関連マクロファージではNF-κBの活性が亢進している(④)。がん細胞内では増殖と生存のシグナル伝達系が亢進し、増殖・転移・治療抵抗性が亢進している(⑤)。カンナビジオールはがん細胞からのケモカインや増殖因子の産生を阻害し(⑥)、がん細胞内の増殖と生存のシグナル伝達系を阻害する(⑦)。セレコックスはCOX-2を阻害し(⑧)、オーラノフィンはSTAT3を阻害(⑨)してマクロファージの活性化を抑制する。ビタミンD3は上皮成長因子受容体(EGFR)の発現を抑制する。
| « 561)トリプル... | 563)手術侵襲... » |




