がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
539)超高齢者はがんで死なない(その4):ゾウやクジラはがんが少ない
図:細胞の遺伝子の変異率が同じであれば、体の大きい個体ほど細胞数が多いので、個体当たりの発がん率は高くなると考えられる。しかし、ゾウやクジラは人間やネズミよりもがんの発生率は低い。このパラドックスは英国のリチャード・ピトー(Sir Richard Peto)が約40年前に指摘したので、「ピトーのパラドックス」と呼ばれている。
539)超高齢者はがんで死なない(その4):ゾウやクジラはがんが少ない
【体が大きく進化するためには、がん抑制のメカニズムの強化が必要】
人類はがんと戦っています。
米国では、ニクソン大統領が1971年12月23日に「National Cancer Act」にサインをし、「がん戦争(war on cancer)」を宣言しています。
日本では、1984年に中曽根首相のときに対がん10か年総合戦略が開始されました。その趣旨は「がんの本体解明を図ることを目標に、分子生物学等関連諸科学の成果を集中的多角的にがん研究に投入する」というものです。それ以降、がん対策は国の重要な政策課題になっています。
しかし生物は、多細胞生物が発生した10億年くらい前からがんと戦っています。
多細胞生物は細胞間での情報伝達を発達させ、全ての細胞の増殖や死が調和をもって制御される必要があります。がん細胞は細胞の増殖や死の制御に異常をきたした細胞であり、生物にとってがん細胞ができることは種を繁栄・維持する上で重大なリスクになります。したがって、多細胞生物が進化する過程で、発がんを抑制するメカニズムを発展させてきました。
生物の進化の過程で、「発がん抑制メカニズム」の獲得は重要な意味を持っています。生体が成長する過程で膨大な数の細胞分裂が起こり、DNA複製にはエラーが避けられません。そのため、生物が種を繁栄・維持するためには、がんの発生を防ぐメカニズムを発達させる必要があります。
少なくとも、生殖期間と子育て期間までがん発生を抑制できなければ、その種はいずれ絶滅します。
がん細胞の発生率は、組織幹細胞の細胞分裂数と生存期間(寿命の長さ)に比例することを537話と538話で解説しました。
DNAポリメラーゼによるDNA複製にはある一定の率でエラーが発生する運命にあり、また酸素呼吸や炎症反応による活性酸素の発生によってDNA変異が生じ、環境中の変異原物質の暴露によってもDNA変異が起こります。そして、このDNA変異の数は組織幹細胞の細胞分裂回数の総和とその生物が生きている期間に比例して増えていくので、体の体積と生きている期間に比例してがんの発生も増えています。
同じ種では体が大きいほどがんの発生率が高いことは538話で解説しました。しかし、「体が大きいほどがんの発生率が高い」という関係は種が異なると当てはまりません。
体重が20gのマウスと体重が200トンのシロナガスクジラでは体重は1000万倍の違いがあります。もし、1個体の体重(体積)と発がん率が比例すると、シロナガスクジラの発がん率はマウスの1000万倍になります。
しかし実際は、シロナガスクジラの生涯の発がん率(寿命は80年程度)はマウスの生涯発がん率(寿命は実験用マウスで2.5年程度)より低いことが報告されています。
生物が大きく進化するときに、大きさに比例してがんの発生率が増えるとその生物は種を維持できません。体を大きく進化させるためには、同時にがんの発生を抑えるメカニズムを強化するように進化する必要があります。そのようながん抑制のメカニズムを獲得した生物が体を大きく進化できると単純に理解できるかもしれません。
体が大きくなるためには「がん抑制メカニズム獲得」の進化圧が存在するので、大きい生物はがん抑制のメカニズムが発達していると考えられています。
実際には、そのメカニズムは解明されていませんが、なぜゾウやクジラにがんが少ないのかはがん予防の研究でも重要なテーマになっています。
【ピトー(Peto)のパラドックス】
マウスの体重が20gで人間が60kgでシロナガスクジラが180トンとすると、人間はマウスの3000倍、シロナガスクジラは人間の3000倍になります。
寿命は実験用のマウスで2.5年、人間とシロナガスクジラで80年くらいでマウスの30倍以上です。
クジラやゾウなどの大型動物は、がん化するおそれのある細胞(組織幹細胞)をより多く持っているため、小型動物よりもがんになる確率が高いであろうと予想されます。しかし実際はそうではなく、クジラやゾウの発がん率は人間やネズミより低いことが明らかになっています。
このように、「大型動物では、細胞数や寿命から推定される発がん率よりも実際はかなり低い」という現象は、一般に「Peto's paradox(ピトーのパラドックス)」と呼ばれて、そのメカニズムについて議論されています。
Petoというのは、英国のリチャード・ピトー(Richard Peto)のことです。喫煙などの発がんの疫学や医学統計やがん予防の分野で有名です。
Richard Dollとの共著の「The causes of cancer: quantitative estimates of avoidable risks of cancer in the United States today.(がんの原因:米国におけるがんの回避できるリスクの定量的推定)J Natl Cancer Inst. 1981 Jun;66(6):1191-308.」はがんの疫学やがん予防の研究者にとってはバイブルのような論文です。
ヒトの発がん因子を検討し、人のがんの約3分の2は、食事や喫煙など生活環境にかかわる要因が原因となっていることを指摘し、それらの多くは回避可能であることより、がんは自分で予防できる疾患であることを明らかにしています。
疫学やがん予防分野における顕著な業績によって1999年にナイトの称号を与えられており、Sir Richard Petoと呼ばれています。(顔写真はトップの図に示している)
このPetoの名前を冠したパラドックスが「ピトーのパラドックス(Peto’s Paradox)」です。
「細胞数に比例してがん細胞の発生率が増えるので、体が大きくなればがんの発生率が増えると考えられる。しかし実際は、ゾウやクジラなど大型哺乳類では人間よりも発がん率が低い」というパラドックスについてPetoは40年くらい前に指摘しています。
そのメカニズムの一つが進化における自然淘汰です。体が大きくなったり寿命が延びると発がん率が上がるというトレードオフの関係があり、その問題を解決するために、体を大きくするように進化するときには、「がんを抑制する」という進化圧が必要になります。
発がんに対する抵抗性を獲得したものが、体を大きくしたり寿命を延ばして種を繁栄・維持できるというのが自然淘汰説です。
この進化における自然淘汰説は容易に納得できます。
問題は、自然淘汰の過程でどのようにしてがん発生を抑制できるようになったかという具体的メカニズムです。
例えば、人間(70kg)とクジラ(36000kg)は体重が約500倍の違いがあります。遺伝子変異の率が同じだと、クジラのがん発生率は人間の約500倍になる計算です。しかし、数学的には、変異率が3.2分の1に減少するだけでクジラは人間と同じがん発生率になるそうです。つまり、DNAポリメラーゼのDNA複製の精度を高めたり、ミスマッチ修復能の効率を高めたり、変異細胞のアポトーシスの効率を高めるなどして、遺伝子変異の蓄積を数分の1に減らすことができれば、発がん率を高めずに体重を数百倍以上に増やすことができる計算になります。(下図)

図:人間とクジラの発がん率が同じと仮定した場合、遺伝子変異率は計算上は3.2倍の差で解決する。(参考:Solutions to Peto's paradox revealed by mathematical modelling and cross-species cancer gene analysis. Philos Trans R Soc Lond B Biol Sci. 2015 Jul 19; 370(1673): 20140222.)
【ゾウはがん抑制遺伝子PT53を多く持っている】
以下のような論文があります。ゾウは体が大きく寿命も長いのに、なぜがんが少ないかという論文です。JAMA(米国医師会雑誌)の論文なので、信頼性はあります。
Potential Mechanisms for Cancer Resistance in Elephants and Comparative Cellular Response to DNA Damage in Humans(ゾウにおけるがん抵抗性を説明できるメカニズムとヒトにおけるDNA傷害に対する細胞応答の比較)JAMA. 2015 Nov 3; 314(17): 1850–1860.
【要旨】
研究の重要性:進化論に関する医学的研究は、腫瘍生物学を含む人間の生理学および病態生理学に重要なヒントを与える可能性がある。
本研究の目的:ゾウにおける発がん抵抗性のメカニズムを明らかにすることと、ゾウと健常人とがんを発生しやすいリー・フラウメニ(Li-Fraumeni)症候群の患者におけるDNA傷害に対する細胞応答を比較する。
研究デザインと対象:ゾウ(n=644)を含む大型で寿命の長い生き物における発がん抵抗性を明らかにする目的で36種の哺乳動物の剖検データを解析した。
発がん抵抗性のメカニズムを検討する目的でアフリカゾウとアジアゾウの遺伝子を解析した。
ゾウ、健常人、リー・フラウメニ症候群の患者の末梢血リンパ球を使って、試験管内でのDNA傷害に対する細胞応答を検討した。この実験では、アフリカゾウとアジアゾウ(n=8)とリー・フラウメニ症候群の患者(n=10)と年齢をマッチさせた健常人コントロール(n=11)が対象となった。人間のサンプルは2014年6月から2015年7月までの間に採取された。
DNA傷害の方法;放射線放射とドキソルビシンを用いた。
主な検討:動物種の間のがん死亡率を計算し、体のサイズと寿命の関係を比較した。ゾウの遺伝子はがん関連の遺伝子の変化について検討した。ゾウとヒトの末梢リンパ球において、DNA修復能とアポトーシスを比較した。
結果:動物種間において、体のサイズの増大や寿命の延長はがん死亡率を高めなかった。(例えば、ロックハイラックス, 1% [95%信頼区間, 0%–5%]; アフリカ野生犬, 8%[95%信頼区間, 0%–16%]; ライオン, 2%[95%信頼区間, 0% –7%])
大きなサイズと長寿命に拘らず、ゾウはがん発生に対して抵抗性を持ち、がん死亡率は4.81% (95%信頼区間, 3.14%–6.49%)であった。これは人間のがん死亡率11〜25%に比べて低い数値であった。
がん抑制遺伝子のTP53は人間ではゲノム当たり1コピー(2対立遺伝子)であるが、アフリカゾウは19 のretrogene (38対立遺伝子) を含む少なくとも20コピー(40対立遺伝子)を持っており、転写活性を有することが逆転写ポリメラーゼ連鎖反応(RT-PCR)で確認された。
電離放射線被ばく(ionizing radiation exposure)によるDNA損傷に対して、ゾウのリンパ球におけるp53 を介するアポトーシスは14.64% (95% 信頼区間, 10.91%-18.37%; P<0.001)で、リー・フラウメニ症候群の患者の2.71% (95% 信頼区間, 1.93%-3.48%)、および健康なヒトの 7.17% (95% 信頼区間, 5.91%-8.44%)に比べ高い率を示した。
また、ドキソルビシン曝露では、リンパ球のアポトーシスはゾウでは24.77% (95% 信頼区間, 23.0%-26.53%; P<0.001)、健康なヒトでは8.10%(95 %信頼区間, 6.55%-9.66%)で、ゾウが圧倒的に高くなっていた。
結論と考察:他の哺乳動物に比べて、ゾウのがん死亡率は推定されるより低いことが示され、そのメカニズムとしてがん抑制遺伝子のTP53のコピー数が多いことが関連している可能性が示された。人間の細胞に比べて、ゾウの細胞はDNA損傷に反応してアポトーシスを起こしやすいことが示された。これらの結果は、もし再現性が得られるならば、発がん抑制のメカニズムを明らかにする進化論的アプローチとなる。
この研究では最初に、サンディエゴ動物園の動物の14年間のデータを収集し、がんの発生率が体の大きさ、あるいは寿命に関係するかどうかを調査しました。
また、エレファント・エンサイクロペディアのデータを収集し、アフリカゾウおよびアジアゾウの死因を分析しています。さらに、様々な動物種のがんによる死亡リスクを算出しています。
次に、8頭のアフリカゾウとアジアゾウ、LFS患者10名、および、がんの家族歴のない人11名(健康な対照群)から血液を採取して白血球を分離し、異なる動物の細胞が持つTP53遺伝子のコピーの数を調べています。
TP53はがん抑制遺伝子のp53タンパク質をコードします。p53は転写因子であり、DNA傷害などの各種細胞ストレスやがん遺伝子シグナルなどによりリン酸化され、アセチル化などの翻訳後修飾にて活性化され、遺伝子の転写調節領域内に存在する特異的塩基配列に結合して転写を活性化します。
多くのがんにおいてTP53遺伝子の変異が報告され、ヒトのがんの約50%にTP53の変異が存在することから、発がんやがんの進展因子として重要な遺伝子であると考えられています。
リー・フラウメニ(Li-Fraumeni)症候群(LFS)は、生殖細胞系列におけるTP53遺伝子の病的変異を原因とする遺伝性疾患です。LFSの患者は、様々な臓器の悪性腫瘍を多発するリスクが高いことが知られています。
細胞に強いDNA損傷が起これば、TP53が活性化されてアポトーシスで死滅して排除されます。TP53遺伝子が変異してDNA損傷に対するアポトーシス誘導が起こらなければ、DNA変異した組織幹細胞が増えて、発がん率が増加します。
リー・フラウメニ(Li-Fraumeni)症候群の患者はPT53遺伝子に変異があるので、DNA損傷が生じても細胞の自殺(アポトーシス)が起こらないので、遺伝子変異が蓄積しやすいのでがんの発生が増えます。
人間の場合は、TP53は1コピー(2対立遺伝子)しかないので、TP53遺伝子の変異による機能低下は起こりやすいのですが、ゾウは20コピーもあるので、TP53の機能低下は起こりにくいので、発がんに抵抗性をもっているという結果です。リー・フラウメニ(Li-Fraumeni)症候群では2個の対立遺伝子のうち1個が変異しているので、がんが発生しやすくなっています。
つまり、ゾウはTP53遺伝子のコピーを増やして発がんに対する防御力を高めているので、体を大きくするように進化できたという考えです。
この論文ではPT53遺伝子が重点的に検討されていますが、その他の動物でがん抑制遺伝子のコピー数が増えている例は多数報告されています。例えば、ウマはMAL遺伝子を8コピー持っており、ウシはIFNB1遺伝子を5コピー持っていると報告されています。
動物が大きく進化する過程で、1つのメカニズムだけでなく、様々な方法で発がんを抑制するメカニズムの強化が進化している可能性が示唆されます。
【大きい動物は代謝率が低い】
個体の発がん率は酸素消費量とも相関します。酸素呼吸をすると活性酸素の産生が増え、遺伝子変異の率を高めるからです。
小型動物が大型動物より代謝量や代謝速度が大きいので、発がん率を高めている原因の一つと考えられています・
標準代謝量は体重の3/4乗(正確には0.751乗)に比例するという法則があり、一般にマウスの体重当たりのエネルギー消費量や薬物の代謝速度は人間の約7倍と言われています。
例えば、マウスの食餌や飲水の摂取量は体重換算で計算すると人間の5~10倍くらいになります。
安静にしているときのエネルギー消費量を標準代謝量と呼び、これは個体が生命を維持していくのに必要な基本的なエネルギーで維持代謝量とも言います。
標準代謝量は、通常、単位時間当たりにして、どれだけ酸素を消費したか、つまり代謝の速度(代謝率)として現します。
標準代謝量は体重の0.751乗に比例することが知られています。0.751はほぼ3/4なので、簡単には3/4乗で計算できます。例えば、1000の3/4乗は、1000 x 1000 x 1000=109の平方根の平方根なので卓上計算機で×と√で計算でき、答えは178です。
つまり、体重が1000倍ならエネルギー消費は178倍で、体重1kgで比較すると、体重が少ない方が約5.6倍(1000÷178)エネルギー消費が多いということになります。
逆に、体重当たりのエネルギー消費はマイナス1/4乗に比例する(あるいは1/4乗に反比例する)といえます。1000の1/4乗(平方根の平方根)で計算すると5.6という数字がでます。
さて、人間(体重60kg)とマウス(体重25g)を比較すると体重は2400倍ですが、エネルギー消費量は2400の3/4乗で、約343倍になります。これは体重1kg当たりでは、エネルギー消費量はマウスの方が人間の7.0倍多いことを示します。(あるいは、2400の1/4乗[平方根の平方根]で計算すると単位体重当たりの7.0倍という数字が出ます。(逆に7の4乗は74=7 x 7 x 7 x 7 =2401)
いろんな計算法がありますが、いずれにしても、体重当たりで計算すると、マウスの酸素消費量は人間の約7倍ということです。
ちなみに、人間の心拍数は1分間に60~80程度、ねずみは1分間に300~400、つまり心拍数も5~7倍です。
つまり、1個の細胞当たりの酸素消費量は7倍程度であるため、遺伝子の変異発生率も増えることになります。
カロリー制限(栄養不良を起こさないで摂取カロリーを減らす食事)ががんの発生率を低下させ、寿命を延ばす最も確実な方法として知られています。このカロリー制限は成長ホルモンやインスリンやインスリン様成長因子-1(IGF-1)のような成長因子や増殖因子の血中濃度を減らす作用があり、結果として細胞の代謝率を低下させます。
高齢になると、一般的に体は小さくなります。同じ種であれば、体が小さいだけで、発がん率は減少します。体が小さければ、標準代謝量も酸素消費量も基礎代謝率も低下するので、がんの発生率が低下し、がんの進行が遅くなる可能性もあります。
超高齢者では、体内環境が基礎代謝率を低下させ、細胞の増殖活性が低下することが、がんの発生やがん死亡が少ない理由として理解できます。
【超高齢になると炎症性応答が低下する】
加齢とともに、関節炎、2型糖尿病、心血管疾患、腎臓病、アルツハイマー病、パーキンソン病、黄斑変性、虚弱(frailty)、呼吸器疾患、ある種のがんなど様々な慢性疾患の発症頻度が高まってきます。
このような加齢関連疾患の発症に慢性炎症が関わっていることは広く認識されています。
加齢が慢性炎症を引き起こして加齢関連疾患の発症を促進し、慢性炎症はさらに老化を促進し、加齢関連疾患をさらに悪化させます。このように、加齢と慢性炎症と加齢関連疾患との間には強い関連があり、悪循環を形成しています。
しかし、超高齢者では細胞の炎症応答が低下します。細胞活性全体が低下するためです。
高齢者では免疫細胞の活性が低下するので、感染症にかかりやすいという問題がありますが、免疫細胞の活性低下は炎症応答の低下によって、がん細胞の増殖活性を低下させることが示唆されます。
加齢というのは発がんの原因になりますが、細胞活性の低下は逆にがん細胞の増殖能を抑制して「発がんやがん進展の抑制」の原因にもなります。
超高齢者にがんが少ない原因の一つに炎症応答の低下は重要な因子です。
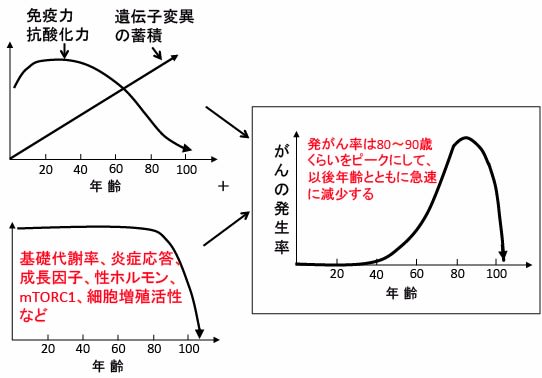
図:遺伝子変異は加齢とともに蓄積し、発がんを抑制する免疫力や抗酸化力は加齢とともに減少するので、がんの発生率は加齢とともに増加する。しかし、がんの発生率は80歳代をピークにして90歳代以降は急速に減少する。90歳以上で発がん率が減少する理由の一つとして80〜90歳以上になると発がん促進要因(基礎代謝率、炎症応答、成長因子、ホルモン、mTORC1活性、細胞増殖活性など)が減少するために、超高齢者の集団ではがんの発生率が低くなることが関与している可能性がある。
【高齢者のがんは放置の方が良い?】
日本でも百寿者(100歳以上)の剖検例が蓄積しています。そのデータによると100歳以上生きた人たちの直接死因で一番多いのは肺炎です。がんも半数くらい見つかりますが、多くは潜在がん、あるいは早期がんで、がんが進展して死因になっているのは1割程度だったと報告されています。
がんの治療法としてがん細胞を徹底的に取り除くことが長年行われてきました。80歳を超えてがんが偶然見つかっても、積極的な治療が行われています。
しかし、これからの高齢化社会に向かって高齢者のがん治療のあり方は議論する必要があります。
「超高齢者はがんが少ない」ことをこのブログで4回に分けて考察した目的は、「高齢者のがんは放置する方が良い」というエビエンス(根拠)をまとめることでした。少なくとも、現在の抗がん剤治療というのは高齢者ほどメリットが少なくなります。
高齢になるほど、がん細胞の増殖活性は低下し、体力や抵抗力や回復力は低下します。
増殖活性(細胞分裂)が低いがん細胞は、増殖活性の高いがん細胞に比べて抗がん剤が効きにくく、さらに体力や抵抗力や回復力の低下は副作用が強く出やすくなります。
つまり、高齢になるほど、抗がん剤のメリットは減少し、デメリットの方が増えることになります。
先週(4月27日)、以下のような報道がありました。(以下は産経ニュースより)
政府と国立がん研究センターが、高齢のがん患者に対する抗がん剤治療について「延命効果が少ない可能性がある」とする調査結果をまとめたことが26日、分かった。調査を踏まえ、厚生労働省は年齢や症状に応じたがん治療のガイドラインを作成する方針。今後は、患者の生活の質(QOL)向上も踏まえて効果の高い治療法を推進し、高齢社会におけるがん治療のあり方を検討する。
国立がん研究センターと厚労省、経済産業省が主体となり調査を実施した。平成19年から20年に同センター中央病院を受診したがん患者約7000人のうち、70歳以上の高齢者約1500人が対象。がんの種類別に、抗がん剤による治療を中心に行った場合と、痛みを和らげる「緩和ケア」に重点を置いた場合とで、受診から死亡までの期間(生存期間)を比較した。
その結果、主に肺がん▽大腸がん▽乳がん-で末期(ステージ4)の高齢患者の場合、抗がん剤治療の有無にかかわらず、生存率は同程度にとどまった。抗がん剤治療が明確な効果を示さない可能性があるという。
例えば肺がんの場合、生存期間が40カ月以上のグループは抗がん剤治療を受けなかった患者のみだった。同様に75歳以上で見た場合、10カ月以上生存した人の割合は、抗がん剤治療を受けなかった患者の方が高く、生存期間も長かった。このため、肺がんでは抗がん剤治療は5年生存率に効果を示さない可能性があると指摘した。胃がんと肝がんについては高齢の患者数が少なく評価を見送った。
政府は調査結果を基に、年齢や症状ごとに適切な治療を行うための診療プログラムの作成を図る方針。抗がん剤治療の副作用で苦しむ患者のQOL改善に役立てる考えだ。
「抗がん剤治療が明確な効果を示さない可能性がある」と控えめな表現になっていますが、「肺がんの場合、70歳以上では生存期間が40カ月以上のグループは抗がん剤治療を受けなかった患者のみだった。75歳以上では、10カ月以上生存した人の割合は、抗がん剤治療を受けなかった患者の方が高く、生存期間も長かった。」という結果は、「70歳以上の肺がんでは、抗がん剤治療を受けると早く死ぬ」と言っているのと同じです。胃がんも肝がんも他のがんも基本的には同じだと思います。
長くがんの臨床をやっていると、このような結果は当たり前のようであり、気づくのが遅すぎるという印象です。
将来的に画期的な薬ができて、75歳以上でも副作用が少なく、有効性が高い治療ができれば、75歳以上でも抗がん剤治療を受けるメリットはでてきます。
問題は、現時点の抗がん剤治療は75歳以上には「メリットがない」、あるいは「死を早めている可能性がある」ということです。
画期的な抗がん剤ができることを期待するしかありません。
進行がんの場合、西洋医学は抗がん剤治療か緩和治療の2つの選択肢しか持っていないのが問題です。抗がん剤治療がメリットがなければ、緩和ケアしか方法が無いからです。
漢方薬やサプリメントや食事療法など、体に負担をかけずにがん細胞の増殖を抑え、がんとの共存を目指すエビデンスのある治療法は幾つもあります。そのような代替療法を理解し、受け入れようとしない点が標準治療の問題かもしれません。
ゾウやクジラのように遺伝子レベルでの抗がん力の強化は今更できません。
高齢者における「がんとの共存」における具体的戦略は、がん細胞の増殖活性や代謝活性を低下させ、炎症応答を抑制することが重要です。
インスリン/インスリン様成長因子のシグナル伝達経路(PI3K/Akt/mTORC1)の抑制、AMP依存性プロテインキナゼー(AMPK)やFoxO3の活性化、インフラマソーム活性や炎症性サイトカイン産生の抑制などが候補になります。
このような目的では、糖質制限、ケトン食、メトホルミン、ジクロロ酢酸、ビタミンD3、メラトニンなど治療法の候補は多数あります。
| « 538)超高齢者... | 540)がん細胞... » |



