がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
540)がん細胞内を酸性化すると増殖が抑制され細胞死が誘導される

図:①炭酸脱水酵素IX(CAIX)は細胞膜に存在し、細胞外の二酸化炭素と水から重炭酸イオン(HCO3-)と水素イオン(H+)に変換する。②細胞外の重炭酸イオンは共輸送体によって細胞内に取り込まれる。③細胞質内の炭酸脱水酵素II(CAII)はミトコンドリアから産生される二酸化炭素を重炭酸イオンと水素イオンに変換する。④V型ATPアーゼ(vacuolar ATPase:液胞型ATPアーゼ)やモノカルボン酸トランスポーター(MCT)やNa+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などの仕組みを使って、細胞内の乳酸や水素イオン(プロトン)を細胞外に排出する。⑤重炭酸イオンは細胞内に保持される。その結果、⑥細胞外pH(pHe)は低下してより酸性化し、⑦細胞内pH(pHi)はよりアルカリ化される。⑧がん細胞は低酸素誘導因子-1(HIF-1)の活性が亢進し、グルコース・トランスポーター(GLUT-1)の発現が増加しグルコースの取り込みが増えている。さらにHIF-1は解糖系酵素と炭酸脱水酵素IX(CAIX)の発現も亢進する。炭酸脱水酵素やモノカルボン酸トランスポーター(MCT)やV-ATPaseを阻害すると、がん細胞内pHが低下(酸性化)して増殖が低下し死滅する。がん細胞外pH(pHe)がアルカリ化すると、がん細胞の浸潤や転移が抑制され、がん細胞に対する免疫細胞(T細胞やNK細胞)の働きが良くなる。ジクロロ酢酸ナトリウム、炭酸脱水酵素阻害剤、プロトンポンプ阻害剤、炭酸水素ナトリウム(重曹)を併用するとpHeをアルカリ化し、pHiを酸性化して、がん細胞の増殖・浸潤・転移を抑制し、細胞死を誘導できる。
540)がん細胞内を酸性化すると増殖が抑制され細胞死が誘導される
【酸塩基平衡と重炭酸緩衝系】
水素イオン指数(pH:potential of hydrogen)は水素イオンの濃度を表す物理量です。pHの読みは「ピーエイチ」(英語読み)、または「ペーハー」(ドイツ語読み)です。
pHは水素イオンのモル濃度を mol/Lで表した数値の逆数の常用対数で示したもので、数値が低いほど酸性(プロトン量が多い)、数値が高いほどアルカリ性(プロトン量が少ない)になります。
体内のpHは非常に狭い範囲で厳密に制御されています。
正常な動脈血のpHは7.35〜7.45という非常に狭い範囲で調節されています。
このpHの調節は酸と塩基のバランスで行われます。
「酸」というのは水素イオン(H+)を放出する物質で、「塩基」というのは水素イオン(H+)を受け取る物質です(下図)。

図:酸は水素イオンを放出し、塩基は水素イオンを受け取る
酸塩基のバランスを一定に保つ働きは体のいろいろなところで行なわれていますが、その中でも代表的な部位は、血液・体液、肺、腎臓です。
血液・体液における酸塩基平衡の調節で最も重要なのが重炭酸緩衝系です。
この系は、重炭酸イオン(HCO3-)が塩基となってプロトン(水素イオン)を受けとって中和してpHを一定に維持します。

体内で産生される水素イオンを重炭酸イオンが中和して、二酸化炭素は肺から排出されて血液・体液のpHが一定に維持されます。
【炭酸脱水酵素は重炭酸緩衝系の働きを高める】
炭酸脱水酵素(Carbonic Anhydrase)は炭酸(H2CO3)から水(H2O)を抜き取り二酸化炭素(CO2)にする酵素です。
私たちは酸素を体内に取り込んで、ミトコンドリアで糖や脂肪を分解してエネルギー(ATP)を産生しています。肺から取り込んだ酸素は血液中に拡散し、赤血球中のヘモグロビンに結合して全身の細胞に運ばれます。
この酸素呼吸の副産物として細胞内で二酸化炭素(CO2)が産生されますが、これは体外に排出する必要があります。この二酸化炭素は細胞外に拡散し、何種類かの方法で血液中を輸送されます。
10%未満は血漿中に溶けて、約20%はヘモグロビンと結合して運搬され、大半は炭酸(H2CO3)に変換されて輸送されます。
赤血球中に炭酸脱水酵素(Carbonic Anhydrase)があって、二酸化炭素が炭酸と重炭酸イオンに変換する作用を助けます。
肺では赤血球の炭酸脱水酵素が重炭酸イオンを二酸化炭素に戻す作用を助け、できた二酸化炭素は拡散して肺から排出されます。
この反応は酵素がなくても自然に起こりますが、炭酸脱水酵素は触媒作用によってこの変換速度を100万倍に加速することができます。
つまり、炭酸脱水酵素は二酸化炭素ガスを血液中に溶解させることによって呼吸によって排出できるようにしています。
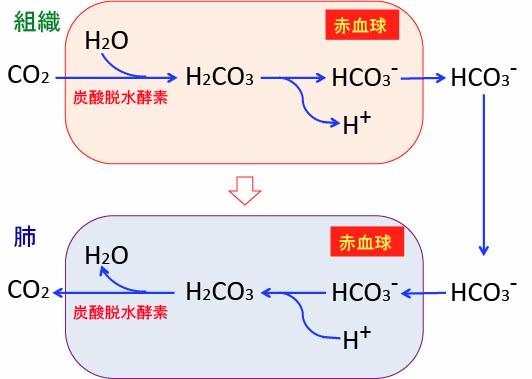
図:体内の組織で産生された二酸化炭素(CO2)は拡散して赤血球内で炭酸脱水酵素で重炭酸イオン(HCO3)に変換されて血清中に溶け込む。重炭酸イオンは肺で赤血球中の炭酸脱水酵素によって二酸化炭素に変換され、肺から排出される。
炭酸脱水酵素は二酸化炭素と水を炭酸(重炭酸イオン+水素イオン)に変換する酵素で、1933年に牛の赤血球から発見されました。その後、体内の全ての細胞に存在することが明らかになっています。
哺乳類の炭酸脱水酵素は構造や局在の異なる10種類以上のアイソザイムが知られています。
炭酸脱水酵素は重炭酸緩衝系を促進することによって、体液や細胞内の酸塩基平衡の制御に重要な働きを担っています。
つまり、動物において炭酸脱水酵素の主たる機能は、二酸化炭素と炭酸水素イオンとを相互変換することで、血液や他の組織の酸-塩基平衡を維持し、組織から二酸化炭素を運び出す補助をしています。
【がん細胞は大量のプロトン(水素イオン)を産生している】
がん細胞では、酸素が十分に利用できる状況でもミトコンドリアでの酸素呼吸が抑制され、グルコース(ブドウ糖)の取込みと解糖系が亢進し、乳酸の生成が増えているという物質代謝の特徴を持っています。これを好気性解糖(Aerobic glycolysis)あるいはワールブルグ効果(Warburg effect)と言います。
ミトコンドリアでの酸素呼吸は解糖系に比べると相対的には抑制されていますが、正常の細胞レベルには起こっています(下図)。

図:がん細胞ではグルコースの取り込みと解糖系が亢進し、ミトコンドリアでの酸素呼吸(酸化的リン酸化)は抑制されている。そのレベルはがん細胞によって異なるが、一つの平均的な数値として、正常細胞のグルコースの取込み量を1とした相対値を記載している。正常細胞では取り込まれたグルコースの8割くらいがミトコンドリアでの代謝に使われている(上図)。がん細胞でもミトコンドリアでの代謝は正常細胞と同程度に起こっているが、グルコースの取込みは10倍程度に亢進し、その多く(80〜90%)は解糖系で代謝され、乳酸の産生が顕著に増えている(下図)。(参考:Free Radic Biol Med 2015 Feb; 0: 253-263)
がん細胞は解糖系が亢進し、乳酸とプロトン(水素イオン)の産生が増えています。グルコース1分子が解糖で2分子の乳酸になるときに2分子のプロトン(H+)が産生されます(下図)。
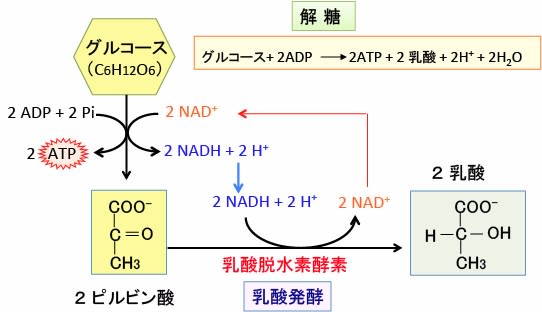
図:解糖系ではグルコースからピルビン酸、ATP、NADH + H+が作られる。嫌気性解糖系や乳酸発酵では、NADH + H+を還元剤として用いてピルビン酸を還元して乳酸にする。乳酸に変換する反応によってNAD+を再生することによって解糖系での代謝が続けられる。したがって、解糖系が亢進すると、細胞内で乳酸とプロトン(H+)が増える。
水素イオン(H+)が蓄積して細胞内のpHが低下して酸性になると細胞内のタンパク質の活性や働きは阻害され、pH低下が顕著になれば細胞は死滅します。そこで、がん細胞は乳酸や水素イオン(プロトン)を細胞外に積極的に排出しています。
乳酸はモノカルボン酸トランスポーター(MCT)という輸送担体で細胞外に排出されます。水素イオンは液胞型プロトンATPアーゼ(vacuolar H+-ATPases)、モノカルボン酸輸送体(monocarboxylate transporter:乳酸-プロトン共輸送体)、Na+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などによって細胞外に放出されます。
がん組織の酸性化した微小環境は、がん細胞の生存にとって様々なメリットを与えます。
組織が酸性化すると正常な細胞が弱り、結合組織を分解する酵素の活性が高まるため、がん細胞が周囲に広がりやすくなり、さらに血管新生が誘導されるので、がん細胞の浸潤や転移が促進されます。
組織が酸性になるとがん細胞を攻撃しにきた免疫細胞の働きが弱ります。
さらに乳酸には、がん細胞を攻撃する細胞傷害性T細胞の増殖や、免疫細胞の働きを高めるサイトカインの産生を抑制する作用があり、がんに対する免疫応答を低下させる作用もあります。
抗がん剤の多くは塩基性なので、酸性の組織には抗がん剤が到達しにくくなり、活性が低下するということも指摘されています。
したがって、がん組織の酸性化を改善できれば、抗がん剤治療や免疫療法の効き目を高めることができることになります。

図:がん細胞は解糖系によるグルコース代謝が亢進して乳酸と水素イオン(プロトン、H+)の産生量が増える。細胞内の酸性化は細胞にとって障害になるので、細胞はV型ATPアーゼ(vacuolar ATPase:液胞型ATPアーゼ)やモノカルボン酸トランスポーター(MCT)やNa+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などの仕組みを使って、細胞内の乳酸や水素イオン(プロトン)を細胞外に排出する。その結果、がん細胞の周囲はpHが低下してがん組織は酸性化している。組織が酸性化すると、免疫細胞の働きが抑制され、血管新生が促進し、がん細胞の浸潤や転移も促進される。
【炭酸脱水酵素はがん細胞内をアルカリ化する】
解糖系で産生される乳酸やプロトン(水素イオン)は、前述のようにV型ATPアーゼ(vacuolar ATPase:液胞型ATPアーゼ)やモノカルボン酸トランスポーター(MCT)やNa+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などの仕組みを使って細胞外に排出されます。
二酸化炭素は炭酸脱水酵素によって排出が促進されます。この場合、細胞質内の炭酸脱水酵素IIは二酸化炭素(CO2)と水(H2O)から重炭酸イオン(HCO3-)と水素イオン(H+)を産生し、水素イオンは上記の方法で細胞外に排出され、重炭酸イオンは細胞内に保持されます。
また、細胞膜に存在する炭酸脱水酵素IXは細胞外で二酸化炭素を水から生成される炭酸を重炭酸イオン(HCO3-)とプロトン(H+)にして重炭酸イオンは共輸送体によって細胞内に取り込まれます。
この炭酸脱水酵素IXは低酸素誘導因子-1(HIF-1)によって発現が誘導されます。がん細胞ではHIF-1の発現と活性が亢進しています。HIF-1は解糖系が亢進してプロトン(水素イオン)の産生を亢進して細胞外を酸性化します。炭酸脱水酵素IXの発現亢進はがん細胞内をアルカリ化するのに役立っています。

図:①炭酸脱水酵素IX(CAIX)は細胞膜に存在し、細胞外の二酸化炭素と水から重炭酸イオン(HCO3-)と水素イオン(H+)に変換する。②細胞外の重炭酸イオンは共輸送体によって細胞内に取り込まれる。③細胞質内の炭酸脱水酵素II(CAII)はミトコンドリアから産生される二酸化炭素を重炭酸イオンと水素イオンに変換する。④水素イオンは細胞外に排出され、重炭酸イオンは細胞内に保持される。その結果、⑤細胞外pH(pHe)は低下してより酸性化し、⑥細胞内pH(pHi)はよりアルカリ化される。
その結果、細胞外は酸性になり、細胞内はさらにアルカリ性になります。
がん組織の微小環境は血液やリンパ液の循環が悪いので、水素イオンはがん組織に蓄積します。その結果、がん細胞の周囲の組織は水素イオンの濃度が高くなってpHが低下します。
正常の組織のpHは7.3〜7.4程度とややアルカリ性ですが、がん組織の微小環境のpHは6.2〜6.9とより酸性になっていると言われています。

図:正常細胞では細胞内pH(pHi)は6.99〜7.05とほぼ中性で、細胞外pH(pHe)は7.3〜7.4とアルカリ性になっていて、pHeがpHiより高い。一方、がん細胞では細胞内pHは7.12〜7.7とアルカリ性になって、細胞外pHは6.2〜6.9と酸性になって、pHiがpHeより高い。
【がん細胞内のアルカリ化は解糖系亢進(ワールブルグ効果)を促進している】
上述のように、細胞内pHと細胞外pHの差は正常細胞ではマイナス(細胞外の方がpHは高い)でがん細胞ではプラス(細胞内の方がpHは高い)になっています。
がん細胞において、細胞内pHがアルカリ性で、細胞外が酸性という状況が細胞増殖や血管新生を促進する重要な要因になっていることが明らかになっています。
したがって、がん細胞の細胞内pHを低下(酸性化)させ、細胞外pHを高める(アルカリ化)方法は、有望ながん治療となります。
がん細胞では、解糖系の亢進によって乳酸とプロトン(水素イオン)の産生は亢進しています。しかし、がん細胞では、プロトンの細胞外排出能を高めることによって、細胞内をアルカリ性に維持し、細胞外の酸性度を高めています。
この細胞外へのプロトンの排出は前述のように、Na+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)、液胞型プロトンATPアーゼ(vacuolar H+-ATPases)、H+/Cl− 共輸送体(H+/Cl− symporter)、モノカルボン酸輸送体(monocarboxylate transporter:乳酸-プロトン共輸送体)、ナトリウム依存性Cl−/HCO3− 交換体(Na+-dependent Cl−/HCO3− exchangers)、炭酸脱水酵素(Carbonic anhydrase)、ATP合成酵素(ATP synthase)などのトランスポーターや酵素によって制御されています。
がん細胞は解糖系での代謝が亢進しており、その結果、乳酸とプロトン(水素イオン)の産生が増えています。
この乳酸とプロトンを細胞外に積極的に放出することによって、細胞内はアルカリ側に維持しています。がん組織は細胞外液の循環が悪いので、細胞外に乳酸やプロトンが蓄積して、細胞外は酸性になっています。このpH勾配の逆転ががん細胞の悪性化進展に関与していることが示されています。
がん遺伝子を導入して細胞のがん化を誘導する実験で、細胞のがん化の過程の初期にNa+-H+ exchanger 1(Na+-H+ 交換輸送体1: 1NHE1)活性が亢進して、がん細胞内のpHがアルカリ化することが観察されています。
この細胞内のアルカリ化は、解糖系での酵素活性を高め、好気性解糖(ワールブルグ効果)を亢進し、細胞の増殖を促進します。
つまり、細胞のがん化過程においてNHE1活性が亢進し、細胞内のアルカリ化が亢進することが、細胞の解糖系とがん化過程をさらに亢進することになるのです。
がん細胞のエネルギー代謝で最も特徴的なのが、酸素が十分に利用できる状況でも、がん細胞はミトコンドリアでの酸素呼吸(酸化的リン酸化)が抑制され、酸素を使わない解糖系でのグルコース代謝が亢進していることです。
この現象は、オットー・ワールブルグ博士によって発見されたのでワールブルグ効果と呼ばれています。
解糖系と酸化的リン酸化の活性は細胞内pHに依存していますが、その作用は逆です。つまり、細胞内のアルカリ化に伴って、酸素呼吸から解糖に移行するのです。
細胞内pH(pHi)がアルカリ化すると解糖系酵素(ホスホフルクトキナーゼ-1や乳酸脱水素酵素など)の活性が亢進することが明らかになっています。
解糖で1分子のグルコースから2分子のプロトンが産生されます。
NHE1(Na+-H+ 交換輸送体1:Na+-H+ exchanger 1)は細胞外のナトリウムイオンと細胞内のプロトンを交換しながら細胞内のプロトンを細胞外に放出する働きを示す交換輸送体です。
pHiが低下(酸性化)するとNHE1にプロトンが結合して構造が変化し活性化します。
NHE1の発現と活性が亢進すると、細胞内はアルカリ化し、細胞外は酸性になります。
NHE1の発現が多いほど、予後が悪いことが報告されています。
がん細胞内が酸性になるとNHE1にプロトンが結合して活性が亢進するので、細胞内の解糖系を阻害するとNHE1の活性を抑制できます。
また、NHE1の発現は低酸素誘導因子-1(HIF-1)で誘導されるので、HIF-1の活性を抑制すると、NHE1の活性を抑制できます。
モノカルボン酸トランスポーター(Monocarboxylate transporter:MCT)は乳酸やピルビン酸やケトン体と一緒にプロトン(水素イオン)を受動拡散で排出する共輸送体です。これもHIF-1で誘導されます。
HIF-1はプロトンを細胞外に排出するポンプやトランスポーターや酵素の発現を亢進して、細胞内pHをアルカリ性(7.3以上)に維持しようとしています。したがって、HIF-1の発現や活性を抑えることは、がん組織の酸性化を阻止します。
ラパマイシンやジクロロ酢酸やジインドリルメタンはHIF-1の活性を抑制します。(364話参照)
モノカルボン酸トランスポーター(MCT)はpHi(細胞内pH)を高め、pHe(細胞外pH)を低下させます。MCTを阻害するとpHiが低下(酸性化)して増殖活性が低下することが示されています。
液胞型プロトンATPアーゼ(V-ATPases)はATPのエネルギーを使ってプロトンを細胞外に排出します。
NHE1やMCTの阻害剤は抗がん作用が期待できるので開発中ですが、まだ臨床で使用できるものはありません。
一方、液胞型プロトンATPアーゼ(V-ATPases)は、胃薬として既に使用されているプロトンポンプ阻害剤で阻害できることが報告されています。
プロトンポンプ阻害剤で細胞外をアルカリ性にして細胞内を酸性にすると、がん細胞の増殖を抑え、抗がん剤の効き目を高めることができます(527話参照)。
炭酸脱水酵素阻害剤は、すでに使われている薬があります。アセタゾラミド(商品名:ダイアモックス)は炭酸脱水酵素阻害作用によって利尿剤や緑内障の治療に使われています。
【炭酸脱水酵素の発現の多いがんは予後が悪い】
炭酸脱水酵素は10種類以上のアイソザイムが存在し、構造や局在が異なります。このうち炭酸脱水酵素IX(carbonic anhydrase IX)は低酸素誘導因子-1(HIF-1)によって発現が誘導され、がん細胞内のpHをアルカリ性にする働きを担っています。
炭酸脱水酵素の発現が亢進しているがんは予後が悪いことが多数の研究で明らかになっています。例えば、以下のような報告があります。
Hypoxia-inducible factor 1 promotes chemoresistance of lung cancer by inducing carbonic anhydrase IX expression.(低酸素誘導因子-1は炭酸脱水酵素IXの発現を誘導することによって肺がん細胞の抗がん剤抵抗性を促進する)Cancer Med. 2017 Jan;6(1):288-297.
低酸素誘導因子-1(HIF-1)の活性亢進は抗がん剤抵抗性を引き起こします。
HIF-1はグルコーストランスポーター(GLUT-1)の発現を亢進してグルコースの取り込みを促進します。さらに解糖系酵素の発現を誘導し、解糖系での糖代謝を亢進します。さらに、HIF-1は炭酸脱水酵素IXの発現を亢進します。
この論文では、肺がん細胞株A549を用いたin vitroの実験系で、低酸素で培養してHIF-1の発現を誘導し、GLUT-1と炭酸脱水酵素IXの発現を誘導すると、HIF-1とGLUT-1と炭酸脱水酵素の発現レベルに比例して、肺がん細胞の抗がん剤抵抗性が亢進することを明らかにしています。
したがって、HIF-1と炭酸脱水酵素の活性を阻害すると肺がん患者の予後を良くできると考察しています。
以下のような論文があります。
Prognostic Significance of Carbonic Anhydrase IX Expression in Cancer Patients: A Meta-Analysis.(炭酸脱水酵素IXの発現レベルはがん患者の予後と関連する:メタ解析)Front Oncol. 2016 Mar 29;6:69.
がん組織の低酸素状態は、増殖・浸潤・転移の促進や治療抵抗性と関連しており、がん患者の予後を悪くしています。炭酸脱水酵素IXは低酸素誘導因子-1で発現が誘導されます。
炭酸脱水酵素IXとがんの悪性度やがん患者の予後との関係が多数報告されており、これらの論文(147件の研究結果)のデータをメタ解析しています。
解析の結果、炭酸脱水酵素の発現が高いほど、再発が多く、生存期間が短くなることを明らかにしています。
その他、炭酸脱水酵素IXの発現が高いほど、がん細胞の悪性度が高くなることは前立腺がんなど多くのがん種で報告されています。
2000年に炭酸脱水酵素IXの遺伝子調節領域に低酸素誘導エレメントの存在が明らかになってから、がん細胞における低酸素誘導因子-1(HIF-1)と炭酸脱水酵素IXとの関連が明らかになり、炭酸脱水酵素IXの発現はがん細胞の増殖や悪性化進展のマーカーとして検討されています。炭酸脱水酵素IXの発現や活性の阻害はがん治療に役立つことが指摘されています。
【がん細胞の細胞内を酸性にするがん治療】
Acetazolamide(商品名:ダオアモックス)は炭酸脱水酵素の非特異的な阻害剤で、利尿作用や緑内障の治療薬として使用されています。
Acetazolamideが抗がん剤やmTORC1阻害剤の抗腫瘍効果を高めることが報告されています。
また、シクロオキシゲナーゼー2(COX-2)阻害剤のcelecoxib(商品名セレコックス)が炭酸脱水酵素の阻害作用があることが報告されています。以下のような報告があります。
The cyclooxygenase-2 inhibitor celecoxib is a potent inhibitor of human carbonic anhydrase II.(シクロオキシゲナーゼ-2阻害剤のセレコキシブはヒト炭酸脱水酵素の強力な阻害剤)Inflammation. 2004 Oct;28(5):285-90.
【要旨】
シクロオキシゲナーゼー2(Cyclooxygenase-2;COX-2)は間質細胞や炎症細胞で発現が亢進している。この誘導性のシクロオキシゲナーゼ・アイソフォームのCOX-2は炎症やある種のがんや虚血の脳組織などで発現が誘導される。
組織の酸性化は炎症において、疼痛や知覚過敏の原因となる。
最近の研究で、COX-2阻害剤のCOX非依存性のメカニズムによる薬効が報告されており、その中に炭酸脱水酵素(carbonic anhydrase)阻害作用がある。
炭酸脱水酵素は亜鉛を活性部位に含む金属酵素で腎臓などの様々な組織や細胞に存在し、酸-塩基バランスに働いている。
腎臓には、COX-2の発現量が非常に高い。セレコキシブは、炭酸脱水酵素阻害剤の代表であるアセタゾラミド(acetazolamide)と同様に、非置換型のスルホンアミド基を持つ特徴的構造を持っている。
本研究では、セレコキシブがナノモルレベルの低濃度でヒト炭酸脱水酵素II(carbonic anhydrase II)を強力に阻害する作用を有することを報告する.
Valdecoxibは比較的弱い活性を示し、炭酸脱水酵素阻害剤に特徴的な非置換型のスルフォンアミド基を有しないRofecoxibは、ヒト炭酸脱水酵素阻害作用を示さなかった。
非置換スルホンアミドを持つセレコキシブおよびバルデコキシブによるヒト炭酸脱水酵素の阻害作用を示すこれらのデータは、作用機序の解明ならびにCOX-2阻害剤に付随する副作用に重要な意味を有する可能性がある。
アセタゾラミドと同様に、非置換型のスルホンアミド基を持つCOX-2阻害剤のセレコキシブとバルデコキシブは炭酸脱水酵素阻害作用を持つという報告です。

図:COX-2阻害剤のCelecoxibとValdecoxibはAcetazolamideと同様にスルホンアミド基を持ち、炭酸脱水酵素を阻害する作用があると報告されている。
がん細胞ではグルコースの取込みと解糖系が亢進し、乳酸と水素イオンの産生が増えています。一方、がん細胞はプロトンの細胞外排出能を高めることによって、細胞内をアルカリ性に維持し、細胞外の酸性度を高めています。
実験で、モノカルボン酸トランスポーター(MCT)と炭酸脱水酵素IXを阻害するとがん細胞内に乳酸とプロトンが蓄積して細胞内pHが低下(酸性化)して死滅するという報告があります。
植物のミノバラン(Terminalia chebula)の実にMCTの阻害作用があるという報告があります。
The Role of Monocarboxylate Transporters and Their Chaperone CD147 in Lactate Efflux Inhibition and the Anticancer Effects of Terminalia chebula in Neuroblastoma Cell Line N2-A. (神経芽細胞腫N2-A細胞における乳酸排出阻害と抗がん作用におけるモノカルボン酸トランスポーターとそのシャペロンタンパク質CD147の役割)European J Med Plants. 2016; 12(4): EJMP.23992.
この論文では、900種類の植物のエキスをスクリーニング(探索)して、ミノバラン(Terminalia chebula)の実のエキスに最も強いMCT阻害活性があったと報告されています。ミノバランの実は「訶子 (カシ)」という生薬名で漢方でも良く使われています。インド伝統医学のアーユルヴェーダでも頻用されています。
したがって、訶子 (カシ)とアセタゾラミド(ダイアモックス)やセレコキシブ(セレコックス)の併用はがん細胞内を酸性化して死滅できるかもしれません。

図:がん細胞はグルコースの取込みと解糖系の亢進で乳酸と水素イオンの産生が亢進している、生薬の訶子 (カシ)のエキスでモノカルボン酸トランスポーター(MCT)を阻害し、アセタゾラミド(ダイアモックス)やセレコキシブ(セレコックス)で炭酸脱水酵素を阻害すると、がん細胞内に乳酸や水素イオンや二酸化炭素を蓄積して細胞内が酸性化して死滅するかもしれない。
がん細胞の細胞外pH(pHe)をアルカリ化し、細胞内pH(pHi)を酸性化するとがん細胞の増殖を抑え、細胞死を誘導し、抗がん剤治療や免疫療法の効き目を高めることができます。
この目的では、低酸素誘導因子-1(HIF-1)の活性抑制、ミトコンドリアの活性亢進、炭酸脱水酵素阻害、プロトンポンプ阻害、重炭酸ナトリウム(重曹)によるプロトン(水素イオン)の消去、解糖系抑制、モノカルボン酸トランスポーターの活性阻害などを組み合せる治療法が考えられます。これらを副作用の出ない量で服用すると、相乗効果による抗腫瘍効果が期待できかもしれません。
この治療法の抗腫瘍効果の根拠は、「がん細胞内のpHが酸性化し、がん細胞外のpHがアルカリ化するとがん細胞は死滅する」ということです。そのためには、ワールブルグ効果の是正(解糖系の阻害とミトコンドリアでの酸素呼吸の促進)と、 プロトンポンプ阻害剤や炭酸水素ナトリウム(重曹)などを用いたがん組織のアルカリ化が重要です。さらにメトホルミンやオーラノフィンやジスルフィラムなどによってがん細胞内の酸化ストレスを高める治療を併用すれば、がん細胞が死滅していく可能性が高くなります。試してみる価値はある代替療法です。
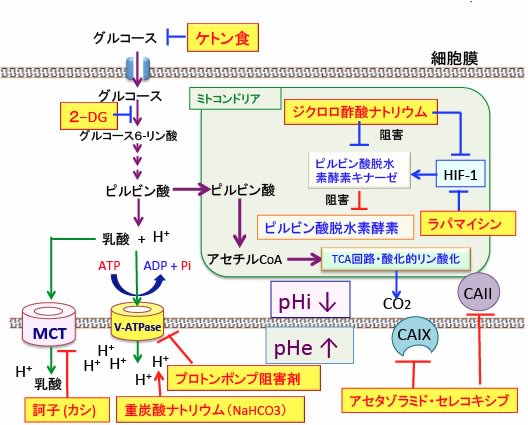
図:低酸素誘導因子-1(HIF-1)の活性抑制(ラパマイシン、ジクロロ酢酸ナトリウム)、ミトコンドリアの活性亢進(ジクロロ酢酸ナトリウム)、炭酸脱水酵素阻害(アセタゾラミド、セレコキシブ)、プロトンポンプ阻害(オメプラゾール)、重炭酸ナトリウム(重曹)によるプロトン(水素イオン)の消去、解糖系抑制(ケトン食、2-デオキシグルコース)、モノカルボン酸トランスポーターの活性阻害(訶子)などを組み合せると、がん細胞内のpH(pHi)を酸性化し、細胞外のpH(pHe)をアルカリ化して、がん細胞の増殖・浸潤・転移を抑制し細胞死を誘導できる。
著書紹介:

詳しくはこちらへ:
| « 539)超高齢者... | 541)乳酸脱水... » |



