がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
397) 漢方がん治療とメトロノミック・ケモテラピー
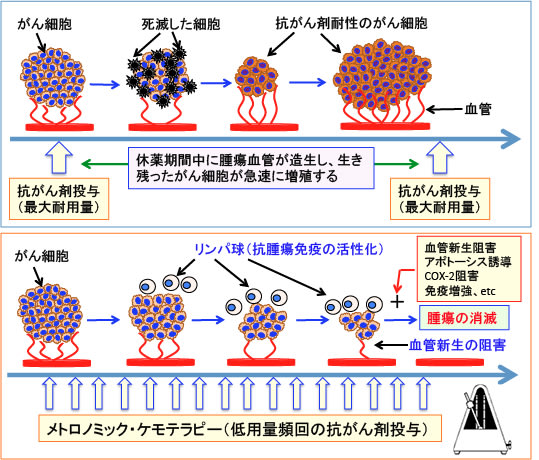
図:通常の抗がん剤治療は、副作用に耐えられる最大量(最大耐用量)の抗がん剤を投与する。この場合、正常組織へのダメージも強いので副作用も強く現れる。また、正常組織のダメージを回復させる必要があるため、抗がん剤投与の間に休薬期間が必要であるが、この休薬期間に腫瘍血管が急速に再生し、生き残ったがん細胞が増殖する。抗がん剤が効きにくい強いがん細胞が選択的に生き残るので、がん組織は次第に抗がん剤が効きにくい細胞が多くなってくる。(図の上)
一方、休薬期間を設けないで、メトロノームのように定期的に頻回に低用量の抗がん剤を投与するメトロノミック・ケモテラピー(Metronomic Chemotherapy)では、血管新生が抑制されて抗腫瘍効果を発揮する。また、低用量の抗がん剤投与は副作用が少なく、免疫系組織の抑制も回避できる。低用量の抗がん剤投与は腫瘍免疫を抑制する制御性T細胞の活性を阻害する作用があり、その結果、がん細胞を排除する抗腫瘍免疫が増強される。メトロノミック・ケモテラピーだけでは抗腫瘍効果に限界があるが、血管新生阻害やアポトーシス誘導やシクロオキシゲナーゼ-2(COX-2)阻害や免疫増強などの治療法を併用すると、さらに抗腫瘍効果を高め、腫瘍を消滅させることも可能になる。
397) 漢方がん治療とメトロノミック・ケモテラピー
【がんの標準治療と補完・代替医療】
がんの標準治療は手術と放射線治療と化学療法(抗がん剤治療やホルモン療法)の3つが主体になっています。
がんが限局している時は手術や放射線治療やラジオ波治療などの方法で、がん組織そのものを切除あるいは死滅させることによって根治できます。
このような場合のがんの補完・代替医療は、治療後の回復促進や再発予防を目標とした食事療法や漢方薬やサプリメントなど副作用がほとんど無い治療法が中心になります。
がん治療の最大の問題点は、がん細胞が他の臓器などに転移して全身に広がった場合に根治できる確実な方法が無いことです。
ステージ4のがん治療に対しては、30年以上にわたってその治療成績はほとんど向上していません。
その理由は、がんが全身に広がった場合は抗がん剤治療が中心になりますが、固形がんに対して現在使われている抗がん剤では根絶できないからです。(367話参照)
最初の抗がん剤はナイトロジェンマスタードで、第一次世界大戦に化学兵器として使われたマスタードガスのイオウ原子を窒素に置き換えた化合物です。DNAをアルキル化することによって核酸の合成を阻害して細胞の増殖を抑えます。
ナイトロジェンマスタードが最初にがん患者に使用されたのは1946年で、非ホジキンリンパ腫の症例で、劇的な効果が認められました。
その後毒性を弱めたナイトロジェンマスタード誘導体が開発され、シクロフォスファミドやメルファランといった抗がん剤が現在も使用されています。これらはアルキル化剤という抗がん剤に分類されています。
抗がん剤治療の成績も分子標的薬などの新薬の開発によって一部のがんでは向上していますが、多くのがんではあまり成績は上がっていません。それは、30年以上前から使われている抗がん剤の多くがまだ使用されていることからも判ります。
現在使用されている抗がん剤の多くは1953年から1983年の間に開発されていると言われています。例えば、シクロフォスファミド(商品名:エンドキサン)は1958年に合成され、1959年に臨床試験が開始され、1962年に注射用製剤と錠剤が販売され、それ以来、各種の悪性腫瘍の治療に主要な抗がん剤として使用されています。
つまり、50年以上前に販売された薬がいまだにメインの抗がん剤として使用されていることが、抗がん剤や抗がん剤を使った治療法の開発に革新的な進歩がないことを示唆しています。
通常の抗がん剤治療は、副作用が耐えられる最大量(最大耐用量)を投与してがん細胞を短期間で死滅させる方法が基本になっています。
抗がん剤に対する耐性が出てくる前に短期間にがん細胞を全滅させる方が良いと考えるからです。白血病や悪性リンパ腫ではこの方法が有効です。
しかし、固形がんの場合は、この方法は必ずしも有効ではありません。
精巣腫瘍や小細胞性肺がんのように抗がん剤治療が著効を示す固形がんもありますが、多くの固形がん(肺がんや膵臓がんや胃がんなど)に対しては、抗がん剤の効き目は極めて限定的です。
固形がんの多くは抗がん剤治療に抵抗性を示し、抗がん剤治療だけでは全身に広がったがん細胞を根絶させることは、ほぼ不可能です。
さて、このような進行したがん患者さんに対する標準治療に限界があるため、様々な補完・代替医療が提唱され、利用されています。その中には遺伝子治療や免疫療法などの先端医療もあり、これらは有効性が証明されれば標準治療に取り入れられる可能性があります。
未認可医薬品や認可薬の適応外使用や、漢方薬、サプリメントなどを使った代替医療や、特殊な食事療法もあります。
このような代替医療における治療法の目標は様々です。つまり、がんの縮小を積極的に行うような方法や、がんを大きくせずにがんとの共存を目標にする方法や、抗がん剤治療の副作用軽減や症状の緩和を目標にする方法などです。
【漢方薬でがんを縮小できるか?】
がん治療における漢方治療の目的は、①標準治療の副作用軽減や症状の改善といった補完治療と、②がんの抑制や縮小を目指す代替治療の2つに大別されます。
①の標準治療の補完というのは、体力や抵抗力や免疫力を高めることによって標準治療(手術や抗がん剤治療や放射線治療)の副作用の軽減や症状の改善や緩和、治療後の回復の促進などを目標とします。
がん治療における漢方治療の併用が再発率の低下や生存率の向上に有効であることは多くの臨床試験によって示されています。
例えば、ステージIIIとIVの進行肺がん患者の抗がん剤治療において、中医薬(漢方薬)を併用した場合の効果を検討した24のランダム化臨床試験のデータをメタ解析した報告があります。それによると、抗がん剤治療に中医薬治療を併用すると、(1)毒性(副作用)を軽減し、(2)生存率を向上し、(3)奏功率を高め、(4)全身状態(KPS)を改善することが示されています。(345話参照)
また、肝臓がんの抗がん剤治療に漢方治療を併用すると、抗がん剤のみで治療した場合に比べて、12ヶ月後、24ヶ月後、36ヶ月後の生存率はそれぞれ1.55倍、2.15倍、2.76倍に向上し、抗がん剤治療によって腫瘍が縮小する率(率奏功率)は1.39倍に上昇することが、26件の臨床試験(対象患者総数2079例)のメタアナリシスで示されています。(105話参照)
その他、多くの臨床試験で有効性と安全性のエビデンスが報告されています。(171話参照)
つまり、がん患者さんの体調や症状の改善や標準治療の補完としての漢方治療の有効性や有用性は十分なエビデンスがあると言えます。
ただし、多くのがん治療の専門医は標準治療以外の治療法の併用を否定するので、がん治療の副作用軽減の目的で漢方治療を積極的に利用している医師は極めて少ないのが現状です。
②の漢方治療の抗がん作用に関しては、『漢方薬はがんに効かない』と多くの医師は断定的に否定しています。確かに、食欲増進や体力増強が効能の主体の処方のエキス製剤の場合は、がん細胞の増殖を抑制したり死滅させる効果は皆無と言えます。
しかし、抗がん作用のある成分を含む生薬(いわゆる「抗がん生薬」)を多く使った煎じ薬は、がん細胞の増殖を抑えたりがん組織を縮小させる効果が実際にあります。
実際に、漢方治療だけで腫瘍マーカーが継続的に低下したり、画像検査で腫瘍の縮小効果を得ることは、それほど稀ではありません。
それは、植物成分には動物に毒になるものがあり、その様な成分が抗がん作用を示すからです。現在使用されている抗がん剤の中にも、ビンカアルカロイドやタキサン類やイリノテカンなど植物成分から開発されたものが数多くあります。(22話、309話、324話参照)
つまり、抗がん生薬を使った漢方治療というのは、低用量頻回投与の抗がん剤治療と類似のメカニズムで抗腫瘍活性を示している可能性があります。
この低用量頻回投与の抗がん剤治療はメトロノミック・ケモテラピー(Metronomic Chemotherapy)と呼ばれる治療法です。がんの漢方治療のメカニズムはメトロノミック・ケモテラピーとの類似性から考察することができます。
漢方治療だけでは抗腫瘍効果は強くはないので、他の治療法との併用を検討する必要があります。
メトロノミック・ケモテラピーもこれだけでは治療効果に限界があるので、様々な併用療法が検討されています。
つまり、漢方がん治療の効果を高める併用療法を考える際の参考として、メトロノミック・ケモテラピーの効果を高める併用療法を検討した研究は役立ちます。
【抗がん剤治療における最大耐用量投与と低用量頻回投与】
局所に限局したがん組織の治療においては、手術と放射線治療の有用性について意義を唱える意見は少ないと言えます。
しかし、抗がん剤治療に対しては多くの批判があります。
がんが進行して全身に広がると基本的には手術や放射線治療の適応はなく、抗がん剤治療が主体になりますが、「抗がん剤は効かない」とか「抗がん剤は百害あって一利なし」といった抗がん剤治療の限界や欠点を強調した意見は多くあります。そのような意見を述べた書籍の多くはベストセラーになるほどです。
このような意見に対して、標準治療を行う立場の専門医から、明確な反論は少ないように思います。その理由の一つは、抗がん剤治療の投与法自体にコンセンサスが得られていない点が多いからです。つまり、がん治療の専門医の間でも投与量や投与法で異なる考えがあるのです。がん専門医の間で抗がん剤治療の方法に統一見解が無ければ、論理的な反論は困難です。
例えば、現在の抗がん剤治療の基本は、患者が耐えられる最大の投与量(最大耐用量)を投与します。抗がん剤の投与量を増やせば増やすほど、がん細胞を死滅させる効果は強くなります。しかし一方、抗がん剤の投与量が増えれば増えるほど正常細胞のダメージによる副作用が強くなり、投与量が限界を超えれば患者さん自身が死亡してしまいます。
患者さんが副作用に耐えられる投与量の範囲で最大限の投与量を設定するのが、最も効果が高いという意見が一般的ですが、この最大耐用量の抗がん剤投与の方法には様々なデメリットと欠陥が指摘されています。
正常組織にダメージを与えて強い副作用を引き起こすだけでなく、免疫力を低下させたり、がん組織の血管新生を促進する可能性や、抗がん剤耐性のがん細胞の出現を促進する可能性などが指摘されています。
このようなデメリットを防ぐ抗がん剤治療法として、メトロノミック・ケモテラピー(Metronomic Chemotherapy)という概念が提唱され、その有効性を示すエビデンスが最近多く報告されています。
メトロノミックとは、リズムを刻む「メトロノームの様な」という意味で、メトロノミック・ケモテラピーとは、メトロノームのように規則的に低用量の抗がん剤を頻回に投与していく抗がん剤治療法です。
最大耐用量を投与する抗がん剤治療では、正常組織のダメージを回復させる期間をもうけるために、週一回とか月に一回というように間歇的な投与法になりますが、この休薬期間に腫瘍血管内皮細胞が急速に再生し、腫瘍血管の新生が亢進して、腫瘍の増大が起こります。
一方、メトロノミック・ケモテラピー(休薬期間をもうけない長期間の低用量投与)では、腫瘍の増大に必要な血管新生を抑制でき、がん細胞の増殖を阻止できると考えられています。
さらに、低用量の投与であるため、副作用が少なく、また免疫細胞の働きを抑えている制御性T細胞の働きを阻害するので、免疫力はむしろ高くなるという効果も報告されています。(トップの図)
近年、メトロノミック・ケモテラピーの有効性を示す報告が多くなっており、最大耐用量を投与する現行の抗がん剤治療に代わる「体にやさしい抗がん剤治療法」として注目されつつあります。
【高用量の抗がん剤投与は腫瘍血管の新生を促進する】
最大耐用量の抗がん剤投与の問題点の一つは、最大耐用量の抗がん剤投与によってダメージを受けた正常組織の回復を計るために休薬期間が必要な点です。そして、この休薬期間にがん組織を養う腫瘍血管の新生が促進されて、腫瘍の増大が起こります。
以下のような論文があります。
Maximum tolerable dose and low-dose metronomic chemotherapy have opposite effects on the mobilization and viability of circulating endothelial progenitor cells.(最大耐用量と低用量メトロノミックケモテラピーは、循環している血管内皮前駆細胞の移動と生存に逆の効果を示す)Cancer Res. 63(15): 4342-6, 2003年
【要旨】
がん組織の増殖には血管発生(vasculogenesis:血管内皮前駆細胞による新しい血管の形成)が必要であることを示すエビデンスが増えている。
この論文では、ヒト悪性リンパ腫細胞を移植した免疫不全マウスを用いた動物実験モデルにおいて、シクロフォスファミドを21日間の休薬期間をもうける最大耐用量投与の場合と、低用量で継続的に頻回投与するメトロノミックなスケジュールで投与する場合で、血中に循環する血管内皮前駆細胞の移動と生存に対して逆の作用を示すことを明らかにした。
最大耐用量のシクロフォスファミドを投与されたマウスでは、シクロフォスファミド投与終了して数日後には大量の血管内皮前駆細胞が血中に出現し、腫瘍は急速に薬剤耐性になった。
一方、シクロフォスファミドの低用量頻回投与を受けたマウスでは、血中の血管内皮前駆細胞の数と生存率は継続的に減少を示し、腫瘍組織の増大が持続的に抑制された。
これらの結果は、抗がん剤のメトロノミックな低用量頻回投与法は骨髄から血中への血管内皮前駆細胞の移動を阻止することによって、新しい血管の形成(血管発生)による腫瘍の増大を抑制することを示しており、有用な治療法となりうる可能性がある。
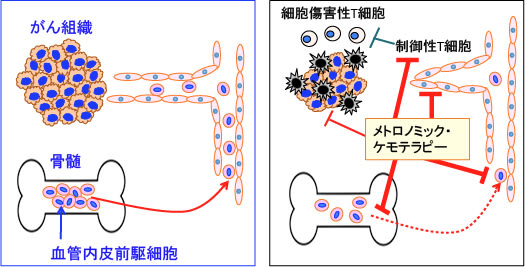
血管内皮前駆細胞(endothelial progenitor cells)というのは、骨髄由来の血液中に存在する幹細胞で、がんや創傷治癒や虚血部位において血管形成に関与する細胞です。サイトカインや成長因子などの作用で骨髄から動員されて新たな血管形成(血管発生)に使われます。
従来、成体の血管形成は、既存血管の内皮細胞が増殖・遊走して新たな血管を作り出す血管新生(angiogenesis)という概念が中心でしたが、1997年に成人末梢血液中に血管内皮前駆細胞(Endothelial Progenitor Cell: EPC)が発見されてから、胎生期のみに起こるとされていた血管発生(vasculogenesis)という現象が成体においても認められ、局所でEPCが増殖・分化して血管新生に関わっていることが明らかになっています。
通常、EPCは骨髄に存在していますが、ケガなどで組織や血管が損傷されるとEPCが血液の中を流れて、損傷部位に呼び集められ、新たな血管を作り、組織の修復を行います。再生医学では虚血性疾患(閉塞性動脈硬化症や糖尿病性足壊疽など)の治療への利用が研究されています。
一方、がん治療においては、この論文にあるように、腫瘍血管の形成に関与し、腫瘍の増大を引き起こす原因としてEPCが検討されています。がん組織が大量の抗がん剤で死滅すると、正常組織の修復と同じ機序で、がん組織の血管を修復・再生するためにEPCが骨髄から動員され、腫瘍血管の形成と造生に利用されるのです。
骨髄からのEPCの動員や血中のEPCの数を減らすことががん治療に有効だと考えられています。
通常の最大耐用量を投与する抗がん剤治療では、正常組織のダメージを回復するために設けた休薬期間にEPCの動員が起こり、腫瘍血管の新生が亢進し、その結果、腫瘍の増大が促進されるという現象が起こります。
一方、抗がん剤の低用量頻回投与によるメトロノミック・ケモテラピーではEPCの動員が起こらず、血中のEPCの数も減少するので、腫瘍の増大が起こらないという結果です(下図)。
がん組織のうち30から99%が正常細胞と言われています。がん細胞の塊のように思えても、がん細胞を養う血管や増殖の基盤になる結合組織を作る線維芽細胞が必要です。がん組織の中にはがん細胞は数%しか占めていない場合もあります。

副作用は少なく、腫瘍血管の増生阻害や抗腫瘍免疫の活性化などによってがん組織の増大を阻止し、長期的ながん縮小あるいはがんとの共存を目指す治療法です。
| « 396)ビタミンA... | 398)糖質制限... » |



