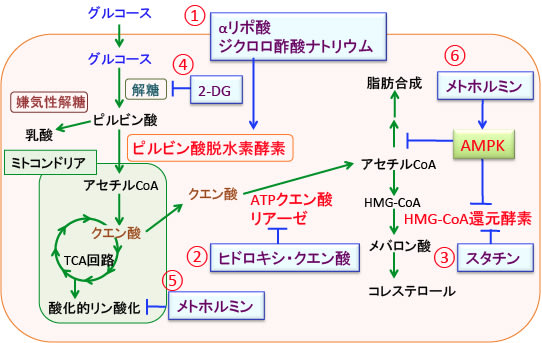
図:がん細胞ではグルコースの取込みと解糖系が亢進し、乳酸の産生が増えている(ワールブルグ効果)。ピルビン酸をアセチルCoAに変換するピルビン酸脱水素酵素の活性を高めてミトコンドリアでの代謝を活性化するとがん細胞の増殖を抑制できる。ピルビン酸脱水素酵素を活性化する物質としてαリポ酸やジクロロ酢酸ナトリウムがある(①)。TCA回路で生成されたクエン酸はアセチルCoAに変換されて脂肪やコレステロールの産生に使われる。クエン酸をアセチルCoAに変換するATPクエン酸リアーゼと、メバロン酸経路の律速酵素であるHMG-CoA還元酵素を阻害すると、がん細胞で亢進している物質合成を抑制できる。ATPクエン酸リアーゼの阻害剤としてヒドロキシ・クエン酸(②)、HMG-CoA還元酵素の阻害剤としてスタチン(特にシンバスタチンが有用)がある(③)。さらに解糖系を阻害する2-デオキシグルコース(④)や酸化的リン酸化を阻害するメトホルミン(⑤)を併用すると、がん細胞における解糖系と脂肪合成とメバロン酸経路を阻止して増殖を抑えることができる。メトホルミンはAMP活性化プロテインキナーゼ(AMPK)を活性化して脂肪酸合成(アセチルCoAカルボキシラーゼ)とHMG-CoA還元酵素を阻害する作用もある。
404)スタチンとヒドロキシクエン酸を使ったがん治療
【抗がん剤の効き目を高める薬剤やサプリメントの活用】
抗がん剤は細胞を死滅させることを目標にしています。そのための作用機序としては、DNAに結合してDNA合成を阻害したり、細胞分裂の際に重要な働きをする微小管の働きを阻害したり、細胞を増やすための細胞成分(核酸や細胞膜など)の合成を阻害したり、増殖のシグナル伝達系の分子を阻害したり、その他多くのメカニズムがあります。
このような作用をがん細胞に作用させれば、がん細胞は分裂できずに増殖を阻止し、死滅できるはずです。
しかし、がん細胞はこのような抗がん剤に対して抵抗性を示すようになります。
例えば、細胞内に入ってきた抗がん剤を細胞外へ排出するポンプの作用をするP-糖タンパク質の産生を増やしたり、薬剤の分解を促進したり、ダメージを受けた細胞成分の修復を促進したり、様々なメカニズムで抗がん剤の効き目を弱めて、耐性を獲得します。
この抗がん剤耐性のメカニズムを利用してがん細胞は抗がん剤治療に生き残り、再び増殖を開始します。(下図)

図:がん細胞は様々なメカニズムで抗がん剤の効き目を弱めている。例えば、①抗がん剤の分解や代謝を促進、②排出ポンプを増やして抗がん剤を細胞外への排出を促進、③抗がん剤のターゲット分子を増産、④アポトーシスに抵抗性になるBcl-2サブファミリーのタンパク質を増やしたり、アポトーシスを誘導するBaxサブファミリーの活性を抑制して細胞死に対して抵抗性を獲得、⑤ダメージを受けたDNAなど細胞成分の修復の促進、など多くのメカニズムが知られている。
このような抗がん剤に耐性を獲得するメカニズムを阻止すると抗がん剤治療の効き目を高めることができます。したがって、がん治療薬の開発において、薬剤耐性を阻止する薬の開発は重要な目標になっています。現在、多くの薬が開発中ですが、まだ認可されたものはありません。
既存の薬やサプリメントを使って、抗がん剤の効き目を高める方法の研究も行われています。がん治療を目標にした医薬品の再開発や適応外処方に関しては
400話、
401話、
402話で解説しています。
抗がん剤耐性のメカニズムはいずれもエネルギー(=ATP)の消費を伴うので、がん細胞のエネルギー産生を抑制することによって阻止することができます。つまり、がん細胞で亢進しているグルコースの取込みや解糖系を阻害する治療法は薬剤耐性を抑制します。ケトン食や2-デオキシグルコースはがん細胞のグルコース代謝を阻害することで、エネルギー産生や物質合成を抑制して抗がん剤の効き目を高めることができます。

図:(左)がん細胞はグルコースの取込みを増やし、エネルギー産生と物質合成が亢進している。このような状況では、抗がん剤や放射線によってダメージを受けてもダメージを修復して増殖活性を維持できる。したがって、治療によって一時的にがんが縮小しても直ぐに増殖を開始するので、がんを消滅できない。(右)がん細胞のグルコース取り込みや代謝を阻害するとATP産生と物質合成が阻害され、ダメージを修復できないので、がん細胞は死滅し、がん組織は縮小を続け、消滅する可能性が高くなる。
【高脂血症治療薬のスタチンの抗がん作用】
コレステロールやステロイドは、アセチルCoA(グルコースや脂肪酸やグルタミンなどの分解によって生成される)から生成されるメバロン酸(Mevalonic acid)を経て生合成されます。この生合成経路をメバロン酸経路と言い、この経路の律速酵素である3-ヒドロキシ-3-メチルグルタリルCoA還元酵素(3-hydroxy-3-methylglutaryl-CoA reductase ;HMG-CoA還元酵素)を阻害すると肝臓でのコレステロール生合成を抑制することができるため、多くのHMG-CoA還元酵素阻害剤が開発され高脂血症治療薬として臨床で使われています。
このようなHMG-CoA還元酵素の働きを阻害することによって血液中のコレステロ-ル値を低下させる薬(HMG-CoA還元酵素阻害剤)の総称をスタチン(Statin)といいます。
メバロン酸はコレステロールの合成に必要なだけでなく、糖たんぱくの合成や、GTP結合タンパク質(Gタンパク質)のイソプレニル化に必要な物質(geranylpyrophophateやfarnesylpyrophosphate)を作ります。(下図)

図:ヒドロキシメチルグルタリル-CoA(HMG-CoA)からメバロン酸に変換するHMG-CoA還元酵素を阻害すると、コレステロール合成の抑制だけでなく、増殖を促進するG結合タンパク質の活性化阻害などを介してがん細胞の増殖を抑える効果も得られる。
GTP結合タンパク質(Gタンパク質)は内在性のGTP加水分解活性をもつタンパク質の総称で、この内、低分子量Gタンパク質群(Ras, Rho,など)は分子量が2万~3万のタンパク質として、これまで100種類以上報告されており、イソプレニル化を受けた後に細胞膜に移行することで、GTP結合型(on)/GDP結合型(off)として細胞内シグナル伝達に関与しています。RasやRhoはがん遺伝子として知られています。
HMG-CoA還元酵素を阻害してイソプレノイド生成が低下すると、低分子量Gタンパク質の活性が低下して、増殖活性が低下します。(イソプレノイドはRasなどの低分子Gタンパク質が細胞膜の脂質に接着するときに必要が生体分子で、それができないと活性化できないので、がん細胞の増殖が抑制されることになります。)
スタチンの抗がん作用については多くの基礎研究が行われており、スタチンによるメバロン酸経路の阻害は、がん細胞のシグナル伝達に影響し、がん細胞の増殖や転移の抑制、血管新生阻害、アポトーシス誘導などの抗がん作用が、培養細胞を使った実験や動物実験で報告されています。
スタチンの服用とがんの発生率を検討した大規模臨床試験が多数行われていますが、その結果は肯定と否定の両方があります。
スタチンを長期間服用している人はがんの発生が少ないという報告は多数あります。たとえば、イギリスの研究では、スタチンを服用している人は服用していない人に比べて大腸がんの発生率が43%に減少することが報告されています。スタチンの服用量と服用期間は大腸がんの発生率と逆相関することが示されています。(BMC Gastroenterol 2012 Apr 24; 12:36)
また、20万人以上を対象にしたイスラエルの研究でも、スタチンを服用しているグループではがん全体の発生率が低く、とくに血液腫瘍の発生率が低いことが報告されています。(Prev. Chronic Dis 2012 Aug 9: E137, doi: 10.5888/pcd9.120005)
しかし最近のメタ解析の論文によると「スタチンの服用はがんの発生リスクを低下させる効果は無い」という結論になっています。(PLoS ONE 7(1): e29849 )
がんの種類(前立腺がんなど)によってはスタチン単独でがん予防効果が認められていますので、スタチンのがん予防効果はがんの種類によるようです。また、スタチンの種類によっても抗腫瘍効果が異なるようです。
抗がん剤とスタチンを併用すると抗腫瘍効果が相乗的に高まることが培養細胞や動物を使った実験で示されています。例えば、培養がん細胞を使った実験で、スタチン(lovastatin)とドセタキセルの併用で相乗的に抗腫瘍効果が増強することが報告されています。
しかし、抗がん剤にスタチンを併用した場合の効果を検討した臨床試験では、スタチンが抗がん剤治療の奏功率や生存期間を向上させる効果は認められていません。(抗がん剤自体の効果が限定的なので、上乗せ効果や相乗効果が得られない可能性もあります)
【脂溶性スタチンは乳がん治療後の再発率を低下させる】
細胞内でメバロン酸経路は、コレステロールだけでなく細胞の増殖や機能に重要な働きを持つ多くの物質を産生し、その結果、メバロン酸経路の律速酵素であるHMG-CoA 還元酵素の阻害はがん治療への利用が検討されています。
しかし、スタチンによる抗腫瘍効果は薬剤の種類によって異なる可能性があります。つまり、スタチンには水溶性のものと脂溶性のものがあり、がん細胞に対する効果を期待するには脂溶性のものを使う必要があるようです。
水溶性スタチンは肝臓細胞膜に存在する有機アニオン輸送担体によって細胞内に取り込まれるので、肝細胞に選択的に取り込まれます。脂溶性スタチンは細胞膜透過性が良いので、あらゆる臓器・組織の細胞内へ移行し得えます。
つまり、肝臓におけるコレステロール産生を抑制する目的では、他の細胞に影響が少ない点で水溶性スタチンの方が良いのですが、がん細胞に取り込まれて、メバロン酸経路を阻害して増殖抑制効果を期待するには脂溶性のものである必要があるようです。
スタチンの中で最も脂溶性の高いのがシンバスタチン(simvastatin)で、乳がんの患者さんがシンバスタチンを服用すると再発率が顕著に低下することが報告されています。この研究では、水溶性スタチンには再発予防効果は認めなかったという結果でした。
Statin Prescriptions and Breast Cancer Recurrence Risk: Danish Nationwide Prospective Cohort Study (スタチン処方と乳がん再発リスク:デンマークにおける全国規模の前向きコホート研究)J Natl Cancer Inst 2011;103:1461–1468
(要旨)
研究の背景:スタチンが循環器疾患だけでなく、がんを含めた多くの疾患に治療効果を示し、そしてこのような効果がある特定のスタチンの脂溶性の程度に依存する可能性が指摘されている。乳がんの発生率とスタチン服用との関連については多くの研究結果が報告されているが、乳がんの再発に及ぼすスタチンの効果については十分に検討されていない。
方法:1996年から2003年の間にデンマークの乳がん登録(Danish Breast Cancer Cooperative Group registry)に報告されたステージIからIIIの浸潤性乳がんの患者18,769人を対象にしたデンマークの全国規模の前向きコホート研究をした。乳がん診断後の追跡期間の平均は6.8年間であった。脂溶性と水溶性のスタチンの内服状況を調査し、乳がんの再発率との関連を統計的に検討した。
結果:このコホートで最も処方された脂溶性スタチンはシンバスタチンであった。シンバスタチンを服用した乳がん患者では再発率の有意な低下を認め、その再発予防効果は100人の乳がん患者を10年間追跡して、スタチンを服用しない場合に比較して10人の再発を防ぐ効果に相当した。水溶性スタチンを服用した患者では再発率はスタチンを服用しないグループと差を認めなかった。
結論:ステージIからIIIと診断されたデンマークの乳がん患者において、最も脂溶性の高いスタチンであるシンバスタチンの服用は再発率の低下と関連していた。しかしながら、水溶性スタチンを服用していた群においては再発率の低下は認めなかった。
この研究では、デンマークで1996年から2003年に診断された18,769人を対象に平均6.8年間追跡して3,419人の再発を認めています。6.8年間で18%の再発率です。
シンバスタチンを服用していた乳がんサバイバーはスタチンを服用していない群に比べて再発リスクが70%に減っていました。
この値は、スタチンを服用しない場合に比べて、シンバスタチンを服用すると10年間の追跡で100人あたり10人の再発患者を減らすのに相当するようです。
乳がんサバイバーの人はホルモン療法の関係や、更年期に入るとコレステロールが高くなるので、保険でシンバスタチンを処方してもらうこともできます。
乳がんサバイバーが
ビタミンD3(
394話)、ドコサヘキサエン酸やエイコサペンタエン 酸などの
ω3系多価不飽和脂肪酸(
314話)、
メトホルミン(
384話)、
大豆製食品(
340話)、今回の
シンバスタチンを服用すると、乳がんの再発リスクをかなり低減できると思います。
【ATPクエン酸リアーゼを阻害するヒドロキシクエン酸】
がん細胞では脂肪酸の新規合成が盛んです。脂肪酸合成酵素(fatty acid synthase: FASN)をはじめ、幾つかの脂質代謝酵素ががんの発生や悪性化を促進することが知られており、これらががん治療の新たな標的分子となる可能性が期待されています。
ATP クエン酸リアーゼの阻害が、がん治療に有効という報告があります。
クエン酸からアセチルCoAに変換する酵素がアデノシン3リン酸クエン酸リアーゼ(ATP:citrate oxaloacetate lyase, EC 4.1.3.8)です。
食事から摂取したグルコース(ブドウ糖)は、解糖系を経てミトコンドリアのクエン酸サイクル(TCA回路)によりエネルギー(ATP)に変換されます。生成したエネルギーは体が必要とするエネルギーとして利用され消費されますが、その消費量が少ない場合には、グルコースはクエン酸に変換された後、ミトコンドリアを出て脂肪合成の場である細胞質へ移行し、アセチルCoAを経由して脂肪酸そして脂肪、あるいは、コレステロールに変換され、体内に蓄積されます。
アセチルCoAはミトコンドリアを通過できないのですがクエン酸は通過できます。TCAサイクルでできたクエン酸がミトコンドリアの外に出て、ATPクエン酸リアーゼによって脂肪の合成に使用されるのです。(下図)。

図:TCA回路で作られるクエン酸から脂肪合成を行う最初のステップに働く酵素がATPクエン酸リアーゼ。
がん細胞は細胞の数を増やすために脂肪合成が亢進しており、ATPクエン酸リアーゼの活性が高くなっている。 ATPクエン酸リアーゼを阻害すると、脂肪の合成を阻害し、がん細胞の増殖を抑えることができる。
がん細胞が分裂して細胞を増やすためには、DNAや細胞膜など多くの細胞成分を合成する必要があります。脂肪も細胞を作るのに必須で、そのため、脂肪合成に重要な酵素であるATPクエン酸リアーゼは多くのがん細胞で活性が亢進していることが報告されています。
したがって、ATPクエン酸リアーゼの阻害は、がん細胞の増殖を抑制する効果が期待できます。実際に、培養がん細胞を使った実験や、移植腫瘍を使った動物実験などで、ATPクエン酸リアーゼの阻害ががん細胞の増殖を抑制する効果があることが報告されています。
ATPクエン酸リアーゼの阻害剤として、ガルシニア・カンボジアに含まれる(-)-ヒドロキシクエン酸があります。
ガルシニア・カンボジア(Garcinia cambogia)の果皮に多量に含まれる(-)-ヒドロキシクエン酸((-)- Hydroxycitric acid、HCA)は、クエン酸より水酸基(-OH)を一つ多く持っている点が違うだけで化学構造が類似しているため、ATPクエン酸リアーゼの酵素活性を競合阻害することが知られています。
ガルシニア・カンボジアはインドや東南アジアに生育する常緑樹で、5~9月頃にオレンジ大の大きさで黄色からやや赤みがかった実をつけます。果実や果皮は柑橘類に似た強い酸味を有し、熟果は果物として生食されるほか、果皮や実は乾燥させて貯蔵し、カレーの酸味付けや魚の塩蔵保存などにも用いられ、長年にわたりスパイスとして利用されています。
インド伝統医学のアーユルヴェーダでは消化を助け食欲を抑える薬として使用されています。
乾燥したガルシニアの果皮には10~30%ものヒドロキシクエン酸を含まれています。
ヒドロキシクエ ン酸は分子内に不斉炭素を有するため4つの異性体が存在しますが、ATPクエン酸リアーゼの阻害効果を持つのは(-)-ヒドロキシクエン酸(HCA)のみです。ガルシニア・カンボジアの果皮あるいはヒドロキシクエン酸は脂肪の合成を阻害するので、肥満抑制効果が期待されてダイエットのサプリメントに利用されています。さらに近年、がんの治療にも役立つことが報告されています。

図:熱帯植物ガルシニア・カンボジアの果実に多く含まれる(-)ヒドロキシクエン酸は構造がクエン酸と類似し、クエン酸と競合阻害することによってATPクエン酸リアーゼを阻害することが報告されている。
【アルファリポ酸とヒドロキシクエン酸の併用は抗がん作用を強める】
アルファリポ酸は、多数の酵素の補助因子として欠かせない体内成分で、特にTCA回路(クエン酸回路)のピルビン酸脱水素酵素複合体の補助因子として、ミトコンドリアでのエネルギー産生に重要な役割を果たしています。糖代謝の促進や抗酸化作用があるので、ダイエット効果や抗老化や美容を目的としたサプリメントとしても人気があります。
一方、ヒドロキシクエン酸はクエン酸より水酸基(OH)を一つ多く持っている点が違うだけで化学構造が類似しているため、ATPクエン酸リアーゼの酵素活性を競合阻害することが知られています。
ATPクエン酸リアーゼ(ATP citrate lyase)は細胞内でクエン酸から脂肪合成を行う最初のステップに必要な酵素で、ATPクエン酸リアーゼを阻害すると脂肪の合成が阻害されます。したがって、ヒドロキシクエン酸も体脂肪を減らすサプリメントとして人気があります。
ダイエット効果のあるこれら2種類のサプリメント(アルファリポ酸とヒドロキシクエン酸)が、がん治療においても効果があることが報告されています。
その理由は、がん細胞は正常細胞に比べて、ピルビン酸脱水素酵素の活性が低下し、ATPクエン酸リアーゼの活性が亢進しているからです。
がん細胞では、ピルビン酸脱水素酵素の活性が低下し、その結果、ミトコンドリアでのTCA回路と酸化的リン酸化による酸素を使ったエネルギー産生(ATP産生)が低下し、酸素を使わない嫌気性解糖系でのエネルギー(ATP)産生が亢進しています。
また、ATPクエン酸リアーゼの活性亢進は、がん細胞が分裂して細胞を増やすときに必要な脂肪の合成を高めるためと考えられます。したがって、ATPクエン酸リアーゼの活性を阻害すると、脂肪の合成が阻害されてがん細胞の増殖を抑えることができます。
以上のことから、ピルビン酸脱水素酵素の活性を高めるアルファリポ酸と、ATPクエン酸リアーゼの活性を阻害するヒドロキシクエン酸を併用すると、がん細胞の増殖を抑えることが推測されます。
実際に、この仮説を検証している研究グループがあり、その研究結果によると、『アルファリポ酸とヒドロキシクエン酸の併用は通常の抗がん剤に匹敵する抗がん作用を示す』『アルファリポ酸とヒドロキシクエン酸の併用は抗がん剤の効き目を高める』という結果が得られています。以下にその論文を紹介します。
A combination of alpha lipoic acid and calcium hydroxycitrate is efficient against mouse cancer models: preliminary results. (αリポ酸とヒドロキシクエン酸カルシウムの組み合わせは担がんマウスの実験にて有効:基礎研究の結果)Oncol Rep. 23(5):1407-16. 2010年
【要旨】
がん細胞におけるエネルギー代謝の異常については多くの検討がなされている。我々は、がん細胞において異常を起こしている2つの酵素、1)がん細胞で活性が低下しているピルビン酸脱水素酵素と、2)多くのがんで過剰に発現しているATPクエン酸リアーゼ(ATP citrate lyase)に注目して研究を行っている。
αリポ酸はピルビン酸脱水素酵素の補酵素であり、ヒドロキシクエン酸はATP クエン酸リアーゼの阻害剤である。この2つのサプリメントの組み合わせは、強い抗がん作用を持っている可能性がある。
そこで、培養がん細胞を使ってαリポ酸とヒドロキシクエン酸の抗がん作用における相乗効果を検討した。
αリポ酸は用量(0.1 ~10μM)およびがん細胞の種類に応じてがん細胞の数を10~50%減少させた。ヒドロキシクエン酸は10~500μMの濃度でがん細胞の数を5~60%減少させた。ヒドロキシクエン酸とαリポ酸を同時に投与すると、抗腫瘍効果は相乗的に増強し、8μMのαリポ酸と300μMのヒドロキシクエン酸の併用でがん細胞は72時間後に100%死滅した。
健常なマウスに、常用される量のヒドロキシクエン酸とαリポ酸を同時に投与しても、毒性は認められなかった。 マウスのがん細胞(膀胱がん細胞MBT-2、メラノーマ細胞B16-F10、ルイス肺がんLL/2)をマウスに移植した実験モデルで、ヒドロキシクエン酸とαリポ酸の組み合わせによる抗腫瘍効果を検討した。この組み合わせは、腫瘍の縮小や生存期間の延長において、シスプラチンや5-FUなどの通常の抗がん剤と同じレベルの抗腫瘍効果を示した。
基礎実験のレベルではあるが、培養細胞と動物を使った実験の結果から、αリポ酸とヒドロキシクエン酸の組み合わせは有効ながん治療となる可能性が示唆された。臨床試験を行う価値がある。
Adding a combination of hydroxycitrate and lipoic acid (METABLOC ) to chemotherapy improves effectiveness against tumor development: experimental results and case report.(抗がん剤治療にヒドロキシクエン酸とリポ酸を併用すると抗腫瘍効果を高める:実験結果と症例報告)Invest New Drugs. 30(1):200-11. 2012年
【要旨】
がん細胞における代謝の異常は、オットー・ワールブルク(Otto Warburg)によって80年以上前に指摘され、ワールブルグ効果(Warburg effect)として知られているが、最近まであまり注目されていなかった。しかし、近年、がんの診断や治療との関連において、がん細胞における代謝やエネルギー産生の異常が注目されるようになった。 著者らは、がん細胞の代謝異常の鍵となる酵素であるATPクエン酸リアーゼとピルビン酸脱水素酵素の活性に作用するヒドロキシクエン酸とアルファリポ酸の抗腫瘍効果に関して基礎研究の結果を報告している。すなわち、3種類のマウスのがん細胞株を使った実験では、ヒドロキシクエン酸とアルファリポ酸の組み合わせは、通常の抗がん剤治療と同等の効果を発揮した。
今回の研究は、通常の抗がん剤治療(特にシスプラチン)の抗腫瘍効果に対して、ヒドロキシクエン酸とアルファリポ酸の組み合わせを併用した場合の影響を明らかにする目的で行った。
マウスのがん細胞(LL/2肺がん細胞、MBT-2膀胱がん細胞)を移植したマウスに、通常の抗がん剤(シスプラチンかメソトレキセート)を投与する実験で、アルファリポ酸とヒドロキシクエン酸を組み合わせた製剤を投与した。
シスプラチンまたはメソトレキセートを単独で使用した場合、あるいはアルファリポ酸+ヒドロキシクエン酸を投与した場合に比べて、シスプラチン(またはメソトレキセート)+アルファリポ酸+ヒドロキシクエン酸の3種類を併用した場合は抗腫瘍効果が著明に増強した。
(アルファリポ酸+ヒドロキシクエン酸は、シスプラチンあるいはメソトレキセートの抗腫瘍効果を相乗的に高めた) 肝臓転移を有する膵臓がん患者(80歳女性)に、ジェムシタビン(ジェムザール)とアルファリポ酸とヒドロキシクエン酸を併用した治療を行ったところ、顕著な抗腫瘍効果を得ることができた。
動物実験と膵臓がんの症例の経験から、通常の抗がん剤治療に、アルファリポ酸とヒドロキシクエン酸を併用して投与すると、抗腫瘍効果を高めることができることが示唆された。
この論文で記載された症例報告の概要を以下に示します。
80歳女性。2009年2月24日にかゆみと倦怠感、黄疸、浮腫の症状にて来院。
CT検査で膵臓の頭部に2cm大の腫瘍を認め、胆管の拡張と肝臓の腫大を認めた。黄疸を改善するために、胆管ドレナージと閉塞した胆管へのステント挿入が行われ、症状が改善した後、5月13日に膵頭十二指腸切除手術が実施された。
組織診断は膵臓の膵管がんで、十二指腸に浸潤を認めた。廓清したリンパ節の70%に転移を認めた。7月6日のCT検査で、肝臓に転移を認めた。腫瘍マーカーのCA19-9は3000以上で、3kg以上の体重減少が認められたため、余命は3~6ヶ月と宣告された。
7月22日からジェムザールによる抗がん剤治療が開始された。ジェムザール(28日に1回1200 mg投与)の効果を高める目的で、次のような代替医療を併用することにした。
Garcinia Cambogia (60% HCA)1200 mg 毎日経口摂取
アルファリポ酸1200 mg 毎日経口摂取
Celecoxib (セレブレックス)200 mg 毎日経口摂取
レチノイン酸50 mg 隔日経口摂取
メラトニン20 mg 午後9時毎日経口摂取
プロシュア (Abbott)2 vials 毎日経口摂取
治療4ヶ月後には肝臓転移は50%に縮小し、7ヶ月後(2009年、12月30日)のCT検査では肝臓の腫瘍は完全に見えなくなった。2010年の3月18日の時点で、当初の予想の3~6ヶ月の余命を超えて、患者はQOL(生活の質)が良い状態で生存していた。
ピルビン酸脱水素酵素キナーゼを阻害してピルビン酸脱水素酵素を活性化するジクロロ酢酸ナトリウムの併用は、αリポ酸とヒドロキシクエン酸の効果を高める可能性があります。
がん細胞で亢進している嫌気性解糖系を抑制し、TCA回路を活性化し、ATPクエン酸リアーゼを阻害する方法を組み合わせると、がん細胞の増殖に必要な細胞成分の合成が阻害され、増殖を抑制することができます。
糖尿病治療薬の
メトホルミンはAMP活性化プロテインキナーゼ(AMPK)を活性化します。AMPKはHMG-CoA還元酵素とアセチルCoAカルボキシラーゼの活性を阻害して、脂肪酸とメバロン酸経路を阻害する作用があります。(
308話と
384話と下図参照)

図:メトホルミンはミトコンドリアの呼吸鎖を阻害して酸化的リン酸化を阻害してATP産生を低下させ、その結果、AMP活性化プロテインキナーゼ(AMPK)を活性化する。AMPKはHMG-CoA還元酵素とアセチルCoAカルボキシラーゼを阻害してメバロン酸経路と脂肪酸合成を阻害して、がん細胞の増殖抑制効果を発揮する。
メトホルミンはミトコンドリアの酸化的リン酸化を阻害し、解糖系を阻害する2-デオキシグルコースと併用して抗腫瘍効果を高めることが報告されています。(
368話参照)
以上のような、がん細胞のエネルギー産生と代謝異常(脂肪酸合成やメバロン酸経路の亢進など)をターゲットにすると、副作用の少ない方法でがん細胞の増殖を抑制できます。
これらの方法に、さらに安価で抗腫瘍活性をもった物質(メベンダゾールやセレコックスなど)を併用すると、がんを縮小させることも可能です。(
402話参照)