がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
731)膠芽腫(グリオブラストーマ)の代替療法(その3):Notchシグナル伝達経路の阻害
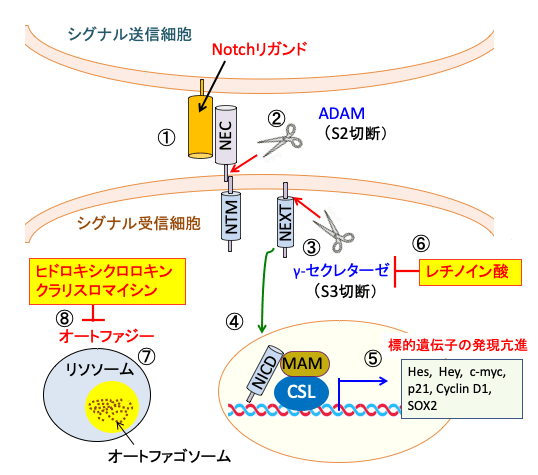
図:シグナル送信側の細胞の表面に発現するNotchリガンドがNotch受容体に結合すると(①)、Notch受容体の構造変化を誘発し、ADMAファミリーのメタロプロテアーゼによってS2部位で切断される(②)。その結果できたNEXTフラグメントはγ-secretase複合体によってS3部位で切断され(③)、Notch細胞内ドメイン(NICD)ができる。NICDは細胞核内に入り、転写因子のCSL(CBF1/Su(H)/Lag2)と活性化補助因子MAM(Mastermind)とNotch転写複合体を形成し(④)、HESやHEYなどのNotch標的遺伝子の転写を活性化する(⑤) 。レチノイン酸はγ-セクレターゼを阻害してNotchシグナル伝達系を阻害する(⑥)。Notch阻害は膠芽腫細胞に細胞保護的オートファジーを誘発する(⑦)。ヒドロキシクロロキンとクラリスロマイシンはオートファジーを阻害する(⑧)。Notchシグナル伝達系阻害剤とオートファジー阻害剤との併用は相乗的な抗腫瘍作用を示すことが報告されている。
731)膠芽腫(グリオブラストーマ)の代替療法(その3):Notchシグナル伝達経路の阻害
【膠芽腫幹細胞は治療に抵抗する】
膠芽腫が再発しやすいのは、膠芽腫のがん幹細胞が抗がん剤や放射線治療に抵抗し、生き残るためです。がん幹細胞の自己複製や増殖を制御しているシグナル伝達系としてヘッジホッグ(Hedgehog)、mTOR、Notch、Wnt-β-Cateninなどがあります。
膠芽腫を根治するためには、これらのシグナル伝達系を阻害し、がん幹細胞を消滅することが最も重要です。

図:抗がん剤治療や放射線治療に対して、成熟したがん細胞が死滅しやすいが、がん幹細胞が抵抗性を示して生き残る(①)。がん幹細胞が生き残れば、がんはいずれ再燃・再発する(②)。膠芽腫のがん幹細胞では、Hedgehog、Notch、Wnt/β-Catenin、mTORC1の各シグナル伝達系が亢進し(③)、幹細胞特性の維持、抗がん剤抵抗性、増殖・転移・浸潤に寄与している(④)。したがって、これらのシグナル伝達系を阻害すると、がん幹細胞を死滅して、膠芽腫を消滅できる。
ヘッジホッグ(Hedgehog)については724話、Wnt/β-カテニンについては730話で解説しています。今回はNotchシグナル伝達系の阻害についてです。
【膠芽腫幹細胞ではNotchシグナル伝達系が亢進している】
膠芽腫幹細胞ではNotchシグナル伝達系が亢進していることが多くの論文で報告されています。例えば、以下の様な報告があります。
Contribution of Notch signaling activation to human glioblastoma multiforme.(ヒト多形性膠芽腫へのNotchシグナル伝達活性化の寄与)J Neurosurg. 2007 Mar;106(3):417-27.
【要旨】
目的:Notch受容体の活性化は、Rasの活性化を介した細胞のがん化に重要であることが示唆されており、多くの神経膠腫はRasシグナル伝達系の異常を示す。多形性膠芽腫の外科切除組織および細胞株のNotchレベルと活性化を測定し、アストロサイトの悪性化と増殖へのノッチ経路活性化の寄与に関して検討した。
方法と結果:ウエスタンブロット分析は、4つの膠芽腫細胞株のうち3つ、および5つの外科切除サンプルのうち4つでNotch1の過剰発現および/または活性化を認めた。
cDNA発現アレイによるNotchシグナル伝達経路の構成要素のmRNA発現レベルの検討では、NotchリガンドJagged-1、Notch 3、およびNotchの下流標的(HES1およびHES2)の発現レベルは、35の切除膠芽腫組織のそれぞれ23、71、および51%で、非腫瘍部脳組織(コントロール)と比較して過剰発現していた。
さらに、遺伝的または薬理学的手段によるNotchシグナル伝達系の阻害は、膠芽腫細胞の増殖を抑制した。
結論:Notchシグナル伝達系の活性化は、グリア細胞のRas誘導性形質転換、神経膠腫の増殖と生存に寄与し、膠芽腫の治療法の新しい標的となる可能性がある。
膠芽腫の増殖と生存にNotchシグナル系の更新が寄与しており、Notchシグナル伝達系を阻害すると治療効果を高めることができる可能性を指摘しています。以下の様な総説論文もあります。
Role of Notch Signaling Pathway in Glioblastoma Pathogenesis.(膠芽腫の病因におけるノッチシグナル伝達経路の役割)Cancers (Basel). 2019 Mar; 11(3): 292.
【要旨】
Notchシグナル伝達は、細胞の増殖、アポトーシス、遊走、自己複製、分化などの重要な生物学的プロセスを調節する、進化的に保存されたシグナル伝達系である。
哺乳類では、Notchシグナル伝達は4つの受容体(Notch1–4)と5つのリガンド(Dll-1,-3,–4、Jagged1–2)で構成され、主に中枢神経系の発達と維持に寄与する。
神経幹細胞は、神経細胞の新生およびその他の神経機能の開始点であり、中枢神経系の恒常性にとって不可欠な役割を持っている。したがって、神経幹細胞の遺伝的および機能的変化は、膠芽腫を含む脳腫瘍の発症につながる可能性がある。
膠芽腫は依然として不治の病であり、現在の治療法の失敗と腫瘍の再発の理由は、膠芽腫組織における神経幹細胞のような特性と攻撃的な表現型を特徴とする膠芽腫幹細胞の存在である。
膠芽腫幹細胞ではNotchシグナル伝達系が亢進しており、細胞分化を抑制し、幹細胞様の特性の維持に関与し、膠芽腫の腫瘍形成および従来の治療抵抗性に寄与することが多くの研究で明らかになっている。
このレビューでは、膠芽腫へのNotchシグナル伝達の寄与と、新しい治療アプローチのターゲットとしての包括的な見解を示す。
膠芽腫幹細胞ではNotchシグナル伝達系が亢進しており、治療抵抗性の原因となっているので、Notchシグナル伝達系の阻害が膠芽腫の治療ターゲットとして有望という指摘です。
同様の総説論文は多く報告されています。以下の様な論文もあります。
Therapeutic Targeting of the Notch Pathway in Glioblastoma Multiforme.(多形性膠芽腫におけるノッチ経路の治療的標的化)World Neurosurg. 2019 Nov;131:252-263.e2.
【要旨】
背景:膠芽腫は、最も一般的な脳腫瘍であり、予後不良の腫瘍である。外科切除、放射線療法および化学療法の標準治療を行っても、5年生存率は5%未満である。近年の研究により、Notchシグナル伝達経路内のいくつかの潜在的な標的が明らかになり、それが膠芽腫患者の転帰の改善につながる可能性がある。
方法:2003年から2015年7月の間に、「Glioblastoma(神経膠芽腫)」および「Receptors(受容体)、Notch(ノッチ)」という用語を含む論文の文献検索を実行した。取得した62の論文のうち、46が基準を満たし、このレビューに含まれた。他の情報源から9つの論文が特定され、それらを含めて、55件の論文がレビューした。
結果:レビューされた55の論文のうち、47は確立されたヒト膠芽腫細胞株を使用していた。 17の論文が人間の膠芽腫手術サンプルを使用していた。
Notch活性を評価した48の論文のうち45は、膠芽腫細胞株でのNotchシグナル経路の活性増加を示した。
Notch経路の標的化は、Notchノックダウンと過剰発現を介して行われ、δ-like ligand, Jagged, γ-secretase, ADAM10, ADAM17, Mastermindlike protein 1を標的とした。
三酸化ヒ素、マイクロRNA、および他のいくつかの化合物が膠芽腫細胞のノッチ経路に影響することが示された。 膠芽腫細胞におけるNotch活性は、低酸素症や、PI3K / AKT / mTORやERK / MAPKなどの特定のがん関連シグナル伝達経路にも関連していることが示された。
ほとんどの論文は、ノッチ活性が膠芽腫細胞の悪性特性を増幅し、この経路を標的にすることで膠芽腫の増殖を抑制できると結論付けていた。
結論:最近の論文は、Notch経路を標的とすることは膠芽腫の将来の治療法に大きな可能性を秘めていることを示唆している。
つまり、多くの研究者が、膠芽腫の治療におけるNotchシグナル伝達系の阻害に注目しているということです。
【Notchシグナルは細胞運命決定のスイッチとなる】
Notchシグナルは進化上保存された細胞間シグナル伝達経路で、多様な組織の発生、恒常性維持に関わっています。
1913年、 米国の遺伝学者トーマス・ハント・モーガン(Thomas Hunt Morgan) の研究室で切り込みの入った翅をもつ雌のショウジョウバエが見つかりました. 翅の先端がわずかに欠けた変異体はNotchと名付けられ、研究が始められました。Notchというのは「V 字形・ U 字形などの切り込み」という意味があります。
モーガンはキイロショウジョウバエを用いた研究で、染色体が遺伝子の担体であることを実証し、その業績により1933年にノーベル生理学・医学賞を受賞しています。
その後、Notch変異のホモ接合体では外胚葉から表皮が形成されず, かわりに神経組織に置き換わっていることが1930年代に発見されました。これにより、正常Notch遺伝子は外胚葉の将来表皮になる予定の細胞が神経系への運命をたどることを抑制する機能をもつことが示されました.
つまり、Notchは外胚葉の運命決定という重大事象にかかわっていることが明らかになりました。
Notchシグナル伝達系はNotchリガンドとNotch受容体からなります。NotchリガンドにはNotch1~4、Notch受容体にはDelta(DLL1、3、4)とJagged(Jagged1、2)などがあります。
1回膜貫通型受容体であるNotchの細胞外ドメインにリガンドが結合すると、細胞内ドメイン(NICD:Notch intercellular domain)が切り離され、NICDは細胞核内に入り、転写因子のCSL(CBF1/Su(H)/Lag2)、活性化補助因子MAM(Mastermind)と複合体を形成し、標的遺伝子の転写を活性化します 。
Notchシグナル伝達経路は、Notch受容体とNotchリガンド、および翻訳後修飾因子として機能するさまざまなタンパク質で構成されていますが、他のシグナル伝達経路のような、さまざまなタンパク質によって誘導される増幅カスケードはありません。
受容体から切り離されたNotch細胞内ドメイン(NICD)が細胞核に移行して転写を活性化するという単純な仕組みです。
Notch経路は、そのシグナル伝達ネットワークが単純であるにもかかわらず、増殖、幹細胞の維持、細胞運命の特定、分化、血管新生など、さまざまな発生および恒常性プロセスに関与しています。
Notchシグナルは、幹細胞の維持に重要な働きを担っています。
一般的にNotchの活性化はがん幹細胞を増やし、Notchの阻害はがん幹細胞のマーカーを低下させ、抗がん剤感受性を高めます。
がん細胞の運動能や浸潤能を高める上皮間葉転換(epithelial-mesenchymal transition; EMT)にも関与します。
上皮間葉転換は上皮細胞が間葉系細胞へと分化するプロセスで、細胞は極性を失って細胞間接着分子であるE-cadherinやclaudin-1などを発現しなくなり、N-cadherinやSMA(smooth muscle α-actin)を発現するようになります。EMTを起こした細胞では運動能や浸潤能の亢進が見られます。
Notchリガンドが上皮細胞のNotch受容体に結合すると、細胞間接着部位のEカドヘリンなど上皮細胞特異的遺伝子の発現がoffとなり、コラーゲンや平滑筋アクチンなどの間葉系特異的遺伝子の発現がonとなり、上皮細胞が間葉系細胞へと転換します。

図:Notch受容体タンパク質は小胞体で合成され(①)、ゴルジ体でS1部位がfurin-like convertaseによって切断されたのち(②)、細胞膜に移行する(③)。シグナル送信側の別の細胞の表面に発現するNotchリガンドがNotch受容体に結合すると(④)、Notch受容体の構造変化を誘発し、ADMAファミリーのメタロプロテアーゼによってS2部位で切断される(⑤)。その結果できたNEXTフラグメントはγ-secretase複合体によってS3部位で切断され(⑥)、Notch細胞内ドメイン(Notch intracellular domain:NICD)ができる。NICDは細胞核内に入り、転写因子のCSL(CBF1/Su(H)/Lag2)と活性化補助因子MAM(Mastermind)とNotch転写複合体を形成し(⑦)、HESやHEYなどのNotch標的遺伝子の転写を活性化する(⑧) 。
【Notchを阻害すると膠芽腫のがん幹細胞は死にやすくなる】
がん幹細胞は幹細胞マーカー(CD133など)を発現しています。
放射線治療やテモゾロミド治療はCD133陰性の成熟がん細胞を死滅できますが、CD133陽性の膠芽腫幹細胞はこれらの治療に抵抗し、多くは生き残ります。
したがって、放射線治療やテモゾロミド治療を行っていると、CD133陽性の膠芽腫幹細胞が増えてきます。この様な状況でNotch阻害剤を併用すると、がん幹細胞の増加を阻止できることが報告されています。
以下の様な報告があります。
NOTCH blockade combined with radiation therapy and temozolomide prolongs survival of orthotopic glioblastoma(放射線療法とテモゾロミドを組み合わせたNOTCH遮断は、同所性膠芽腫の生存を延長する)Oncotarget. 2016 Jul 5; 7(27): 41251–41264.
【要旨の抜粋】
多形性膠芽腫の標準治療には、手術とそれに続く放射線療法およびテモゾロミドによる化学療法が含まれる。膠芽腫組織には幹細胞様の特性を持つ細胞が存在し、このがん幹細胞様の膠芽腫細胞は放射線およびテモゾロミドに対して抵抗性を示すため、治療は失敗し、再発することが多い。
NOTCHシグナル伝達経路は、ヒト膠芽腫細胞で発現が亢進しており、NOTCH阻害剤は異種移植モデルでin vivoで膠芽腫細胞の増殖を抑制する。
ここでは、NOTCH /γ-セクレターゼ阻害剤のRO4929097と標準治療(放射線+テモゾロミド)の組み合わせが、標準治療のみの場合と比較して、腫瘍増殖を抑制し、生存期間を延長することを示す。
放射線治療とテモゾロミドとNOTCH /γ-セクレターゼ阻害剤の3つの組み合わせは、増殖を弱め、腫瘍塊の成長を減少させ、初代および確立された神経膠腫細胞株のクローン原性生存率を著しく低下させることを示す。
神経膠腫幹細胞マーカーであるCD133、SOX2、およびネスチンは、標準治療とNOTCH阻害剤の併用投与後に減少した。
これらの結果は、標準治療とNOTCH阻害剤の組み合わせが、膠芽腫幹細胞の増殖を抑制し、膠芽腫患者の生存を改善することを示唆しており、さらなる研究を推進する必要を示している。
Notchシグナル伝達系の活性化は膠芽腫幹細胞のがん幹細胞特性の維持に必要なので、
Notchシグナルを阻害すると腫瘍を作る能力が消失し、放射線治療やテモゾロミドの治療効果が高まるということです。
RO4929097はガンマ-セクレターゼ阻害剤として最初はアルツハイマー病の治療薬として開発され、その後がん治療薬として研究されていますが、まだ薬にはなっていません。
アルツハイマー病は脳内にアミロイドβペプチド(Aβ)を主成分とする老人斑が広く観察され、 この Aβのプロセシングにおいてセクレターゼという酵素が重要な役割を担っています。
γ-セクレターゼは Aβ 産生経路においてカルボキシ末端側の切断に関与し、Aβ量および凝集性を決定します。そのためγ-セクレターゼはアルツハイマー病の創薬標的分子と考えられ、様々なγ-セクレターゼ阻害剤が開発されています。このγ-セクレターゼ阻害剤はNotchシグナル伝達系の阻害剤にもなるのです。
放射線治療とテモゾロミド治療にNotch阻害剤(γ-セクレターゼ阻害剤)を併用すると、移植腫瘍の増殖が抑制され、担がんマウスの生存期間が延長するという結果です。
Notch阻害剤が膠芽腫幹細胞を減らすので、放射線治療とテモゾロミド治療の効き目を高めるということです。
【レチノイン酸はγ-セクレターゼを阻害する】
レチノイン酸にγ-セクレターゼ阻害作用が報告されています。以下の様な報告があります。
Retinoic Acid-Elicited RARα/RXRα Signaling Attenuates Aβ Production by Directly Inhibiting γ-Secretase-Mediated Cleavage of Amyloid Precursor Protein.(レチノイン酸によって誘発されるRARα/RXRαシグナル伝達は、アミロイド前駆体タンパク質のγ-セクレターゼを介した切断を直接阻害することにより、Aβ産生を減少させる)ACS Chem Neurosci. 2013 Jul 17; 4(7): 1093–1100.
【要旨】
レチノイン酸によって誘発されるシグナル伝達は、発生、器官形成、および免疫応答において重要な役割を果たすことが示されている。 レチノイン酸は、アルツハイマー病関連遺伝子の発現を調節し、トランスジェニックマウスモデルのアミロイド病変を軽減する。この研究では、レチノイン酸がγ-セクレターゼ活性を直接阻害することでアミロイド-βの産生を抑制できるかどうかを調べた。
細胞のRA処理は、コントロールと比較して、アミロイド前駆体タンパク質C末端フラグメントAPP-C99のγ-セクレターゼを介したプロセシングの有意な阻害を引き起こした。 レチノイン酸によって誘発されるシグナル伝達は、APP-C99の蓄積を有意に増加させ、分泌されたAβ40の産生を減少させることが見出された。
さらに、レチノイン酸が誘導するγ-セクレターゼ活性の阻害は、細胞外シグナル調節キナーゼ(ERK1 / 2)の有意な活性化を介して媒介されることが見出された。細胞をERK阻害剤PD98059で処理すると、レチノイン酸を介したγ-セクレターゼの阻害が完全に阻止された。これらの発見と一致して、レチノイン酸は完全長アミロイド前駆体タンパク質のセクレターゼ媒介タンパク質分解を阻害することが観察された。
最後に、レチノイン酸が核レチノイン酸受容体-α(RARα)およびレチノイドX受容体-α(RXRα)を介してγ-セクレターゼを阻害することを明らかにした。
私たちの実験結果は、アルツハイマー病の病理学におけるレチノイン酸の神経保護の役割についての新しいメカニズムを提供し、アルツハイマー病の治療のターゲットとしてのレチノイン酸シグナル伝達系の重要性を示している。
レチノイン酸シグナル伝達経路については後述しますが、この経路がγ-セクレターゼ活性を阻害する作用があるという報告です。
レチノイン酸がNotchシグナル伝達系を阻害する作用を示唆しています。
【レチノイン酸はNotchシグナル経路を阻害して膠芽腫由来の幹様がん細胞の分化を誘導する】
レチノイドには細胞の分化を誘導する作用があります。がん細胞を正常細胞に分化誘導する治療も古くから試みられています。レチノイドを用いて膠芽腫細胞の幹細胞の分化を誘導する試みも行われています。
以下の様な報告があります。
Regulation of glioblastoma stem cells by retinoic acid: role for Notch pathway inhibition.(レチノイン酸による神経膠芽腫幹細胞の調節:Notch経路阻害の役割)Oncogene. 2011 Aug 4; 30(31): 3454–3467.
【要旨】
細胞分化を誘導する因子ががん幹細胞に影響を与えるメカニズムを理解する必要がある。この目的に向けて、我々は、オールトランスレチノイン酸(RA)に対する膠芽腫幹様細胞の応答を細胞および分子レベルで検討した。
膠芽腫幹様細胞は、成長因子を添加した無血清培地で非接着性神経幹細胞塊(non-adherent neurospheres)として増殖させた。
培養細胞へのレチノイン酸添加は急速に形態変化を誘発し、G1 / G0からSへの移行部位で細胞周期を停止し、サイクリンD1発現を減少させ、p27発現を増加させた。
免疫蛍光法およびウエスタンブロット分析は、レチノイン酸が系統特異的分化マーカーTuj1およびGFAPの発現を誘導し、CD133、Msi-1、ネスチン、Sox-2などの神経幹細胞マーカーの発現を低下させることを示した。
レチノイン酸治療は、ニューロスフェア(神経幹細胞塊)形成能力を劇的に低下させ、軟寒天中でコロニーを形成するニューロスフェア(神経幹細胞塊)の能力を阻害し、皮下および頭蓋内に移植した異種移植片の増殖を阻害した。
発現マイクロアレイ分析により、レチノイン酸添加から48時間以内に変化した約350個の遺伝子が同定された。
影響を受ける経路には、レチノイドのシグナル伝達と代謝、細胞周期の調節、系統決定、細胞接着、細胞とマトリックスの相互作用、細胞骨格の再構成が含まれていた。
Notchシグナル伝達系への影響は、これらのレチノイン酸応答経路の中で最も顕著であった。
Notch経路の抑制は、HESおよびHEYファミリーメンバーの発現低下によって確認された。
レチノイン酸によって誘導される細胞分化と幹細胞枯渇は、Notch細胞内ドメインによるNotchシグナル伝達の恒常的な活性化によって阻止された。
私たちの実験結果は、レチノイン酸が膠芽腫由来の幹様がん細胞を標的とするメカニズムを同定し、膠芽腫の分化療法に適用可能な新規標的を特定した。
ニューロスフェア(neurosphere)というのは、神経幹細胞の浮遊増殖培養によって形成される球状の細胞凝集塊です。増殖因子のEGFとbFGFを含む無血清培地を用いて細胞を浮遊培養し、球状の細胞塊(neurosphere)として神経幹細胞を増殖させることができます。
脳組織から取り出した細胞を増殖因子を含む無血清培地で培養すると細胞塊を分離でき、この細胞塊には神経細胞とグリア細胞に分化できる神経幹/前駆細胞が増殖しています。
膠芽腫の場合も、ニューロスフェアを形成するのは膠芽腫幹細胞です。したがって、レチノイン酸処理によってニューロスフェア形成能が低下するのはがん幹細胞の性状を喪失することを意味します。
この実験では、レチノイン酸によってNotchシグナル伝達系が抑制されることを確認しています。つまり、レチノイン酸は様々なメカニズムを介してがん細胞の増殖を抑制しますが、Notchシグナル伝達系の阻害も重要なメカニズムの一つということです。
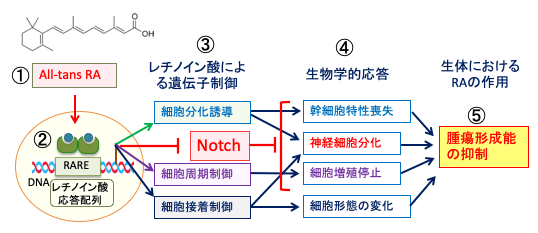
図:オールトランス・レチノイン酸(①)は遺伝子のレチノイン酸応答配列に作用して遺伝子発現を制御している(②)。オールトランス・レチノイン酸(All-trans RA)は細胞分化や細胞周期や細胞接着の制御に関与し、Notchシグナル伝達系を阻害する(③)。その結果、膠芽腫幹細胞は幹細胞特性を喪失し、神経細胞への分化が促進され、細胞増殖が停止し、細胞形態の変化が誘導される(④)。その結果、腫瘍形成能が抑制される(⑤)。
【ベータカロテンとレチノールとレチノイン酸の関係】
まず、ビタミンAの代謝と作用について簡単に説明します。
ビタミンAは別名をレチノール(retinol)と言い、脊椎動物の発生過程、細胞分化、生殖、視覚、免疫系の調節などに重要な働きを行っているビタミンです。
レチノールは細胞内で代謝されてレチノイン酸に変換され、レチノイン酸が細胞核内の受容体に結合することによって遺伝子発現を誘導して様々な作用を発揮します。
レチノイン酸によって細胞分化や増殖に関連する500以上の遺伝子が誘導されると言われています。
ベータカロテンは体内でビタミンAに変換されます。ベータカロテンやビタミンA(レチノール)は食品から摂取され、レチノールは肝臓で貯蔵されて必要に応じて血中に放出され、血清濃度は1~2μMの範囲で維持されています。
細胞内に取り込まれたレチノールはまずレチノール脱水素酵素によってレチナールアルデヒド(レチナール)に変換され、さらにレチナールアルデヒド脱水素酵素によってオール・トランス・レチノイン酸(All-Trans Retinoic Acid:ATRA)になり、イソメラーゼで9-シス・レチノイン酸(9-cis RA)になります。ATRAと9-cis RAが遺伝子発現に関与します。(下図)

図:ベータカロテンとビタミンA(レチノール)は食品から摂取される。レチノールはレチノール脱水素酵素によってレチナールに変換され、さらにレチナールアルデヒド脱水素酵素によってオール・トランス・レチノイン酸(All-Trans Retinoic Acid: ATRA)になり、さらに9-シス・レチノイン酸(9-cis RA)になる。ATRAはレチノイン酸受容体(RAR)に結合し、9-cis RAはレチノイドX受容体(RXR)に結合し、レチノイン酸応答配列に結合して標的遺伝子の発現を誘導する。レチノイドによって誘導される遺伝子は細胞分化やアポトーシスの誘導や、細胞増殖を抑制する働きに関与するので、がん細胞の増殖を抑制する方向で働く。
【レチノイドは細胞分化を誘導する】
レチノイド(retinoid)はビタミンA(レチノール)およびその誘導体や類縁化合物の総称で、生体内では活性型であるAll-trans retinoic acid (ATRA:オール・トランス・レチノイン酸)として細胞核内の受容体に結合して、その生理作用を発揮します。
レチノイン酸の核内受容体には、レチノイン酸受容体(retinoic acid receptor: RAR)とレチノイドX受容体(retinoid X receptor: RXR)があり、それぞれα、β、γのサブタイプが存在します。
これらの受容体はリガンドの結合刺激によりホモ二量体(RAR-RARやRXR-RXR)を形成しますが、RXRはRXRとのホモ二量体だけでなく、RARやPPARやビタミンD受容体(VDR)などの核内受容体とのヘテロ二量体(RAR-RXR、PPAR-RXR、VDR-RXRなど)も形成します。(「ホモ」は「同じ」、「ヘテロ」は「異なる」という意味で、同じ受容体が2つ並ぶのがホモ二量体で、異なる2種類の受容体が並ぶのがヘテロ二量体)
そして、これらの二量体は標的遺伝子のプロモーター領域に存在するレチノイン酸応答配列やレチノイドX応答配列、ペルオキシソーム増殖因子応答配列、ビタミンD応答配列などに結合することによって、様々な標的遺伝子の発現を調節しています。
異性体の関係にあるAll-trans-RA (ATRA) と 9-cis-RA (9C-RA)は2つともRARのリガンドになりますが、RXRのリガンドとなるのは9C-RAのみです。(異性体とは分子式は同じで、原子の結合状態や立体配置が違うために異なる性質を示す化合物)
レチノイン酸受容体(RAR)とレチノイドX受容体(RXR)には、それぞれのリガンドが入り込んで結合するポケット状の構造があるのですが、RARのリガンド結合ポケットにはATRAと9C-RAの両方のレチノイドが納められますが、RXRのリガンド結合ポケットには9C-RAしか納められなくて、ATRAははみ出すからRXRのリガンドとはなれないからです。
レチノイドは炭化水素鎖を基本骨格としており、炭素が水素で飽和している場合はまっすぐな構造をしますが、水素で飽和していない二重結合(CH=CH)の部分で構造が変わります。
すなわち、炭素間に二重結合がある所で曲がる時に、「シス型」と「トランス型」という2種類の構造を取ります。「シス(cis)は「同じ側」「近い方」、トランス(trans)は「反対側」「遠い方」というような意味の接頭辞です。
つまり、二重結合の所でシス型は水素が同じ側に並び、トランス型は反対側に並びます。シス型の2重結合のところで炭化水素の鎖は曲がります。(下図)

All-trans-RAは全ての不飽和炭化水素鎖がトランス型になっているレチノイン酸で、9-cis-RAというのは9番目の炭素のところでシス型の構造になっているレチノイン酸という意味です。
この構造の違いによって分子式(C20H28O2)は同じでも立体的な大きさに違いが生じるので、RARとRXRの2つの受容体のリガンド結合部位への親和性が異なるということです。
レチノイドによって発現が調節される遺伝子は、細胞の分化や増殖や死(アポトーシス)の制御に重要な働きを担っているため、その機能異常は細胞のがん化に関連し、ある種のがんに対してレチノイドが効く場合があります。
例えば、レチノイン酸の二重結合がすべてトランス型になったall-trans retinoic acid(ATRA)は急性前骨髄球性白血病の特効薬になっています。急性前骨髄球性白血病は白血球に分化する途中の骨髄細胞が腫瘍化した白血病で、オールトランスレチノイン酸によって途中で止まった分化を誘導することによって増殖能を失わせ、死滅させることができるのです。
難治性にきびの治療に用いられている13-cisレチノイン酸(イソトレチノイン)は、体内でAll-trans レチノイン酸に変換されて効果を発揮します(下図)。All-trans レチノイン酸は9-cis レチノイン酸に変換します。これらのレチノイドは単独では抗腫瘍効果は弱いのですが、他の治療との組合せで抗腫瘍効果が高まることが報告されています。

図:ビタミンAの体内における活性本体であるAll-trans retinoic acid(ATRA)はレチノイン酸受容体(RAR)に結合するとホモ二量体を形成し、標的遺伝子のプロモーター領域にあるレチノイン酸応答配列(RARE)に結合して遺伝子転写のスイッチをオンにする。ATRAの異性体である9-cis retinoic acidはレチノイン酸受容体(RAR)の他にレチノイドX受容体(RXR)にも結合して、ホモ二量体やヘテロ二量体を形成して細胞核内の受容体に結合して標的遺伝子の転写を誘導して生理機能を発揮する。13-cis retinoic acid(イソトレチノイン)はプロドラッグであり、細胞内でAll-trans RAに変換されて、同様の遺伝子発現の調節を行う。
レチノイン酸はNotchシグナル伝達系を阻害して、膠芽腫幹細胞の幹細胞特性を喪失させて、成熟した膠芽腫細胞に分化誘導し、膠芽腫の治療にプラスに作用するということです。
【オートファジー阻害はNotch阻害の抗腫瘍効果を増強する】
以下の様な報告があります。
Targeting Notch Signaling and Autophagy Increases Cytotoxicity in Glioblastoma Neurospheres.(Notchシグナル伝達とオートファジーを標的とすることは、膠芽腫ニューロスフェアへの細胞毒性を増加させる)Brain Pathol. 2016 Nov;26(6):713-723.
【要旨】
Notchシグナル伝達系などの発生経路を標的とする治療法は、幹様細胞を含む多くの神経膠芽腫細胞を排除するが、その有効性はさまざまなメカニズムによって制限される。
化学療法抵抗性の1つのメカニズムはオートファジーの誘導である。しかし、オートファジーがNotch阻害剤への応答をどのように影響するかはほとんどわかっていない。
γ-セクレターゼ阻害剤MRK003を使用して、膠芽腫ニューロスフェアのNotch経路活性をブロックし、オートファジーへの影響を評価した。
γ-セクレターゼ阻害剤の添加によって、オートファジーマーカーの増加が認められた。
オートファジー阻害剤のクロロキンをMRK003と組み合わせることにより、Notch阻害単独と比較して、アポトーシスの有意な誘導と増殖抑制が認められた。
軟寒天のクローン形成性の阻害に対しても、クロロキンとMRK003の併用は同様の抗腫瘍効果を示した。これらの結果は、薬理学的ノッチ遮断が神経膠腫ニューロスフェアに保護的オートファジーを誘発し、化学療法抵抗性をもたらし、オートファジー阻害剤との併用治療によって無効にできることを示した。
γ-セクレターゼ阻害剤を添加すると、がん細胞のオートファジーが亢進します。このオートファジー亢進は細胞を保護するための反応です。したがって、クロロキンでオートファジーを阻害することはγ-セクレターゼ阻害剤による細胞毒性を増強するというメカニズムです。
別の研究グループからも同様な実験結果が報告されています。
The anti-malarial drug chloroquine sensitizes oncogenic NOTCH1 driven human T-ALL to γ-secretase inhibition.(抗マラリア薬クロロキンは、発がん性のNOTCH1駆動型ヒトT細胞急性リンパ芽球性白血病のγ-セクレターゼ阻害に対する感受性を高める)Oncogene. 2019 Jul;38(27):5457-5468.
この論文では、T細胞急性リンパ芽球性白血病(T-ALL)細胞に対するγ-セクレターゼ阻害剤の抗腫瘍効果がオートファジー阻害剤のクロロキンで増強されることを報告しています。
クロロキンは、NotchリガンドのNOTCH1の細胞内輸送と分解を阻害してNotchシグナル伝達系を阻害するのでγ-セクレターゼ阻害剤との相乗効果があるということです。
【細胞が栄養飢餓になるとオートファジーが亢進する】
オートファジー (Autophagy) は、細胞内のタンパク質を分解するための仕組みの一つです。
「auto-」はギリシャ語の「自分自身」を表す接頭語で「phagy」は「食べること」の意で、「自食(じしょく)」と日本語訳されています。
オートファジーは細胞内タンパクや小器官を二重の脂質膜で包み込み,これをリソソームに輸送して分解する仕組みです。
細胞は栄養飢餓に陥るとオートファジーにより細胞質やオルガネラの一部を分解および再利用し、細胞の生存に必要なエネルギーやアミノ酸を得ています。
細胞が飢餓条件下におかれると、細胞質に隔離膜と呼ばれる扁平な小胞が現れます。その後、膜は細胞質内の異常タンパク質や細胞内小器官を取り込みながら伸長し、先端どうしが融合して、オートファゴソームが形成されます。 オートファゴソームがリソソームと融合して内包物は分解されます。自己消化で得られたアミノ酸は栄養源として再利用されます。

図:細胞質に隔離膜と呼ばれる扁平な小胞が現れ、異常なタンパク質や細胞内小器官を取り込む(①)。その後、膜は細胞質を取り込みながら伸長し(②)、先端どうしが融合して、オートファゴソームが形成される(③)。 オートファゴソーム内にはミトコンドリアなどの大きなオルガネラも含まれる。オートファゴソームがリソソームと融合すると(④)、内包物は分解される(⑤)。自己消化で得られたアミノ酸は栄養源として再利用される。
オートファジーの細胞保護機能は栄養欠乏の条件下で細胞の生存に必要なエネルギーと代謝中間体を提供するものとして一般的に理解されています。
抗がん剤治療に対する抵抗性のメカニズムの一つとしてオートファジーが注目されています。
抗がん剤や放射線で小胞体ストレスが亢進すると細胞に死滅しやすくなります。オートファジーは異常タンパク質を分解して小胞体ストレスを軽減すると同時に、タンパク質を分解してアミノ酸を再利用して増殖に使うことができます。
がん細胞のオートファジーを阻害することは、化学療法または放射線に対する感受性を増強し、抗がん剤および放射線治療に対する耐性を克服することができると考えられています。
オートファジー阻害剤としてはクロロキンやヒドロキシクロロキンが有名です。
【クロロキンとヒドロキシクロロキンはオートファジーを阻害する】
クロロキン(chloroquine)はマラリアの治療もしくは予防のために1940年代から用いられています。クロロキンの側鎖末端にヒドロキシル基(-OH)が付加したのがヒドロキシクロロキン(hydroxychloroquine)です。(下図)

ヒドロキシクロロキンの薬物動態はクロロキンと同様ですが、消化管からの吸収がより速やかで腎臓からの排泄も速く、クロロキンより毒性が低いので、ヒドロキシクロロキンの方が主に使用されています。
経口投与で70%前後が消化管から吸収されます。
シトクロムP450酵素(CYP 2D6、2C8、3A4、3A5)で代謝されます。
WHO必須医薬品モデル・リストに収載されている薬です。
ヒドロキシクロロキン硫酸塩(Hydroxychloroquine sulfate)は、マラリア、皮膚エリテマトーデス、全身性エリテマトーデスなどの治療薬として世界中で広く使用されています。
ヒドロキシクロロキンは米国で1955年に承認されて以降、70 カ国以上で承認されており、適正量かつ短期間の使用では重篤な副作用は少ないとされています。
全身性エリテマトーデスの治療に欠かせない薬とされており、日本でもヒドロキシクロロキンの全身性エリテマトーデスへの治験が 2012 年に始まり、2015 年に承認されました。
ヒドロキシクロロキン硫酸塩(商品名:プラケニル)は免疫調節薬に分類されており、免疫系を抑制することによって自己免疫疾患の活動性を抑制します。
全身性エリテマトーデスでステロイドと免疫抑制薬を使用している場合、ヒドロキシクロロキン硫酸塩(プラケニル)を加えることによってステロイドをより減量しやすくなります。
ヒドロキシクロロキンががん治療で注目されている理由は、ヒドロキシクロロキンは細胞内のタンパク質を分解するオートファジーを阻害する作用があるためです。
オートファジー阻害薬はがん治療薬として開発が行われていますが、ヒドロキシクロロキンは現時点でFDA(米国食品医薬品局)が承認している医薬品の中でオートファジ阻害作用が証明されている唯一の医薬品です。
このオートファジー阻害作用は、がん細胞の細胞死を誘導し、抗がん剤感受性を高めます。
近年、がん治療の抵抗性の一つのメカニズムとしてオートファジーが注目されています。
抗がん剤治療で小胞体ストレスが亢進すると細胞に死滅しやすくなります。オートファジーは異常タンパク質を分解して小胞体ストレスを軽減すると同時に、タンパク質を分解してアミノ酸を再利用して増殖に使うことができるためです。
オートファジーは細胞内の異常タンパク質を分解してリサイクル(再利用)するシステムです。
抗がん剤などでダメージを受けた細胞内小器官や異常タンパク質を分解して細胞のストレス負荷(小胞体ストレス)し、同時に栄養枯渇した状態において、細胞内のタンパク質やエネルギーを産生するための物質を得るために分解した栄養素をリサイクルすることによって生存を維持します。
したがって、抗がん治療にオートファジー阻害剤を併用すると、小胞体ストレスの亢進と、栄養飢餓が亢進して細胞が死滅しやすくなって、抗がん剤の効き目を高めることができます。

図:リボソームで合成されたタンパク質は小胞体で折り畳みや翻訳語修飾を受けて正常な機能を持ったタンパク質になる(①)。抗がん剤治療は小胞体にダメージを与え(②)、小胞体ストレスを引き起こし(③)、小胞体内で折畳み不全の異常タンパク質が増える(④)。小胞体内に異常タンパク質が凝集して蓄積し(⑤)、細胞機能が阻害されて細胞死が誘導される(⑥)。異常タンパク質はオートファゴソームに取り込まれ(⑦)、リソソームと癒合してオートファジーのメカニズムで分解される(⑧)。オートファジーは小胞体ストレス負荷を軽減し、栄養素をリサイクルすることによって(⑨)、細胞死を阻止する(⑩)。
以下のような論文があります。
Low concentration of chloroquine enhanced efficacy of cisplatin in the treatment of human ovarian cancer dependent on autophagy(低濃度のクロロキンは、オートファジーに依存するヒト卵巣がんの治療におけるシスプラチンの抗腫瘍効果を増強する)Am J Transl Res. 2017 Sep 15;9(9):4046-4058.
【要旨の抜粋】
背景:シスプラチンは卵巣がんの治療に使用され、強力な抗腫瘍効果を発揮する。オートファジーががん細胞の生存プロセスとして機能することが多くの研究で明らかにされており、オートファジー阻害薬のクロロキンと様々な化学療法薬の併用効果が検討されている。この研究では、クロロキンが卵巣がんの治療におけるシスプラチンの効果を高めることができるかどうかを検討した。
結果:低濃度のクロロキンだけでは細胞の生存率、移動、または浸潤に影響を及ぼさないが、ヒト卵巣がん細胞のSKOV3とhey細胞の両方で、低濃度のクロロキンの併用は、シスプラチンによる細胞の生存率、移動、浸潤を阻害する効果を高めた。
シスプラチンは、オートファゴソームの形成を誘導し、オートファジー関連タンパク質ATG 5、ATG 7、ベクリン1およびLC3B II / LC3B Iを増加させた。
クロロキン単独ではがん細胞のアポトーシスとアポトーシス関連タンパク質の発現に影響しなかったが、クロロキンとシスプラチンの併用投与はシスプラチン単独よりもアポトーシス誘導を増強した。
異種移植腫瘍を用いた動物実験でも、クロロキンとシスプラチンの併用は、シスプラチン単独よりも、移植腫瘍の増殖をより抑制し、細胞分裂の指標であるki-67発現を低下させ、アポトーシスの指標である切断型カスパーゼ3発現を増強した。
結論:シスプラチン投与は、卵巣がん細胞のおいて細胞保護的なオートファジーを誘導する。クロロキンはオートファジーを阻害することによって、シスプラチンの抗腫瘍効果を高める。
がん細胞に抗がん剤のシスプラチンを投与すると細胞死を逃れる一つのメカニズムとしてオートファジーを亢進します。オートファジーの亢進は抗がん剤によるダメージからがん細胞を保護する働きをします。したがって、オートファジーを阻害する作用のあるクロロキンを併用すると、がん細胞が死滅しやすくなるということです。
ヒドロキシクロロキンの効果をメタ解析した報告があります。
The clinical value of using chloroquine or hydroxychloroquine as autophagy inhibitors in the treatment of cancers:A systematic review and meta-analysis(がんの治療におけるオートファジー阻害剤としてのクロロキンまたはヒドロキシクロロキンを使用することの臨床的価値:系統的レビューとメタ分析)Medicine (Baltimore). 2018 Nov; 97(46): e12912.
【要旨】
背景:オートファジーは、異常なタンパク質や細胞内小器官の除去とリサイクルを行うリソソームを使った細胞内のメカニズムである。オートファジーの異常ががんを含む様々な疾患の発症に関連していることが多くの研究で明らかになっている。がん治療におけるオートファジー阻害剤の使用が検討されているが、オートファジー阻害剤の有効性については議論の余地がある。そこで、オートファジー阻害剤を使ったがん治療の臨床的価値を評価することを目的として、メタ分析を行った。
方法:オートファジー阻害剤を使ったがん治療を評価する臨床研究を検索した。これらの研究からデータを抽出して、全奏効率、6か月間の無増悪生存率、および1年全生存率率の相対リスク(RR)を評価した。
結果:7件の臨床試験が確認された(n = 293)。ヒドロキシクロロキン+ゲムシタビンの併用が2件、ヒドロキシクロロキン+ドキソルビシンの併用が1件、クロロキン+放射線の併用が1件、クロロキン+テモゾロミド+放射線の組み合わせが1件、およびヒドロキシクロロキンの単独療法が1件であった。
オートファジー阻害剤を併用しなかった場合に比べて、オートファジー阻害剤を併用したがん治療では、全奏功率(RR:1.33、95%信頼区間:0.95–1.86、P = .009)、6か月間の無増悪生存率(RR:1.72、95%信頼区間:1.05–2.82、P = .000 )、1年間の全生存率(RR:1.39、95%信頼区間:1.11–1.75、P = .000)はいずれも高かった。
結論:このメタ分析の結果は、化学療法や放射線療法においてオートファジー阻害剤の併用が治療効果を高めることを示しており、オートファジー阻害剤の併用はがん治療に新しい戦略を提供する可能性がある。
以下のような報告があります。
Phase I trial of hydroxychloroquine with dose-intense temozolomide in patients with advanced solid tumors and melanoma.(進行性固形腫瘍および黒色腫の患者における高用量テモゾロミドを併用したヒドロキシクロロキンの第I相試験)Autophagy. 2014 Aug;10(8):1369-79.
【要旨の抜粋】
ヒドロキシクロロキンでオートファジーを阻害すると、アルキル化化合物による化学療法による細胞死を亢進できることが前臨床モデルの研究で示されている。
この第1相臨床試験では、進行性固形悪性腫瘍患者を対象に、高用量テモゾロミドとの組み合わせにおける、ヒドロキシクロロキンの最大耐量、安全性、有効性、薬物動態および薬力学を評価した。
40人の患者(転移性黒色腫が73%)が、ヒドロキシクロロキンを1日 200〜1200 mgと、高用量のテモゾモミド(150 mg / m2)を7日間あるいは14日間毎日投与された。この組み合わせは忍容性が良好であり、用量制限毒性は観察されなかった。
ヒドロキシクロロキンは最大耐用量に到達しなかったので、第2相臨床試験での推奨されるヒドロキシクロロキンの投与量は、高用量のテモゾロミドと組み合わせて、1日に1回600mgを2回服用と決定された。
一般的な毒性には、グレード2の疲労(55%)、食欲不振(28%)、吐き気(48%)、便秘(20%)、および下痢(20%)であった。
転移性黒色腫の患者において部分奏功が3/22(14%)および病状安定が6/22(27%)の患者で観察された。
最終用量のコホートでは、治療抵抗性のBRAF野生型黒色腫の患者の2/6がほぼ完全に奏効し、病状安定の延長を認めた。併用療法に反応して、末梢血単核細胞のオートファジー液胞に有意な蓄積が観察された。
この研究は、高用量のヒドロキシクロロキンと高用量のテモゾロミドの組み合わせが安全で忍容性があり、オートファジー阻害の程度と関連していることを示している。
長期にわたる病状安定と奏功率の向上は、黒色腫患者における抗腫瘍活性を示唆しており、悪性黒色腫におけるより強力なオートファジー阻害剤と化学療法の組み合わせのさらなる研究が必要である。
がん領域においては、抗がん剤治療の効果を高めることが多くの基礎研究で報告され、複数の臨床試験が実施されています。
オートファジーを阻害する作用によって、抗がん剤の効果を高めることが報告されています。ヒドロキシクロロキンはリソソームの酸性化を阻害してリソソームの働きを阻止します。
抗生物質のクラリスロマイシンもオートファジーを阻害する効果が報告されています。クラリスロマイシンと抗がん剤治療の併用効果が多数報告されています。
クラリスロマイシンとヒドロキシクロロキンは異なるメカニズムでオートファジーを阻害するので、この2つを併用するとオートファジーを強力に阻害できる可能性があります。
以上から、オールトランス・レチノイン酸とヒドロキシクロロキンとクラリスロマイシンの併用は膠芽腫幹細胞を消滅させる方法として試してみる価値はあると思います。
新刊紹介:膠芽腫(グリオブラストーマ)の根治を目指す補完・代替医療
本書はプリント・オン・デマンド(Print on Demand)という出版形式で書店では販売していません。アマゾンからの購入になります。
アマゾンからの購入はこちらへ:
| « 730)膠芽腫(... | 732)膠芽腫(... » |




