がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
566) 酸化治療とミトコンドリア毒: がん細胞のミトコンドリアをオーバーヒートさせるという治療

図:がん細胞はグルコースの取込みと解糖系でのエネルギー産生が亢進している。2-デオキシグルコースはヘキソキナーゼを阻害することによって解糖系とペントースリン酸経路を阻害する(①)。高濃度ビタミンC点滴と半枝蓮は、細胞内の活性酸素の産生を高め(②)、がん細胞の解糖系を阻害してエネルギー産生を低下させる(③)。抗生物質のドキシサイクリンはミトコンドリアのタンパク合成を阻害してミトコンドリア機能を阻害する(④)。ジクロロ酢酸はピルビン酸脱水素酵素を活性化してTCA回路を亢進する(⑤)。メトホルミンは呼吸酵素複合体Iを阻害してATP産生を低下させ(⑥)、同時にミトコンドリアでの活性酸素の産生を高める(⑦)。ジスルフィラムとオーラノフィンはがん細胞の抗酸化システムを阻害して活性酸素の産生を高める(⑧)。ケトン食はグルコースの取込みとペントースリン酸経路を阻害し(⑨)、さらにケトン体のアセト酢酸はアセチルCoAに変換されてTCA回路を活性化する(⑩)。これらの総合作用で、細胞のATP産生は低下し、活性酸素の産生が亢進して酸化傷害によって細胞は死滅する(⑪)。
566) 酸化治療とミトコンドリア毒: がん細胞のミトコンドリアをオーバーヒートさせるという治療
【酸化ストレスの2面性とは】
細胞内外からの活性酸素やフリーラジカルによって細胞が酸化傷害を受ける状況を酸化ストレスと言います。
細胞がミトコンドリアで酸素呼吸を行うと活性酸素が発生し、炎症が起こると炎症細胞から活性酸素やフリーラジカル(化学反応性が高まって他の物質を酸化する原子や分子のこと)の産生が増えます。
活性酸素やフリーラジカルは、DNAやタンパク質や脂質と反応してDNAの変異や細胞のダメージを生じさせるので、その結果としてがんの発生や再発を促進し、がん細胞の増殖や悪性進展を促進します。
そして、この酸化ストレスの増加に対しては、細胞は活性酸素を消去する酵素(スーパーオキシド・ディスムターゼ、カタラーゼ、グルタチオン・ペルオキシダーゼ、チオレドキシン還元酵素など)の発現や活性を高めたり、フリーラジカルを消去するグルタチオンなどの物質の生成を高めたりして、酸化ストレスを軽減しようとします(下図)。

図:細胞内ではミトコンドリアで酸素を使ってATP産生を行うときに活性酸素が発生し、炎症があると炎症細胞から活性酸素が発生する。このようにして産生された活性酸素は細胞に酸化傷害を引き起こすが、細胞内には活性酸素を消去する抗酸化物質や抗酸化酵素による抗酸化力が存在し、酸化還元のバランスを維持することによって酸化傷害の発生を防いでいる。活性酸素種の量と抗酸化力の差が酸化ストレスとなる。細胞内には、酸化ストレスの増大に応じて、抗酸化酵素の発現や活性を亢進することによって抗酸化力を高めるメカニズムが存在する。
抗酸化力を高めることは、がんの発生や進展を予防する効果があります。したがって、細胞の抗酸化力を高めることはがん細胞の発生やがん細胞の悪性化進展の抑制につながるので、「抗酸化力を高めることは、がんの発生や再発の予防に役に立つ」というのが研究者のコンセンサスになっています。
しかし一方、がん細胞はこの抗酸化力を利用して治療に抵抗性になっていることが明らかになっています。
放射線治療や抗がん剤治療は、がん細胞に酸化ストレスを誘導し、その酸化ストレスによる細胞のダメージががん細胞を死滅させる作用として重要です。がん細胞は正常細胞と同様に、酸化ストレスを軽減する仕組みを利用して、放射線や抗がん剤に対して抵抗性を獲得しています。
したがって、「放射線治療や抗がん剤治療を行うときには、がん細胞の抗酸化力を弱める方法を併用すると、抗腫瘍効果を高めることができる」ということになります。つまり、がん細胞は酸化ストレスに対する抵抗力(抗酸化力)を高めることによって放射線や抗がん剤に抵抗性になっているので、この仕組みを阻害することはがん治療に役立つと考えられています。
実際に、がん治療の研究分野では、がん細胞の抗酸化力を阻害する薬の開発ががん治療に役立つという観点からの研究論文が数多く発表されています。
つまり、がんの発生や再発予防の目的では酸化ストレスを軽減することが良いのですが、放射線治療や抗がん剤治療などがん細胞を死滅させる目的ではがん細胞の酸化ストレスを高める方が良いのです。これが、がん治療における『酸化ストレスの2面性』です。

図:がん細胞において酸化ストレスが増大すると、遺伝子変異の発生、がん遺伝子の活性化、細胞増殖や転移の促進、アポトーシス抵抗性が誘導され、がん細胞の悪性進展や治療に対する抵抗性が高まる(①)。しかし、さらに酸化ストレスが増大して、ある閾値を超えると、細胞の酸化傷害(細胞膜脂質の過酸化など)が高度になって細胞機能が障害され、増殖が停止し、さらに細胞死が誘導される(②)。がんの発生や再発を予防する目的では、がん細胞の酸化ストレスを軽減する治療が有効であり、がん細胞を死滅させる目的ではがん細胞の酸化ストレスを高める治療が有効になる(③)。抗酸化剤は酸化ストレスを軽減するため、中等度の酸化ストレスでがん細胞の活動性が高まる状態を抑制するが、抗がん剤や放射線治療などで高度の酸化ストレスを与えているときは治療効果を阻害する。
【がん細胞のミトコンドリアは活性酸素がでやすい】
細胞内のミトコンドリアでは、酸素を使ったエネルギー産生の過程で活性酸素が発生します。活性酸素は細胞内のタンパク質や脂質や核酸を酸化してダメージを与えます。
正常細胞においては、ミトコンドリアにおける物質代謝やエネルギー産生過程は整然とコントロールされており、活性酸素の発生は最小限に抑えられています。つまり、正常な細胞内では活性酸素によるダメージが少ない状態に維持されています。
一方、がん細胞ではミトコンドリアに様々な異常が起こっています。ATPを産生する呼吸鎖にも異常が起こっており、酸素を使ったエネルギー産生過程で大量の活性酸素が産生されやすくなっています。これは、排気ガス処理装置が壊れた自動車が排気ガスをまき散らすのと同じ状態です。
つまり、がん細胞ではミトコンドリアでの酸素消費を増やせば、活性酸素の産生が増えて、酸化ストレスによって細胞がダメージを受けて死滅するリスクが高いのです。
がん細胞では、このような酸化ストレスの増加を防ぐために、酸素を使わない解糖系でのエネルギー産生を増やしています。つまり、酸素がある条件でも解糖系でのATP産生を増やし、酸素を使ったミトコンドリアでのATP産生を抑制している理由の一つは、酸化ストレスを高めたくないからです。
ミトコンドリアでのエネルギー産生を抑制するため、効率の悪い解糖系でエネルギー産生を行う必要があるために、グルコースの取込みと解糖系の亢進が起こっているということになります。
またグルコース-6-リン酸からのペントース・リン酸経路での代謝も亢進しており、この系で産生されるNADPHが細胞内の酸化ストレスを軽減するために利用されます。(下図)

図:がん細胞におけるグルコース代謝の特徴を示している。がん細胞ではミトコンドリアの呼吸鎖の異常などによって酸素を使ってATPを産生すると活性酸素の産生量が増える状況にある(①)。そこでがん細胞ではミトコンドリアでのATP産生(酸化的リン酸化)を抑制して酸化ストレスの増大を防いでいる。そのため、解糖系が亢進し乳酸の産生が増えている(②)。また、ペントース・リン酸経路が亢進し、この経路でできるNADPHは活性酸素の消去に使われる(③)。脂肪酸やケトン体はミトコンドリアで代謝されるので、通常はがん細胞はエネルギー源として利用しない(④)。がん細胞は細胞内の抗酸化システムを亢進して酸化ストレスを軽減している(⑤)。
【がん幹細胞はミトコンドリアの量が増えている】
一般に、がん細胞では、酸素が十分に利用できる状況でもミトコンドリアでの酸素呼吸が抑制され、グルコース(ブドウ糖)の取込みと解糖系が亢進し、乳酸の生成が増えているという物質代謝の特徴を持っています。これを好気性解糖(Aerobic glycolysis)あるいはワールブルグ効果(Warburg effect)と言います。
しかし、がん細胞はこの基本法則を厳密に守っているわけではありません。特にがん幹細胞(Cancer Stem Cell)では、エネルギー産生や物質代謝において、かなりの柔軟性(フレキシビリティ)を持っています。
エネルギー産生には酸素を使わない解糖系とミトコンドリアで酸素を使う酸素呼吸(酸化的リン酸化)があります。
エネルギー産生の材料には、グルコースだけでなく、アミノ酸、脂肪酸、ケトン体、乳酸などを使います。
脂肪酸やケトン体をエネルギー産生に利用するには、ミトコンドリアでの代謝になるので、解糖系が亢進しミトコンドリアでの酸素呼吸が低下している「通常のがん細胞」では、脂肪酸やケトン体を利用しにくい状態にあります。これが、超低糖質高脂肪食のケトン食の抗がん作用の根拠の一つです。しかし、ケトン食の抗腫瘍効果には限界があります。
グルコースが枯渇して利用できなくなったり、解糖系が阻害されると、ミトコンドリアでの酸素呼吸によるエネルギー産生を亢進します。エネルギー産生の材料が脂肪酸とケトン体しかなければ、これらを利用します。
このような代謝の状況を「代謝の柔軟性(metabolic flexibility)」と言います。解糖系を阻害する方法やケトン食だけでは、がん幹細胞を死滅できません。代謝の柔軟性によってミトコンドリアを利用するエネルギー産生にスイッチを切り替えることができるからです。
グルコースが利用できない状況でがん細胞が生きていくためには、脂肪酸やケトン体も利用するようになるのです。
がん幹細胞(cancer stem cell)は腫瘍始原細胞(tumor initiating cell)とも呼ばれ、がん細胞を生み出すもとになる細胞であり、がん組織中に少数(数%程度)存在しています。
通常の抗がん剤治療や放射線治療に対して、成熟したがん細胞は死滅しやすいのですが、がん幹細胞は様々な機序で抵抗性を示します。
がん幹細胞が生き残れば、がんはいずれ再燃・再発するので、がん幹細胞の放射線感受性や抗がん剤感受性を高める方法の開発が重要と考えられています。
がん幹細胞のマーカーとしてアルデヒド脱水素酵素(Aldehyde dehydrogenase)が知られています。
アルデヒド脱水素酵素はがん幹細胞に多く発現し、この酵素の発現が多いがんほど増殖が早く予後が悪いことが報告されています。
アルデヒド脱水素酵素は細胞内のアルデヒドを酸化することによってがん細胞内の酸化ストレスを軽減しています。
さらに、がん幹細胞ではミトコンドリアの量が増えていることが報告されています。
がん幹細胞が細胞分裂を繰り返し、腫瘍塊を作る時にミトコンドリアでの物質代謝やエネルギー産生が必要だからです。ミトコンドリアで酸素呼吸を行うと活性酸素が増えて酸化ストレスが亢進するので、アルデヒド脱水素酵素などの抗酸化システムが亢進していると考えられます。
したがって、ミトコンドリアの機能を阻害し、アルデヒド脱水素酵素を阻害するとがん幹細胞を死滅することができます。このとき、がん細胞の解糖系を阻害し、ミトコンドリアでの酸素呼吸を無理矢理増やすと、がん細胞は酸化ストレスが亢進して死滅します。

図:がん組織にはがん幹細胞 (cancer stem cells)と呼ばれる細胞が存在して、通常のがん細胞(成熟がん細胞)を供給しながらがん組織を構成している。がん幹細胞は自己複製を行う一方、不均等分裂により一部が自己複製のサイクルから逸脱して分化し通常のがん細胞となっている。 成熟がん細胞はミトコンドリアが少なく、アルデヒド脱水素酵素(Aldehyde dehydrogenase;ALDH)の活性は低く、腫瘍形成能を持たない。一方、がん幹細胞は、ミトコンドリアが多く、アルデヒド脱水素酵素(ALDH)の活性が高い。この性質が腫瘍形成能やアポトーシス抵抗性の原因となっている。したがって、がん幹細胞を死滅させるにはミトコンドリア機能とアルデヒド脱水素酵素(ALDH)は重要なターゲットになる。
【がんを感染症のように治療する】
ミトコンドリアはエネルギー産生と物質代謝の中心です。がん幹細胞は幹細胞の性質を維持するためにミトコンドリアの量と機能を高めていることが報告されています。ミトコンドリアの機能を阻害すると、がん幹細胞の腫瘍形成能が阻害されることが報告されています。
ミトコンドリアは元々は細菌だったので、細菌を死滅する抗生物質はミトコンドリア毒が多いと言えます。実際に、抗生物質を使ってがん幹細胞の腫瘍形成能を阻害する治療が検討されています。以下のような報告があります。
Antibiotics that target mitochondria effectively eradicate cancer stem cells, across multiple tumor types: treating cancer like an infectious disease.(ミトコンドリアを標的とする抗生物質は、複数の腫瘍タイプにわたってがん幹細胞を効果的に根絶させる:がんを感染症のように治療する。)Oncotarget. 2015 Mar 10;6(7):4569-84.
【要旨】
この論文では、がん幹細胞を選択的に標的化することによって、がんを治療する新しい戦略を提案する。
がん治療における遺伝子変異に依存しない治療法を提供するために、複数の腫瘍タイプにわたってがん幹細胞の間で高度に保存されている細胞の特徴を探索した。
これにより、がんの種類とは関係なく、「がん幹細胞」を単一の疾患として、全てのがんを効果的に治療することができる。
がん幹細胞のクローン性の増殖および生存には、ミトコンドリア新生に対して厳密な依存性が存在し、これががん幹細胞の弱点になっていることを明らかにした。
興味深いことに、FDA承認の抗生物質の中には、ミトコンドリアの生合成を阻害することが「副作用」としてなっているものがあり、この作用はがん治療においては「治療効果」として利用できる。
この分析に基づいて、8つの異なる腫瘍タイプ(乳がん、非浸潤性乳管がん、卵巣がん、前立腺がん、肺がん、膵臓がん、メラノーマおよび膠芽腫)の12種類のがん細胞株を用いて、FDAが認可した4〜5種類の抗生物質ががん幹細胞を根絶するのに使用できることを示す。
ミトコンドリアを標的とする抗生物質の5つのクラスには、エリスロマイシン系薬、テトラサイクリン系薬、グリシルサイクリン系薬、抗寄生虫薬およびクロラムフェニコールが含まれる。
それぞれの薬剤クラスの中から1個づつを選び、アジスロマイシン、ドキシサイクリン、チゲサイクリン、パモ酸ピルビニウム、クロラムフェニコールの解析結果を報告する。
重要なことは、これらの薬物の多くは、正常細胞に対して無毒であり、抗がん剤治療の副作用を軽減する可能性がある。
したがって、複数の腫瘍タイプにおけるがん治療のためにFDA承認の抗生物質を再利用することにより、感染症のようながんを治療することを提案する。
最後に、がん幹細胞を根絶する能力はまだ臨床的には評価されていないが、がん関連感染症を標的として行われた(がん細胞自体をターゲットとしたものではない)ドキシサイクリンおよびアジスロマイシンを用いた最近の臨床試験は、がん患者において既に有効な治療効果を示している。
抗がん剤治療が効いている場合でも、治療開始して半年から1年くらいで再増殖します。これは、がん細胞が抗がん剤に耐性を獲得する結果です。
がん組織は不均一な組織であり、元々耐性を持ったがん細胞が存在する場合もあります。この場合は、抗がん剤治療によって抗がん剤耐性のがん細胞が選択的に残って増殖が加速されるので、もっと早く効かなくなります(554話参照)。
このような抗がん剤抵抗性にはがん幹細胞の存在が重要視されています。
がん幹細胞の増殖と生存と腫瘍形成には、ミトコンドリア新生が必要という報告があります。
正常な上皮細胞が増殖・生存するためには、インテグリンを介した細胞外マトリックスとの接着が必要です。上皮細胞は細胞や細胞外基質と接着して増殖し、浮遊状態では増殖できず細胞死が誘導されます。
一方、がん細胞では足場が無くても増殖できます。
がん細胞を培養する実験で、がん細胞が腫瘍の塊を作るとき、単層で増殖するときに比べて60種類以上のミトコンドリア関連タンパク質が過剰に発現するという報告があります。つまり、がん幹細胞の腫瘍形成能(腫瘍塊を形成する能力)にはミトコンドリア新生(biogenesis)が必要だということです。
そこで、この論文では、がん幹細胞の腫瘍形成能を指標にしてミトコンドリア毒性のある抗生物質の作用を検討しています。
その結果、人間のミトコンドリアに毒性のある抗菌剤を添加するとがん幹細胞の腫瘍形成能が阻止されたという結果を報告しています。

図:リボソームはタンパク質を合成する作用があり、リボソームの働きを阻害するとタンパク質が合成できないので、抗菌作用を示す。細菌とミトコンドリアのリボソームは類似しており、細菌のリボソームの働きを阻害する抗菌剤は人間のミトコンドリアの蛋白合成を阻害して、ミトコンドリア新生を阻害する。エリスロマイシンとクロラムフェニコールは細胞の50Sリボソームに作用し、ミトコンドリアの39Sリゾソームにも作用する。テトラサイクリンとグリシルサイクリンは細菌の30Sリボソームに作用し、ミトコンドリアの28Sリボソームに作用する。
この論文では、抗菌剤としてテトラサイクリン、エリスロマイシン、グリシルサイクリン、クロラムフェニコールを検討し、いずれもがん細胞のミトコンドリア新生を阻害し、がん幹細胞の腫瘍形成能を阻害することを報告しています。
腫瘍形成能などのがん幹細胞の幹細胞の性質(stemness)の維持にミトコンドリア新生が必要で、このミトコンドリア新生を阻止すると、がん細胞は腫瘍形成ができずに死滅するという結果です。

図:抗生物質のドキシサイクリンは細菌のリボソームの働きを阻害することによってタンパク質の合成を阻害し、抗菌作用を発揮する(①)。ミトコンドリアのリボソームは細菌のリボソームと相同性が高いので、ドキシサイクリンはミトコンドリア新生を阻害する(②)。メトホルミンはミトコンドリア呼吸酵素を阻害することによってATP産生を低下させ、活性酸素の産生を高める(③)。ジクロロ酢酸ナトリウムはミトコンドリアの酸素呼吸を亢進して活性酸素の産生を亢進する(④)。活性酸素の産生亢進に対してがん細胞は抗酸化システム(アルデヒド脱水素酵素やチオレドキシン系など)を亢進している(⑥)。ジスルフィラムとオーラノフィンはがん細胞の抗酸化システムを阻害する(⑦)。2-デオキシグルコース(2-DG)や半枝蓮や高濃度ビタミンC点滴は解糖系を阻害することによってATP産生低下をさらに促進する(⑧)。
【抗生物質のドキシサイクリンはがん幹細胞の腫瘍形成能を阻害する】
前述の論文では、効果や費用や副作用などを総合的に考慮すると、テトラサイクリン系のドキシサイクリンが最も良いようです。
その理由は、体内での半減期が長く、尿路感染症や前立腺炎やニキビの治療に1日200mgで4〜6ヶ月の長期服用が行われており、副作用が少ないことが知られています。
ドキシサイクリンの抗腫瘍効果は動物の移植腫瘍の実験でも示されています。例えば、膵臓がんを移植したマウスの実験では、腫瘍の増殖を80%抑制することが報告されています。乳がんの骨転移の実験では、骨転移を60%以上抑制する作用が報告されています。
ドキシサイクリン(商品名:ビブラマイシン)はテトラサイクリン誘導体の抗生物質です。テトラサイクリンの有効性と安定性を改善した医薬品で、50年以上前(1960年代後半)にFDA(米国食品医薬品局)が承認しています。グラム陽性とグラム陰性の両方の細菌に効き、にきびの治療に使われています。
テトラサイクリンは細菌のリボソームの30Sサブユニットに結合して、細菌のタンパク合成を阻害します。この細菌の30Sリボソーム・サブユニットはミトコンドリアの28Sリボソーム・サブユニットと相同性があるため、ミトコンドリアのタンパク質合成を阻害する作用もあり、この作用によってミトコンドリア機能やミトコンドリア新生を阻害します(下図)。

図:ドキシサイクリンは細菌のリボソームの30Sサブユニットに結合して、ポリペプチド鎖へのアミノ酸の結合を阻害して、細菌のタンパク合成を阻害する。細菌の30Sリボソーム・サブユニットとミトコンドリアの28Sリボソーム・サブユニットは相同性があるため、ミトコンドリアのタンパク質合成を阻害する作用もある。
ドキシシクリンにがん細胞の増殖や腫瘍形成能を阻害する作用が報告されています。以下のような報告があります。
Induction of Mitochondrial Dysfunction and Oxidative Damage by Antibiotic Drug Doxycycline Enhances the Responsiveness of Glioblastoma to Chemotherapy.(抗生物質のドキシサイクリンはミトコンドリアの機能異常と酸化障害を引き起こして、グリオブラストーマの抗がん剤に対する反応性を亢進する)Med Sci Monit. 2017 Aug 26;23:4117-4125.
【要旨】
研究の背景:がん治療において、ミトコンドリアの機能異常を誘導する方法の有効性が指摘されている。抗生物質のドキシサイクリンが、ミトコンドリアをターゲットにすることによって抗がん作用を示すことが報告されている。この研究では、ドキシサイクリンがグリオブラストーマ(膠芽腫)の治療に有効かどうかを検討した。
実験方法:グリオブラストーマの増殖や生存やミトコンドリアでの代謝に対するドキシサイクリンの効果を検討した。40匹のマウスを用いた移植腫瘍の実験系で、テモゾロマイドとドキシルビシンの併用による治療効果を検討した。
結果:ドキシサイクリンは、グリオブラストーマ細胞株に対して、細胞増殖を抑制し、アポトーシス(細胞死)を誘導した。培養細胞の実験系(in vitro)および移植腫瘍の動物実験系(in vivo)で、ドキシサイクリンはグルオブラストーマのテモゾロマイド感受性を亢進した。
作用機序として、ドキシサイクリンはミトコンドリア膜ポテンシャルを低下させ、ミトコンドリアの呼吸を阻害することによってミトコンドリア機能を阻害した。
ドキシサイクリンはミトコンドリアのATP産生を低下させ、ミトコンドリアのスーパーオキシドと細胞内の活性酸素種の量を高め、酸化傷害の指標である8-OHdGと蛋白質のカルボニル化と脂質過酸化を増やした。
これは、ドキシサイクリンはミトコンドリアにおけるエネルギー産生を破綻させ、酸化ストレスを高めて細胞の酸化傷害によって、グリオブラストーマ細胞を死滅させることを示している。
抗酸化剤のN-アセチル-L-システインを投与すると、ドキシサイクリンの増殖抑制とアポトーシス誘導作用が阻止された。これは、ドキシサイクリンがグリオブラストーマに酸化ストレスを高めて抗腫瘍作用を示すことを示している。
結論:我々の研究では、抗生物質のドキシサイクリンが、ミトコンドリアの機能不全および酸化的ストレスを誘導することによって、グリオブラストーマの治療に有効であることを示している。 我々の研究はまた、グリオブラストーマにおけるミトコンドリア代謝の重要性を示している。
ドキシサイクリンはミトコンドリアの酸素呼吸を阻害してATP産生を低下させ、さらに活性酸素の産生を高めて、酸化傷害を引き起こすという結果です。ドキシサイクリンは細胞内エネルギー(ATP)を減少させ、同時に酸化ストレスを高めることによってがん細胞を死滅させるというメカニズムです。
以下のような報告があります。
Doxycycline inhibits the cancer stem cell phenotype and epithelial-to-mesenchymal transition in breast cancer.(ドキシサイクリンは乳がん細胞におけるがん幹細胞の性質と上皮-間葉移行を阻止する)Cell Cycle. 2017 Apr 18;16(8):737-745.
【要旨】
乳がん細胞は乳がん幹細胞から発生し、乳がん幹細胞の足場非依存性の増殖と生存にはミトコンドリア新生が必要であることが示されている。したがって、乳がん治療においてミトコンドリアは重要なターゲットになる。
FDA(米国食品医薬品局)の認可薬であるドキシサイクリンの副作用の一つにミトコンドリア新生の阻害がある。
この研究では、乳がん細胞と乳がん幹細胞の腫瘍形成や浸潤、移動、アポトーシス、がん幹細胞のマーカー、上皮-間葉移行に関連したマーカーに対するドキシサイクリンの作用とそのメカニズムを検討した。さらに、乳がん細胞に対するドキシサイクリンの阻害作用におけるオートファジーの関与を検討した。
我々は、ドキシサイクリンが乳がん細胞と乳がん幹細胞の生存と増殖を阻害し、乳がん細胞の腫瘍形成能と移動と浸潤と上皮-間葉移行を低下させることを明らかにした。
ドキシサイクリン投与は、がん幹細胞のマーカーであるOct4、Sox2、Nanog 、 CD44の発現を有意に低下させた。さらに、ドキシサイクリンはオートファジーのマーカーのLC-3BI とLC-3BIIの発現を低下させ、上皮-間葉移行とがん幹細胞のマーカーに対する作用にオートファジー阻害作用の関与が示唆された。
ドキシサイクリンは乳がん細胞の上皮-間葉移行とがん幹細胞の性質を阻害する作用を有することが示され、乳がん治療に利用できる可能性が示唆された。
ドキシサイクリンが、乳がん幹細胞の幹細胞として能力を維持させる作用と上皮-間葉移行(上皮細胞が線維芽細胞のような間葉系細胞の性質を獲得して周囲組織への浸潤性が高まること)を阻止するという結果です。そのメカニズムとしてミトコンドリアの働きを阻害する作用を指摘しています。
リボソームはmRNAの遺伝情報を読み取ってタンパク質へと変換する細胞内小器官です。細菌は30Sサブユニットと50Sサブユニットの2つから構成されます。
真核生物のリボソームは少し大きく、40Sサブユニットと60Sサブユニットから構成されます。
細菌とヒトなどの真核生物ではリボソームの構造が異なるため、細菌のリボソームにのみ特異的な阻害剤は、病原細菌に対する毒性は高くヒトに対する毒性が低い抗生物質になります。
そのような抗生物質としてアミノグリコシド系化合物(ストレプトマイシン、ネオマイシン、カナマイシン)やテトラサイクリン、クロラムフェニコール、マクロライド系化合物などがあります。
ドキシサイクリンはテトラサイクリン系の抗生物質です。細菌のリボソームに対する選択性が高いので、副作用は少ないのですが、ミトコンドリアのリボソーム(28Sと39Sサブユニットから構成)にも作用して、ミトコンドリアのタンパク質合成を阻害する作用があるということです。そして、この作用ががん治療に使えるということです。
ミトコンドリアはエネルギー(ATP)産生だけでなく、細胞内カルシウムの恒常性維持、アポトーシス制御、細胞内シグナル伝達系など多くの機能において重要な働きを担っています。
がん細胞は活性酸素の産生を抑えるためにミトコンドリアの酸素呼吸を抑制していますが、ミトコンドリアが破綻して機能が阻害されると、がん細胞は生存できません。
ミトコンドリアを活性化して(酸素呼吸を増やして)、同時にミトコンドリアの呼吸鎖や機能を阻害すると、活性酸素の発生が増え、酸化ストレスが亢進して、がん細胞特異的にミトコンドリアを破綻できることになります。このとき、ドキシサイクリンはミトコンドリアの破綻を促進する効果を発揮します。
がん細胞のミトコンドリアをオーバーヒートさせるようなイメージです。
【ミトコンドリアにおける活性酸素の産生を増やすとがん細胞は死滅する】
最近はミトコンドリアをターゲットにしたがん治療薬の開発が注目されています。いわゆるミトコンドリア毒は抗がん作用が期待できます。
メトホルミン(metformin)は、世界中で1億人以上の2型糖尿病患者に使われているビグアナイド系経口血糖降下剤です。
メトホルミンは、ミトコンドリアの呼吸鎖の最初のステップである呼吸酵素複合体I を阻害することが明らかになっています。メトホルミンはミトコンドリアのグリセロールリン酸脱水素酵素(mitochondrial glycerol-phosphate dehydrogenase: mGDP)を阻害することも報告されています。(下図)

図:メトホルミンは有機カチオン輸送体1(organic cation transporter 1 :OCT1)によって細胞内に入り、ミトコンドリアに集積する。ミトコンドリアでは呼吸酵素複合体IとmGDP(ミトコンドリア・グリセロールリン酸脱水素酵素)を阻害してNADH酸化を阻害する。その結果、呼吸鎖活性の低下はミトコンドリアでのTCA回路の活性を低下させ、ミトコンドリアでのATP産生は低下する。これらの作用はAMP活性化プロテインキナーゼ(AMP)シグナル伝達系を亢進し、cAMP/PKAシグナル伝達系を抑制し、糖新生を抑制し、解糖を亢進する。(参考:BMC Biol. 2014; 12: 82.)
メトホルミンは抗老化作用や寿命延長作用があります。そのメカニズムとして、呼吸酵素阻害によるATP産生阻害が関連しています。
ATP産生阻害によってAMPK(AMP依存性プロテインキナーゼ)が活性化されます。さらに、電子伝達系(呼吸鎖)の阻害によって活性酸素の産生が増える結果、細胞は転写因子のFox03aやPGC-1α(ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α)やNrf2の活性を高め、抗酸化酵素酵素や解毒酵素の発現を高め、ストレス抵抗性を高め、加齢関連疾患の発症を抑制し、寿命を延ばす作用を発揮します。ミトホルミシスの機序です(504話参照)。
このメトホルミンの呼吸酵素阻害作用は、がん細胞において活性酸素の産生を増やす目的でがん治療への応用が検討されています。
前述の論文でも、ドキシサイクリンとメトホルミンの併用の有用性を指摘してます。両方ともミトコンドリアの機能を障害して、さらに活性酸素の産生を増やし、がん細胞の酸化ストレスを高めて、がん細胞の増殖を抑制し、細胞死を誘導できると推測しています。
ドキシサイクリンはミトコンドリアのリボソームの働きを阻害してタンパク質合成を阻害し、ミトコンドリア新生を阻害します。
メトホルミンは呼吸酵素複合体を阻害して、活性酸素の産生を高めます。
さらに、ジクロロ酢酸ナトリウムによってミトコンドリアの代謝を活性化すると、ミトコンドリアでの活性酸素の産生を増やすことができます。
酸化ストレスを軽減するために、がん細胞はアルデヒド脱水素酵素やチオレドキシン還元酵素などの抗酸化システムを亢進しています。これらの抗酸化システムはジスルフィラムやオーラノフィンで阻止できます。
このようにして、がん細胞の酸化ストレスを高めれば、がん細胞を死滅できます。
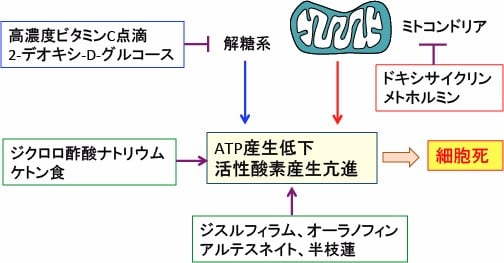
図:細胞質での解糖系とミトコンドリアでの酸素呼吸(酸化的リン酸化)を同時に阻害すれば、エネルギー(ATP)が枯渇して細胞は死滅する。解糖系阻害の方法として高濃度ビタミンC点滴や2-デオキシグルコースがある。ミトコンドリアでのエネルギー阻害にはメトホルミンやドキシサイクリンがある。さらに、酸化ストレスを高める方法としてジクロロ酢酸ナトリウム、ケトン食、ジスルフィラム、オーラノフィン、アルテスネイト、半枝蓮などの併用も有効。これらを組み合せることによってがん細胞に選択的を死滅できる。
【がん細胞に選択的にエネルギーを枯渇させる】
がん幹細胞を死滅させるためには、「解糖系とミトコンドリアでの酸素呼吸を同時に阻害する」という方法が考えられます。
しかし、解糖と酸素呼吸を阻害すると、正常細胞にもダメージが大きくなります。
そこで、正常細胞とがん細胞のミトコンドリアや抗酸化システムの違いを利用することになります。
一つは、がん細胞はミトコンドリアの機能に様々な異常があって、活性酸素が出やすい状況にあります。酸化ストレスの亢進はがん細胞の増殖や転移を抑制し、細胞死を誘導します。
つまり、代謝をターゲットにしたがん治療には①解糖系の阻害、②ミトコンドリアでのATP産生阻害、③ミトコンドリアでの活性酸素の産生亢進、④抗酸化システムの阻害の4つが必要だと言えます。
がん細胞の酸化ストレスを高めてがん細胞を死滅させる治療法は「oxidation therapy(酸化治療)」と呼ばれ、このようながん治療に関する研究論文が最近かなり増えています。
がん細胞は酸化ストレスに弱いので、酸化ストレスを能動的に高めることによって、がん細胞を死滅させる治療法の開発が注目されています。
放射線治療と一部の抗がん剤(ビンブラスチン、シスプラチン、マイトマイシンC、ドキソルビシン、カンプトテシンなど)は、がん細胞に酸化傷害を引き起こして細胞にダメージを与えて死滅させます。
このような治療に対して、がん細胞は抗酸化酵素を誘導したりグルタチオンの産生量を増やして、酸化ストレスに対する抵抗性を高めます。これが、薬剤耐性の一つのメカニズムになっているので、抗酸化酵素の誘導やグルタチオンの産生を阻害すると、これらの治療に対する効果を高め、さらに抵抗性獲得を阻害することができます。
放射線治療や抗がん剤治療以外で、がん細胞にエネルギーを枯渇し、活性酸素の発生量を増やす方法として、2-デオキシグルコース、高濃度ビタミンC点滴、ジクロロ酢酸ナトリウム、メトホルミン、ジスルフィラム、オーラノフィン、ドキシサイクリン、半枝蓮、ケトン食などがあります。(トップの図)
進行がんの抗がん剤治療の場合、副作用で体力が低下したり、QOL(生活の質)が低下して、必ずしも治療を受けるメリットが無い場合も多くあります。そのような場合は、標準治療では緩和ケアに移行します。
緩和ケアと並行して、副作用の少ない方法でがん細胞の増殖を抑えると、QOLの改善と延命効果が得られます。エビデンスに基づいた補完・代替医療を利用することも役立ちます。保険診療機関で受ける標準治療以外に、がんの治療法があることを多くのがん患者さんは知りません。それが、死ぬ間際まで抗がん剤治療を受けている理由となっています。現在の抗がん剤治療は、「QOLを良くした状態で延命する」という点では理想の治療とは言えません。効果が低く、副作用の強い抗がん剤だけが進行がんのベストの治療法で無いことをもっと理解する必要があります。
| « 565)抗がん剤... | 567)臨床試験... » |





