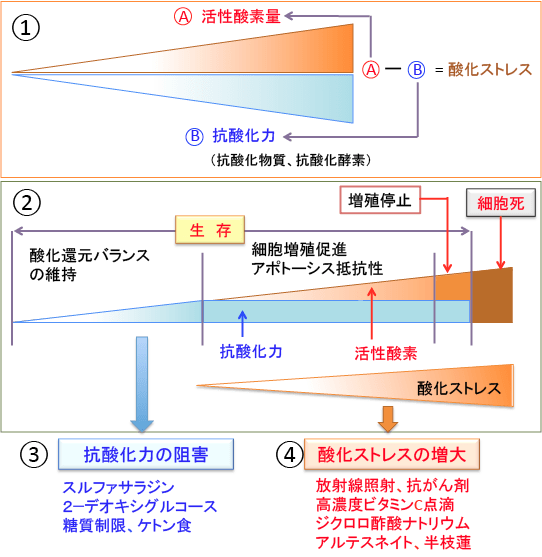
図:①細胞内ではミトコンドリアで酸素を使ってATP産生を行うときに活性酸素が発生し、炎症があると炎症細胞から活性酸素が発生する。このようにして産生された活性酸素は細胞に酸化傷害を引き起こすが、細胞内には活性酸素を消去する抗酸化物質や抗酸化酵素による抗酸化力が存在し、酸化還元のバランスを維持することによって酸化傷害の発生を防いでいる。活性酸素種の量と抗酸化力の差が酸化ストレスとなる。細胞内には、酸化ストレスの増大に応じて、抗酸化酵素の発現や活性を亢進することによって抗酸化力を高めるメカニズムが存在する。
②がん細胞において酸化ストレスが増大すると、遺伝子変異の発生、細胞増殖の促進、アポトーシス抵抗性が誘導され、がん細胞の悪性進展や治療に対する抵抗性が高まる。しかし、さらに酸化ストレスが増大して、ある閾値を超えると、細胞の酸化傷害(細胞膜脂質の過酸化など)が高度になって細胞機能が障害され、増殖が停止し、さらに細胞死が誘導される。放射線治療や一部の抗がん剤治療はがん細胞に酸化ストレス(酸化傷害)を高めて細胞を死滅させる治療法と言える。
がん細胞の抗酸化力を減弱させる(③)か、酸化ストレスを高める(④)と、がん細胞を死滅させやすくできる。がん細胞の抗酸化力を減弱させる方法としてスルファサラジン、2−デオキシグルコース、糖質制限、ケトン食などがあり、酸化ストレスを高める方法としては、放射線照射や抗がん剤の他に、高濃度ビタミンC点滴、ジクロロ酢酸ナトリウム、アルテスネイト、半枝蓮などがある。この2つのメカニズムを組み合わせれば、がん細胞をより死滅できる。
しかし、がん細胞を死滅できるレベルに酸化ストレスを高めることができなければ、中途半端な酸化ストレス上昇はがんを悪化させるリスクに注意が必要である。そのため、がん細胞の抗酸化力を阻害する方法(③)の併用がポイントになる。
352)がん細胞の酸化ストレスを高めて死滅させる方法
【がん細胞と酸化ストレス:北風 vs 太陽】
イソップ童話の「北風と太陽」では、北風と太陽が力比べをするために、どちらが旅人の上着を脱がせることができるかという勝負をします。
北風は、風を力いっぱい吹いて上着を吹き飛ばそうとしますが、旅人は上着をしっかり押さえてしまい、旅人の服を脱がせることができませんでした。
次に太陽が燦燦と照りつけると、旅人は暑さに耐え切れず、自分から上着を脱いでしまい、この勝負は太陽が勝ったという話です。
物事を解決しようとするとき、力づくで行ってもうまく行くとは限らないという喩えです。
敵対する国との外交でも、経済制裁や武力行使で相手国に譲歩させる手段と、逆に、援助や融和政策によって妥協させて穏やかに解決する手段と、どちらがうまくいくかという議論もあります。
どちらが有効かは、ケースバイケースです。圧力をかけた方がうまく行く場合もあり、融和の方が解決する場合もあります。
さて、がん細胞と酸化ストレスの関係も似たような関係にあります。
がんの予防や治療において、「がん細胞の酸化ストレスを軽減する」のと「がん細胞の酸化ストレスを高める」のどちらが良いかという問題です。
この2つは全く逆なので、間違った方を選択すると、がんを悪化させるという結果になるので、注意が必要です。
対応を間違わないためには、酸化ストレスの2面性を理解しておく必要があります。
【酸化ストレスの2面性とは】
細胞には、活性酸素や発がん物質や細胞毒など様々な傷害やストレスに対して自らを守る仕組みやシステムを持っています。
例えば、発がん物質に対しては、それを解毒する酵素によって対抗します。
活性酸素や細胞毒によって細胞がダメージを受ければ、それを修復してもとに戻すシステムが作動します。例えば、DNAの傷を修復するDNA修復酵素が働くので、紫外線や活性酸素によってDNAにたえず傷がついてもがんの発生を防いでくれます。
細胞内外からの活性酸素やフリーラジカルによって細胞が酸化傷害を受ける状況を酸化ストレスと言います。
細胞がミトコンドリアで酸素呼吸を行うと活性酸素が発生し、炎症が起こると炎症細胞から活性酸素やフリーラジカル(化学反応性が高まって他の物質を酸化する原子や分子のこと)の産生が増えます。
活性酸素やフリーラジカルは、DNAやタンパク質や脂質と反応してDNAの変異や細胞のダメージを生じさせるので、その結果としてがんの発生や再発を促進し、がん細胞の増殖や悪性進展を促進します。
そして、この酸化ストレスの増加に対しては、細胞は活性酸素を消去する酵素(スーパーオキシド・ディスムターゼ、カタラーゼ、グルタチオン・ペルオキシダーゼなど)の発現や活性を高めたり、フリーラジカルを消去するグルタチオンなどの物質の生成を高めたりして、酸化ストレスを軽減しようとします。
抗酸化力を高めることは、がんの発生や進展を予防する効果があります。したがって、細胞の抗酸化力を高めることはがん細胞の発生やがん細胞の悪性化進展の抑制につながるので、「抗酸化力を高めることは、がんの発生や再発の予防に役に立つ」というのが研究者のコンセンサスになっています。
しかし一方、がん細胞はこの抗酸化力を利用して治療に抵抗性になっていることが明らかになっています。放射線治療や抗がん剤治療は、がん細胞に酸化ストレスを誘導し、その酸化ストレスによる細胞のダメージががん細胞を死滅させる作用として重要です。がん細胞は正常細胞と同様に、酸化ストレスを軽減する仕組みを利用して、放射線や抗がん剤に対して抵抗性を獲得しています。
したがって、「放射線治療や抗がん剤治療を行うときには、がん細胞の抗酸化力を弱める方法を併用すると、抗腫瘍効果を高めることができる」ということになります。つまり、がん細胞は酸化ストレスに対する抵抗力(抗酸化力)を高めることによって放射線や抗がん剤に抵抗性になっているので、この仕組みを阻害することはがん治療に役立つと考えられています。
実際に、がん治療の研究分野では、がん細胞の抗酸化力を阻害する薬の開発ががん治療に役立つという観点からの研究論文が数多く発表されています。
つまり、がんの発生や再発予防の目的では酸化ストレスを軽減することが良いのですが、放射線治療や抗がん剤治療などがん細胞を死滅させる目的ではがん細胞の酸化ストレスを高める方が良いのです。

図:がん細胞において酸化ストレスが増大すると、遺伝子変異の発生、細胞増殖の促進、アポトーシス抵抗性が誘導され、がん細胞の悪性進展や治療に対する抵抗性が高まる。しかし、さらに酸化ストレスが増大して、ある閾値を超えると、細胞の酸化傷害(細胞膜脂質の過酸化など)が高度になって細胞機能が障害され、増殖が停止し、さらに細胞死が誘導される。がんの発生や再発を予防する目的では、がん細胞の酸化ストレスを軽減する治療が有効であり、がん細胞を死滅させる目的ではがん細胞の酸化ストレスを高める治療が有効になる。
【がん細胞に酸化ストレスを高める方法】
がん細胞の酸化ストレスを高めてがん細胞を死滅させる治療法は「oxidation therapy(酸化治療)」と呼ばれ、このようながん治療に関する研究論文が最近かなり増えています。
がん細胞は酸化ストレスに弱いので、酸化ストレスを能動的に高めることによって、がん細胞を死滅させる治療法の開発が注目されています。
そもそも放射線治療と一部の抗がん剤(ビンブラスチン、シスプラチン、マイトマイシンC、ドキソルビシン、カンプトテシンなど)は、がん細胞に酸化傷害を引き起こして細胞にダメージを与えて死滅させます。
このような治療に対して、がん細胞は抗酸化酵素を誘導したりグルタチオンの産生量を増やして、酸化ストレスに対する抵抗性を高めます。これが、薬剤耐性の一つのメカニズムになっているので、抗酸化酵素の誘導やグルタチオンの産生を阻害すると、これらの治療に対する効果を高め、さらに抵抗性獲得を阻害することができます。
放射線治療や抗がん剤治療以外で、がん細胞に活性酸素の発生量を増やす方法として、高濃度ビタミンC点滴、ジクロロ酢酸ナトリウム、アルテスネイト、半枝蓮などがあります。
高濃度ビタミンC点滴は、1 回に50~100グラムという大量のビタミンCを1~3 時間かけて点滴するという治療法です。がん細胞に取込まれたビタミンCが過酸化水素を発生することでDNAやミトコンドリアにダメージを与え、解糖系を阻害してATP産生を阻害することによって抗がん作用を発揮すると報告されています。ビタミンCはブドウ糖を構造が似ており、同じ糖輸送担体( グルコーストランスポーター) によって細胞内に取込まれます。がん細胞はブドウ糖の取込みが亢進し抗酸化酵素(カタラーゼなど) の活性が低下しているので、大量のビタミンCががん細胞に取込まれ、がん細胞が選択的に死滅させることができるという治療法です。
糖質制限によって利用できるブドウ糖が少ないと、がん細胞に取込まれるビタミンCの量が増えます。したがって、糖質制限やケトン食は高濃度ビタミンCの抗がん作用を増強します。

図:ビタミンCによって発生した過酸化水素がDNAにダメージを与えると、PARPが活性化されNADが枯渇し、解糖系もTCA回路も進まなくなります。活性酸素はミトコンドリアもダメージを与えます。これらの作用で、エネルギーが枯渇して細胞が死滅することになります。
半枝蓮(はんしれん;学名は Scutellaria barbata) は中国各地や台湾、韓国などに分布するシソ科の植物で、古くからがんの治療に中国や台湾などで使用され、その有効性が示されています。半枝蓮の抗がん作用に関しては、民間療法における臨床経験から得られたものが主体ですが、近年、半枝蓮の抗がん作用に関する基礎研究が多数発表されています。米国のベンチャー企業が半枝蓮の抽出エキスを使って乳がんなどに対する効果を臨床例で検討しており、有効性が報告されています。
基礎研究では、半枝蓮には、がん細胞の増殖抑制作用、アポトーシス( プログラム細胞死) 誘導作用、抗変異原性作用、抗炎症作用、発がん過程を抑制する抗プロモーター作用などが報告されています。さらに、がん細胞の嫌気性解糖系と酸化的リン酸化の両方を阻害してエネルギー産生を低下させ、がん細胞を死滅させる作用が報告されています(図)。
図:半枝蓮はミトコンドリアに作用してミトコンドリアからの活性酸素の産生を高める。活性酸素によってDNAがダメージを受けるとポリADPリボース合成酵素(PARP)の活性が亢進し、NAD+(酸化型ニコチンアミドアデニンジヌクレオチド)が枯渇する。NAD+が枯渇すると解糖系は進まなくなる。活性酸素の産生増加はミトコンドリアにおける酸化的リン酸化を阻害する。つまり、半枝蓮は解糖系と酸化的リン酸化の両方を阻害することによってATPの産生を低下させ、がん細胞を死滅させる。
高濃度ビタミンC点滴と半枝蓮の相乗効果については
303話で紹介しています。
アルテスネイト(Artesunate)は中国で古くからマラリアなどの感染症の治療に使われていた青蒿(セイコウ:Artemisia annua)というキク科の薬草から分離された成分で、現在ではマラリアの特効薬として使用されています。アルテスネイトは分子の中に鉄イオンと反応してフリーラジカルを産生するendoperoxide bridge を持っています。がん細胞は鉄を多く取り込んでいるので、その鉄と反応してフリーラジカルを産生してがん細胞を死滅させるという作用機序が提唱されています。(図)
図:アルテスネイトは鉄イオンと反応してフリーラジカルを発生し殺細胞作用を示す。がん細胞は鉄の取込みが高いのでアルテスネイトにより死滅するが、正常細胞は鉄が少ないので傷害を受けない。
がん遺伝子のc-Mycや低酸素状態によって発現が誘導される低酸素誘導性因子1αという転写因子はトランスフェリンレセプターの発現を高めています。鉄は細胞増殖に必要なため、がん細胞はトランスフェリンレセプターを多く発現して鉄を多く取り込んでいます。細胞分裂の早いがん細胞ほど鉄を多く取り込んでいると言われています。一方、がん細胞はスーパーオキシド・ディスムターゼ(SOD)やカタラーゼやグルタチオンペルオキシダーゼなどの抗酸化酵素の発現が少なく、酸化ストレスに対する抵抗力(抗酸化力)が低下していると言われています。したがって、がん細胞内の鉄と反応してフリーラジカルを発生するアルテスネイトは、正常細胞を傷つけずにがん細胞に選択的に障害を与えることができるのです。(図)
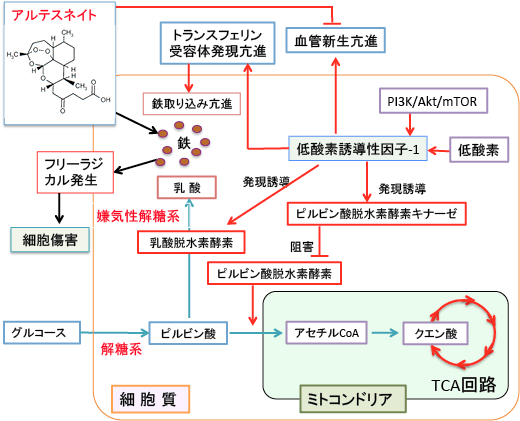
図:がん細胞は低酸素誘導性因子-1の発現が亢進している。低酸素誘導性因子-1はトランスフェリン受容体の発現を誘導して鉄の取込みを高める。がん細胞に取り込まれた鉄とアルテスネイトが反応してフリーラジカルを発生するとがん細胞は死滅する。
アルテスネイトによってがんや肉腫が縮小した臨床報告があり、人間における腫瘍にたいしても有効であることが証明されています。進行した非小細胞性肺がんの抗がん剤治療にアルテスネイトを併用すると抗腫瘍効果が高まることが、中国で行われたランダム化比較試験で報告されています。
最近の研究では、アルテスネイトは多彩な作用メカニズムで抗腫瘍効果を発揮することが報告されています。がん細胞内でフリーラジカルを産生して酸化ストレスを高める以外に、血管新生阻害作用、DNAトポイソメラーゼIIa阻害作用、細胞増殖や細胞死のシグナル伝達系に影響する作用などが報告されています。
ケトン食や嫌気性解糖系を阻害する方法でがん細胞のエネルギー産生を低下させ、がん細胞のTCA回路を活性化して酸化ストレスを増大させると同時に、がん細胞に多く含まれる鉄を利用して酸化ストレスを増大させるアルテスネイトの併用はがん細胞を選択的に死滅させる効果が期待できます。
がん細胞におけるミトコンドリアの機能低下は不可逆的なものではなく、可逆的に活性化することもできます。がん細胞で嫌気性解糖系が阻害されると、エネルギー産生をミトコンドリアでの酸化的リン酸化反応に移行せざるを得なくなります。元々がん細胞は抗酸化酵素の発現が低下しているので正常細胞よりも抗酸化力が低い特徴があります。したがって、ミトコンドリアにおける酸化的リン酸化が活性化して活性酸素の産生が高まるとがん細胞内で酸化ストレスが増大し、アポトーシスが起こりやすくなります。
ピルビン酸脱水素酵素を活性化してピルビン酸からアセチルCoAへの変換を促進してTCA回路を回せば、酸化的リン酸化による活性酸素の産生が増え、酸化ストレスの増大によってがん細胞が死滅することが報告されています。ピルビン酸脱水素酵素を活性化する方法としてジクロロ酢酸ナトリウムがあります。(図)
ジクロロ酢酸ナトリウム(sodium dichloroacetate)は酢酸(CH3COOH)のメチル基(CH3)2つの水素原子が塩素原子(Cl)に置き換わったジクロロ酢酸(CHCl2COOH)のナトリウム塩です。構造式はCHCl2COONaになります。
ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによってピルビン酸脱水素酵素の活性を高める作用があります。ミトコンドリアの異常による代謝性疾患、乳酸アシドーシス、心臓や脳の虚血性疾患の治療などに、医薬品として古くから(25年以上前から)使用されています。がん治療の場合は、体重1kg当たり10~15mgを水に溶かして服用します。
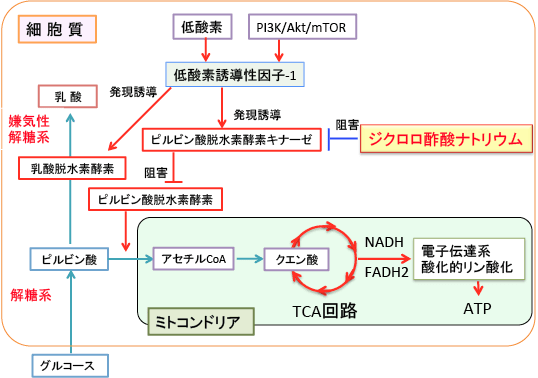
図:がん細胞では、ピルビン酸を乳酸に変換する乳酸脱水素酵素の活性(嫌気性解糖系によるエネルギー産生)が亢進し、ピルビン酸をアセチルCoAに変換するピルビン酸脱水素酵素の活性が低下しているため、ミトコンドリアでのTCA回路と電子伝達系によるエネルギー産生は低下している。低酸素になると誘導される低酸素誘導性因子-1(HIF-1)はピルビンン酸脱水素酵素キナーゼの発現を促進してピルビン酸脱水素酵素の活性を低下させる。ピルビン酸脱水素酵素キナーゼを阻害するジクロロ酢酸ナトリウムを使用すると、このがん細胞特異的な嫌気性解糖系の亢進を是正し、がん細胞を死滅させることができる。
がん細胞の抗酸化力を減弱させる方法として
スルファサラジンと
2−デオキシグルコースと
ケトン食については
346話で解説しています。
がん細胞も含め細胞は酸化ストレスが高まると、抗酸化酵素の発現を促進し、さらに抗酸化酵素の発生を高めたり、活性酸素を消去するグルタチンの合成を高めることによって酸化ストレスを軽減するメカニズムが作動します。
したがって、がん細胞の活性酸素の産生を高めるだけではがん細胞を酸化ストレスで死滅させることには限界があります。そこで、酸化ストレスの増大に伴ってがん細胞で誘導される抗酸化力の亢進を妨げる治療を併用することが重要です。この目的ではケトン食や2−デオキシグルコースやスルファサラジンの併用が有効です。
【がん細胞に酸化ストレスを高める治療とケトン食の併用効果について】
高圧酸素療法とケトン食の併用の抗がん作用については
346話(後半部分)で紹介しています。また、ケトン食ががん細胞の抗酸化力を減弱する理由も説明しています。
つまり、がん細胞は酸化ストレスに弱いので、酸化ストレスを与えると細胞はダメージを受けます。このとき、グルコースが十分にあれば、解糖系で産生されるエネルギーとペントース・リン酸経路で生成されるNADPHによって酸化傷害に対して抵抗性と回復力を高めることができます。
NADPH(ニコチンアミドアデニンジヌクレオチドリン酸) は、細胞内の過酸化水素や過酸化脂質の消去に必要なグルタチオンの還元に必要です。つまり、がん細胞のグルコース供給が不十分でペントース・リン酸経路でのNADPHの生成が不足すると、還元型グルタチオンの量が不足して、酸化傷害で死にやすくなります。
ケトン食はがん細胞のグルコースの利用を妨げ、エネルギー産生やNADPH生成を減らすので、高圧酸素で酸化ストレスが高くなると死滅することになります。
ケトン食の効果を高める2-デオキシ-D-グルコースの併用も有効です。2-デオキシ-D-グルコースは解糖系と同時にペントース・リン酸経路も阻害してHADPHの生成を減らします。
ペントース・リン酸経路では2カ所でNADPHが産生され、2-デオキシ-D-グルコース-6リン酸は最初のNADPH産生の代謝は受けますが2個目は反応が進まないため、NADPHの産生は半分になります。ただし、2-デオキシ-D-グルコース-6リン酸はヘキソキナーゼの活性を阻害するので、グルコース-6リン酸自体の生成を阻害するので、NADPHの産生を効率よく阻害することになります。
追記:
高濃度ビタミンC投与と解糖系を阻害する治療の併用が相乗効果で、非小細胞性肺がんのアポトーシスを促進することが最近の論文で報告されています。この2つの治療法の組合せが、がん細胞の酸化ストレスと高めてアポトーシスを誘導するという結果を報告しています。
PLoS One. 2013 Jun 11;8(6):e67081. doi: 10.1371/journal.pone.0067081. Print 2013.
Ascorbic acid and a cytostatic inhibitor of glycolysis synergistically induce apoptosis in non-small cell lung cancer cells.
ケトン食は酸化ストレスを高めて肺がんの放射線化学療法の効果を高めるという論文が最近報告されています。要旨を以下に紹介指定おきます。
Ketogenic diets enhance oxidative stress and radio-chemo-therapy responses in lung cancer xenografts.(ケトン食は移植肺がんの実験モデルにおいて、酸化ストレスと放射線化学療法の奏功率を高める)Clin Cancer Res. 2013 Jul 15;19(14):3905-13.
【要旨】
目的:ケトン食は脂肪が多く、糖質とタンパク質が少ない食事で、細胞のエネルギー(ATP)供給源を解糖系からではなく、脂肪酸の酸化とミトコンドリアでの呼吸によるATP産生を強制する食事である。
正常細胞に比べてがん細胞は、ミトコンドリアでの代謝によって慢性的な酸化ストレスの状態にあると考えられている。本研究では、移植肺がんの動物実験モデルを用いて、「ケトン食が酸化ストレスを高めることによって放射線化学療法(radio-chemo-therapy)の奏功率を高める」という仮説を検証した。
実験方法: NCI-H292とA549の2種類の肺がん細胞株を移植したマウスを通常食かケトン食(脂肪:タンパク質+糖質のカロリー比が4:1)で飼育し、通常の分割照射(1回1.8~2グレイ)か少分割照射(1回6グレイ)か通常の分割照射にカルボプラチンを併用した治療を行った。
マウスの体重と腫瘍のサイズを測定した。腫瘍組織の酸化ストレスのレベルは過酸化脂質生成物のヒドロキシノネナールで修飾されたタンパク質の量で、細胞増殖の程度はPCNA(proliferating cell nuclear antigen:増殖性細胞核抗原)の量で、DNAダメージの程度はリン酸化ヒストンH2AX(γH2AX)の量で、それぞれ評価した。
結果:NCI-H292細胞とA549細胞を移植したマウスの両方において、放射線治療単独群に比べて、放射線治療とケトン食を併用した群の方が、腫瘍の増殖速度はより低下した(P < 0.05)。
放射線治療とカルボプラチンの化学療法を併用した場合も、ケトン食を与えた群の方が通常食(コントロール)群より腫瘍の増殖速度が低下した。放射線治療とケトン食を併用したマウスの腫瘍組織では、ヒドロキシノネナールで修飾されたタンパク質の量で測定される脂質酸化による酸化障害の程度が高く、PCNAの免疫染色で評価される細胞増殖のレベルは低下した。
結論:これらの実験結果は、肺がんを移植したマウスの実験系において、ケトン食は酸化ストレスを高めることによって、放射線化学療法の効果を高めることを示している。
この結果は、放射線治療や抗がん剤治療を受けているときのケトン食の有効性を示唆しており、さらに抗酸化力を低下させるためにスルファサラジンや2-デオキシグルコースを併用するとさらに効果が高まる可能性を示唆しています。


画像をクリックするとサイトに移行します。