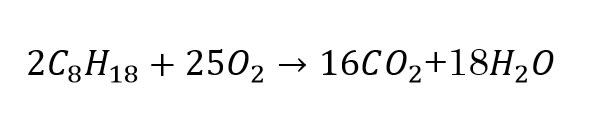
ガソリンは、Wikiによれば炭素数が4~10の炭化水素の混合物らしい。
本来は無色透明の揮発性の液体であるが、着色されているし、
その他にもオクタン価を高めるためにいろいろな添加されているようだ。
それはともかく、単純化するために添加物を考えず、
ガソリンの化学式も単一の物として考えてみる。
学校で習うガソリンの燃焼式は次の通り。
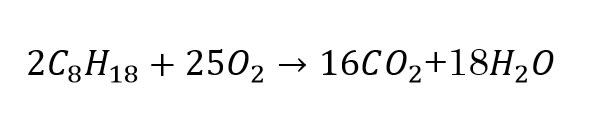
ここではガソリンをC8H18(オクタン)としている。
式は、2モルのガソリンを完全燃焼させると、16モルのCO2、
すなわち、二酸化炭素が発生することを示している。
半分で考えると1モルのガソリンが8モルの二酸化炭素を発生させるわけだ。
さて、1モルのガソリンの重さを計算する。
C(炭素)は1モル12gで、H(水素)は1gなので、
C8H18の1モルは、12×8+18=114gとなる。
一方、CO2の1モルは、
C(炭素)の1モルが12gと、O(酸素)16gから、
12+16×2=44gとなる。 (56じゃないよ)
ガソリン1モルが二酸化炭素8モルとなるので、44×8=352g、
つまり、114gのガソリンが燃えると352gの二酸化炭素が出る。
ほぼ3倍(3.09倍)!
式で使ったガソリン(オクタン)の比重は0.7、
実際のガソリンの比重は製品によって幅があるらしいが、0.75程度と考えられる。
ガソリン40L(約30kg)を燃やすと、酸素を約105kg消費し、
約42kgの水が生成され、92kgほどの二酸化炭素が出る。
こんなに二酸化炭素が出ると知ってました?
本来は無色透明の揮発性の液体であるが、着色されているし、
その他にもオクタン価を高めるためにいろいろな添加されているようだ。
それはともかく、単純化するために添加物を考えず、
ガソリンの化学式も単一の物として考えてみる。
学校で習うガソリンの燃焼式は次の通り。
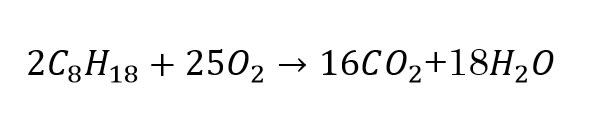
ここではガソリンをC8H18(オクタン)としている。
式は、2モルのガソリンを完全燃焼させると、16モルのCO2、
すなわち、二酸化炭素が発生することを示している。
半分で考えると1モルのガソリンが8モルの二酸化炭素を発生させるわけだ。
さて、1モルのガソリンの重さを計算する。
C(炭素)は1モル12gで、H(水素)は1gなので、
C8H18の1モルは、12×8+18=114gとなる。
一方、CO2の1モルは、
C(炭素)の1モルが12gと、O(酸素)16gから、
12+16×2=44gとなる。 (56じゃないよ)
ガソリン1モルが二酸化炭素8モルとなるので、44×8=352g、
つまり、114gのガソリンが燃えると352gの二酸化炭素が出る。
ほぼ3倍(3.09倍)!
式で使ったガソリン(オクタン)の比重は0.7、
実際のガソリンの比重は製品によって幅があるらしいが、0.75程度と考えられる。
ガソリン40L(約30kg)を燃やすと、酸素を約105kg消費し、
約42kgの水が生成され、92kgほどの二酸化炭素が出る。
こんなに二酸化炭素が出ると知ってました?


























※コメント投稿者のブログIDはブログ作成者のみに通知されます