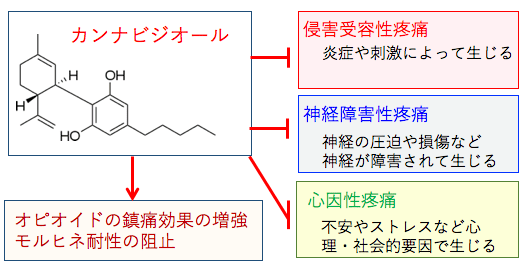
 図:疼痛は様々な原因で生ずる。外傷や火傷や炎症などによって末梢神経の侵害受容体が刺激されて生じる「侵害受容性疼痛」、坐骨神経痛や多発性硬化症や脊髄損傷による痛みや糖尿病神経障害による痛み・しびれなど、神経の圧迫や損傷などによって生じる「神経障害性疼痛」、不安やストレスなど心理・社会的な要因で起こる心因性疼痛に大別される。がん性疼痛では、これら複数の原因が関与していることが多い。カンナビジオールはこ . . . 本文を読む
図:疼痛は様々な原因で生ずる。外傷や火傷や炎症などによって末梢神経の侵害受容体が刺激されて生じる「侵害受容性疼痛」、坐骨神経痛や多発性硬化症や脊髄損傷による痛みや糖尿病神経障害による痛み・しびれなど、神経の圧迫や損傷などによって生じる「神経障害性疼痛」、不安やストレスなど心理・社会的な要因で起こる心因性疼痛に大別される。がん性疼痛では、これら複数の原因が関与していることが多い。カンナビジオールはこ . . . 本文を読む
 図:神経細胞間で刺激によってアナンダミドが合成され(①)、細胞外に放出されて細胞膜のカンナビノイド受容体に結合して作用を発揮する(②)。一方、細胞内では、アナンダミドは脂肪酸結合タンパク質(fatty acid-binding proteins:FABP)に結合して細胞内を運搬され(③)、小胞体の脂肪酸アミドハイドロラーゼ(fatty acid amide hydrolase:FAAH)で分解され . . . 本文を読む
図:神経細胞間で刺激によってアナンダミドが合成され(①)、細胞外に放出されて細胞膜のカンナビノイド受容体に結合して作用を発揮する(②)。一方、細胞内では、アナンダミドは脂肪酸結合タンパク質(fatty acid-binding proteins:FABP)に結合して細胞内を運搬され(③)、小胞体の脂肪酸アミドハイドロラーゼ(fatty acid amide hydrolase:FAAH)で分解され . . . 本文を読む
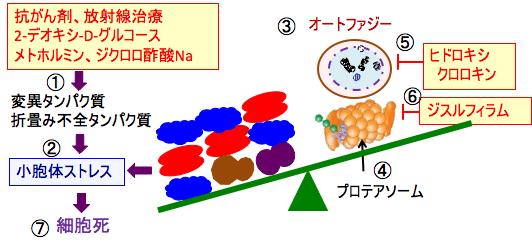 図:抗がん剤、放射線治療、2-デオキシ-D-グルコース、メトホルミン、ジクロロ酢酸ナトリウムは細胞内に変異タンパク質や折畳み不全のタンパク質を増やし(①)、小胞体ストレスを引き起こす(②)。オートファジー(③)とプロテアソーム(④)は異常タンパク質を分解することによって小胞体ストレスを軽減する。ヒドロキシクロロキンはオートファジーを阻害し(⑤)、ジスルフィラムはプロテアソームを阻害する(⑥)。これ . . . 本文を読む
図:抗がん剤、放射線治療、2-デオキシ-D-グルコース、メトホルミン、ジクロロ酢酸ナトリウムは細胞内に変異タンパク質や折畳み不全のタンパク質を増やし(①)、小胞体ストレスを引き起こす(②)。オートファジー(③)とプロテアソーム(④)は異常タンパク質を分解することによって小胞体ストレスを軽減する。ヒドロキシクロロキンはオートファジーを阻害し(⑤)、ジスルフィラムはプロテアソームを阻害する(⑥)。これ . . . 本文を読む
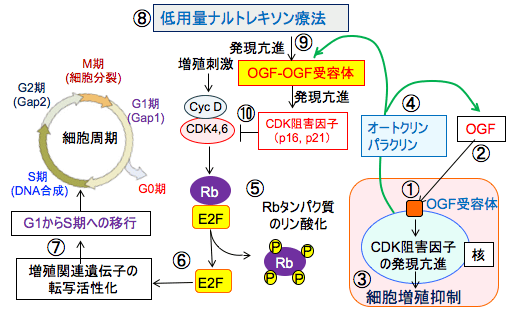 図:(右)オピオイド増殖因子受容体(OGF受容体)は細胞核の核膜の外側に存在し(①)、オピオイド増殖因子(OGF:メチオニン・エンケファリン)(②)と結合して核の中に移行し、サイクリン依存性キナーゼ(CDK)阻害因子の発現を亢進して細胞増殖を抑制する(③)。オピオイド増殖因子はオートクリン(自己分泌)あるいはパラクリン(傍分泌)の機序で細胞の増殖を抑制する因子として作用し(④)、発生や創傷治癒や血 . . . 本文を読む
図:(右)オピオイド増殖因子受容体(OGF受容体)は細胞核の核膜の外側に存在し(①)、オピオイド増殖因子(OGF:メチオニン・エンケファリン)(②)と結合して核の中に移行し、サイクリン依存性キナーゼ(CDK)阻害因子の発現を亢進して細胞増殖を抑制する(③)。オピオイド増殖因子はオートクリン(自己分泌)あるいはパラクリン(傍分泌)の機序で細胞の増殖を抑制する因子として作用し(④)、発生や創傷治癒や血 . . . 本文を読む
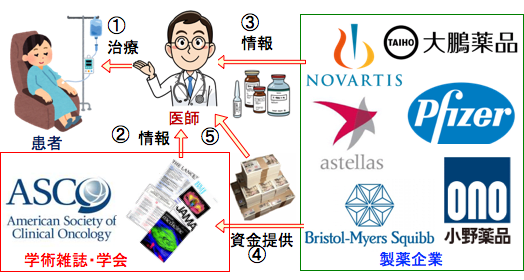 図:医師は薬を使って患者を治療する(①)。医師は医薬品や治療法の情報を学術雑誌や学会から得ている(②)。製薬会社主催の説明会や講演会などからも医薬品の情報を得ているが、製薬企業は販売促進に有利な情報を与える傾向にある(③)。学術雑誌には広告の名目で多額の資金が製薬企業から入っている。医学雑誌の編集委員医師にも製薬会社から金銭が渡っている。学会も製薬企業の資金が入っており、製薬企業の思惑に沿った内容 . . . 本文を読む
図:医師は薬を使って患者を治療する(①)。医師は医薬品や治療法の情報を学術雑誌や学会から得ている(②)。製薬会社主催の説明会や講演会などからも医薬品の情報を得ているが、製薬企業は販売促進に有利な情報を与える傾向にある(③)。学術雑誌には広告の名目で多額の資金が製薬企業から入っている。医学雑誌の編集委員医師にも製薬会社から金銭が渡っている。学会も製薬企業の資金が入っており、製薬企業の思惑に沿った内容 . . . 本文を読む
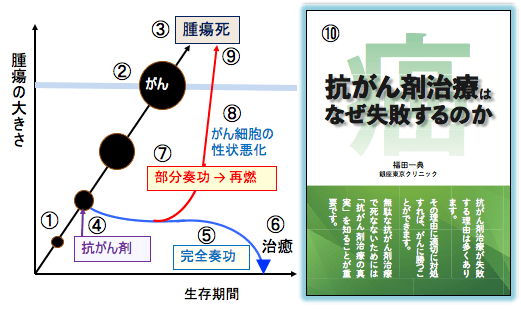 図:がん組織は初めは小さいが(①)、次第に増大して(②)、がんが進行するといずれ死に至る(③)。抗がん剤治療(④)を実施し、完全奏功(⑤)すれば治癒も期待できる(⑥)。しかし多くの場合、腫瘍が一時的に縮小(部分奏功)しても、抗がん剤に耐性を獲得し、がんの再燃が起こる(⑦)。抗がん剤治療後に再増殖したがん細胞は治療抵抗性の性質を獲得し、進行速度も速くなり、性状が悪化している(⑧)。その結果、急速に増 . . . 本文を読む
図:がん組織は初めは小さいが(①)、次第に増大して(②)、がんが進行するといずれ死に至る(③)。抗がん剤治療(④)を実施し、完全奏功(⑤)すれば治癒も期待できる(⑥)。しかし多くの場合、腫瘍が一時的に縮小(部分奏功)しても、抗がん剤に耐性を獲得し、がんの再燃が起こる(⑦)。抗がん剤治療後に再増殖したがん細胞は治療抵抗性の性質を獲得し、進行速度も速くなり、性状が悪化している(⑧)。その結果、急速に増 . . . 本文を読む
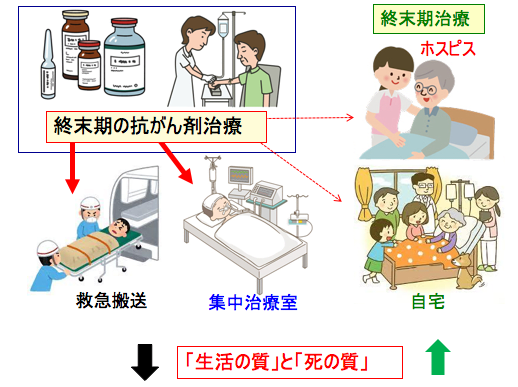 図:終末期(死亡2〜6か月前)に抗がん剤治療を受けると、救急外来受診や集中治療室入院を受ける頻度が増える。ホスピスケアを受ける機会を失い、自宅など患者が望んだ場所で死亡する割合が少なくなる。終末期の抗がん剤治療は「生活の質」と「死の質」の両方を低下させる。このような結果に、終末期に抗がん剤治療を受ける決断をしたことを後悔する遺族は多い。
873)終末期の抗がん剤治療を後悔する遺族は多い
【抗が . . . 本文を読む
図:終末期(死亡2〜6か月前)に抗がん剤治療を受けると、救急外来受診や集中治療室入院を受ける頻度が増える。ホスピスケアを受ける機会を失い、自宅など患者が望んだ場所で死亡する割合が少なくなる。終末期の抗がん剤治療は「生活の質」と「死の質」の両方を低下させる。このような結果に、終末期に抗がん剤治療を受ける決断をしたことを後悔する遺族は多い。
873)終末期の抗がん剤治療を後悔する遺族は多い
【抗が . . . 本文を読む
 図:がん組織に抗がん剤耐性のがん細胞集団が存在しているとき、抗がん剤感受性のがん細胞は抗がん剤耐性のがん細胞と競合することによって抗がん剤耐性がん細胞の増殖を抑える働きをしている。高用量の抗がん剤投与によって抗がん剤感受性がん細胞が消滅すると、競合状態から解放され、抗がん剤耐性のがん細胞の増殖をむしろ促進する結果となる。
872)抗がん剤治療はなぜ失敗するのか(その5): 競合解放によって増殖が . . . 本文を読む
図:がん組織に抗がん剤耐性のがん細胞集団が存在しているとき、抗がん剤感受性のがん細胞は抗がん剤耐性のがん細胞と競合することによって抗がん剤耐性がん細胞の増殖を抑える働きをしている。高用量の抗がん剤投与によって抗がん剤感受性がん細胞が消滅すると、競合状態から解放され、抗がん剤耐性のがん細胞の増殖をむしろ促進する結果となる。
872)抗がん剤治療はなぜ失敗するのか(その5): 競合解放によって増殖が . . . 本文を読む
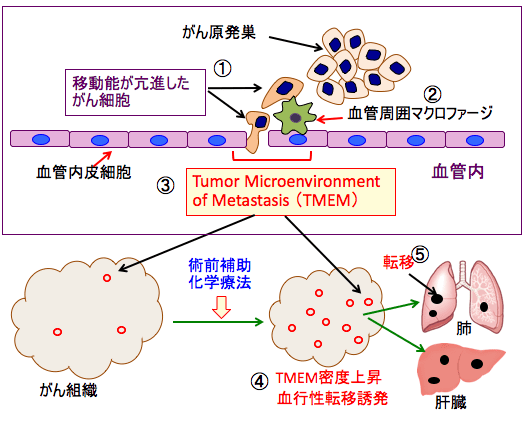 図:(上)がん原発巣から運動能(移動能)が亢進したがん細胞が血管に侵入するために血管内皮細胞と接触する(①)。がん細胞が血管内に侵入する際には、血管新生を促進するアンジオポエチンの受容体のTie2と血管内皮細胞増殖因子A(VEGFA)を高発現する血管周囲マクロファージ(腫瘍関連マクロファージの1種)が手助けする(②)。このがん細胞とマクロファージと血管内皮細胞の3者が密に接した部分はがん細胞が血管 . . . 本文を読む
図:(上)がん原発巣から運動能(移動能)が亢進したがん細胞が血管に侵入するために血管内皮細胞と接触する(①)。がん細胞が血管内に侵入する際には、血管新生を促進するアンジオポエチンの受容体のTie2と血管内皮細胞増殖因子A(VEGFA)を高発現する血管周囲マクロファージ(腫瘍関連マクロファージの1種)が手助けする(②)。このがん細胞とマクロファージと血管内皮細胞の3者が密に接した部分はがん細胞が血管 . . . 本文を読む
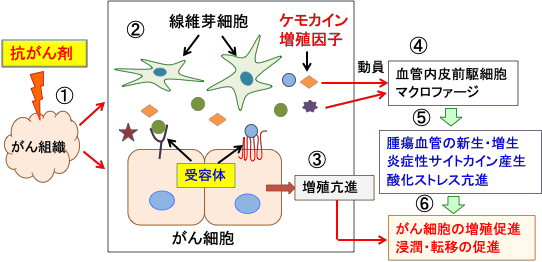 図:抗がん剤治療によってがん組織はダメージを受ける(①)。ダメージを受けた組織を修復するために、がん組織中の線維芽細胞からケモカインや増殖因子が産生される(②)。がん細胞はケモカインや増殖因子に対する受容体が刺激され、増殖が亢進する(③)。ケモカインや増殖因子は骨髄の血管内皮前駆細胞や炎症細胞(マクロファージなど)をがん組織に動員する(④)。その結果、抗がん剤でダメージを受けたがん組織は血管の新生 . . . 本文を読む
図:抗がん剤治療によってがん組織はダメージを受ける(①)。ダメージを受けた組織を修復するために、がん組織中の線維芽細胞からケモカインや増殖因子が産生される(②)。がん細胞はケモカインや増殖因子に対する受容体が刺激され、増殖が亢進する(③)。ケモカインや増殖因子は骨髄の血管内皮前駆細胞や炎症細胞(マクロファージなど)をがん組織に動員する(④)。その結果、抗がん剤でダメージを受けたがん組織は血管の新生 . . . 本文を読む
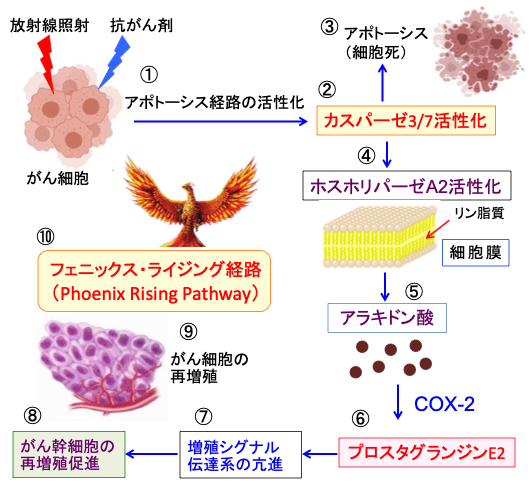 図:がん細胞が放射線照射や抗がん剤で強いダメージを受けるとアポトーシス経路が活性化され(①)、最終的にアポトーシスを実行するカスパーゼ3と7が活性化されて(②)、細胞死(アポトーシス)が誘導される(③)。活性化したカスパーゼ3と7は細胞のホスホリパーゼA2を切断して活性化し(④)、細胞膜のリン脂質からアラキドン酸を産生し(⑤)、がん細胞に過剰に発現しているシクロオキシゲナーゼ-2(COX-2)によ . . . 本文を読む
図:がん細胞が放射線照射や抗がん剤で強いダメージを受けるとアポトーシス経路が活性化され(①)、最終的にアポトーシスを実行するカスパーゼ3と7が活性化されて(②)、細胞死(アポトーシス)が誘導される(③)。活性化したカスパーゼ3と7は細胞のホスホリパーゼA2を切断して活性化し(④)、細胞膜のリン脂質からアラキドン酸を産生し(⑤)、がん細胞に過剰に発現しているシクロオキシゲナーゼ-2(COX-2)によ . . . 本文を読む
 図:抗がん剤や放射線照射によってがん細胞が遺伝子毒性の強いストレスを受けると(①)、多くのがん細胞は死滅してがん組織は縮小する(②)。しかし、一部のがん細胞は多倍体あるいは多核の巨大がん細胞になる(③)。この巨大がん細胞は増殖能を喪失しているが代謝的に活性であり、SASP (senescence-associated secretory phenotype : 老化関連分泌表現型)と呼ばれる様々な . . . 本文を読む
図:抗がん剤や放射線照射によってがん細胞が遺伝子毒性の強いストレスを受けると(①)、多くのがん細胞は死滅してがん組織は縮小する(②)。しかし、一部のがん細胞は多倍体あるいは多核の巨大がん細胞になる(③)。この巨大がん細胞は増殖能を喪失しているが代謝的に活性であり、SASP (senescence-associated secretory phenotype : 老化関連分泌表現型)と呼ばれる様々な . . . 本文を読む
 図:がん細胞では低酸素やPI3K/Akt/mTORC1シグナル伝達系の活性化によって低酸素誘導因子-1(HIF-1)の活性が恒常的に亢進している(①)。HIF-1はピルビン酸脱水素酵素キナーゼの発現を誘導し(②)、ピルビン酸脱水素酵素キナーゼはピルビン酸脱水素酵素をリン酸化してその活性を阻害する(③)。その結果、ピルビン酸からアセチルCoAへの変換が阻止されてミトコンドリアでの糖代謝(酸化的リン酸 . . . 本文を読む
図:がん細胞では低酸素やPI3K/Akt/mTORC1シグナル伝達系の活性化によって低酸素誘導因子-1(HIF-1)の活性が恒常的に亢進している(①)。HIF-1はピルビン酸脱水素酵素キナーゼの発現を誘導し(②)、ピルビン酸脱水素酵素キナーゼはピルビン酸脱水素酵素をリン酸化してその活性を阻害する(③)。その結果、ピルビン酸からアセチルCoAへの変換が阻止されてミトコンドリアでの糖代謝(酸化的リン酸 . . . 本文を読む
 図:がん細胞ではグルコース・トランスポーター1(GLUT1)からグルコースの取り込みが増えている(①)。解糖系では1分子のグルコースから2分子のピルビン酸、2分子のATP、2分子のNADH + H+が作られる(②)。乳酸脱水素酵素Aは、NADH + H+を還元剤として用いてピルビン酸を還元して乳酸にする(③)。この乳酸発酵によってNAD+を再生することによって解糖系での代謝(無酸素でのATP産生) . . . 本文を読む
図:がん細胞ではグルコース・トランスポーター1(GLUT1)からグルコースの取り込みが増えている(①)。解糖系では1分子のグルコースから2分子のピルビン酸、2分子のATP、2分子のNADH + H+が作られる(②)。乳酸脱水素酵素Aは、NADH + H+を還元剤として用いてピルビン酸を還元して乳酸にする(③)。この乳酸発酵によってNAD+を再生することによって解糖系での代謝(無酸素でのATP産生) . . . 本文を読む
 図:ケトン食は低糖質+高脂肪(特にMCTオイル、ω3多価不飽和脂肪酸を増やす)の食事となる(①)。グルコース(ブドウ糖)とインスリンとインスリン様成長因子-1(IGF-1)はがん細胞の増殖を促進する。したがって、低糖質食は血糖とインスリンとIGF-1によるシグナル伝達系を抑制して(②)、がん細胞の増殖や浸潤や転移や抗がん剤抵抗性を阻止する(③)。MCTオイル(中鎖脂肪酸中性脂肪)はケト . . . 本文を読む
図:ケトン食は低糖質+高脂肪(特にMCTオイル、ω3多価不飽和脂肪酸を増やす)の食事となる(①)。グルコース(ブドウ糖)とインスリンとインスリン様成長因子-1(IGF-1)はがん細胞の増殖を促進する。したがって、低糖質食は血糖とインスリンとIGF-1によるシグナル伝達系を抑制して(②)、がん細胞の増殖や浸潤や転移や抗がん剤抵抗性を阻止する(③)。MCTオイル(中鎖脂肪酸中性脂肪)はケト . . . 本文を読む