抗ウイルス薬
現在、COVID-19に対する抗ウイルス薬の候補に挙がっている既存薬は、▽レムデシビル(米ギリアド・サイエンシズ)▽デキサメタゾン(先発品は日医工の「デカドロン」)▽ファビピラビル(富士フイルム富山化学の「アビガン」)▽シクレソニド(帝人ファーマの「オルベスコ」)▽ナファモスタット(先発品は日医工の「フサン」)▽カモスタット(先発品は小野薬品工業の「フオイパン」)――など。
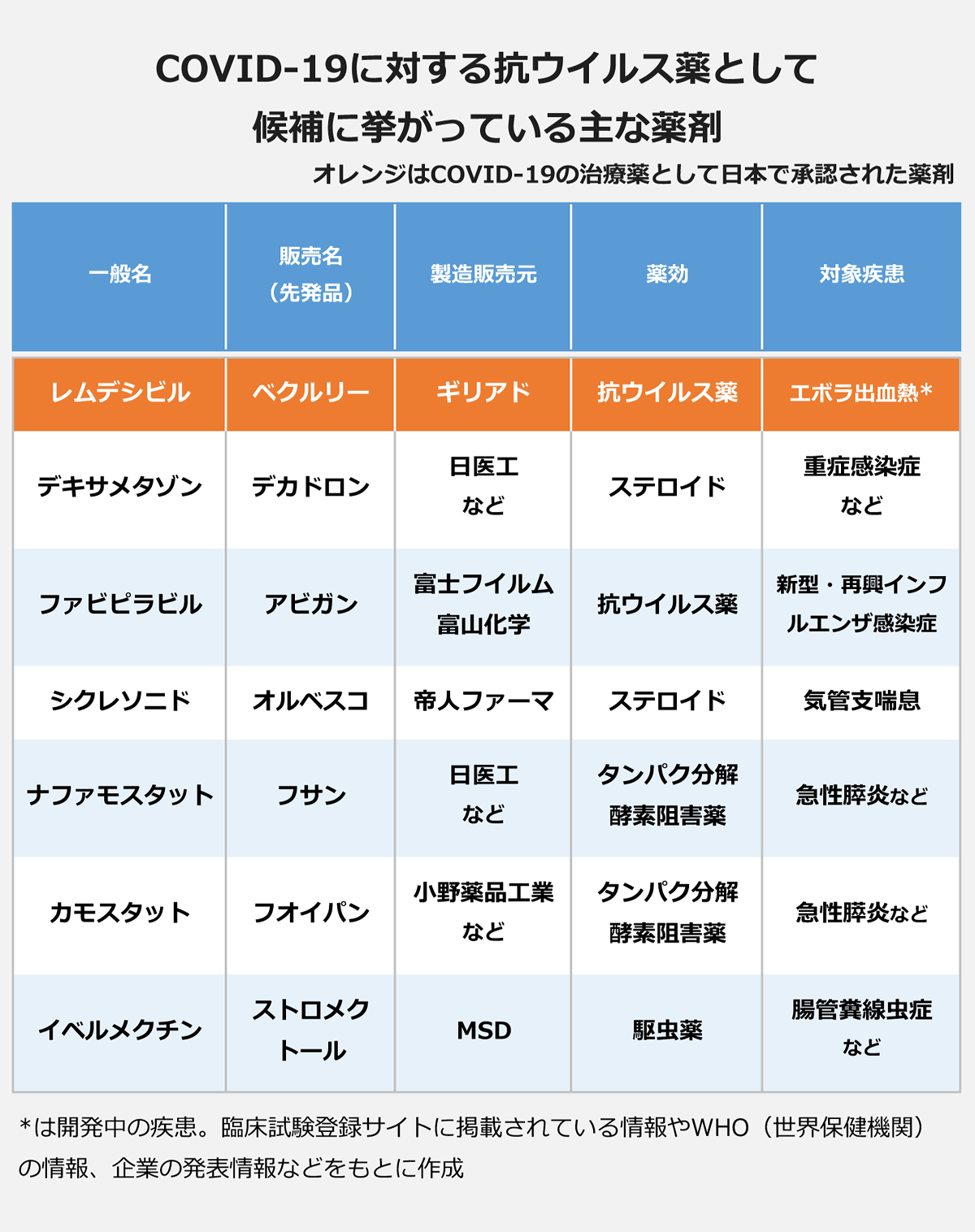
このうちレムデシビルは、5月7日に日本で新型コロナウイルス感染症治療薬として承認(製品名・ベクルリー)。デキサメタゾンはCOVID-19治療薬としての承認は取得していませんが、厚生労働省の「診療の手引き」に標準的な治療法として掲載されています。
レムデシビル(米ギリアド)
レムデシビルはもともとエボラ出血熱の治療薬として開発されていた抗ウイルス薬。コロナウイルスを含む一本鎖RNAウイルスに抗ウイルス活性を示します。
米FDA(食品医薬品局)は5月1日、レムデシビルについて、COVID-19の重症入院患者を対象に緊急時使用許可を与えました。許可の根拠となったのは、米国立アレルギー・感染症研究所(NIAID)主導で中等症から重症の患者を対象に行われた臨床第3相(P3)試験と、ギリアドが行っている重症患者対象のP3試験。NIAID主導の試験では、回復までの期間をプラセボに比べて31%早めることが示され(レムデシビル群11日、プラセボ群15日)、死亡率も有意差はつかなかったものの改善傾向が示されました(レムデシビル群8.0%、プラセボ群11.6%)。
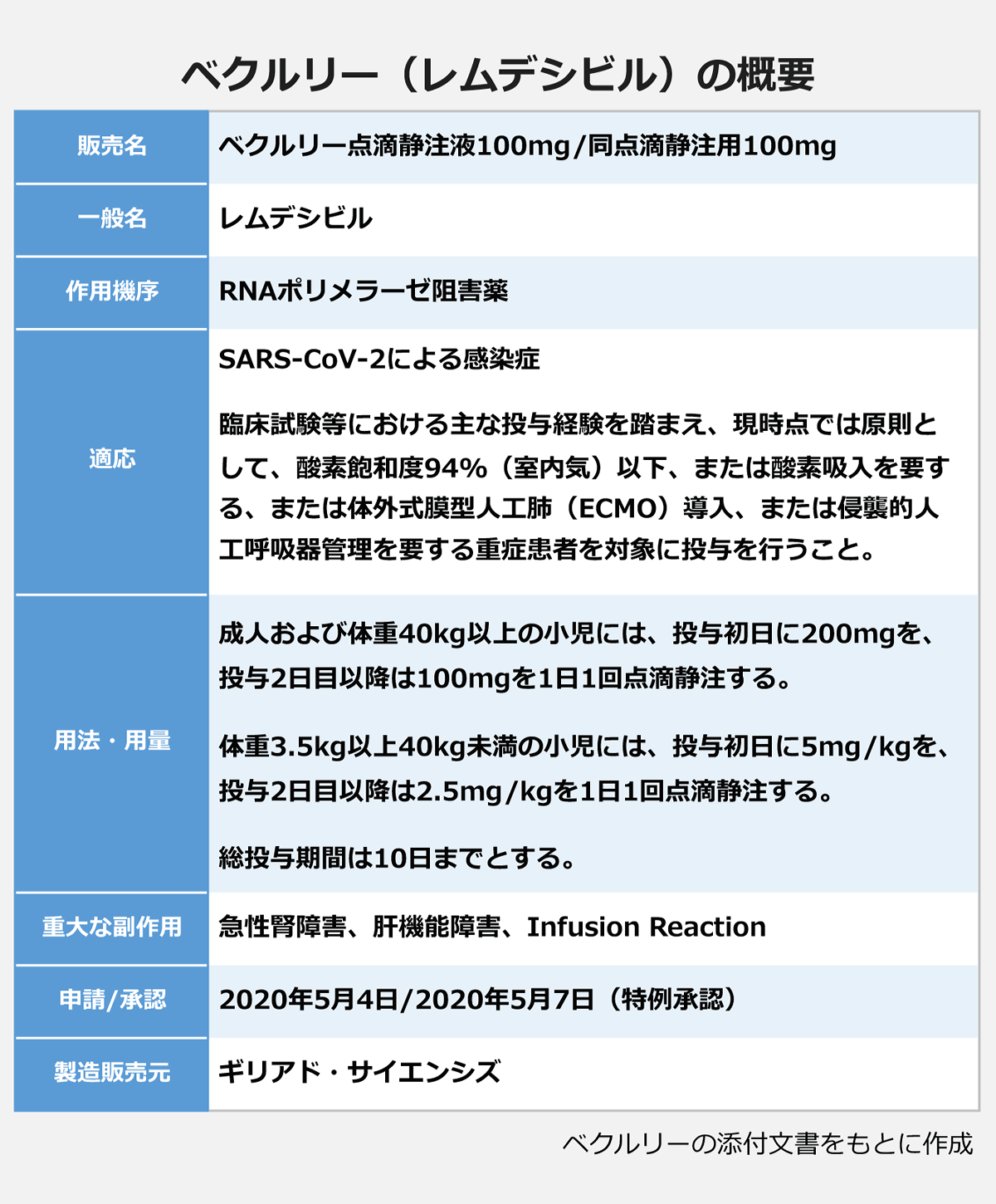
日本では、FDAによる使用許可を受けて特例承認を適用する方針が示され、ギリアドが5月4日に承認申請。同7日に開かれた厚生労働省の薬事・食品衛生審議会医薬品第二部会が特例承認を了承し、厚労省は即日承認しました。
ギリアドは2本のP3試験を行っており、4月末に公表された重症患者対象の試験の主要結果(対象患者約6000人のうち397人分の解析結果)では、5日間の投与で10日間投与と同等の効果が得られる可能性が示されました。中等症患者1600人を対象としたもう1本の試験は、6月1日に初期の結果(584人分の解析結果)が発表。レムデシビルを5日間投与した患者は、標準治療のみの患者に比べて投与11日目に臨床症状の改善が見られた患者の割合が有意に高かった一方、10日間投与した患者と標準治療のみの患者では有意差はありませんでした。
現在使われているレムデシビルは点滴薬ですが、ギリアドは吸入薬の開発にも着手しています。P1試験に入っており、安全性が確認されれば8月にCOVID-19患者を対象とした試験を開始する予定。成功すれば、軽症患者にも外来や自宅で投与しやすくなり、同社のダニエル・オデイCEOは「パンデミックを食い止めるのに重要な意味を持つ」とコメントしています。
デキサメタゾン(日医工など)
デキサメタゾンは重症感染症や間質性肺炎などの治療薬として承認されているステロイド薬。先発医薬品「デカドロン」(日医工)のほか、複数の後発医薬品が販売されています。英国で行われた大規模臨床研究で重症患者の死亡を減少させたと報告され、厚生労働省の「診療の手引き」にレムデシビルとともに標準的な治療法として掲載されています。
英国の臨床研究では、人工呼吸器を装着した患者と酸素投与が必要な患者で死亡率を有意に低下させた一方、酸素投与の必要ない患者では効果が見られませんでした。米NIHのガイドラインでも、人工呼吸器や酸素投与を必要とする患者に対する治療薬として推奨されています。
ファビピラビル(富士フイルム富山化学)
ファビピラビルは2014年に日本で承認された抗インフルエンザウイルス薬。新型インフルエンザが発生した場合にしか使用できないため、市場には流通していませんが、新型インフルエンザに備えて国が備蓄しています。
ファビピラビルは、インフルエンザウイルスの遺伝子複製酵素であるRNAポリメラーゼを阻害することでウイルスの増殖を抑制する薬剤。COVID-19を引き起こす新型コロナウイルスもインフルエンザウイルスと同じRNAウイルスであることから、効果を示す可能性があると期待されています。ただし、動物実験で催奇形性が確認されているため、妊婦や妊娠している可能性がある人には使うことができず、妊娠する可能性がある場合は男女ともに避妊を確実に行う必要があります。
藤田医科大は7月10日、新型コロナウイルス感染症の無症状・軽症患者を対象に全国47医療機関で行った多施設非盲検ランダム化試験の結果を発表。患者89人を、1~10日目にアビガンを投与する群(通常投与群)と6~15日目に投与する群(遅延投与群)に割り付け、評価を行った結果、通常投与群は遅延投与群に比べて、ウイルスの消失や解熱に至りやすい傾向が見られたものの、統計学的な有意差は示されませんでした。これとは別に、富士フイルム富山化学が3月から国内で臨床試験を行っており、米国でも4月からP2試験を実施中です。
シクレソニド(帝人ファーマ)
シクレソニドは、日本では2007年に気管支喘息治療薬として承認された吸入ステロイド薬。国立感染症研究所による実験で強いウイルス活性を持つことが示され、実際に患者に投与したところ肺炎が改善した症例も報告されています。
国内では、無症候または軽症のCOVID-19患者を対象に、対症療法と肺炎の発症または増悪の割合を比較する多施設共同の臨床試験が国立国際医療研究センターを中心に行われています。
その他
タンパク分解酵素阻害薬ナファモスタットや同カモスタットは、COVID-19の原因ウイルスであるSARS-CoV-2の細胞内への侵入を阻止する可能性があるとされ、日本では東京大付属病院などでファビピラビルとナファモスタットの併用療法を検討する臨床研究が進行中です。
ナファモスタットをめぐっては、先発医薬品「フサン」の製造販売元である日医工に、第一三共、東京大、理化学研究所を加えた4者が、共同で吸入製剤の開発に着手。7月から非臨床試験を始め、来年3月までの臨床試験開始を目指しています。カモスタットの先発医薬品「フオイパン」を製造販売する小野薬品も、6月5日からCOVID-19を対象とした臨床試験を開始しました。
腸管糞線虫症と疥癬の治療薬として承認されている駆虫薬イベルメクチン(MSDの「ストロメクトール」)もウイルスの増殖を阻害する可能性があるとされており、日本では北里大病院が医師主導治験の実施を検討しています。
一方、一時、治療薬の候補として期待された抗HIV薬ロピナビル/リトナビル(米アッヴィの「カレトラ」)は、中国の研究グループが3月に有効性が認められなかったとする臨床試験結果を米医学誌ニューイングランド・ジャーナル・オブ・メディシンで報告。同じく治療薬候補として注目された抗マラリア薬のクロロキンとヒドロキシクロロキンも、治療効果が乏しいとして米FDAが緊急使用許可を取り消し、WHO(世界保健機関)も臨床試験を中止すると発表しました。
重症患者に対する治療薬
COVID-19が重症化すると、サイトカインストームと呼ばれる過剰な免疫反応に重篤な臓器障害を起こしたり、急性呼吸窮迫症候群(ARDS)という重度の呼吸不全を起こしたりすることが知られています。
こうした重症患者に対する治療薬としては、サイトカインの一種であるIL-6(インターロイキン-6)の働きを抑える抗体医薬や、サイトカインによる刺激を伝えるJAK(ヤヌスキナーゼ)を阻害する薬剤が候補に挙げられています。

抗IL-6受容体抗体
スイス・ロシュは4月から、中外製薬が創製した抗IL-6受容体抗体トシリズマブ(製品名「アクテムラ」)のP3試験を米国、カナダ、欧州などで実施していましたが、7月29日、有効性を示すことができなかったと発表しました。ロシュは進行中のレムデシビルとの併用療法のP3試験を含め、抗ウイルス薬との併用の可能性を探る方針。日本では中外が重症患者を対象にP3試験を行っています。
米リジェネロン・ファーマシューティカルズと仏サノフィも、共同開発した抗IL-6受容体抗体サリルマブ(同「ケブザラ」)の臨床試験を行っていますが、ジェネロン主導で行われた米国P3試験は、有効性を示せず中止となりました。サノフィ主導で行われている米国外での試験は続いており、今年9月までに結果が明らかになる見込みです。
JAK阻害薬
JAK阻害薬では、関節リウマチ治療薬バリシチニブ(米イーライリリーの「オルミエント」)が米NIAID主導のアダプティブデザイン試験の一部としてレムデシビルとの併用療法に関する国際共同臨床試験を開始。同試験には日本も参加しています。6月15日からは、リリー主導で単剤療法のP3試験も行われています。
JAK阻害薬ではこのほか、トファシチニブ(米ファイザーの「ゼルヤンツ」)も欧州で医師主導臨床試験が行われているほか、スイス・ノバルティスも骨髄線維症などの適応で承認されているルキソリチニブ(製品名「ジャカビ」)のP3試験を準備していることを明らかにしています。
日本新薬は、骨髄線維症を対象に開発中のJAK阻害薬NS-018をCOVID-19による重症肺炎やARDSの治療薬に転用することを検討。同社は、肺動脈性肺高血圧症治療薬セレキシパグ(製品名「ウプトラビ」)をCOVI-D19で生じる血栓症の治療薬として開発することも検討しています。
その他
エーザイは、かつて重症敗血症を対象に開発していたものの、P3試験で主要評価項目を達成できずに開発を中止したTLR4拮抗薬エリトランの臨床試験を開始。試験は、Global Coalition for Adaptive Researchによる国際共同治験「REMAP-COVID」として行われ、米国で開始したあと、日本を含むグローバルへと拡大する予定です。エリトランは、サイトカイン産生の最上流に位置するTLR4(Toll様受容体4)の活性化を阻害する薬剤で、サイトカインストームの抑制を狙います。
イーライリリーは、がんなどを対象に開発中の抗アンジオポエチン2(Ang2)抗体LY3127804について、ARDSを発症するリスクの高いCOVID-19入院患者を対象とするP2試験を開始。Ang2はARDSを呈する患者で増加することがわかっており、試験ではAng2を阻害することでARDSの発症や人工呼吸器の使用を減らせるかどうかを検証しています。
英アストラゼネカは海外で白血病治療薬として承認されているBTK(ブルトン型キナーゼ)阻害薬アカラブルチニブの臨床試験を実施中。このほかにも、糖尿病治療薬のSGLT-2阻害薬ダパグリフロジン(製品名「フォシーガ」)について、米セントルーク・ミッドアメリカ・ハートインスティチュートと臓器不全などの重度の合併症を発症する危険性のある患者を対象としたP3試験を行っています。
武田薬品工業と米アッヴィ、米アムジェンは8月3日から、武田の遺伝性血管性浮腫治療薬イカチバント(製品名「フィラジル」)とアムジェンの乾癬治療薬アプレミラスト(同「オテズラ)、アッヴィが非アルコール性脂肪肝炎などを対象に開発中のcenicrivirocの3つの薬剤について、重症入院患者を対象とした臨床試験を始めました。
新規抗ウイルス薬の開発
既存薬を転用するアプローチで治療薬の開発が進む一方で、新規の薬剤を開発しようとする動きも広がっています。

武田薬品工業は、米CSLベーリングなど血漿分画製剤を手掛ける海外の製薬企業9社と提携し、原因ウイルスSARS-CoV-2に対する高度免疫グロブリン製剤の開発を進めています。10社は、原料となる血漿の採取から臨床試験の企画・実施、製造まで幅広く協力し、ノーブランドの抗SARS-CoV-2高度免疫グロブリン製剤を共同で開発・供給する計画。今夏にも、NIAIDと協力して成人患者を対象としたグローバル試験を始める予定です。
イーライリリーは6月1日から、カナダのアブセレラと共同開発しているSARS-CoV-2に対する抗体医薬「LY-CoV555」のP3試験を米国で開始しました。LY-CoV555はCOVID-19の回復者の血液から同定された中和抗体で、P3試験はCOVID-19が広がりやすく、重症化しやすい高齢者がいる介護施設で実施。リリーは中国・上海のジュンシー・バイオサイエンシズとも抗体医薬の開発で提携しており、6月からP1試験を行っています(開発コードは「JS016」)。
リジェネロンも6月から、2つの中和抗体を混合したカクテル抗体「REGI-COV2」の臨床試験を開始。米ビル・バイオテクノロジーは2つの抗ウイルス抗体(VIR-7831とVIR-7832)の開発で英グラクソ・スミスクライン(GSK)と提携し、今夏にP2試験を始める予定です。米アッヴィは、米ハーバーバイオメドやオランダ・ユトレヒト大などと抗体医薬の開発で提携しています。
ビルは米アルナイラム・ファーマシューティカルズと共同でSARS-CoV-2を標的とするsiRNA核酸医薬も開発しており、開発候補として吸入型のsiRNA「VIR-2703(ALN-COV)」を特定。今年の末をメドに臨床試験を始める見込みです。今年5月、国産初の核酸医薬となるデュシェンヌ型筋ジストロフィー治療薬「ビルテプソ」(ビルトラルセン)を発売した日本新薬も、新型コロナウイルスに対する核酸医薬の開発を検討。バイオベンチャーのボナックもCOVID-19向け核酸医薬の研究を進めています。
米メルクは米リッジバック・バイオセラピューティクスと提携し、抗ウイルス薬「MK-4482」のP2試験を実施中。ファイザーはSARS-CoV-2に対する抗ウイルス活性を示すプロテアーゼ阻害薬候補を特定しており、今夏にも臨床試験を始める予定です。塩野義製薬も北海道大との共同研究でCOVID-19に対する抗ウイルス薬の候補を特定。今年度中の臨床試験開始を目指して研究を進めています。
オンコリスバイオファーマは鹿児島大と契約を結び、同大が見出した抗ウイルス薬の開発に着手。カネカは国立感染症研究所と共同で治療用抗体を開発しており、製薬会社と組んで21年度中に臨床試験を始めたいとしています。
ワクチン
WHOの8月13日時点のまとめによると、現在、臨床試験に入っているCOVID-19ワクチン候補は29種類。このほかに138種類が前臨床の段階にあります。ロシア保健省は8月11日、国立ガマレヤ研究所(モスクワ)が開発したCOVID-19に対するウイルスベクターワクチン「スプートニクV」を承認したと発表。COVID-19ワクチンの承認は世界初ですが、同ワクチンはまだ臨床試験を実施している段階で、安全性や有効性には疑問の声も上がっています。

アストラゼネカやモデルナなど先行
開発が先行しているのは、英オックスフォード大と英アストラゼネカのアデノウイルスベクターワクチン「ChAdOx1-S/AZD1222」など。ChAdOx1-S/AZD1222は英国でP3試験が行われており、米国での開発では米IQVIAと提携。バーチャルトライアルを活用し、開発を急ぎます。
米モデルナのmRNAワクチン「mRNA-1237」も7月27日にP3試験を開始。独ビオンテックと米ファイザーのmRNAワクチン「BNT162b2」も、同日からP2/3試験を始めました。中国のシノバックやシノファームの不活化ワクチンもP3試験に入っており、米イノビオも今夏にDNAワクチン「INO-4800」のP2/3試験を始める予定です。
ワクチン開発には欧米の大手製薬企業も参入しています。米ジョンソン・エンド・ジョンソンは、ウイルスベクターワクチン「Ad26.COV2.S」のP1/2a試験を7月30日に米国とベルギーで開始。日本や欧州のほかの国でも試験を計画しており、9月のP3試験開始を目指しています。米メルクはオーストリア・テミスの買収で獲得した麻疹ウイルスベクターワクチンの臨床試験を今年7~9月期に始める予定です。IAVI(国際エイズワクチン推進構想)とも別のワクチンを開発しており、年内の臨床試験開始を目指しています。
サノフィとグラクソ・スミスクラインは、共同開発中の組換えタンパクワクチンについて9月P1試験を開始する予定です。サノフィは米トランスレート・バイオともmRNAワクチンの開発で提携しており、GSKも抗ウイルス抗の開発で提携するビル・バイオテクノロジーとワクチン開発でも協力しています。

国内ではアンジェスが治験開始
国内では、大阪大とアンジェスが共同開発するDNAワクチン「AG0301-COVID19」が、6月30日からP1/2試験を行っています。対象は20~65歳の健康成人で、目標症例数は30例(低用量群15例、高用量群15例)。アジュバントを含む同ワクチンを2週間間隔で2回、筋肉内注射し、安全性と免疫原性を評価します。
塩野義製薬は、グループ会社のUMNファーマで組換えタンパクワクチンの開発を進めており、年内の臨床試験開始に向けて厚生労働省などと協議を進めています。KMバイオロジクスも不活化ワクチンの開発に着手しており、最短で11月に臨床試験を開始する意向。第一三共は、mRNAワクチンについて来年3月の臨床試験開始を目指しており、アイロムグープのIDファーマもセンダイウイルスベクターを使ったワクチンの臨床試験を来年3~5月に始める見込みです。
田辺三菱製薬はカナダ子会社メディカゴで植物由来ウイルス様粒子を使ったワクチンを開発中。グラクソ・スミスクラインと提携し、7月13日にカナダでP1試験を始めました。
(前田雄樹)
(公開:2020年2月28日/最終更新:2020年8月21日)

























