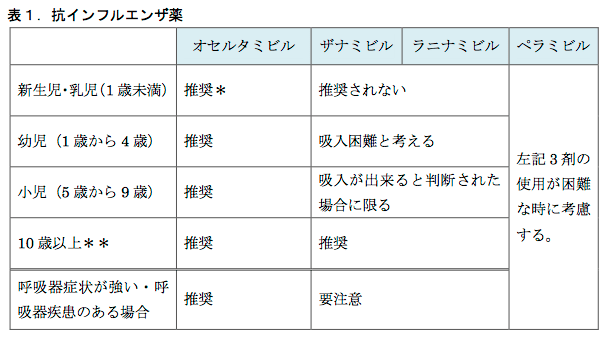
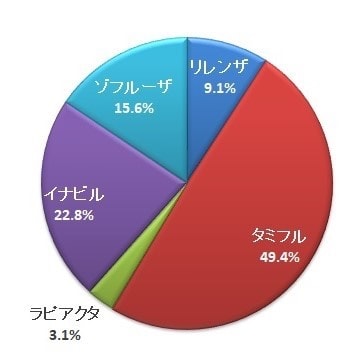
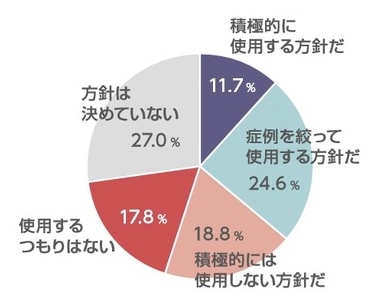
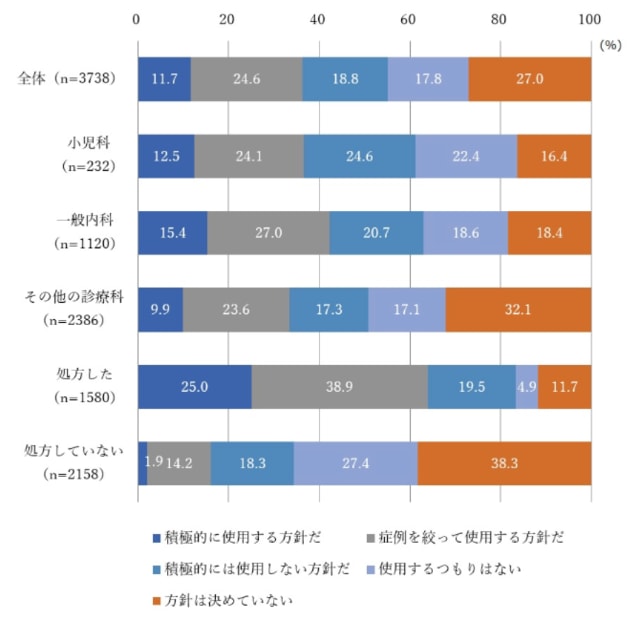
ゾフルーザ®の耐性化率が高いことが問題視されている今日この頃ですが、抗インフルエンザ薬とインフルエンザウイルスのイタチごっこはこれが初めてではありません。
古くはシンメトレル®、記憶に新しいタミフル®&ラピアクタ®、そして現在問題になっているゾフルーザ®。
その歴史を簡単に紐解いてみましょう。
シンメトレル®はもはや過去の薬なので、あまり調べていません。
ノイラミニダーゼ阻害薬であるタミフル®とゾフルーザ®の耐性化は、ともにインフルエンザウイルスの遺伝子変異によるもの(前者はH275Y変異、後者は)と説明されています。
耐性ウイルスの出現には2つのパターンがあるようです。
1.薬の使いすぎで顕在化(薬剤選択圧と呼びます)
抗インフルエンザ薬をたくさん使えば使うほど、変異株がそれをかいくぐって増えて目立つ現象。抗菌薬(=抗生物質)の薬剤耐性もこのパターン。耐性株は一般株比較して、感染力が劣る。
2.自然発生
自然界で発生したウイルスの遺伝子変異が、たまたま薬剤耐性であった場合。2008年のアフリカでのタミフル®耐性化はこのパターン(アフリカではほとんどタミフル®が使用されていなかった)。
発生の仕方で、感染力が異なるのですね。
1.シンメトリル®(一般名:アマンタジン)
この薬剤はA型インフルエンザにのみ有効で、B型には元々効きません。
アマンタジンの耐性株は、03~04年ごろから中国を中心に広がり、そこから2シーズン後には、ほぼ全世界に広がりました。現在はA(H1N1)、A(H3N2)ともに100%耐性です。そのため抗インフルエンザ薬として臨床的に使用されることはありません。
現在はパーキンソン病の治療薬として用いられています。
2.タミフル®(一般名:オセルタミビル)
タミフル®は2001年に発売された、画期的な薬剤でした。2007/8シーズンに薬剤耐性のA(H1N1)ソ連型ウイルスがヨーロッパで検出され、翌2008/9シーズンに全世界へ広がりました。耐性株は感受性株と比較して、症状が異なるとか、重症化する現象は認めませんでした。
薬剤耐性株は増殖力・感染力に劣るため、流行は拡大しないとされていますが、この変異株は全世界へ広がりました。その理由として、感染力低下をを代償する遺伝子変異(※)を獲得したためと説明されています。
※ ノイラミニダーゼ遺伝子 222番(アルギニンからグルタミン) 234番(バリンからメチオニン)
翌2009/10シーズンに新型インフルエンザA(H1N1)pdmのパンデミックが起こり、選手交代と言わんばかりにAソ連型は姿を消し去り、耐性ウイルスもなくなりました。
□ 2008/09インフルエンザシーズンにおけるインフルエンザ(A/H1N1)オセルタミビル耐性株(H275Y)の国内発生状況 [第2報]
(Vol. 30 p. 101-106: 2009年4月号)
・・・2007/8シーズンの後半から、ノイラミニダーゼ(NA)蛋白の275番目のアミノ酸がヒスチジンからチロシン(H275Y)に置換し、オセルタミビルに対して耐性となるA/H1N1亜型ウイルスが、世界各地で高頻度に検出されるようになり、医療機関における抗インフルエンザ薬の選択に大きな影響が出ている。これまでの世界各国における耐性株の発生頻度は、2007年後半~2008年3月期は16%、2008年4月~9月期は44%、2008年10月~12月期は92%と、耐性株が急速に世界中に広がっている 1)。現時点では、オセルタミビル耐性のA/H1N1ウイルスは、米国で97%、EU諸国で98%、豪州、中米、アフリカ諸国で80~100%となっている。日本周辺では、韓国で99%、台湾で100%である。
・・・昨シーズン(2007/08)に国内で分離されたオセルタミビル耐性A/H1N1株の発生頻度は、わずか2.6%(1,734株中45株)だったのに対し、今シーズン(2008/09)は42都道府県から耐性株が分離され、発生頻度は99.6%(1,239株中1,234株)となった。すなわち、わずか半年あまりで国内においてもA/H1N1耐性株が劇的に増加していることが明らかとなった。今シーズンに分離されたA/H1N1国内耐性株も、昨シーズンと同様に今季向けワクチン株であるA/ブリスベン/59/2007に遺伝的にも抗原的にも類似しているため、今季ワクチンは有効であると考えられる。これに加えて、耐性株はもう一つの抗インフルエンザ薬であるザナミビルに対しては感受性であることから、ザナミビルによる治療も有効であると考えられる。一方、A/H3N2亜型およびB型インフルエンザウイルスでは、わずかながら感受性低下を示すA/H3N2亜型 1株を除いては、両薬剤に対して明確な耐性を示す株は確認されていない。
今回、世界中で検出されている耐性株の大半は、オセルタミビルを使用していない国で分離されていることから、今回の耐性株は、オセルタミビルの頻用によって耐性ウイルスが出現したり、耐性ウイルスが選択されて流行しているわけではない。また、病原性は通常のA/H1N1株と大きく変わらず、特に重篤な症状を引き起こすとの報告はない。
一方、過去に報告された耐性ウイルスは、野生株に比べて伝播力や感染力が低下した「欠陥ウイルス」であり、自然に淘汰されてきた。これに対して、今回の耐性ウイルスは、オセルタミビル耐性の性状とともに、別の遺伝子変異によって、野生株よりも強い伝播力を獲得しているものと考えられる。A/H1N1ウイルスが2シーズン連続して流行の主流となることは通常経験されておらず、これも今回の耐性ウイルスの伝播力の強さを反映したものかもしれない。
2013/14シーズンに札幌市でタミフル®/ラピアクタ®耐性のA(H1N1)pdm09ウイルスの地域的流行が推定されましたが、全国規模の流行にはなりませんでした。
タミフル®耐性ウイルスは、同時にラピアクタ®にも耐性を示し、一方でリレンザ®とイナビル®には耐性を示さないという特徴があります。また、A(H3N2)香港型には耐性化していません。
A/H1N1pdm09ウイルスにおける耐性化は、H275Y変異(NA遺伝子の275番目のヒスチジンがチロシンに変異)によるものです。WHOの耐性ウイルス判定基準では、ノイラミニダーゼ阻害薬はH275Y変異をもつN1ウイルスはオセルタミビル耐性とし、それ以外はIC50値を感受性基準と比較して判定します。
ノイラミニダーゼ阻害薬耐性化には以下の現象が観察され、その一部に私は不思議な印象を受けます。
・A(H1N1)ソ連型でもA(H1N1)pdm09でも耐性化した遺伝子はH275Y変異で同じ、しかし前者は全世界に拡大し、後者は一部の小流行で終わった(不思議)。
・ノイラミニダーゼ阻害薬はB型インフルエンザウイルスに耐性を示したことはない。
・タミフルとラピアクタは同時に耐性化する。
※ この理由は、ウイルスのノイラミニダーゼ構造の薬剤に結合する部位が類似 しているため、タミフル®に薬剤耐性を獲得すると、ラピアクタ®にも耐性化する、と説明されています。
・リレンザとイナビルに耐性化したインフルエンザウイルスは存在しない。
不思議ですね。
□ 札幌市でタミフル耐性A/H1N1pdm09ウイルスを検出〜リレンザとイナビルに対する感受性は低下していない
(2014/1/6:日経メディカル)
国立感染症研究所は1月6日、札幌市でタミフル耐性A/H1N1pdm09ウイルスが検出されたと発表した。2013/14シーズンに、札幌市の患者から分離されたA(H1N1)pdm09ウイルス5株について、札幌市衛生研究所が遺伝子解析による薬剤耐性マーカーの1次スクリーニングを行ったところ、5株すべてがH275Y変異を持っていることが明らかになった。
さらに国立感染症研究所で、抗インフルエンザ薬であるタミフル、ラピアクタ、リレンザ、イナビルに対する薬剤感受性試験を行った結果、H275Y変異が確認された5株は、いずれもタミフルとラピアクタに対して耐性を示すことが確認された。一方、リレンザおよびイナビルに対しては感受性を保持していた。
また、この5株とは別に、2013年11月中旬に札幌市内の病院で、健康成人の重症インフルエンザ症例が確認され、国立病院機構仙台医療センターで検体を検査したところ、さきの5株と同様にH275Y変異をもつことが明らかになった。
これらの6株は、4例が10歳以下の小児、2例が成人から検出されたものだった。いずれも散発例で、個々の患者の間で直接的な感染伝播はなかったと判断されたという。しかしながら、6株のウイルスのHA遺伝子およびNA遺伝子の塩基配列はほぼ同じであることから、「同一の耐性ウイルスが札幌市内で伝播されている可能性が高い」としている。
6例の患者は検体採取前に抗インフルエンザ薬の投与を受けていなかったことから、薬剤により患者の体内で耐性ウイルスが選択された可能性は否定される、としている。
今回札幌市で確認された耐性ウイルスは、タミフルとラピアクタに対する感受性は500倍以上低下していたことが分かっている。一方、リレンザとイナビルに対する感受性は低下していなかった。このことから感染研では、「地域における耐性ウイルスの検出状況を考慮し、臨床経過から薬剤耐性が疑われる場合には、交叉耐性を示さない薬剤を使用することを考慮すべきであろう」との見解を示している。
<参考文献>
・<速報>2013/14シーズンに札幌市で検出された抗インフルエンザ薬耐性A(H1N1)pdm09ウイルス
耐性株でも臨床経過に差がない、というのも不思議です。
この点に関しては、日本のノイラミニダーゼ阻害薬の血中濃度は、耐性株でも有効なレベルまで上昇すると説明されています(⇩)。

(2015.1.15:感染症TODAY:タミフル耐性ウイルスに対する臨床効果:富良野病院副院長 角谷富士男)
3.ゾフルーザ®(一般名:バロキサビル)
ゾフルーザ®では、自然界では存在しないPAI38T(PA蛋白質の38番目のアミノ酸)変異が、ゾフルーザ®使用後に発生することが判明しています。すると、ゾフルーザ®の効果が半減どころか、1/100まで落ちてしまうのです。
さらに問題なのは、耐性化率の高さです。
現時点では、タミフル耐性は数%と一ケタレベルですが、ゾフルーザ®耐性は約10%と高く、さらに小児に限ると20%を越えるデータもあります。
また、これまでの歴史では「薬剤耐性株は感染力が低下するので流行して問題になることはない」という現象が普通でした。しかし今回、このPAI38T変異株がゾフルーザ®未使用患者からも検出されており、専門家は問題視しています。この意味することは「変異株も増殖性・感染性を保っている」すなわち「耐性株が流行する可能性がある」ということ。
注視していく必要があります。
□ 新規抗インフルエンザ薬バロキサビル未投与患者からのバロキサビル耐性変異ウイルスの検出
(IASR Vol. 40 p67-69: 2019年4月号)より一部抜粋
・・・インフルエンザウイルスPA蛋白質の38番目のアミノ酸I38はA型およびB型ウイルス間で高度に保存されており、A(H3N2)ウイルスのPA I38T変異は遺伝子データベースに登録された17,227件のPAシークエンス中に1件も含まれていない。また、日本ならびに米国で実施されている流行株の耐性株サーベイランスにおいてもPA I38T変異は1例も検出されていない。一方、バロキサビルの臨床試験では、バロキサビル投与によりPA I38T変異が検出され、ウイルスのバロキサビル感受性低下に関与することが明らかになっている。したがって、PA I38T耐性変異はバロキサビル投与に起因する変異であると考えられている。実際に2018年12月には横浜市でバロキサビル投与後の小児から、PA I38T耐性変異を持ち、バロキサビルに対する感受性が約80~120倍低下したバロキサビル耐性変異A(H3N2)ウイルスが2株検出された。本稿では、2018年11月~2019年2月にかけて採取されたA(H3N2)ウイルスの解析により、バロキサビル未投与患者3名からバロキサビル耐性変異ウイルス3株を検出した。
・・・PA I38T耐性変異はバロキサビル投与に起因する変異であると考えられているため、上記3名のバロキサビル未投与患者から検出された3株のPA I38T耐性変異ウイルス(A/三重/41/2018、A/横浜/88/2018およびA/神奈川/IC18141/2019)は、バロキサビル投与患者から感染伝播した可能性が示唆される。次世代シークエンサーを用いた遺伝子解析により、今シーズンに日本国内で検出された11例のPA I38T耐性変異A(H3N2)ウイルス感染患者のうち、8例では患者の体内でPA I38T耐性変異ウイルスと変異を持たない感受性ウイルスが混在していたことが分かった。一方、ヒト上気道上皮細胞のウイルスレセプター発現パターンを模したヒト化MDCK細胞(hCK細胞)で分離したウイルスの遺伝子解析から、8例中3例ではウイルス分離後に感受性ウイルスが消失しPA I38T耐性変異ウイルスに完全に置き換わったことが確認された。したがってhCK細胞におけるPA I38T耐性変異ウイルスの増殖能は、感受性ウイルスと比べて十分保持されていることが明らかになった。これまでに、実験室株A/Victoria/3/75(H3N2)のPA蛋白質にI38T変異を導入した人工ウイルスを用いた実験から、培養細胞におけるPA I38T耐性変異ウイルスの増殖能は変異を持たない野生型ウイルスと比べて低下することが報告されているが、現在の流行株には適用されない可能性がある。
2018年10月~2019年1月の間に、日本国内の医療機関に供給されたバロキサビルは約550.9万人分と報告されており、昨シーズンの約40万人分から急増している。日本国内の耐性株サーベイランスにおいて、昨シーズンはバロキサビル耐性変異ウイルスの検出率は0%であったが、今シーズンは増加傾向にある。日本国内で報告されたバロキサビル耐性変異ウイルスは、生後8か月から14歳までの患者から検出されており、ほとんどが12歳未満の小児である。バロキサビルの第Ⅲ相臨床試験において、耐性変異ウイルスの検出率は12歳以上で9.7%、12歳未満では23.4%と高く、また耐性変異ウイルスが検出された患者ではウイルス力価の再上昇が認められ、感受性ウイルスが検出された患者と比べて罹病期間が延長することが報告されている。米国では2018年10月に12歳以上のインフルエンザ感染患者を対象としてバロキサビルが承認されたが、12歳未満の小児に関しては現在第Ⅲ相臨床試験が進行中で、未承認である。
2018/19シーズンの抗インフルエンザ薬の中でゾフルーザ®処方率が第一位となったそうです。
しかし、耐性化率の高さとコストを考慮し、あえて採用しなかった病院もあり、話題になりました。
□ ゾフルーザ採用見送り
(2018年11月11日:亀田総合病院HPより)
すでにバロキサビル(商品名:ゾフルーザ)が、抗インフルエンザ薬の市場第1位になったようです。1回投与という簡便さが受けたのでしょうか?
先に結論を述べますが、当科では今シーズンはゾフルーザを使用する予定はありません。
産経新聞:インフル薬「ゾフルーザ」シェア1位に 負担軽く人気
ウイルスの排泄がday 2-3がタミフルより少ない状態となることが利点とされていますが、本当にそれによって感染性が落ちることは示されていません(飛沫予防策の期間は変わりません)。また、インフルエンザウイルスA/H3N2で、治療中に約10%が耐性化する可能性が指摘されており、その場合、ウイルス排泄はタミフル群より多いため、むしろそのような株が大勢を占めた場合、感染伝播拡大の危険性もあります。また、コストは、4789円(40mg)で、タミフルの2720円(5日分)の1.76倍です。タミフルのジェネリックはさらに安く1360円(ゾフルーザはこれの3.52倍)となっており、もし1000万人を治療するとした場合、タミフルのジェネリックとゾフルーザを比較すると、前者のほうが342億9000万円もお安くなります。また、将来的に、タミフル耐性ウイルスがでた場合の治療薬となる可能性もあり、今から使用して、耐性ウイルスを増やしてしまってもよいのか、という問題もあります。
(利点)
・1回投与でよい
・耐性化しない場合は、ウイルス排泄量が早く減少
(欠点)
・耐性化のリスク
・コスト(税金と健康保険と自己負担)
・未知の副作用があるかも
今のところ論文として発表されたものは、12-64歳の結果であり、小児に対するdataは十分ではありません(保険は通っています。国内で第III相試験が、単一armで実施されたようであり、添付文書に記載あります。社内資料とのこと。詳細は不明です。18/77例で、耐性化の懸念あり、非常に高率です)。
以上から、適応を慎重に検討する必要があると思われます。当科では、今年度の採用は見送っています。依然として、今までの実績・文献的根拠から、タミフル(一般名:オセルタミビル)が第1選択であると考えています。
古くはシンメトレル®、記憶に新しいタミフル®&ラピアクタ®、そして現在問題になっているゾフルーザ®。
その歴史を簡単に紐解いてみましょう。
シンメトレル®はもはや過去の薬なので、あまり調べていません。
ノイラミニダーゼ阻害薬であるタミフル®とゾフルーザ®の耐性化は、ともにインフルエンザウイルスの遺伝子変異によるもの(前者はH275Y変異、後者は)と説明されています。
耐性ウイルスの出現には2つのパターンがあるようです。
1.薬の使いすぎで顕在化(薬剤選択圧と呼びます)
抗インフルエンザ薬をたくさん使えば使うほど、変異株がそれをかいくぐって増えて目立つ現象。抗菌薬(=抗生物質)の薬剤耐性もこのパターン。耐性株は一般株比較して、感染力が劣る。
2.自然発生
自然界で発生したウイルスの遺伝子変異が、たまたま薬剤耐性であった場合。2008年のアフリカでのタミフル®耐性化はこのパターン(アフリカではほとんどタミフル®が使用されていなかった)。
発生の仕方で、感染力が異なるのですね。
1.シンメトリル®(一般名:アマンタジン)
この薬剤はA型インフルエンザにのみ有効で、B型には元々効きません。
アマンタジンの耐性株は、03~04年ごろから中国を中心に広がり、そこから2シーズン後には、ほぼ全世界に広がりました。現在はA(H1N1)、A(H3N2)ともに100%耐性です。そのため抗インフルエンザ薬として臨床的に使用されることはありません。
現在はパーキンソン病の治療薬として用いられています。
2.タミフル®(一般名:オセルタミビル)
タミフル®は2001年に発売された、画期的な薬剤でした。2007/8シーズンに薬剤耐性のA(H1N1)ソ連型ウイルスがヨーロッパで検出され、翌2008/9シーズンに全世界へ広がりました。耐性株は感受性株と比較して、症状が異なるとか、重症化する現象は認めませんでした。
薬剤耐性株は増殖力・感染力に劣るため、流行は拡大しないとされていますが、この変異株は全世界へ広がりました。その理由として、感染力低下をを代償する遺伝子変異(※)を獲得したためと説明されています。
※ ノイラミニダーゼ遺伝子 222番(アルギニンからグルタミン) 234番(バリンからメチオニン)
翌2009/10シーズンに新型インフルエンザA(H1N1)pdmのパンデミックが起こり、選手交代と言わんばかりにAソ連型は姿を消し去り、耐性ウイルスもなくなりました。
□ 2008/09インフルエンザシーズンにおけるインフルエンザ(A/H1N1)オセルタミビル耐性株(H275Y)の国内発生状況 [第2報]
(Vol. 30 p. 101-106: 2009年4月号)
・・・2007/8シーズンの後半から、ノイラミニダーゼ(NA)蛋白の275番目のアミノ酸がヒスチジンからチロシン(H275Y)に置換し、オセルタミビルに対して耐性となるA/H1N1亜型ウイルスが、世界各地で高頻度に検出されるようになり、医療機関における抗インフルエンザ薬の選択に大きな影響が出ている。これまでの世界各国における耐性株の発生頻度は、2007年後半~2008年3月期は16%、2008年4月~9月期は44%、2008年10月~12月期は92%と、耐性株が急速に世界中に広がっている 1)。現時点では、オセルタミビル耐性のA/H1N1ウイルスは、米国で97%、EU諸国で98%、豪州、中米、アフリカ諸国で80~100%となっている。日本周辺では、韓国で99%、台湾で100%である。
・・・昨シーズン(2007/08)に国内で分離されたオセルタミビル耐性A/H1N1株の発生頻度は、わずか2.6%(1,734株中45株)だったのに対し、今シーズン(2008/09)は42都道府県から耐性株が分離され、発生頻度は99.6%(1,239株中1,234株)となった。すなわち、わずか半年あまりで国内においてもA/H1N1耐性株が劇的に増加していることが明らかとなった。今シーズンに分離されたA/H1N1国内耐性株も、昨シーズンと同様に今季向けワクチン株であるA/ブリスベン/59/2007に遺伝的にも抗原的にも類似しているため、今季ワクチンは有効であると考えられる。これに加えて、耐性株はもう一つの抗インフルエンザ薬であるザナミビルに対しては感受性であることから、ザナミビルによる治療も有効であると考えられる。一方、A/H3N2亜型およびB型インフルエンザウイルスでは、わずかながら感受性低下を示すA/H3N2亜型 1株を除いては、両薬剤に対して明確な耐性を示す株は確認されていない。
今回、世界中で検出されている耐性株の大半は、オセルタミビルを使用していない国で分離されていることから、今回の耐性株は、オセルタミビルの頻用によって耐性ウイルスが出現したり、耐性ウイルスが選択されて流行しているわけではない。また、病原性は通常のA/H1N1株と大きく変わらず、特に重篤な症状を引き起こすとの報告はない。
一方、過去に報告された耐性ウイルスは、野生株に比べて伝播力や感染力が低下した「欠陥ウイルス」であり、自然に淘汰されてきた。これに対して、今回の耐性ウイルスは、オセルタミビル耐性の性状とともに、別の遺伝子変異によって、野生株よりも強い伝播力を獲得しているものと考えられる。A/H1N1ウイルスが2シーズン連続して流行の主流となることは通常経験されておらず、これも今回の耐性ウイルスの伝播力の強さを反映したものかもしれない。
2013/14シーズンに札幌市でタミフル®/ラピアクタ®耐性のA(H1N1)pdm09ウイルスの地域的流行が推定されましたが、全国規模の流行にはなりませんでした。
タミフル®耐性ウイルスは、同時にラピアクタ®にも耐性を示し、一方でリレンザ®とイナビル®には耐性を示さないという特徴があります。また、A(H3N2)香港型には耐性化していません。
A/H1N1pdm09ウイルスにおける耐性化は、H275Y変異(NA遺伝子の275番目のヒスチジンがチロシンに変異)によるものです。WHOの耐性ウイルス判定基準では、ノイラミニダーゼ阻害薬はH275Y変異をもつN1ウイルスはオセルタミビル耐性とし、それ以外はIC50値を感受性基準と比較して判定します。
ノイラミニダーゼ阻害薬耐性化には以下の現象が観察され、その一部に私は不思議な印象を受けます。
・A(H1N1)ソ連型でもA(H1N1)pdm09でも耐性化した遺伝子はH275Y変異で同じ、しかし前者は全世界に拡大し、後者は一部の小流行で終わった(不思議)。
・ノイラミニダーゼ阻害薬はB型インフルエンザウイルスに耐性を示したことはない。
・タミフルとラピアクタは同時に耐性化する。
※ この理由は、ウイルスのノイラミニダーゼ構造の薬剤に結合する部位が類似 しているため、タミフル®に薬剤耐性を獲得すると、ラピアクタ®にも耐性化する、と説明されています。
・リレンザとイナビルに耐性化したインフルエンザウイルスは存在しない。
不思議ですね。
□ 札幌市でタミフル耐性A/H1N1pdm09ウイルスを検出〜リレンザとイナビルに対する感受性は低下していない
(2014/1/6:日経メディカル)
国立感染症研究所は1月6日、札幌市でタミフル耐性A/H1N1pdm09ウイルスが検出されたと発表した。2013/14シーズンに、札幌市の患者から分離されたA(H1N1)pdm09ウイルス5株について、札幌市衛生研究所が遺伝子解析による薬剤耐性マーカーの1次スクリーニングを行ったところ、5株すべてがH275Y変異を持っていることが明らかになった。
さらに国立感染症研究所で、抗インフルエンザ薬であるタミフル、ラピアクタ、リレンザ、イナビルに対する薬剤感受性試験を行った結果、H275Y変異が確認された5株は、いずれもタミフルとラピアクタに対して耐性を示すことが確認された。一方、リレンザおよびイナビルに対しては感受性を保持していた。
また、この5株とは別に、2013年11月中旬に札幌市内の病院で、健康成人の重症インフルエンザ症例が確認され、国立病院機構仙台医療センターで検体を検査したところ、さきの5株と同様にH275Y変異をもつことが明らかになった。
これらの6株は、4例が10歳以下の小児、2例が成人から検出されたものだった。いずれも散発例で、個々の患者の間で直接的な感染伝播はなかったと判断されたという。しかしながら、6株のウイルスのHA遺伝子およびNA遺伝子の塩基配列はほぼ同じであることから、「同一の耐性ウイルスが札幌市内で伝播されている可能性が高い」としている。
6例の患者は検体採取前に抗インフルエンザ薬の投与を受けていなかったことから、薬剤により患者の体内で耐性ウイルスが選択された可能性は否定される、としている。
今回札幌市で確認された耐性ウイルスは、タミフルとラピアクタに対する感受性は500倍以上低下していたことが分かっている。一方、リレンザとイナビルに対する感受性は低下していなかった。このことから感染研では、「地域における耐性ウイルスの検出状況を考慮し、臨床経過から薬剤耐性が疑われる場合には、交叉耐性を示さない薬剤を使用することを考慮すべきであろう」との見解を示している。
<参考文献>
・<速報>2013/14シーズンに札幌市で検出された抗インフルエンザ薬耐性A(H1N1)pdm09ウイルス
耐性株でも臨床経過に差がない、というのも不思議です。
この点に関しては、日本のノイラミニダーゼ阻害薬の血中濃度は、耐性株でも有効なレベルまで上昇すると説明されています(⇩)。

(2015.1.15:感染症TODAY:タミフル耐性ウイルスに対する臨床効果:富良野病院副院長 角谷富士男)
3.ゾフルーザ®(一般名:バロキサビル)
ゾフルーザ®では、自然界では存在しないPAI38T(PA蛋白質の38番目のアミノ酸)変異が、ゾフルーザ®使用後に発生することが判明しています。すると、ゾフルーザ®の効果が半減どころか、1/100まで落ちてしまうのです。
さらに問題なのは、耐性化率の高さです。
現時点では、タミフル耐性は数%と一ケタレベルですが、ゾフルーザ®耐性は約10%と高く、さらに小児に限ると20%を越えるデータもあります。
また、これまでの歴史では「薬剤耐性株は感染力が低下するので流行して問題になることはない」という現象が普通でした。しかし今回、このPAI38T変異株がゾフルーザ®未使用患者からも検出されており、専門家は問題視しています。この意味することは「変異株も増殖性・感染性を保っている」すなわち「耐性株が流行する可能性がある」ということ。
注視していく必要があります。
□ 新規抗インフルエンザ薬バロキサビル未投与患者からのバロキサビル耐性変異ウイルスの検出
(IASR Vol. 40 p67-69: 2019年4月号)より一部抜粋
・・・インフルエンザウイルスPA蛋白質の38番目のアミノ酸I38はA型およびB型ウイルス間で高度に保存されており、A(H3N2)ウイルスのPA I38T変異は遺伝子データベースに登録された17,227件のPAシークエンス中に1件も含まれていない。また、日本ならびに米国で実施されている流行株の耐性株サーベイランスにおいてもPA I38T変異は1例も検出されていない。一方、バロキサビルの臨床試験では、バロキサビル投与によりPA I38T変異が検出され、ウイルスのバロキサビル感受性低下に関与することが明らかになっている。したがって、PA I38T耐性変異はバロキサビル投与に起因する変異であると考えられている。実際に2018年12月には横浜市でバロキサビル投与後の小児から、PA I38T耐性変異を持ち、バロキサビルに対する感受性が約80~120倍低下したバロキサビル耐性変異A(H3N2)ウイルスが2株検出された。本稿では、2018年11月~2019年2月にかけて採取されたA(H3N2)ウイルスの解析により、バロキサビル未投与患者3名からバロキサビル耐性変異ウイルス3株を検出した。
・・・PA I38T耐性変異はバロキサビル投与に起因する変異であると考えられているため、上記3名のバロキサビル未投与患者から検出された3株のPA I38T耐性変異ウイルス(A/三重/41/2018、A/横浜/88/2018およびA/神奈川/IC18141/2019)は、バロキサビル投与患者から感染伝播した可能性が示唆される。次世代シークエンサーを用いた遺伝子解析により、今シーズンに日本国内で検出された11例のPA I38T耐性変異A(H3N2)ウイルス感染患者のうち、8例では患者の体内でPA I38T耐性変異ウイルスと変異を持たない感受性ウイルスが混在していたことが分かった。一方、ヒト上気道上皮細胞のウイルスレセプター発現パターンを模したヒト化MDCK細胞(hCK細胞)で分離したウイルスの遺伝子解析から、8例中3例ではウイルス分離後に感受性ウイルスが消失しPA I38T耐性変異ウイルスに完全に置き換わったことが確認された。したがってhCK細胞におけるPA I38T耐性変異ウイルスの増殖能は、感受性ウイルスと比べて十分保持されていることが明らかになった。これまでに、実験室株A/Victoria/3/75(H3N2)のPA蛋白質にI38T変異を導入した人工ウイルスを用いた実験から、培養細胞におけるPA I38T耐性変異ウイルスの増殖能は変異を持たない野生型ウイルスと比べて低下することが報告されているが、現在の流行株には適用されない可能性がある。
2018年10月~2019年1月の間に、日本国内の医療機関に供給されたバロキサビルは約550.9万人分と報告されており、昨シーズンの約40万人分から急増している。日本国内の耐性株サーベイランスにおいて、昨シーズンはバロキサビル耐性変異ウイルスの検出率は0%であったが、今シーズンは増加傾向にある。日本国内で報告されたバロキサビル耐性変異ウイルスは、生後8か月から14歳までの患者から検出されており、ほとんどが12歳未満の小児である。バロキサビルの第Ⅲ相臨床試験において、耐性変異ウイルスの検出率は12歳以上で9.7%、12歳未満では23.4%と高く、また耐性変異ウイルスが検出された患者ではウイルス力価の再上昇が認められ、感受性ウイルスが検出された患者と比べて罹病期間が延長することが報告されている。米国では2018年10月に12歳以上のインフルエンザ感染患者を対象としてバロキサビルが承認されたが、12歳未満の小児に関しては現在第Ⅲ相臨床試験が進行中で、未承認である。
2018/19シーズンの抗インフルエンザ薬の中でゾフルーザ®処方率が第一位となったそうです。
しかし、耐性化率の高さとコストを考慮し、あえて採用しなかった病院もあり、話題になりました。
□ ゾフルーザ採用見送り
(2018年11月11日:亀田総合病院HPより)
すでにバロキサビル(商品名:ゾフルーザ)が、抗インフルエンザ薬の市場第1位になったようです。1回投与という簡便さが受けたのでしょうか?
先に結論を述べますが、当科では今シーズンはゾフルーザを使用する予定はありません。
産経新聞:インフル薬「ゾフルーザ」シェア1位に 負担軽く人気
ウイルスの排泄がday 2-3がタミフルより少ない状態となることが利点とされていますが、本当にそれによって感染性が落ちることは示されていません(飛沫予防策の期間は変わりません)。また、インフルエンザウイルスA/H3N2で、治療中に約10%が耐性化する可能性が指摘されており、その場合、ウイルス排泄はタミフル群より多いため、むしろそのような株が大勢を占めた場合、感染伝播拡大の危険性もあります。また、コストは、4789円(40mg)で、タミフルの2720円(5日分)の1.76倍です。タミフルのジェネリックはさらに安く1360円(ゾフルーザはこれの3.52倍)となっており、もし1000万人を治療するとした場合、タミフルのジェネリックとゾフルーザを比較すると、前者のほうが342億9000万円もお安くなります。また、将来的に、タミフル耐性ウイルスがでた場合の治療薬となる可能性もあり、今から使用して、耐性ウイルスを増やしてしまってもよいのか、という問題もあります。
(利点)
・1回投与でよい
・耐性化しない場合は、ウイルス排泄量が早く減少
(欠点)
・耐性化のリスク
・コスト(税金と健康保険と自己負担)
・未知の副作用があるかも
今のところ論文として発表されたものは、12-64歳の結果であり、小児に対するdataは十分ではありません(保険は通っています。国内で第III相試験が、単一armで実施されたようであり、添付文書に記載あります。社内資料とのこと。詳細は不明です。18/77例で、耐性化の懸念あり、非常に高率です)。
以上から、適応を慎重に検討する必要があると思われます。当科では、今年度の採用は見送っています。依然として、今までの実績・文献的根拠から、タミフル(一般名:オセルタミビル)が第1選択であると考えています。