ご紹介する論文は,本邦の多施設共同研究「JALPAC(Japanese Longitudinal Biomarker Study in PSP and CBD)」の一環として行われた研究で,進行性核上性麻痺(PSP)や大脳皮質基底核症候群(CBS)の診断基準を満たす症例におけるIgLON5抗体関連疾患の頻度を調査したものです.岐阜大学をはじめ,鳥取大学,東名古屋病院,新潟大学など多くの医療機関によるものです.とくに大学院生の大野陽哉先生が頑張りました.
IgLON5抗体関連疾患は稀な自己免疫性脳炎ですが,運動障害や睡眠障害,球麻痺など多岐にわたる症状を呈します.一部の患者では,PSPやCBSに類似した症候を呈することがあります.しかし,臨床的にPSPやCBSと診断された症例におけるIgLON5抗体の頻度は海外における小規模な研究のみで十分に調査されておらず,本研究はその実態を明らかにすることを目的としました.
2014年から2021年にJALPACに登録された350人の患者のうち,223人がPSPまたはCBSの診断基準を満たしました(平均年齢73歳,男性が55%).PSPは106人で,その中にはリチャードソン症候群(PSP-RS),PSP-P,PSP-PAGF,PSP-Cなどのサブタイプが含まれていました.一方,CBS患者は161人で,改訂ケンブリッジ基準やアームストロング基準に基づいて診断されてました(図上).
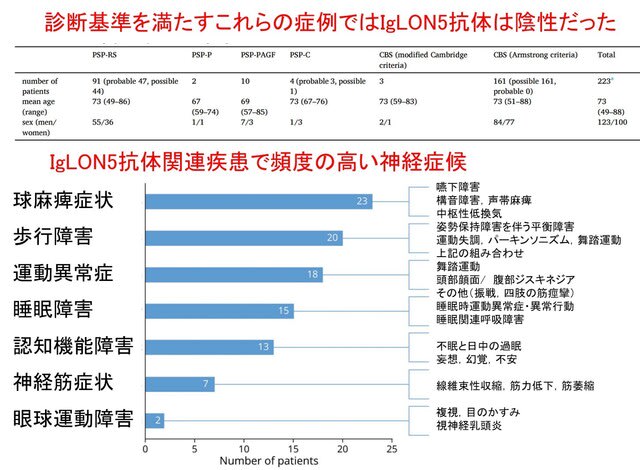
さて結果ですが,全患者の血清を用いてIgLON5抗体をcell-based assayにて検索しましたが,いずれの患者からも抗体は検出されませんでした.この結果から,PSPやCBSの診断基準を満たす患者においてIgLON5抗体関連疾患はまずないか,あっても極めて低い可能性が示唆されました.研究の限界として,脳脊髄液での抗体検索ができなかった点が挙げられますが,過去の検討では脳脊髄液にのみ抗体が認められた患者はごく稀であることから,今回の結果に大きな影響はないものと考えられました.またJALPACの登録がMDS-PSP基準の発表前に始まったため,この診断基準が適用されていないという問題点もあります.
そうなると,どのような時にIgLON5抗体関連疾患を疑うべきかという点に関心が移ります.最近,この疾患が発見されて10年が経ち,Grausらが総説を発表していますが,そのなかで患者が病院を訪れるきっかけとなった症状を示しています(図下).多い順に球麻痺症状(構音障害・嚥下障害),異常歩行,運動異常症,睡眠障害ということが分かります.つまりPSPやCBSに類似するものの「どうも変だぞ!?」と考える臨床力が重要で,具体的には非典型的症候や進行が早いなど経過がおかしい場合にIgLON5抗体関連疾患を疑う必要があるということです.
Ono Y, Takigawa H, Takekoshi A, Yoshikura N, Aiba I, Hanajima R, Kowa H, Kanazawa M, Tokuda T, Tokumaru AM, Morita M, Hasegawa K, Nakashima K, Ikeuchi T, Kimura A, Shimohata T; JALPAC Study Group. Frequency of anti-IgLON5 disease in patients with a typical clinical presentation of progressive supranuclear palsy/corticobasal syndrome. Parkinsonism Relat Disord. 2025 Jan 15:107289.(doi.org/10.1016/j.parkreldis.2025.107289)
Graus F, et al. Anti-IgLON5 Disease 10 Years Later: What We Know and What We Do Not Know. Neurol Neuroimmunol Neuroinflamm. 2025 Jan;12(1):e200353.(doi.org/10.1212/NXI.0000000000200353)
IgLON5抗体関連疾患は稀な自己免疫性脳炎ですが,運動障害や睡眠障害,球麻痺など多岐にわたる症状を呈します.一部の患者では,PSPやCBSに類似した症候を呈することがあります.しかし,臨床的にPSPやCBSと診断された症例におけるIgLON5抗体の頻度は海外における小規模な研究のみで十分に調査されておらず,本研究はその実態を明らかにすることを目的としました.
2014年から2021年にJALPACに登録された350人の患者のうち,223人がPSPまたはCBSの診断基準を満たしました(平均年齢73歳,男性が55%).PSPは106人で,その中にはリチャードソン症候群(PSP-RS),PSP-P,PSP-PAGF,PSP-Cなどのサブタイプが含まれていました.一方,CBS患者は161人で,改訂ケンブリッジ基準やアームストロング基準に基づいて診断されてました(図上).

さて結果ですが,全患者の血清を用いてIgLON5抗体をcell-based assayにて検索しましたが,いずれの患者からも抗体は検出されませんでした.この結果から,PSPやCBSの診断基準を満たす患者においてIgLON5抗体関連疾患はまずないか,あっても極めて低い可能性が示唆されました.研究の限界として,脳脊髄液での抗体検索ができなかった点が挙げられますが,過去の検討では脳脊髄液にのみ抗体が認められた患者はごく稀であることから,今回の結果に大きな影響はないものと考えられました.またJALPACの登録がMDS-PSP基準の発表前に始まったため,この診断基準が適用されていないという問題点もあります.
そうなると,どのような時にIgLON5抗体関連疾患を疑うべきかという点に関心が移ります.最近,この疾患が発見されて10年が経ち,Grausらが総説を発表していますが,そのなかで患者が病院を訪れるきっかけとなった症状を示しています(図下).多い順に球麻痺症状(構音障害・嚥下障害),異常歩行,運動異常症,睡眠障害ということが分かります.つまりPSPやCBSに類似するものの「どうも変だぞ!?」と考える臨床力が重要で,具体的には非典型的症候や進行が早いなど経過がおかしい場合にIgLON5抗体関連疾患を疑う必要があるということです.
Ono Y, Takigawa H, Takekoshi A, Yoshikura N, Aiba I, Hanajima R, Kowa H, Kanazawa M, Tokuda T, Tokumaru AM, Morita M, Hasegawa K, Nakashima K, Ikeuchi T, Kimura A, Shimohata T; JALPAC Study Group. Frequency of anti-IgLON5 disease in patients with a typical clinical presentation of progressive supranuclear palsy/corticobasal syndrome. Parkinsonism Relat Disord. 2025 Jan 15:107289.(doi.org/10.1016/j.parkreldis.2025.107289)
Graus F, et al. Anti-IgLON5 Disease 10 Years Later: What We Know and What We Do Not Know. Neurol Neuroimmunol Neuroinflamm. 2025 Jan;12(1):e200353.(doi.org/10.1212/NXI.0000000000200353)