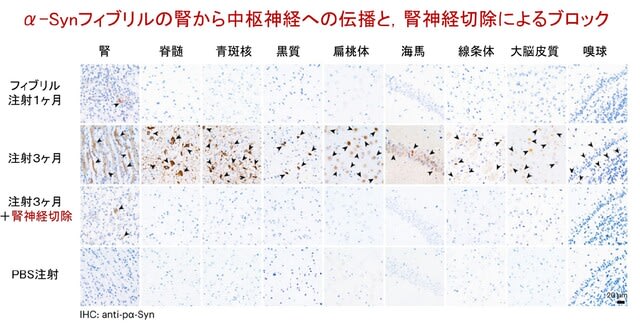
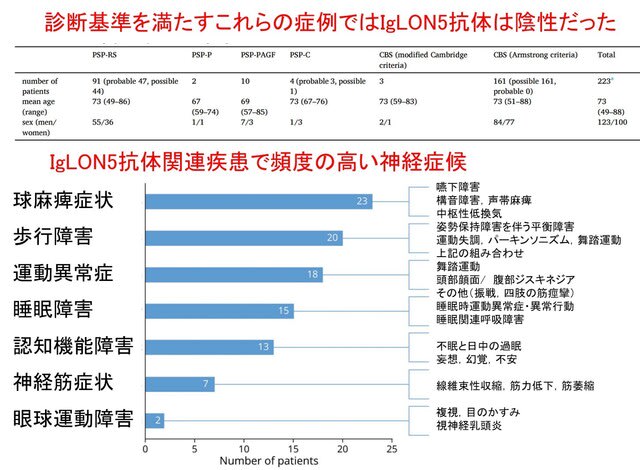
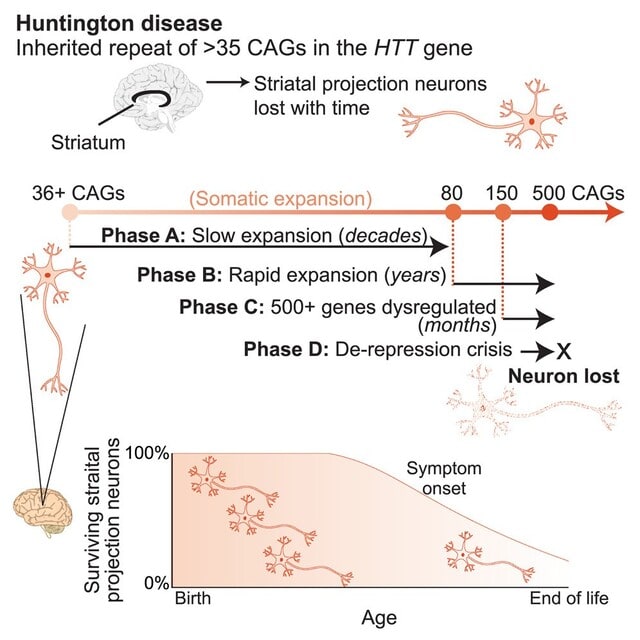
自己免疫性ノドパチーなど,IgG4抗体が関与する自己免疫疾患に関する総説がNeurol Neuroimmunol Neuroinflamm誌に公開されています.IgG4抗体による自己免疫疾患の病態機序,そしてその病態に合わせた免疫療法として何が最適かを解説しています.結論を言うと,IgG4抗体は,他のIgG抗体サブクラス(IgG1~IgG3)と異なり,炎症を介さず,主にタンパク質間相互作用を妨害するため,IVIgの主要な作用メカニズムが働かず,効きにくいということになります.
この論文のポイントは図1です.(A)は IgGの解説です.2本のH鎖と2本のL鎖で構成されます.そしてFc断片に自然免疫細胞のFc受容体が結合することで,貪食作用を可能にします.またIgGは特定の抗原に結合する2つの抗原結合断片(Fab)を持ちます.つぎに(B)のIgG1~IgG3抗体は,2つの同一の抗原結合部位(青色)を持ち,それらが同じ抗原(赤)に結合します.つまり同一抗原に2つのFab armで結合します.この状態を二価性(bivalent)+単一特異性(monospecific)を持つと呼びます.そして(C)の IgG4抗体では,2本のH鎖とL鎖が非共有結合によって結合しています.このためIgG4抗体は,一方のFabアームが他のIgG4分子と交換されるという「Fabアーム交換」を継続的に行います.この結果,IgG1~IgG3のように同一の抗原と強く結合することができません(図の1つは黄,もう1つは黒で書かれています).この状態を一価性(monovalent),二重特異性(bispecific)を持つと呼びます.

IgG4抗体は2つの特徴を持ちます.第1は,炎症を引き起こす能力が極めて低いということです.IgG4はC1q補体に結合できないため,補体を介した細胞傷害を起こしません.またマクロファージや他の免疫細胞に存在するFc受容体に対する結合が弱いため,抗体依存性細胞傷害(ADCC)やファゴサイトーシス(貪食作用)を誘導しにくい特徴があります.第2はIgG4抗体はタンパク質間の相互作用を直接阻害するということです.このため,例えばランヴィエ絞輪に存在する接着分子(例:Contactin-1,Neurofascin-155,Caspr1)の結合を妨げ,神経伝導障害を引き起こします.これが自己免疫性ノドパチーです(図2).同様の病態としては,MuSK抗体陽性重症筋無力症,LGI1抗体関連脳炎,Caspr2抗体関連脳炎,IgLON5抗体関連脳炎,DPPX抗体関連脳炎があります.これらの疾患では,MuSK,LGI1,Caspr2,IgLON5,DPPXといった神経伝導やシナプス伝達に関与する分子がIgG4抗体の標的とされ,機能不全が引き起こされます.

治療に関して,なぜIVIgが効果を示しにくいかについても論じられています.それは上述した通り,IgG4抗体は補体を活性化せず,Fc受容体を介した免疫応答も誘導しないため,IVIgの主要な作用メカニズムが働かないためです.しかしIgG4抗体は短命のB細胞や形質細胞によって産生されるため,リツキシマブなどのB細胞除去療法が効果的であり,長期的な疾患の安定化が期待されます.自己抗体のIgG抗体サブクラスを理解することの大切さを示す論文ですが,自己抗体が病原性を有する細胞表面抗原抗体においてとくに重要と言えるかと思います.
Querol L, Dalakas MC. The Discovery of Autoimmune Nodopathies and the Impact of IgG4 Antibodies in Autoimmune Neurology. Neurol Neuroimmunol Neuroinflamm. 2025 Jan;12(1):e200365. doi: 10.1212/NXI.0000000000200365.
この論文のポイントは図1です.(A)は IgGの解説です.2本のH鎖と2本のL鎖で構成されます.そしてFc断片に自然免疫細胞のFc受容体が結合することで,貪食作用を可能にします.またIgGは特定の抗原に結合する2つの抗原結合断片(Fab)を持ちます.つぎに(B)のIgG1~IgG3抗体は,2つの同一の抗原結合部位(青色)を持ち,それらが同じ抗原(赤)に結合します.つまり同一抗原に2つのFab armで結合します.この状態を二価性(bivalent)+単一特異性(monospecific)を持つと呼びます.そして(C)の IgG4抗体では,2本のH鎖とL鎖が非共有結合によって結合しています.このためIgG4抗体は,一方のFabアームが他のIgG4分子と交換されるという「Fabアーム交換」を継続的に行います.この結果,IgG1~IgG3のように同一の抗原と強く結合することができません(図の1つは黄,もう1つは黒で書かれています).この状態を一価性(monovalent),二重特異性(bispecific)を持つと呼びます.

IgG4抗体は2つの特徴を持ちます.第1は,炎症を引き起こす能力が極めて低いということです.IgG4はC1q補体に結合できないため,補体を介した細胞傷害を起こしません.またマクロファージや他の免疫細胞に存在するFc受容体に対する結合が弱いため,抗体依存性細胞傷害(ADCC)やファゴサイトーシス(貪食作用)を誘導しにくい特徴があります.第2はIgG4抗体はタンパク質間の相互作用を直接阻害するということです.このため,例えばランヴィエ絞輪に存在する接着分子(例:Contactin-1,Neurofascin-155,Caspr1)の結合を妨げ,神経伝導障害を引き起こします.これが自己免疫性ノドパチーです(図2).同様の病態としては,MuSK抗体陽性重症筋無力症,LGI1抗体関連脳炎,Caspr2抗体関連脳炎,IgLON5抗体関連脳炎,DPPX抗体関連脳炎があります.これらの疾患では,MuSK,LGI1,Caspr2,IgLON5,DPPXといった神経伝導やシナプス伝達に関与する分子がIgG4抗体の標的とされ,機能不全が引き起こされます.

治療に関して,なぜIVIgが効果を示しにくいかについても論じられています.それは上述した通り,IgG4抗体は補体を活性化せず,Fc受容体を介した免疫応答も誘導しないため,IVIgの主要な作用メカニズムが働かないためです.しかしIgG4抗体は短命のB細胞や形質細胞によって産生されるため,リツキシマブなどのB細胞除去療法が効果的であり,長期的な疾患の安定化が期待されます.自己抗体のIgG抗体サブクラスを理解することの大切さを示す論文ですが,自己抗体が病原性を有する細胞表面抗原抗体においてとくに重要と言えるかと思います.
Querol L, Dalakas MC. The Discovery of Autoimmune Nodopathies and the Impact of IgG4 Antibodies in Autoimmune Neurology. Neurol Neuroimmunol Neuroinflamm. 2025 Jan;12(1):e200365. doi: 10.1212/NXI.0000000000200365.