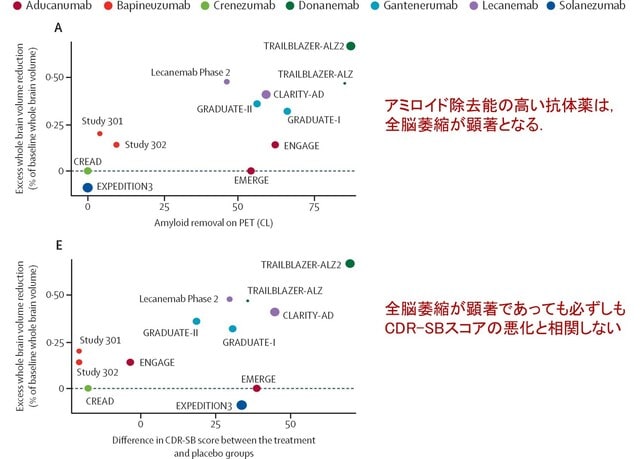
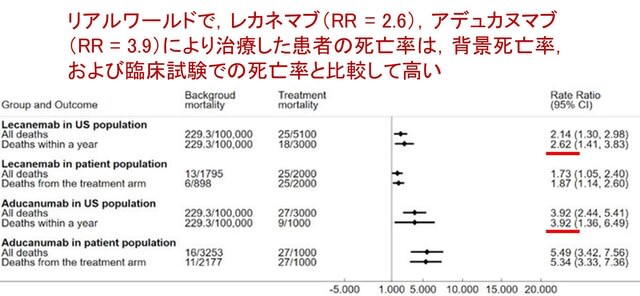
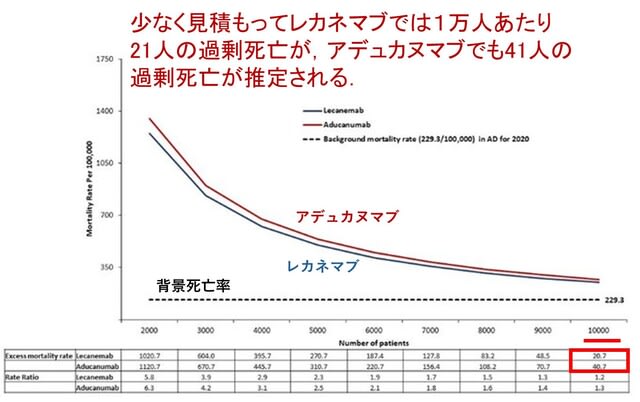
アルツハイマー病に対するアミロイドβ抗体薬(レカネマブ,ドナネマブ)の臨床試験では,実薬群で脳体積の減少が速く進むという「矛盾した」結果が報告されています.これに対し,昨年10月のLancet Neurol 誌の「Personal View」欄で,「アミロイド除去に伴う偽萎縮(amyloid-removal-related pseudo-atrophy)」という新たな解釈が提唱されました(文献1).これは,脳体積の減少は,アミロイドβ除去による生理的な変化で,病的なものではないというものです.私もブログでご紹介しましたが,感想として「現時点で脳萎縮は安全と結論づけるにはデータが不十分で,長期試験や個々の患者レベルのデータ解析が必要だ」と書きました(https://tinyurl.com/28yfo5u9).
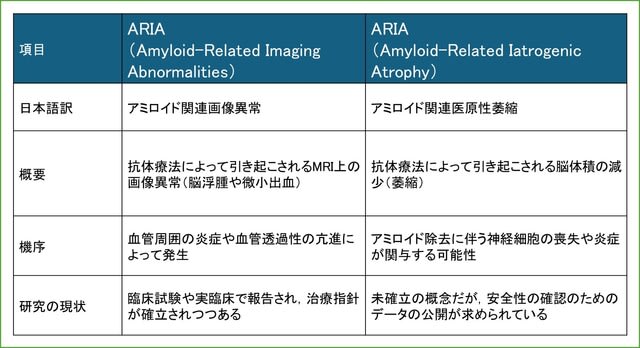
最新号のLancet Neurol 誌のCorrespondenceに「偽萎縮」に対する反論が掲載されています(文献2).オーストラリア,英国,米国の3人の研究者によるものです.タイトルは「Amyloid-related iatrogenic atrophy of the brain: data transparency is an urgent safety priority」で,「偽萎縮」とはまったく反対の立場で,アミロイド除去に伴う医原性脳萎縮(amyloid-related iatrogenic atrophy;ARIA!)という新たな解釈を提唱しています!(表は2つのARIAの違いです)
3人はやはり,上述したように,脳体積の減少と認知機能の関連について,個々の患者レベルのデータが公開されていないことを指摘し,治療効果を適切に評価するためには,脳体積の変化が認知機能や臨床転帰にどのように影響するのかが分からないまま議論するという,透明性が確保されない状況では,有害な副作用を過小評価するリスクがあると警鐘を鳴らしています.
つぎにアミロイド除去による脳体積減少の正確な機序はいまだ不明であるのに,「偽萎縮」という用語を使って神経変性や炎症の影響を過小評価すべきではないと指摘しています.その根拠として,①抗体療法を受けた患者の剖検で,アミロイド斑の減少と同時に神経細胞の喪失やミクログリアの活性化が報告されていること(例としてアミロイドβワクチンAN1792を提示).②ドナネマブ(TRAILBLAZER-ALZ試験)では,アミロイドβがほとんど存在しない白質においても有意な脳体積の減少が観察されており,アミロイド除去による「偽萎縮」では説明がつかないこと.③βセクレターゼ(BACE)阻害薬を用いた研究では,アミロイド斑の除去がほとんど起こらないにもかかわらず脳体積の変化がみられること,を挙げています. この3人の反論に対するreplyも掲載され,ミクログリアはアミロイド除去の過程で一時的に活性化されるが,長期的にはその活性は低下するなどとさらに反論しています.しかし個々の患者データに公開による透明性の確保には同意しています.
ヒポクラテスは「Primum non nocere(まず,害を与えないこと)」と言っています.一部の患者さんに治療が害を与えているということがないかを十分に検証することが重要です.この治験の関係者は,脳萎縮をきたした患者の認知機能の変化,加えてARIA(アミロイド関連画像異常)をきたした患者の認知機能の変化といった個々人のデータを開示すべきと思います.
(文献)
1. Belder CRS, et al. Brain volume change following anti-amyloid β immunotherapy for Alzheimer's disease: amyloid-removal-related pseudo-atrophy. Lancet Neurol. 2024 Oct;23(10):1025-1034.
2. Ayton S, et al. Amyloid-related iatrogenic atrophy of the brain: data transparency is an urgent safety priority. Lancet Neurol. 2025;24(3):189-190.
最新号のLancet Neurol 誌のCorrespondenceに「偽萎縮」に対する反論が掲載されています(文献2).オーストラリア,英国,米国の3人の研究者によるものです.タイトルは「Amyloid-related iatrogenic atrophy of the brain: data transparency is an urgent safety priority」で,「偽萎縮」とはまったく反対の立場で,アミロイド除去に伴う医原性脳萎縮(amyloid-related iatrogenic atrophy;ARIA!)という新たな解釈を提唱しています!(表は2つのARIAの違いです)

3人はやはり,上述したように,脳体積の減少と認知機能の関連について,個々の患者レベルのデータが公開されていないことを指摘し,治療効果を適切に評価するためには,脳体積の変化が認知機能や臨床転帰にどのように影響するのかが分からないまま議論するという,透明性が確保されない状況では,有害な副作用を過小評価するリスクがあると警鐘を鳴らしています.
つぎにアミロイド除去による脳体積減少の正確な機序はいまだ不明であるのに,「偽萎縮」という用語を使って神経変性や炎症の影響を過小評価すべきではないと指摘しています.その根拠として,①抗体療法を受けた患者の剖検で,アミロイド斑の減少と同時に神経細胞の喪失やミクログリアの活性化が報告されていること(例としてアミロイドβワクチンAN1792を提示).②ドナネマブ(TRAILBLAZER-ALZ試験)では,アミロイドβがほとんど存在しない白質においても有意な脳体積の減少が観察されており,アミロイド除去による「偽萎縮」では説明がつかないこと.③βセクレターゼ(BACE)阻害薬を用いた研究では,アミロイド斑の除去がほとんど起こらないにもかかわらず脳体積の変化がみられること,を挙げています. この3人の反論に対するreplyも掲載され,ミクログリアはアミロイド除去の過程で一時的に活性化されるが,長期的にはその活性は低下するなどとさらに反論しています.しかし個々の患者データに公開による透明性の確保には同意しています.
ヒポクラテスは「Primum non nocere(まず,害を与えないこと)」と言っています.一部の患者さんに治療が害を与えているということがないかを十分に検証することが重要です.この治験の関係者は,脳萎縮をきたした患者の認知機能の変化,加えてARIA(アミロイド関連画像異常)をきたした患者の認知機能の変化といった個々人のデータを開示すべきと思います.
(文献)
1. Belder CRS, et al. Brain volume change following anti-amyloid β immunotherapy for Alzheimer's disease: amyloid-removal-related pseudo-atrophy. Lancet Neurol. 2024 Oct;23(10):1025-1034.
2. Ayton S, et al. Amyloid-related iatrogenic atrophy of the brain: data transparency is an urgent safety priority. Lancet Neurol. 2025;24(3):189-190.