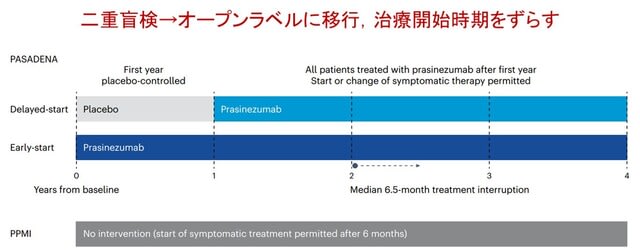
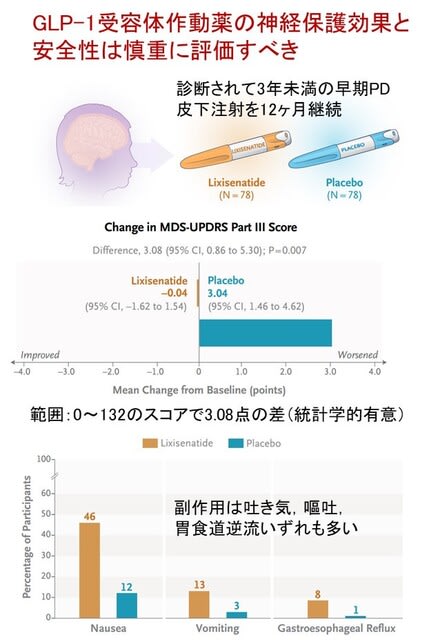
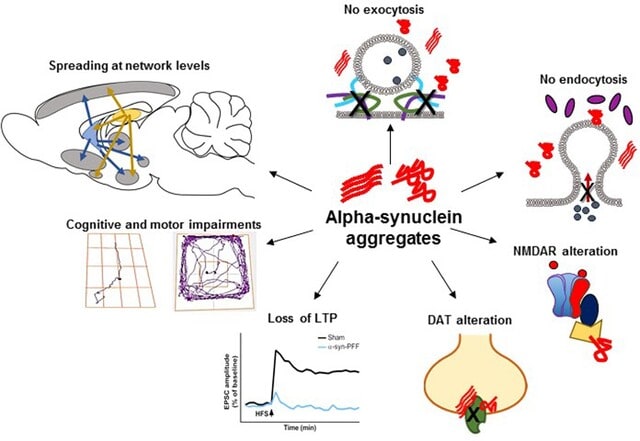
パーキンソン病やレビー小体型認知症は,異常なαシヌクレイン(α-Syn)の蓄積によって進行する神経変性疾患です.これまでもα-Synは腸管で産生され,迷走神経を介して脳へ伝播するという仮説が注目されてきました.しかし,中国から腎臓が新たなα-Syn形成の起点となり得ることを示した研究が,Nature Neuroscience誌に発表され,非常に驚きました.
著者らはパーキンソン病患者や慢性腎疾患(CKD)患者の腎臓を検討しました.この結果,α-Synがこれらの患者の腎臓周囲の神経線維や血管に蓄積していることを確認しました.さらに腎臓に蓄積したα-Synが腎神経を介して脊髄や脳に伝播することを,動物モデル(α-Syn A53Tマウスの腎臓に病的α-Synプリオン様線維を注射するモデル)を用いた実験で明らかにしました.この腎神経は腎臓と脳を結ぶ自律神経で,交感神経と副交感神経が含まれています.腎臓で蓄積したα-Synは,この神経経路の求心性線維を通じて,まず脊髄の側角に到達し,そこから脊髄を上行して,孤束核や青斑核などの脳幹領域に伝播します.さらに黒質緻密部や線条体,海馬,大脳皮質,嗅球といった中枢神経系全体に広がり,病理変化を引き起こすことが免疫染色やトレーサー実験にて示されました(図1).
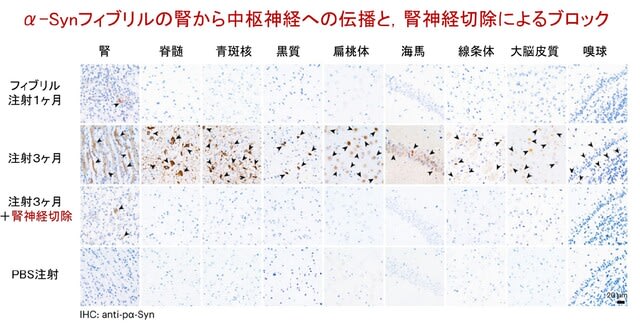
つぎに腎神経を切除する実験が行われました(図1).この結果,脊髄や脳幹,黒質緻密部,線条体などの中枢神経系でのα-Syn蓄積が完全に阻止されることが確認されました.これにより,腎神経が病的タンパクの伝播において主要な役割を果たしていることが証明されました.またα-Synが中枢神経系に到達すると,線条体や黒質緻密部におけるドパミン神経細胞の減少が生じ,これに伴う運動障害が観察されました.一方で,腎神経を切除した場合,この運動障害は顕著に改善しました.
さらに血中α-Synの主要な供給源である赤血球の役割にも注目されました.野生型マウスに対して放射線照射を行い,骨髄細胞を破壊したあと,α-Synノックアウトマウスの骨髄を移植しました.つまりこのマウスでは移植後に産生される赤血球はα-Synを持たないこととなり,血中α-Syn濃度が著しく低下しました.このマウスではα-Syn病理が軽減され,脳内での異常蓄積が抑制されました.また運動障害も顕著に改善しました.
腎障害とパーキンソン病の関連を文献検索するといろいろ報告があり,1例を挙げると,CKDや尿蛋白がパーキンソン病の発症リスクに与える影響を調べた研究が,韓国から報告されています(Nam GE, et al. 2019).腎機能が低下し,eGFRが30未満の場合,パーキンソン病発症のハザード比(HR)は1.47と顕著に増加すること,そして尿蛋白が1+以上のケースでもHRは1.12に上昇することが示されています(図2).パーキンソン病は脳だけの病気でないことを改めて実感しました.さらに血中α-Synを標的とした治療法(例えばα-Syn抗体もそのひとつと言えます)が,パーキンソン病やレビー小体病の進行を抑制する新しい治療アプローチとなり得ることを示した点で興味深い論文です.

Yuan X, et al. Propagation of pathologic α-synuclein from kidney to brain may contribute to Parkinson’s disease. Nat Neurosci. 2024.(doi.org/10.1038/s41593-024-01866-2)
Nam GE, et al. Chronic renal dysfunction, proteinuria, and risk of Parkinson's disease in the elderly. Mov Disord. 2019 Aug;34(8):1184-1191.(doi.org/10.1002/mds.27704)
著者らはパーキンソン病患者や慢性腎疾患(CKD)患者の腎臓を検討しました.この結果,α-Synがこれらの患者の腎臓周囲の神経線維や血管に蓄積していることを確認しました.さらに腎臓に蓄積したα-Synが腎神経を介して脊髄や脳に伝播することを,動物モデル(α-Syn A53Tマウスの腎臓に病的α-Synプリオン様線維を注射するモデル)を用いた実験で明らかにしました.この腎神経は腎臓と脳を結ぶ自律神経で,交感神経と副交感神経が含まれています.腎臓で蓄積したα-Synは,この神経経路の求心性線維を通じて,まず脊髄の側角に到達し,そこから脊髄を上行して,孤束核や青斑核などの脳幹領域に伝播します.さらに黒質緻密部や線条体,海馬,大脳皮質,嗅球といった中枢神経系全体に広がり,病理変化を引き起こすことが免疫染色やトレーサー実験にて示されました(図1).

つぎに腎神経を切除する実験が行われました(図1).この結果,脊髄や脳幹,黒質緻密部,線条体などの中枢神経系でのα-Syn蓄積が完全に阻止されることが確認されました.これにより,腎神経が病的タンパクの伝播において主要な役割を果たしていることが証明されました.またα-Synが中枢神経系に到達すると,線条体や黒質緻密部におけるドパミン神経細胞の減少が生じ,これに伴う運動障害が観察されました.一方で,腎神経を切除した場合,この運動障害は顕著に改善しました.
さらに血中α-Synの主要な供給源である赤血球の役割にも注目されました.野生型マウスに対して放射線照射を行い,骨髄細胞を破壊したあと,α-Synノックアウトマウスの骨髄を移植しました.つまりこのマウスでは移植後に産生される赤血球はα-Synを持たないこととなり,血中α-Syn濃度が著しく低下しました.このマウスではα-Syn病理が軽減され,脳内での異常蓄積が抑制されました.また運動障害も顕著に改善しました.
腎障害とパーキンソン病の関連を文献検索するといろいろ報告があり,1例を挙げると,CKDや尿蛋白がパーキンソン病の発症リスクに与える影響を調べた研究が,韓国から報告されています(Nam GE, et al. 2019).腎機能が低下し,eGFRが30未満の場合,パーキンソン病発症のハザード比(HR)は1.47と顕著に増加すること,そして尿蛋白が1+以上のケースでもHRは1.12に上昇することが示されています(図2).パーキンソン病は脳だけの病気でないことを改めて実感しました.さらに血中α-Synを標的とした治療法(例えばα-Syn抗体もそのひとつと言えます)が,パーキンソン病やレビー小体病の進行を抑制する新しい治療アプローチとなり得ることを示した点で興味深い論文です.

Yuan X, et al. Propagation of pathologic α-synuclein from kidney to brain may contribute to Parkinson’s disease. Nat Neurosci. 2024.(doi.org/10.1038/s41593-024-01866-2)
Nam GE, et al. Chronic renal dysfunction, proteinuria, and risk of Parkinson's disease in the elderly. Mov Disord. 2019 Aug;34(8):1184-1191.(doi.org/10.1002/mds.27704)