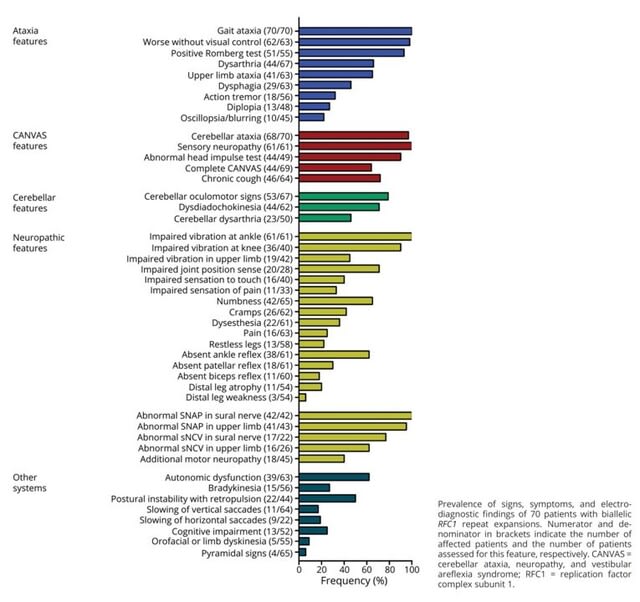
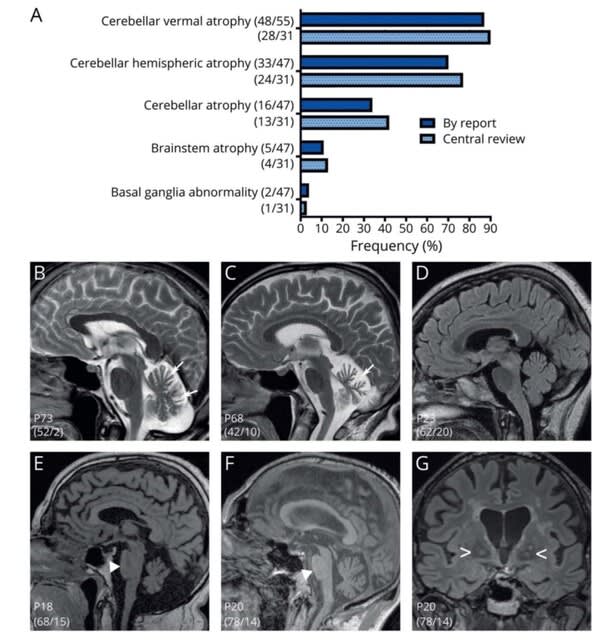
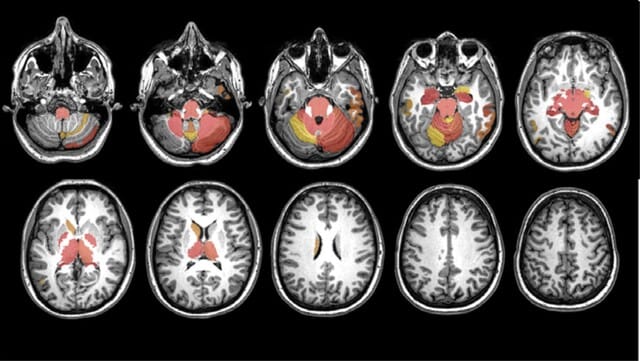
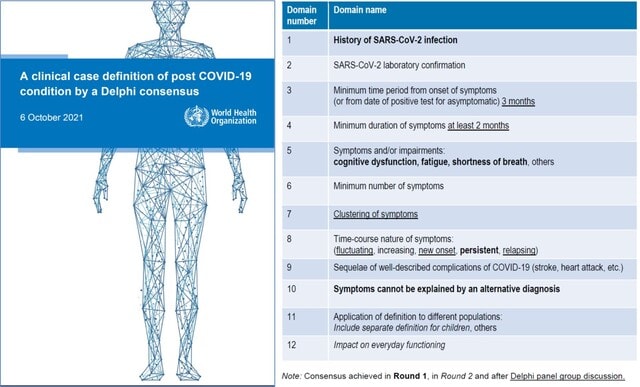
今回のキーワードは,デルタ株に対する免疫は2 回目のワクチン接種から数ヵ月後に全年齢層で低下する,ワクチン接種で神経合併症のリスクが高まるが,感染するとよりリスクが高い,最終の抗CD20治療からの期間と全治療期間は,ワクチン接種後の抗体反応低下と関連する,重症COVID-19では感染早期にTGFβが不適切に増加し,NK細胞の機能と早期のウイルス防御を阻害している,重症化リスク因子を持つの外来患者に早期にフルボキサミンを使用することで,救急搬送ないし転院を抑制できる,です.
最初の論文はイスラエルの感染者数の変動に,ワクチン接種後数ヶ月で効果が低下したことが影響していることを示した報告です.現在,感染状況が落ち着いていますが,イスラエルと同じ轍を踏まないために,ブースター接種の機会が来れば必ず行うことが推奨されます.興味深い報告はサイトカインの1つ,TGFβが早期に増加する症例では,がん細胞やウイルス感染細胞を攻撃するナチュラルキラー細胞(NK細胞)の働きに変化が起きて重症化が生じることが示されました.TGFβ受容体阻害剤などに重症化抑制効果が期待できるかもしれません.最後に以前から話題になっていた抗うつ薬フルボキサミンの重症化抑制作用に関する大規模研究が報告されました.
◆デルタ株に対する免疫は,2 回目のワクチン接種から数ヵ月後に全年齢層で低下する.
イスラエルはファイザーワクチンを接種することで,COVID-19の流行が急激に抑制された.その後,感染者がほとんどいない時期を経て,2021年6月中旬から流行が再燃した(図1).
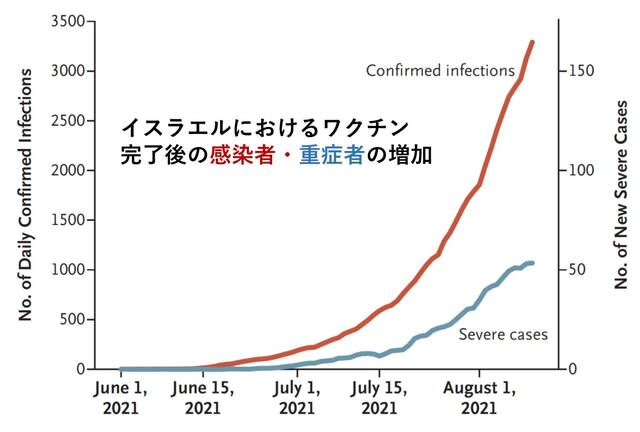
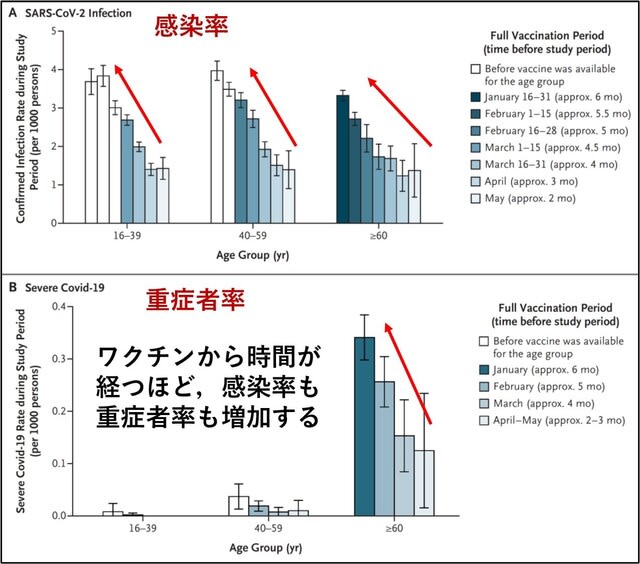
この再燃の原因について検討した研究が報告された.2021年6月以前にワクチン完全接種を受けたイスラエルの「全住民」を対象に,2021年7月11日~31日の期間の感染および重症化を検討した.結果としては,60歳以上の人では,7月11日~31日における感染率は,2021年1月にワクチン完全接種を受けた人の方が,2か月後の3月に完全接種を受けた人よりも高かった(率比1.6;95%CI,1.3~2.0).40~59歳では率比1.7(95%信頼区間,1.4~2.1),16歳~39歳の人では,率比1.6(95%CI,1.3~2.0)であった.重症化率は,60歳以上では1.8(95%CI,1.1~2.9),40~59歳では2.2(95%CI,0.6~7.7)であった(16~39歳では人数が少なく算出不能).以上よりデルタ株に対する免疫は,2 回目のワクチン接種から数ヵ月後に,全年齢層で低下したことが示された(図2).→ イスラエルの経験から学び,ブースター接種をしっかりと行い,第6波を最小限に抑える必要がある.
New Engl J Med. Oct 27, 2021.(doi.org/10.1056/NEJMoa2114228)
◆ワクチン接種で神経合併症のリスクが高まるが,感染するとよりリスクが高い.
COVID-19の感染や予防接種に関連した稀な神経合併症の報告が増えている.英国から,アストラゼネカワクチン(n = 2041万7752人)またはファイザーワクチン(n = 1213万4782人)の初回接種後28日間,およびPCR検査陽性後(n = 200万5280人)の神経学的合併症について検討した.アストラゼネカワクチンでは,ギランバレー症候群(発生率比(IRR),2.90,接種後15~21日目)および顔面神経麻痺(IRR,1.29,15~21日目)のリスクが上昇した.ファイザーワクチンでは,出血性脳卒中のリスクが上昇した(IRR,1.38,15-21日).スコットランドのコホートでは,アストラゼネカワクチンとギランバレー症候群との関連がさらに裏付けられた(IRR,2.32,1~28日目).PCR陽性の検査後28 日間では,ギランバレー症候群を含むすべての神経学的転帰のリスクが大幅に高かった(IRR,5.25).全体として,アストラゼネカワクチンの接種を受けた1000万人あたり38件,PCR陽性後には1000万人あたり145件のギランバレー症候群の過剰発生があると推定された.以上よりCOVID-19ワクチンを接種すると神経合併症のリスクが高まるが,COVID-19の感染はよりリスクが高まることが分かった(図3).
Nat Med. Oct 25, 2021.(doi.org/10.1038/s41591-021-01556-7)

◆最終の抗CD20治療からの期間と全治療期間は,ワクチン接種後の抗体反応低下と関連する.
英国から,多発性硬化症(MS)患者473名を対象とした,COVID-19ワクチン後の対する抗体産生に対する疾患修飾療法の影響を検討した研究が報告された.結論は,疾患修飾療法を受けていない場合と比べ,抗CD20モノクローナル抗体とフィンゴリモドの使用は,ワクチン接種後のseroconversionの低下と関連していた(オッズ比0.03と0.04).その他の薬剤はいずれも未治療群と有意な差はなかった.最終の抗CD20治療からの期間,ならびに全治療期間が長いことは,ワクチン接種に対する抗体反応低下と有意に関連していた.またT細胞免疫に関する予備的研究では,抗体陰性の被験者の40%に抗SARS-CoV2 T細胞反応が測定できた.以上より,疾患修飾療法の中には,MS患者のCOVID-19ワクチン接種後の抗体が減弱するリスクをもたらす薬剤があることを認識する必要がある.
Ann Neurol. 22 October 2021 https://doi.org/10.1002/ana.26251
◆重症COVID-19では感染早期にTGFβが不適切に増加し,NK細胞の機能と早期のウイルス防御を阻害している.
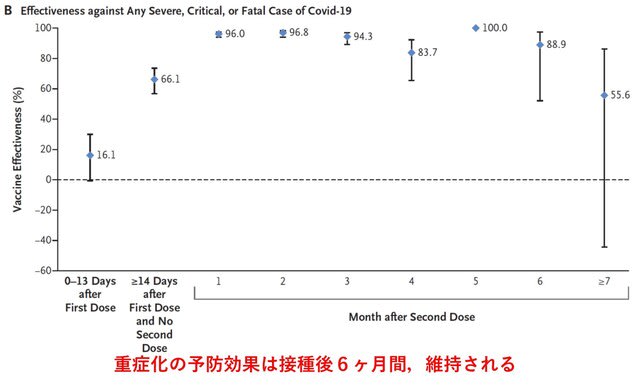
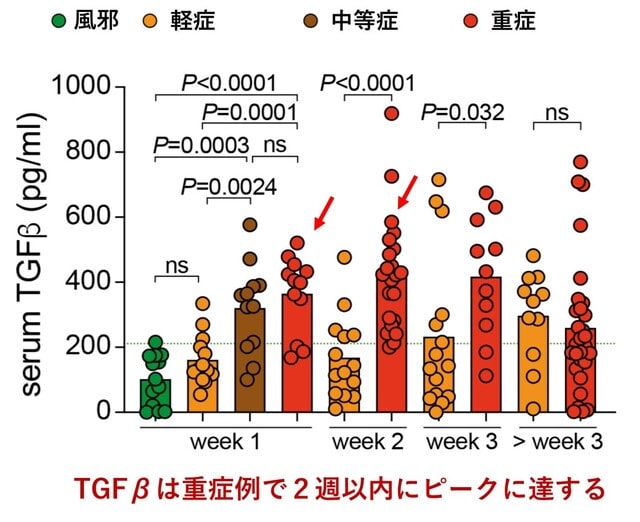
ナチュラルキラー(NK)細胞は,RNAウイルスを含むさまざまなウイルスに対して顕著な防御活性を持つ自然免疫系のリンパ球である.COVID-19では,活性化された「適応的」表現型を持つNK細胞が増加しているにもかかわらず,NK細胞の機能が変化している可能性が指摘されていた.ドイツから,COVID-19におけるウイルス量の減少がNK細胞の状態と相関すること,NK細胞が感染した標的細胞を認識することでSARS-CoV-2の複製を制御できることが示された.重症のCOVID-19では,細胞傷害性エフェクター分子が高発現しているにもかかわらず,NK細胞はウイルス制御,サイトカイン産生,細胞傷害性に顕著な欠陥を示した.COVID-19の全病期におけるNK細胞の単一細胞RNAシーケンシング(scRNA-seq)により,ユニークな遺伝子発現が明らかになった.インターフェロンによるNK細胞活性化の転写ネットワークには,細胞接着,顆粒エクソサイトーシス,細胞媒介細胞傷害に関連する遺伝子の発現が低下した支配的なTGFβ応答が認められる.重症のCOVID-19では,TGFβの血清レベルが感染後2週間以内にピークに達し(図4),その結果,TGFβ依存性にNK細胞の機能が大きく阻害されることがわかった.これと対照的に,軽症患者のTGFβは発症後3週間を過ぎてからわずかに増加するのみであった.以上より,重症COVID-19では感染早期のTGFβの不適切な増加が,NK細胞の機能と早期のウイルス防御を阻害している可能性が示された.TGFβの抑制により,重症化を防げる可能性が出てきた.
Nature. Oct 25, 2021.(doi.org/10.1038/s41586-021-04142-6)
◆重症化リスク因子を持つの外来患者に早期にフルボキサミンを使用することで,救急搬送ないし転院を抑制できる.
近年,COVID-19に対する抗うつ薬フルボキサミン(選択的セロトニン再取り込み阻害薬)の治療効果が期待されている.ブラジルからフルボキサミンの重症化抑制効果を検討するTOGETHER試験が報告された.糖尿病や高血圧などのハイリスク因子を持つブラジル人成人を対象とした偽薬対照無作為化試験である.フルボキサミン(100mg,1日2回,10日間)または偽薬のいずれかに割り付けられた.主要評価項目は,COVID-19による救急搬送,または三次病院への転院のいずれかとして定義される「入院」の複合エンドポイントとした.結果はフルボキサミン群,偽薬群741名ずつ割り振られた.COVID-19により「入院」した患者の割合は,偽薬と比較してフルボキサミン群で低く(79/741例[11%]対119/756例[16%];相対リスク[RR]0.68),かつ優越性が認められた(リスク差5.0%).主要評価項目の結果は,修正intention-to-treat解析では同様の結果(RR 0.69),per-protocol解析ではより大きな結果(RR 0.34)が得られた.死亡については,ITT解析で,フルボキサミン群17名,偽薬群25名であった(OR 0.68),per-protocol解析では各1名,12名であった(OR 0.09).緊急性の高い有害事象に有意差はなかった.以上より,COVID-19と診断された高リスクの外来患者に,早期にフルボキサミン(1回100mg,1日2回,10日間)を使用することで,救急搬送ないし転院を抑制できる可能性がある.
Lancet Global health. Oct 27, 2021.(doi.org/10.1016/S2214-109X(21)00448-4)
最初の論文はイスラエルの感染者数の変動に,ワクチン接種後数ヶ月で効果が低下したことが影響していることを示した報告です.現在,感染状況が落ち着いていますが,イスラエルと同じ轍を踏まないために,ブースター接種の機会が来れば必ず行うことが推奨されます.興味深い報告はサイトカインの1つ,TGFβが早期に増加する症例では,がん細胞やウイルス感染細胞を攻撃するナチュラルキラー細胞(NK細胞)の働きに変化が起きて重症化が生じることが示されました.TGFβ受容体阻害剤などに重症化抑制効果が期待できるかもしれません.最後に以前から話題になっていた抗うつ薬フルボキサミンの重症化抑制作用に関する大規模研究が報告されました.
◆デルタ株に対する免疫は,2 回目のワクチン接種から数ヵ月後に全年齢層で低下する.
イスラエルはファイザーワクチンを接種することで,COVID-19の流行が急激に抑制された.その後,感染者がほとんどいない時期を経て,2021年6月中旬から流行が再燃した(図1).

この再燃の原因について検討した研究が報告された.2021年6月以前にワクチン完全接種を受けたイスラエルの「全住民」を対象に,2021年7月11日~31日の期間の感染および重症化を検討した.結果としては,60歳以上の人では,7月11日~31日における感染率は,2021年1月にワクチン完全接種を受けた人の方が,2か月後の3月に完全接種を受けた人よりも高かった(率比1.6;95%CI,1.3~2.0).40~59歳では率比1.7(95%信頼区間,1.4~2.1),16歳~39歳の人では,率比1.6(95%CI,1.3~2.0)であった.重症化率は,60歳以上では1.8(95%CI,1.1~2.9),40~59歳では2.2(95%CI,0.6~7.7)であった(16~39歳では人数が少なく算出不能).以上よりデルタ株に対する免疫は,2 回目のワクチン接種から数ヵ月後に,全年齢層で低下したことが示された(図2).→ イスラエルの経験から学び,ブースター接種をしっかりと行い,第6波を最小限に抑える必要がある.
New Engl J Med. Oct 27, 2021.(doi.org/10.1056/NEJMoa2114228)

◆ワクチン接種で神経合併症のリスクが高まるが,感染するとよりリスクが高い.
COVID-19の感染や予防接種に関連した稀な神経合併症の報告が増えている.英国から,アストラゼネカワクチン(n = 2041万7752人)またはファイザーワクチン(n = 1213万4782人)の初回接種後28日間,およびPCR検査陽性後(n = 200万5280人)の神経学的合併症について検討した.アストラゼネカワクチンでは,ギランバレー症候群(発生率比(IRR),2.90,接種後15~21日目)および顔面神経麻痺(IRR,1.29,15~21日目)のリスクが上昇した.ファイザーワクチンでは,出血性脳卒中のリスクが上昇した(IRR,1.38,15-21日).スコットランドのコホートでは,アストラゼネカワクチンとギランバレー症候群との関連がさらに裏付けられた(IRR,2.32,1~28日目).PCR陽性の検査後28 日間では,ギランバレー症候群を含むすべての神経学的転帰のリスクが大幅に高かった(IRR,5.25).全体として,アストラゼネカワクチンの接種を受けた1000万人あたり38件,PCR陽性後には1000万人あたり145件のギランバレー症候群の過剰発生があると推定された.以上よりCOVID-19ワクチンを接種すると神経合併症のリスクが高まるが,COVID-19の感染はよりリスクが高まることが分かった(図3).
Nat Med. Oct 25, 2021.(doi.org/10.1038/s41591-021-01556-7)

◆最終の抗CD20治療からの期間と全治療期間は,ワクチン接種後の抗体反応低下と関連する.
英国から,多発性硬化症(MS)患者473名を対象とした,COVID-19ワクチン後の対する抗体産生に対する疾患修飾療法の影響を検討した研究が報告された.結論は,疾患修飾療法を受けていない場合と比べ,抗CD20モノクローナル抗体とフィンゴリモドの使用は,ワクチン接種後のseroconversionの低下と関連していた(オッズ比0.03と0.04).その他の薬剤はいずれも未治療群と有意な差はなかった.最終の抗CD20治療からの期間,ならびに全治療期間が長いことは,ワクチン接種に対する抗体反応低下と有意に関連していた.またT細胞免疫に関する予備的研究では,抗体陰性の被験者の40%に抗SARS-CoV2 T細胞反応が測定できた.以上より,疾患修飾療法の中には,MS患者のCOVID-19ワクチン接種後の抗体が減弱するリスクをもたらす薬剤があることを認識する必要がある.
Ann Neurol. 22 October 2021 https://doi.org/10.1002/ana.26251
◆重症COVID-19では感染早期にTGFβが不適切に増加し,NK細胞の機能と早期のウイルス防御を阻害している.
ナチュラルキラー(NK)細胞は,RNAウイルスを含むさまざまなウイルスに対して顕著な防御活性を持つ自然免疫系のリンパ球である.COVID-19では,活性化された「適応的」表現型を持つNK細胞が増加しているにもかかわらず,NK細胞の機能が変化している可能性が指摘されていた.ドイツから,COVID-19におけるウイルス量の減少がNK細胞の状態と相関すること,NK細胞が感染した標的細胞を認識することでSARS-CoV-2の複製を制御できることが示された.重症のCOVID-19では,細胞傷害性エフェクター分子が高発現しているにもかかわらず,NK細胞はウイルス制御,サイトカイン産生,細胞傷害性に顕著な欠陥を示した.COVID-19の全病期におけるNK細胞の単一細胞RNAシーケンシング(scRNA-seq)により,ユニークな遺伝子発現が明らかになった.インターフェロンによるNK細胞活性化の転写ネットワークには,細胞接着,顆粒エクソサイトーシス,細胞媒介細胞傷害に関連する遺伝子の発現が低下した支配的なTGFβ応答が認められる.重症のCOVID-19では,TGFβの血清レベルが感染後2週間以内にピークに達し(図4),その結果,TGFβ依存性にNK細胞の機能が大きく阻害されることがわかった.これと対照的に,軽症患者のTGFβは発症後3週間を過ぎてからわずかに増加するのみであった.以上より,重症COVID-19では感染早期のTGFβの不適切な増加が,NK細胞の機能と早期のウイルス防御を阻害している可能性が示された.TGFβの抑制により,重症化を防げる可能性が出てきた.
Nature. Oct 25, 2021.(doi.org/10.1038/s41586-021-04142-6)

◆重症化リスク因子を持つの外来患者に早期にフルボキサミンを使用することで,救急搬送ないし転院を抑制できる.
近年,COVID-19に対する抗うつ薬フルボキサミン(選択的セロトニン再取り込み阻害薬)の治療効果が期待されている.ブラジルからフルボキサミンの重症化抑制効果を検討するTOGETHER試験が報告された.糖尿病や高血圧などのハイリスク因子を持つブラジル人成人を対象とした偽薬対照無作為化試験である.フルボキサミン(100mg,1日2回,10日間)または偽薬のいずれかに割り付けられた.主要評価項目は,COVID-19による救急搬送,または三次病院への転院のいずれかとして定義される「入院」の複合エンドポイントとした.結果はフルボキサミン群,偽薬群741名ずつ割り振られた.COVID-19により「入院」した患者の割合は,偽薬と比較してフルボキサミン群で低く(79/741例[11%]対119/756例[16%];相対リスク[RR]0.68),かつ優越性が認められた(リスク差5.0%).主要評価項目の結果は,修正intention-to-treat解析では同様の結果(RR 0.69),per-protocol解析ではより大きな結果(RR 0.34)が得られた.死亡については,ITT解析で,フルボキサミン群17名,偽薬群25名であった(OR 0.68),per-protocol解析では各1名,12名であった(OR 0.09).緊急性の高い有害事象に有意差はなかった.以上より,COVID-19と診断された高リスクの外来患者に,早期にフルボキサミン(1回100mg,1日2回,10日間)を使用することで,救急搬送ないし転院を抑制できる可能性がある.
Lancet Global health. Oct 27, 2021.(doi.org/10.1016/S2214-109X(21)00448-4)