今回のキーワードは,
退院後の症状の持続,空気感染とその対策,スペインの抗体保有率,血小板に生じる変化,COVID-19感染後に発症した多発性硬化症とパーキンソニズム,脳出血を伴う急性散在性脳脊髄炎,血栓性微小血管症,神経免疫療法のコンセンサスです.
入院患者の長期的経過については分かっていませんでしたが,退院2ヶ月後,完全に症状が消失する人はわずか12.6%という結果が報告されました.また空気感染はほぼ間違いないこと,集団免疫は不可能であることも報告されています.COVID-19は決して甘く考えてはいけない疾患であり,特効薬もない現状では,改めて感染予防対策を徹底する必要性があります.
◆COVID-19では退院後も症状は持続する.
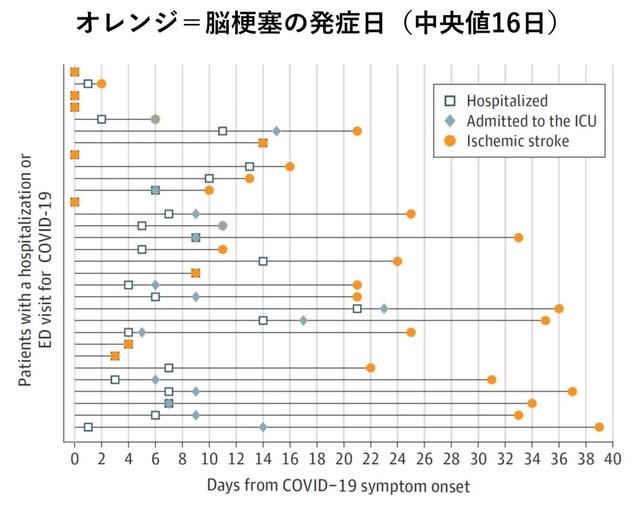
イタリアの単一施設からの報告.COVID-19患者の退院後の状況を確認するため,WHOの検疫中止基準(3日間連続発熱なし,その他の症状の改善,PCRが24時間間隔で2回陰性)を満たした全患者143名を追跡調査した.平均在院日数は 13.5 日,21 名(15%)が非侵襲的人工呼吸,7 名(5%)が侵襲的人工呼吸を受けた.評価は発症から平均60日後に行われた.
COVID-19に関連する症状が完全に消失したのは18名(12.6%)のみであった.55%で3種類以上の症状が持続し,32%で1~2種類の症状が持続していた.具体的には疲労(53.1%),呼吸困難(43.4%),関節痛(27.3%),胸部痛(21.7%)の頻度が高かった(図1).QOLの悪化は44.1%の患者で認められた.退院後も継続的な経過観察が必要である.
JAMA. July 9, 2020(doi.org/10.1001/jama.2020.12603)

◆空気感染が起きることを認識し,換気を心がける.
世界32カ国の科学者239名が,COVID-19は患者の呼吸や咳により生じた空中を浮遊する小さな飛沫(microdroplet)により,数メートルもしくは部屋サイズの範囲で,
空気感染(airborne transmission)することはほぼ確実であるという論文を発表した.また空気感染を防ぐ方法として以下の3点を提示している.
1)
十分かつ効果的な換気を行う(外気を取り入れる.特に公共の建物,職場,学校,病院,高齢者施設では重要)(図2).
2)通常の換気に加え,局所の排気,高効率空気濾過,殺菌性紫外線などの空気感染対策を行う.
3)特に公共交通機関や公共の建物では,過密状態を避ける.
Clin Infect Dis. July 06 2020(doi.org/10.1093/cid/ciaa939)

◆COVID-19が蔓延したスペインでも集団免疫にはほど遠い
スペインで,無作為抽出法を用いて市町村名簿から6.1万人を選び,4月27日から5月11日に
抗体保有率を調査したところ,ポイントオブケア検査で5.0%,免疫アッセイで4.6%であった.性差はなく,10歳未満の子供の陽性率は3.1%未満と低かった.陽性率はマドリッド周辺で高いものの10%を超える程度で,沿岸部では3%未満と,地域的なばらつきが大きかった
.抗体陽性者の約3分の1は無症状であった.2つの抗体検査とも陽性であった人のうち,以前にPCR検査を受けた割合はわずか19.5%のみであった.→ 抗体保有率が5%ということは,①適切な予防策を行えば大半の人は感染を予防できること,②集団免疫は困難であり,無理に感染を待つような方策はすべきではないことを意味する.また抗体陽性者の2割未満しかPCRを受けていなかったことや,血清学的に感染の既往を認める者の3分の1は無症状であったことは今後の対策に重要な知見で,少なくとも自覚症状を認める者や濃厚接触者は確実にPCRを行う必要がある.
Lancet. July 06, 2020(doi.org/10.1016/S0140-6736(20)31483-5)
◆COVID-19は血小板の遺伝子発現の変化をきたし,凝集を促進する.
COVID-19ではしばしば血栓症を合併し,臓器不全や死亡を招く.しかしウイルス感染が血小板機能を変化させるかは不明であった.米国から患者血小板についての研究が報告された.まずRNAシークエンシングとそのパスウェイ解析で,タンパク質のユビキチン化,抗原提示,ミトコンドリア機能障害に関連するパスウェイの遺伝子発現に明確な変化が見られた.またウイルス受容体ACE2は,血小板中のmRNAやタンパク質から検出されなかった.しかし驚くべきことに,患者25名中2名の血小板から,SARS-CoV-2 N1遺伝子のmRNAが検出された.つまり,
血小板がACE2を介さずにウイルスmRNAを取り込む可能性が示唆される.また血小板活性化マーカーであるP-selectinの発現は,活性化の前後とも増加し,さらに患者血小板はフィブリノーゲンやコラーゲンに対しより速く凝集した.ウイルス感染により血小板機能に変化が生じ,血小板凝集が起こり,病態に関与する可能性がある.
Blood. June 23, 2020(oi.org/10.1182/blood.2020007214)
◆症例報告(1)COVID-19感染後に発症した多発性硬化症(MS).
スペインからの報告.29歳女性.右視力低下にて発症.視野欠損と眼痛を呈した.神経学的に錐体路徴候を認めた.また視覚症状に先立って嗅覚障害,味覚障害を呈した.眼窩MRIで造影効果を伴う右視神経病変,頭部MRIでは脳室周囲に多発する脱髄病変を認め,うち1つで造影効果を認めた.脊髄MRIは異常なし.オリゴクローナル・バンド陽性,抗AQP4抗体,抗MOG抗体は陰性.鼻咽頭拭いおよび髄液PCRは陰性であったが,IgM/IgGは陽性だった.パルス療法後,ステロイド内服を行い,視力はと眼痛は徐々に改善した.ウイルス感染によって誘導された免疫機構が,リンパ球を活性化して炎症反応を起こすことで,MSの発症に関与した可能性がある.
Multiple Scler Relat Disord. July 06, 2020(doi.org/10.1016/j.msard.2020.102377)
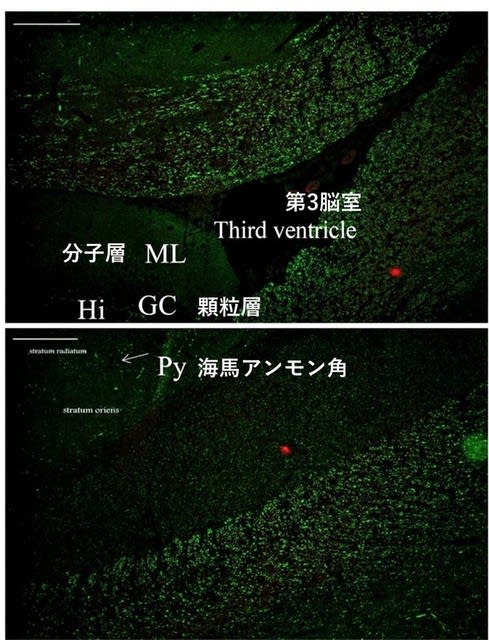
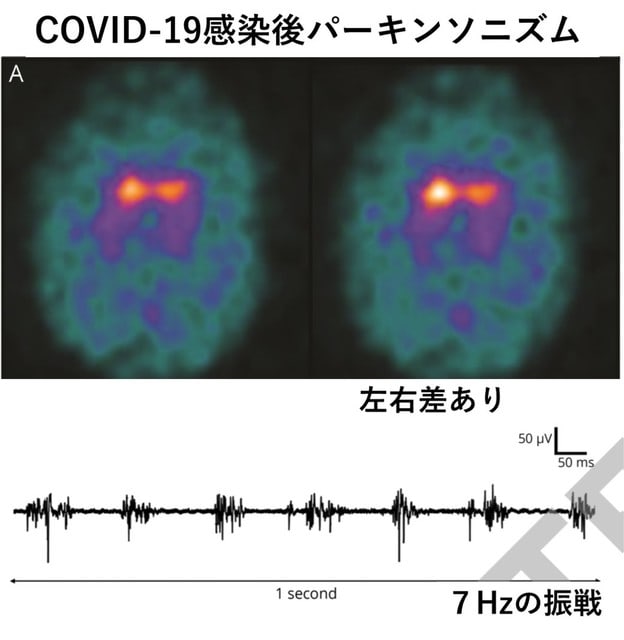
◆症例報告(2)COVID-19感染後に急性発症したパーキンソニズム.
スペインからの報告.58歳男性.重症のCOVID-19のため人工呼吸器を装着され,離脱後に全身性ミオクローヌスが出現し消失.つづいて一過性に変動する意識レベルの障害,さらに
非対称性の運動緩慢・筋強剛と軽度の7Hzの安静時,姿勢時振戦,垂直方向性眼球運動障害,オプソクローヌスを呈した.頭部MRIでは異常なし.DaT-SPECTでは,両側淡蒼球のシナプス前ドーパミン取り込みの減少を非対称性に認めた(図3).とくに治療をせずにパーキンソン症状は改善傾向にある.
Neurology. July 8, 2020(doi.org/10.1212/WNL.0000000000010282)
◆神経合併症として,脳出血を伴う急性散在性脳脊髄炎(ADEM)が多い.
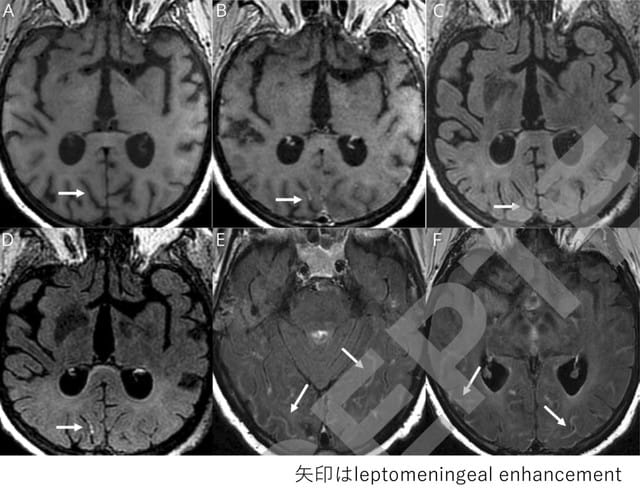
英国Queen Squareからの症例集積研究.神経症状を呈した43名の内訳は,29名がPCR陽性で確定診断,8例がWHO基準でprobable,6名がpossibleであった.43名は5つのカテゴリーに分類された.(i) 脳症(10名):せん妄/精神症状を呈し,頭部MRIや髄液の異常は認めず,9名は支持療法のみで完全ないし部分的に回復した.(ii) 炎症性中枢神経症候群(12名):脳炎(2名,感染性または感染後),急性散在性脳脊髄炎(ADEM)(9名)を含む(図4).
ADEMの内訳は出血性変化を認める例が5名と多く,呼吸器症状の重症度とは無関係であった.その他,壊死1名,脳脊髄炎2名,脊髄炎単独1名であった.10名はステロイド治療を受け,うち3名はIVIGも併用された.1名は完全に回復し,10名は部分的に回復,1名は死亡した.(iii) 虚血性脳卒中(8名):4名は肺塞栓症を合併し,うち1名は死亡した.iv)末梢神経障害(8名):ギラン・バレー症候群(GBS)を7名,腕神経叢障害を1名で認めた.8名中6名が部分的回復ないし回復中.(v)その他(5名).検査については,1例も髄液PCRで陽性になった症例なし.血清・髄液自己抗体(NMDAR,LGI1,AQP4,MOG)もすべて陰性.Dダイマーは脳梗塞例でとくに高値であった.著者らはICUにおいて,頭部MRIや脳波が施行困難ななかでの診断の難しさを指摘している.また治療についても,
ウイルス血症を呈しリンパ球減少を認める患者へのステロイド療法の是非,Dダイマー上昇を認めるADEMやGBSに対するIVIGの是非は難しい問題であると指摘している.
Brain. July 08, 2020(doi.org/10.1093/brain/awaa240)

◆COVID-19に伴う脳血管障害の特徴.
スペインからの1病院から報告.50日間でCOVID-19患者が1683名入院し,そのうち23名
(1.4%)が脳血管障害を発症した.全例で頭部と胸部CTが行われ,6名(26.1%)で頭部MRIが行われた.病理組織を6名で得た(脳生検2名,動脈血栓4名).診断の内訳は脳梗塞17名(73.9%,動脈解離2名),脳出血5名(21.7%),PRES 1名であった.脳梗塞は意外にも椎骨脳底動脈領域で多かった(6/17,35.3%).出血を認めた群では,くも膜下出血,頭頂・後頭葉白質脳症,微小出血,単発または多発性の局所性血腫を呈した.脳生検では血栓性微小血管症と内皮障害が認められたが,血管炎や壊死性脳炎は認められなかった.入院期間中の機能的予後不良(mRS 4~6)は73.9%(17/23)で,年齢が主要な予測因子であった(オッズ比1.5;P=0.043).7名(30.4%)が死亡した.
出血素因を伴う内皮障害に起因する血栓性微小血管症が脳血管障害の病態と考えられる.
Brain. July 09, 2020(doi.org/10.1093/brain/awaa239)
◆COVID-19の中枢神経病理は微小血管障害と虚血性変化.
ロンドンから2名の中枢神経病理の報告.これまで神経病理の報告は少なく,微小血栓と急性梗塞(doi.org/10.1101/2020.05.18.20099960),特異的な病理学的変化を伴わない低酸素性変化(doi.org/10.1056/NEJMc2019373),脳幹の血管周囲のリンパ球浸潤(doi.org/10.1016/s0140-6736(20)31282-4)が報告されている.今回の報告のうち1名は,
新皮質梗塞,小出血性および非出血性の白質病変を呈し,既報例の所見と著しく類似していた(図5)(doi.org/10.1007/s00401-020-02166-2).原因としては,ウイルス感染に伴う血管障害,免疫介在性障害,または低血圧や局所血栓に伴う二次的な低酸素症が考えられた.COVID-19では一人の患者であっても,脳内に多様の病態が生じ,さらにECMOや心停止なども影響して,複雑な所見を呈しうる.
Acta Neuropathol. July 08, 2020 (doi.org/10.1007/s00401-020-02190-2)

◆COVID-19時代における神経免疫療法の現時点のコンセンサス
神経免疫疾患に対して免疫療法を受けている患者にCOVID-19がもたらすリスクは,依然として不明である.医療の分野でよく使われているデルファイ法を用いて,現在の文献上のコンセンサスについて検討した.以下,結果を示す.
【コンセンサスが強いもの】
● 感染していない患者では,進行中の免疫療法を中止すべきではない.
● 神経免疫疾患の急性増悪に対し,ステロイド療法,IVIG,血漿交換療法は施行できる.
● MSにおいて,酢酸グラチラマーおよびIFNβは,COVID-19の感染および経過にマイナスの影響を与えない.
● 活動性の高いMSでは,ナタリズマブは,他の強力な疾患修飾薬より,COVID-19感染のリスクが低いと考えられている.
● MSでは,スフィンゴシン1-リン酸受容体モジュレーターや細胞除去療法(抗CD20抗体によるB細胞除去など)は,COVID-19感染のリスクを高める.
● MSにおいては,治療を継続している患者に対しては,細胞除去療法の延期を検討することができる.
【コンセンサスが得られていない点】
● テリフルノミドとフマル酸ジメチルがCOVID-19感染のリスクを高めるかどうかは不明.
● 感染して軽症または無症候の場合,ならびに濃厚接触した場合,免疫療法を中止すべきかどうかは不明.
● 高度の炎症を示す重症COVID-19の経過に,疾患修飾薬がどのように影響を与えるかは不明.
Nat Rev Neurol. July 8, 2020(doi.org/10.1038/s41582-020-0385-8)