今回のキーワードは,
退院後10日は要注意,家庭内二次感染の危険因子,ギラン・バレー症候群はむしろ減っている,脳血管内皮細胞におけるACE2発現と微小出血,小児38例の中枢神経画像所見,5つの重症化に関わる遺伝子の同定,ヤヌスキナーゼ阻害剤バリシチニブの臨床試験の成功,米国で緊急使用許可が認められたモノクローナル抗体バマニビマブの情報です.
既存薬をCOVID-19に使用し効果を期待するdrug repositioningの試みは残念ながらほとんど失敗しました.やはりCOVID-19の病態の理解が治療薬開発には不可欠ということになります.今回,英国から重症者のゲノムワイド関連解析が報告され,重症化に関わる5つの遺伝子が同定されました.そのひとつがサイトカイン・シグナル伝達で活性化する酵素TYK2ですが,これを抑制する
ヤヌスキナーゼ阻害剤バリシチニブが重症患者の回復時間を短縮しました.またウイルス・スパイク蛋白質に対する中和抗体が米国で使用可能になりました.少しずつですが,予後を改善する治療薬にも希望の光が見えてきました.
◆COVID-19は再入院率が高く,とくに退院後10日は要注意.
COVID-19の初回入院後の転帰に関するデータは限られている.米国から退役軍人を対象とした退院後60日までの再入院率と再入院の理由,死亡率の結果が報告された.入院は2179名で,そのうち678名(31.1%)がICUで治療を受け,279例(12.8%)が機械的人工呼吸を受け,1775例(81.5%)が退院した.退院後60日以内に479名(27.0%)が再入院または死亡した.再入院時の診断で最も多かったのはCOVID-19(30.2%),敗血症(8.5%),肺炎(3.1%),心不全(3.1%)であった.また
退院後最初の10日間は肺炎ないし心不全と比較して,より再入院・死亡の頻度が高く(13%),臨床的悪化のリスクが高い期間であることが分かった(図1).以上より,退院後を考慮に入れない,入院中の患者の予後や死亡率のみに焦点を当てた調査・臨床試験は,COVID-19の重篤度を過小評価する可能性がある.
JAMA. Dec 14, 2020(doi.org/10.1001/jama.2020.21465)

◆家庭における二次感染は,症状あり,成人,配偶者においてより高頻度である.
家庭内における二次感染が問題になっているが,その頻度については不明である.米国から54件の研究,7万7758人の参加者を対象としたメタ解析が報告された.
推定される家庭内の二次感染率は16.6%で,SARS(7.5%)やMERS(4.7%)よりも高かった.また家庭内の二次感染率に影響する因子として,症状ある患者との接触>無症状患者との接触(18.0%対0.7%),成人患者との接触>小児患者との接触(28.3%対16.8%),配偶者が患者>他の家族が患者(37.8%対17.8%)であった.家庭における隔離が継続されるのであれば,家庭は重要な感染の場であり続けることになる.
JAMA Netw Open. 2020;3(12):e2031756(doi.org/10.1001/jamanetworkopen.2020.31756)
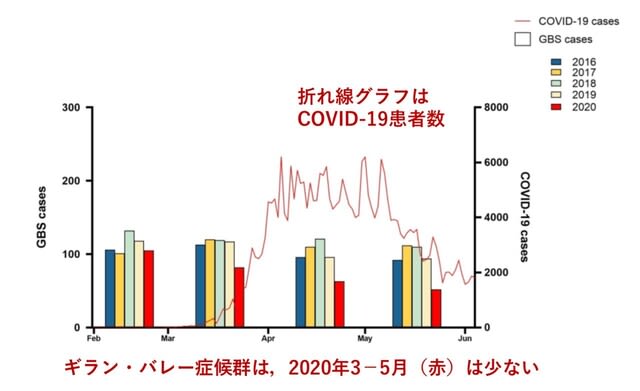
◆COVID-19とGBSには因果関係はなく,パンデミック後,GBSは減少している.
COVID-19とギラン・バレー症候群(GBS)の因果関係について調査した英国からの報告.2016年から2019年までに英国の病院で治療されたGBSの発生率は,年間10万人あたり1.65~1.88人であった. 2020年3月~5月におけるGBSの発生率は,2016~2019年の同時期と比較して,なんと低下していた!(図2).この間,47例のGBS症例(COVID-19関連25名,非COVID-19関連22名)を経験したが,両群間で脱力のパターン,極期までの時間,神経生理所見,髄液所見,転帰に有意差は認めなかった.唯一,気管内挿管の頻度はCOVID-19群でより高かったが(54%対23%),これはCOVID-19に伴う肺病変に関連するものと考えられた.COVID-19とGBSの関連は完全には否定できないが,本研究からは因果関係は見いだせなかった.
むしろロックダウンにより,カンピロバクターや呼吸器ウイルスなどのGBSを引き起こす感染症が減少し,GBSが減っているのかもしれない.→ 自身の経験でも,確かにGBS入院は減少している印象がある.しかし以前紹介したようにイタリア(doi.org/10.1136/jnnp-2020-324837),また最近ではスペインで発症率の増加が指摘されており(doi.org/10.1002/ana.25987),もう少し検討を重ねる必要がある.
Brain. Dec 14, 2020(doi.org/10.1093/brain/awaa433)
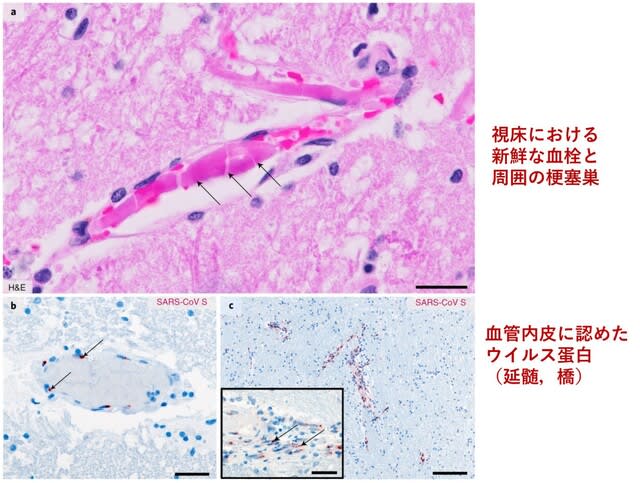
◆COVID-19による微小出血はACE2発現を伴う血管内皮炎により生じる.
COVID-19に伴う中枢神経症状の機序として,血管障害が関与する可能性が指摘されてきた.スイスから,点状出血ないし微小血栓(microbleeds)を認めた6名の脳病理所見の検討が報告された.うち2名は,播種性血管内凝固症候群(DIC)を認めたため検討から除外した.4名の検討で,微小出血は大脳の皮質・白質接合部で最も顕著であったが,脳幹,深部灰白質,小脳にも認められた.2名では
血管壁内に炎症細胞浸潤が認められ,SARS-CoV2ウイルス感染に伴う血管内皮炎と考えられた.1例を除き脳血管におけるACE2発現の増加が認められた.COVID-19における微小出血は,ACE2発現を伴う血管内皮炎の結果生じ,脳症を引き起こす可能性が考えられた.
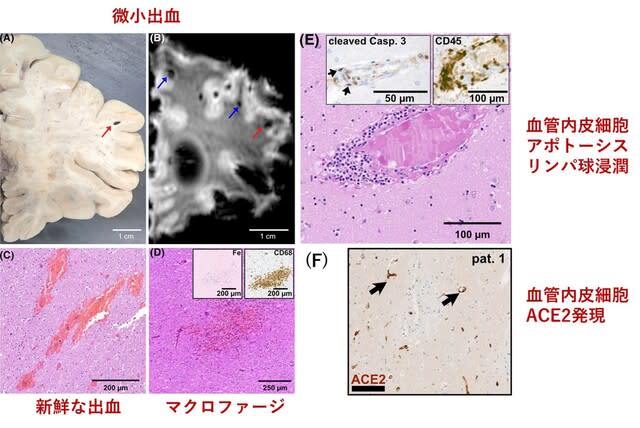
図3の説明:(A) 肉眼的検査では,大部分が皮質近傍の多発出血であった.(B)死後脳のSWI画像で,微小出血が認められた.C)HE染色による半卵円中心の新鮮な出血.(D)脳梁にマクロファージ(CD68)と血液分解産物(Fe)を含む亜急性出血.E)大脳基底核における血管内微小血栓症と血管内皮炎.血管内皮細胞のアポトーシスが観察された(活性化カスパーゼ3).血管内皮内リンパ球(CD45).F)患者血管内皮におけるACE2発現(対照では陰性ないしごく微弱の染色).
Neuropathol Appl Neurobiol. Nov 29, 2020.(doi.org/10.1111/nan.12677)
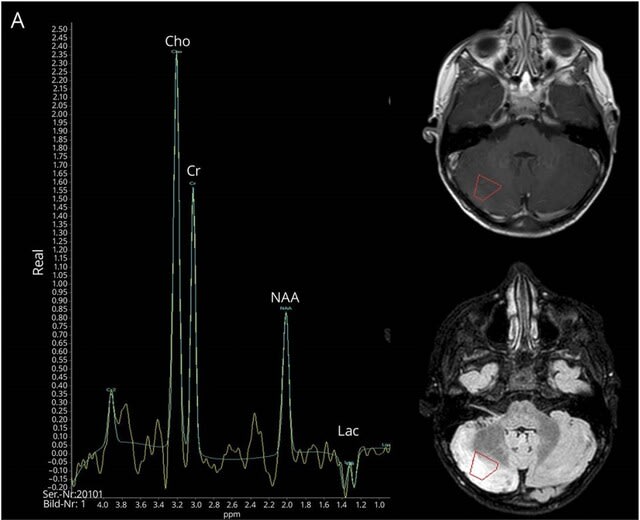
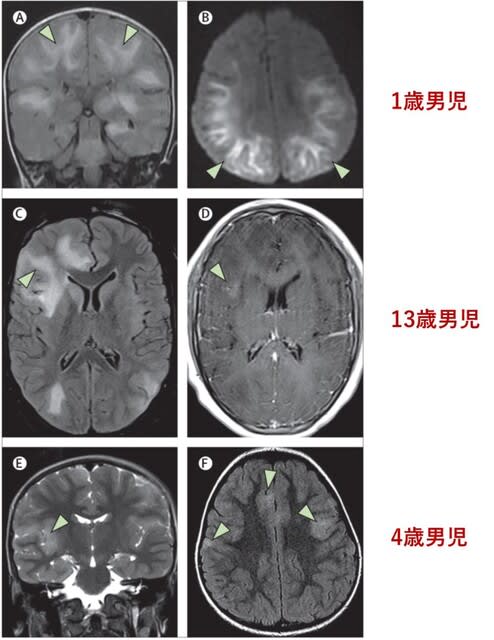
◆小児でもさまざまな神経筋合併症が生じうる ―38名の画像所見―
フランス,英国,米国,ブラジルなど10カ国の共同研究で,COVID-19感染に伴う中枢神経症状を呈した小児38名の画像所見が報告された.所見は軽度から重度まで様々であった.頻度の多い画像所見として,
感染後免疫介在性急性播種性脳脊髄炎(ADEM)様所見(16名;図4),異常造影所見(13名),脊髄炎(8名)であった.脳神経の造影所見(=脳神経炎)は,それに対応する神経症候がなくても認められた.脳梁膨大部病変(7名)および筋炎(4名)は,多系統炎症症候群(MIS-C)で主に認められた.脳血管の異常所見は成人に比べて少なかった.ほとんどの小児は良好な転帰を示したが,4名は非定型中枢神経感染症(結核腫,細菌感染,帯状疱疹ウイルス感染)を併発し,死亡した.
Lancet child adolescent health. Dec 15, 2020(doi.org/10.1016/S2352-4642(20)30362-X)
◆重症化因子として5つの遺伝子(OAS1/2/3, TYK2, DPP9, IFNAR2, CCR2)が同定された.
英国の208のICUからのCOVID-19の重症患者2244名を対象としたゲノムワイド関連解析(GWAS)の結果が報告された.抗ウイルス制限酵素活性化因子(OAS1, OAS2, OAS3;結核菌の増殖を抑制する作用も有する)をコードする遺伝子クラスターの染色体12q24.13,チロシンキナーゼ2(TYK2)をコードする遺伝子の近傍の染色体19p13.2,ジペプチジルペプチダーゼ9(DPP9)をコードする遺伝子内の染色体19p13.3,インターフェロン受容体遺伝子IFNAR2の染色体21q22.1において有意な関連を同定した(図5).
Ⅰ型インターフェロンのシグナル伝達に関わるIFNAR2の低発現と,サイトカイン・シグナル伝達で活性化する酵素TYK2の高発現が重症化に関与する可能性がある.また肺組織におけるトランスクリプトーム解析から,単球/マクロファージCCR2ケモカイン受容体の高発現が重症化と関連している可能性が示唆された.以上のように,宿主側の抗ウイルス防御機構と炎症性臓器障害のメディエーターに関連する遺伝因子が重症化因子として同定された.
Nature. Dec11, 2020(doi.org/10.1038/s41586-020-03065-y)

◆ヤヌスキナーゼ阻害剤バリシチニブの臨床試験の成功.
米国から,上述のTYK2を阻害するJAK阻害剤バリシチニブの臨床試験(ACTT-2試験)がNEJM誌に報告され,入院患者回復促進効果が認められた!入院成人を対象に,バリシチニブとレムデシビルの併用を評価する二重盲検,無作為化,プラセボ対照試験である.全患者にレムデシビル(10日以内)+バリシチニブ(14日以内)またはレムデシビル+偽薬を投与した.主要評価項目は回復までの期間,副次評価項目は15日目の臨床状態の改善とした.計1033名が無作為化を受けた(うち併用療法は515 名).併用療法群の回復までの期間の中央値は7日,対照群は8日で,1日の短縮(回復率比,1.16;P=0.03)(図6A),15日目の臨床状態の改善のオッズは30%高かった(オッズ比,1.3).
割り付け時に高流量酸素または人工呼吸器管理を受けた患者に限定すると,回復までの期間は併用療法群で10日,対照群で18日で,8日短縮した!(回復率比,1.51)(図6D).28日死亡率は併用群で5.1%,対照群で7.8%であった(死亡ハザード比,0.65).重篤な有害事象の発生頻度は対照群よりも併用群の方が低かった(16.0%対21.0%).以上より,バリシチニブとレムデシビルの併用は,特に高流量酸素または非侵襲的人工呼吸(NPPV)を受けている患者において回復時間を短縮し,臨床状態の改善を促進する点でレムデシビル単独よりも優れていた.
New Engl J Med. Dec11, 2020(doi.org/10.1056/NEJMoa2031994)

◆米国FDAの緊急使用許可を取得したモノクローナル抗体バマニビマブの情報.
11月7日のブログで紹介した,SARS-CoV-2ウイルスの対する中和抗体療法が,米国ではすでに可能になっている(doi.org/10.1056/NEJMoa2029849).このバムラニビマブ(LY-CoV555;リリー社)は,SARS-CoV-2のスパイク蛋白質の受容体結合ドメインに結合し,スパイク蛋白質のヒトACE2受容体への結合を阻害する.重症化ないし入院への進行リスクが高いと考えられる
軽度または中等度の患者において,救急部門の受診および入院の減少との関連性を認めたため,FDAから緊急使用許可を取得した.しかし,入院患者における有益な効果は認められていない.バムラニビマブは,700mgの単回点滴静注で,アナフィラキシーを管理するための設備を備えた施設で,1時間以上かけて注入する.SARS-CoV-2検査結果が陽性となった後,できるだけ早く,症状発現後10日以内に投与する.適格患者を以下に示す.
1)以下のうち1つ以上を有する患者:肥満(BMI≧35),慢性腎臓病,糖尿病,免疫抑制性疾患,免疫抑制療法を受けている,65歳以上.
2)55歳以上で,以下の1つ以上を認める患者:心血管疾患,高血圧症,COPDまたはその他の慢性呼吸器疾患.
3)12~17歳で以下のうち1つ以上を認める患者:年齢および性別のBMIが85パーセンタイル以上であること,鎌状赤血球症,先天性または後天性の心臓病,神経発達障害,医療関連の技術依存(例:気管切開術,胃瘻造設術,陽圧換気),喘息や日常的に治療が必要な慢性呼吸器疾患.
JAMA. Dec 11, 2020(doi.org/10.1001/jama.2020.24415)